拟南芥缺铜敏感突变体的鉴定分析
2016-07-03杜亚琳
杜亚琳
(农业部东北地区园艺作物生物学与种质创制重点实验室,东北农业大学园艺学院,哈尔滨150030)
拟南芥缺铜敏感突变体的鉴定分析
杜亚琳
(农业部东北地区园艺作物生物学与种质创制重点实验室,东北农业大学园艺学院,哈尔滨150030)
为进一步探明植物缺铜响应机制,利用甲基磺酸乙酯(EMS)诱变、体视显微形态观察和ICP-MS技术对拟南芥(Col)缺铜敏感突变体cds-1进行鉴定分析。结果表明:在缺铜条件下,cds-1的根伸长发育受到抑制,而高浓度铜处理则可使得cds-1根长部分恢复至野生型。除根伸长发育受到抑制外,cds-1根部形态(根毛长度和根直径)与野生型相比也有较大差异。cds-1与野生型植株体内铜含量无显著差异。遗传分析该突变体性状由2对隐性等位基因控制。
突变体;拟南芥;铜;EMS
铜是植物生长和发育必需的微量元素,诸多代谢过程,如光合作用、线粒体电子传递、呼吸作用、活性氧代谢、细胞壁结构改变及乙烯反应等,均需要铜作为辅助因子[1-2]。由于其在发育过程中的重要意义,铜动态平衡在植物体内处于精细调控状态。植物体内铜浓度在不同物种及不同外源铜环境条件下存在差异[3]。植物体内,铜浓度一般为2~50μg/g,而6μg/g铜浓度足以保证植物正常的生长和发育。然而当铜浓度低于5μg/g或高于20μg/g时,植物体表现缺铜或铜毒害症状[2]。缺铜症状在不同土壤类型和作物中表现有所差异,但在有机质土壤生长的植物易表现缺铜症状,如生长速率减缓、叶片颜色变淡、花粉活力减弱、结实率和产量降低等。
缺铜胁迫条件下,植物通过调控铜吸收和转运已经演化获得1个精细调控体内铜动态平衡的机制[45]。如拟南芥通过提高铜的吸收和获取应对缺铜胁迫。缺铜胁迫上调拟南芥铜转运蛋白基因的表达,如ZIP2、ZIP4和FRO3等[6-7]。此外,缺铜胁迫时,在转铜伴侣CCH作用下,在衰老过程中铜在各组织间重新分配[8]。植物的另一个缺铜响应机制为改变铜在体内的分配,此机制在莱茵衣藻中研究较深入[9],然而拟南芥分配机制与莱茵衣藻不同。在缺铜条件下,拟南芥铜锌超氧物歧化酶CSD1和CSD2,及转铜伴侣CCS均下调表达,且呈共表达模式[6,10]。随着CSD1和CSD2在缺铜胁迫下的下调表达,铁超氧物歧化酶基因FSD1表达增加,进而取代Cu/ZnSOD的功能,节余的铜将用于缺铜胁迫条件下植物最必须的功能代谢过程[3,10]。铜相关microRNA的鉴定有利于进一步理解植物的缺铜响应机制。Cu-miroRNA受到低铜诱导表达和高铜抑制表达,而Cu-miroRNA下调表达介导的铜动态平衡,主要受关键作用因子miR398的调控,而miR398只在低铜环境中表达。在缺铜胁迫下,miR398能够直接调控CSD1mRNA的降解,同时,其还调控CSD2和COX5b-1的表达[11]。此外,另外3个低铜上调表达microRNA家族,miR397、miR408和miR857,同样可调控铜蛋白基因的表达[12]。
植物缺铜响应机制的相关研究已取得较大进展,但目前铜胁迫条件下植物调控铜动态平衡的生理与分子机制仍不能清晰阐述,而突变体材料则是研究植物缺铜适应机制的理想材料。van Vliet等[13]获得1个铜富集敏感突变体cup1-1,该突变体体内植物螯合态的生物合成及功能未受到影响,可能是体内积累了过量铜而使其拥有铜富集敏感表型。Murphy和Taiz[14]利用VMT技术快速鉴定获得1个拟南芥铜富集敏感突变体cus。在EMS诱变基础上,Wu等[15]获得了1个缺铜敏感突变体tpst-2,酪氨酸硫化转移酶基因内含子保守可变剪切位点的突变导致该突变性状的产生,生理生化及蛋白质水平试验证据表明,该基因可能参与铜介导的乙烯信号传导途径。笔者从甲基磺酸乙酯(EMS)诱变获得的拟南芥(哥伦比亚型,Col)M2代群体中筛选拟南芥缺铜敏感突变体,以期为后续利用基因工程技术研究该基因的功能及探索植物缺铜响应机制奠定基础。
1 材料与方法
1.1 试验材料
拟南芥(Arabidopsis)生态型为哥伦比亚型(野生型,WT)。EMS诱变的拟南芥WT型M2种子购自于美国Lehle种子中心。种子经0.1%HgCl2消毒5min后,用无菌水冲洗3~4次,然后用0.1%的琼脂悬浮于MGRL培养基[15],于4℃条件下黑暗处理2d后转至光照为100μmol/(m2·s)、光照/黑暗为16h/8h光周期、温度为22℃的光照培养箱进行培养。培养基采用MGRL配方:1.512mmol/L NaH2PO4·2H2O,0.257mmol/L Na2HPO4· 12H2O,1.5mmol/L MgSO4·7H2O,2mmol/L Ca (NO3)4·4H2O,3mmol/L KNO3,67μmol/L Na2EDTA·2H2O,8.6μmol/L FeSO4·7H2O,10.3μmol/L MnSO4,1μmol/L ZnSO4·7H2O,30μmol/L H3BO3,24nmol/L(NH4)6Mo7O24· 4H2O,130nmol/L CoCl2·6H2O,分别在培养基中添加不同浓度的CuSO4,0和50μmol/L分别为缺铜(-Cu)和高铜(50Cu)。
1.2 突变体的筛选
以野生型种子作为对照,将由EMS诱变的拟南芥WT型2 000粒M2代种子播种于缺铜培养基上,处理5d后将根伸长发育受到抑制的单株转移至高铜培养基生长,5d后将根伸长发育部分或完全恢复至野生型单株再次转移至缺铜培养基,根伸长发育再次受到缺铜抑制的单株作为潜在的拟南芥缺铜敏感突变体并自交繁种。将M3种子再次在缺铜和高铜培养基中进行筛选和验证,最终鉴定具有显著缺铜敏感的突变体(命名为csd-1)。
1.3 拟南芥植株根长测定
将野生型和突变体种子消毒后置于4℃黑暗培养2d,然后分别播种于缺铜和高铜培养基上生长10d(光照为100μmol/(m2·s)、16(光照)/8(黑暗)h光周期、温度为22℃),利用软件ImageJ(http://rsb.info.nih.gov/ij/)测定植株根长,每个处理不少于30个单株,统计分析采用Turkey法进行(P<0.05)。
1.4 铜含量测定
将野生型和突变体种子消毒后置于4℃黑暗培养2d,然后植株分别播种于缺铜和高铜培养基上生长10d(光照为100μmol/(m2·s)、光照/黑暗为16h/8h光周期、温度为22℃),分地上部和根分别取材,用蒸馏水将样品冲洗3次后置于65℃烘干,并用硝酸硝解。样品铜含量采用ICP-MS (SPQ9700;SII,Chiba,Japan)测定[16]。
1.5 突变体的体视显微形态学观察
将突变体和野生型种子分别播种2个处理(缺铜和高铜培养基)生长7d,取其根部,利用体视显微镜(SteREO Discovery.V12)进行体视显微形态学观察,每个处理不少于10株植株。
1.6 突变体的遗传分析
将csd-1突变体与Ler野生生态类型进行杂交,以获得F1代种子,进而将F1自交收获F2种子。将F1种子和F2种子播种于缺铜培养基上观察F1及F2植株的缺铜敏感性及分离比例。
2 结果与分析
2.1 拟南芥铜缺失敏感突变体cds-1的筛选及表型
经鉴定得1株拟南芥铜敏感突变体,命名为cds-1(图1A)。在缺Cu条件下生长10d,野生型根长为(8.1±0.25)cm,cds-1根长为(3.2±0.27)cm;而在高铜条件下,野生型根长为(7±0.31)cm,cds-1根长为(5.3±0.1)cm(图1B)。经形态学观察得,cds-1突变体在缺铜条件下主根变粗,侧根数量和长度均有所增加;高铜处理对野生型的根部形态无影响,但却能部分恢复cds-1突变体的根部形态(图2),表明,cds-1是拟南芥铜缺失敏感突变体。在缺铜和高铜条件下,野生型和cds-1突变体的地上部和根铜含量均无显著性差异(图3)。
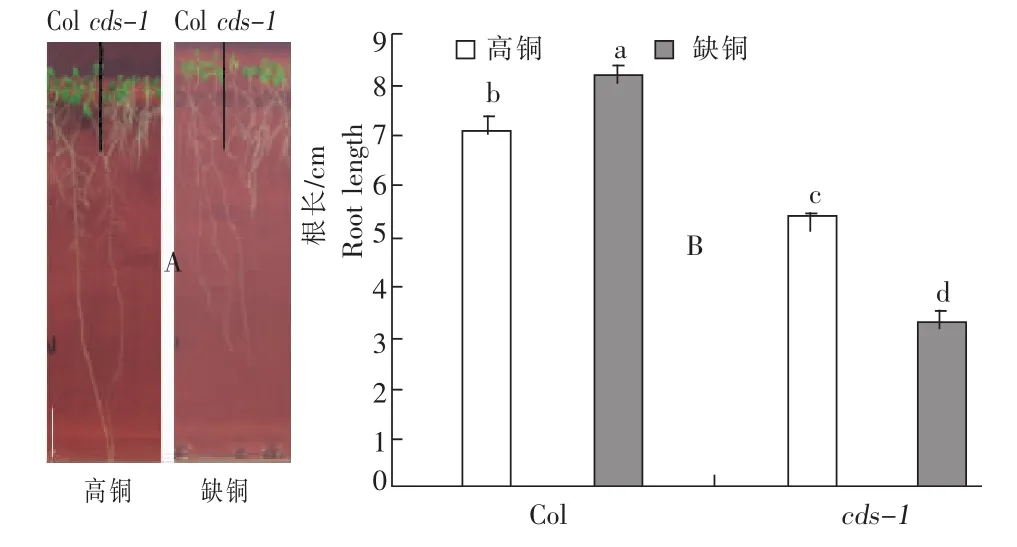
图1 拟南芥缺铜敏感突变体cds-1及其野生型植株的根长Fig.1 The root length of Cu deficiency sensitive mutant cds-1and wild type plants
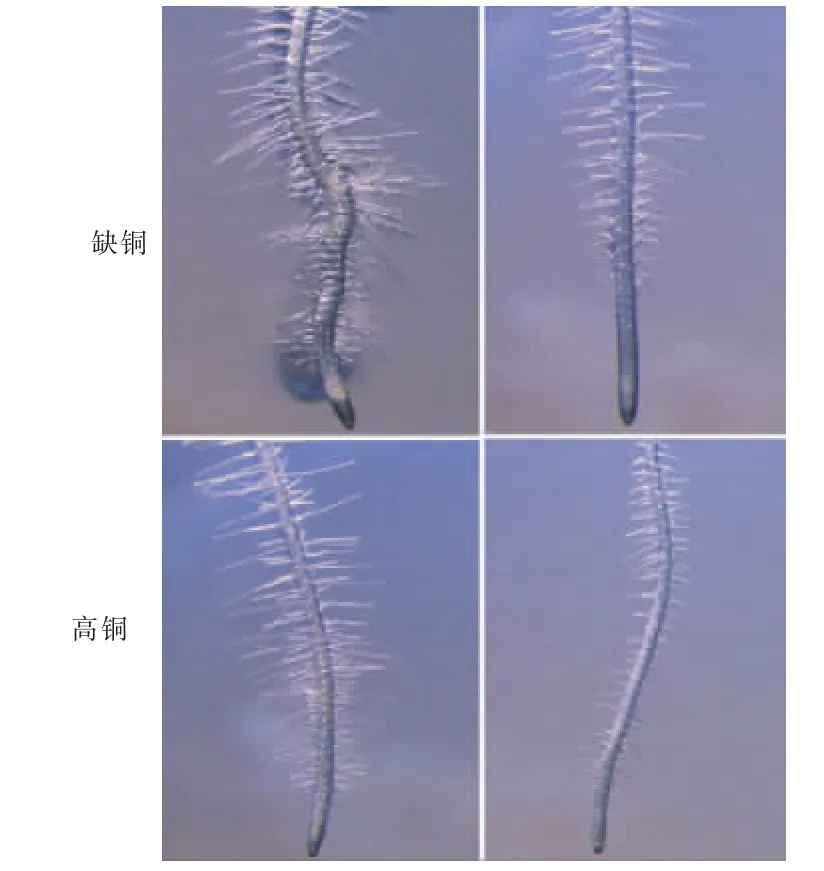
图2 拟南芥缺铜敏感突变体cds-1及其野生型植株的根组织形态Fig.2 Stereo microscope morphological observation of root tissue of Cu deficiency sensitive mutant cds-1and wild type plants

图3 拟南芥铜敏感突变体cds-1及其野生型的铜含量Fig.3 Cu content of the Cu deficiency sensitive mutant cds-1and wild type plants
2.2 拟南芥铜缺失敏感突变体cds-1的遗传特征
经遗传分析,30株F1植株全部为野生型表型,在F2植株中有670株表现为野生型表型,46株植株表现为突变表型,野生型∶突变体=15∶1,表明该突变性状由2对隐性等位基因控制。
3 结论与讨论
突变体是功能基因组学研究的重要材料。随着各种植物全基因组测序工作的陆续完成,植物突变体已广泛应用于鉴定调控植物形态和生理性状与基因的连锁分析及其相关基因的克隆和功能研究。目前,应用于突变体获得的方法有多种,EMS诱变是其中效率较高的技术[17]。此外,针对EMS诱变特点,结合基因组重测序技术,开发了各种新型的用于鉴定EMS诱变突变体目标基因的技术,如结合重测序和图位克隆进行基因的鉴定、利用F2分离群体进行基因鉴定的MutMap技术和利用M3分离群体进行基因鉴定的MutMap+技术等[17-19],为下一步克隆控制拟南芥缺铜敏感突变体目标基因提供了技术支持。
鉴于cds-1突变体是经EMS诱变产生的拟南芥铜缺失敏感突变体。据植物铜吸收和铜调控植物生长发育的信号传导途径[4-5],突变体对缺铜生长条件产生敏感性,可能是由于其某个负责铜吸收、转运的基因发生了突变,或因其某个负责铜生理功能发挥的信号传导基因发生突变。为阐明此问题,测定野生型及cds-1突变体的铜含量结果显示,在缺铜和高铜条件下野生型和cds-1突变体的地上部和根铜含量均无显著性差异,表明,cds-1突变基因不是负责铜吸收相关基因,可能是负责突变体内铜的利用或铜归宿性转运得相关基因。目前,cds-1基因的图位克隆工作正在进行中,该基因的克隆可为进一步阐明植物缺铜敏感的分子调控机理提供基础。
[1]Pilon M,Abdel-Ghany S E,Cohu C M,et al.Copper cofactor delivery in plant cells[J].Curr Opin Plant Biol,2006,9(3):256-263.
[2]Burkhead J L,Reynolds K A,Abdel-Ghany S E,et al.Copper homeostasis[J].New Phytol,2009,182 (4):799-816.
[3]Cohu C M,Pilon M.Regulation of superoxide dismutase expression by copper availability[J].Physiol Plantarum,2007,129(4):747-755.
[4]Puig S,Thiele D J.Molecular mechanisms of copper uptake and distribution[J].Curr Opin Chem Biol,2002,6(2):171-180.
[5]De Freitas J,Wintz H,Kim J H,et al.Yeast,a model organism for iron and copper metabolism studies[J].Biometals,2003,16(1):185-197.
[6]Wintz H,Fox T,Wu Y Y,et al.Expression profiles of A.thaliana in mineral deficiencies reveal novel transporters involved in metal homeostasis[J].J Biol Chem,2003,278(48):47644-47653.
[7]Mukherjee I,Campbell N H,Ash J S,et al.Expression profiling of the Arabidopsis ferric chelate reductase(FRO)gene family reveals differential regulation by iron and copper[J].Planta,2006,223(6):1178-1190.
[8]Mira H,Mart nez N,Pe arrubia L,et al.Expression of a vegetative-storage-protein gene from Arabidopsis is regulated by copper,senescence and ozone[J].Planta,2002,214(6):939-946.
[9]Merchant S S,Allen M D,Kropat J,et al.Between a rock and a hard place:trace element nutrition in Chlamydomonas[J].Biochim Biophys Acta,2006,1763(7):578-594.
[10]Abdel-Ghany S E,M ller-Moul P,Niyogi K K,et al.Two P-type ATPases are required for copper delivery in Arabidopsis thaliana chloroplasts[J].Plant Cell,2005,17(4):1233-1251.
[11]Yamasaki H,Abdel-Ghany S E,Cohu C M,et al.Regulation of copper homeostasis by micro-RNA in Arabidopsis[J].J Biol Chem,2007,282(22):16369-16378.
[12]Abdel-Ghany SE,Pilon M.MicroRNA-mediated systemic down-regulation of copper protein expression in response to low copper availability in Arabidopsis[J].J Biol Chem,2008,283(23):15932-15945.
[13]van Vliet C,Anderson C R,Cobbett C S.Coppersensitive mutant of Arabidopsis thaliana.Plant Physiol,1995,109(3):871-878.
[14]Murphy A,Taiz L.A new vertical mesh transfer technique for metal-tolerance studies in Arabidopsis (ecotypic variation and copper-sensitive Mutants)[J].Plant Physiol,1995,108(1):29-38.
[15]Wu T,Kamiya T,Yumoto H,et al.An Arabidopsis thaliana copper-sensitive mutant suggests a role of phytosulfokine in ethylene production[J].J Exp Bot,2015,66(13):3657-3667.
[16]Takano J,Wada M,Ludewig U,et al.The Arabidopsis major intrinsic protein NIP5;1is essential for efficient boron uptake and plant development under boron limitation[J].Plant Cell,2006,18(6):1498-1509.
[17]Tabata R,Kamiya T,Shigenobu S,et al.Identification of an EMS-induced causal mutation in a gene required for boron-mediated root development by lowcoverage genome re-sequencing in Arabidopsis[J].Plant Signal Behav,2013,8(1):e22534.
[18]Abe A,Kosugi S,Yoshida K,et al.Genome sequencing reveals agronomically important loci in rice using MutMap[J].Nat Biotechnol,2012,30(2):174-178.
[19]Fekih R,Takagi H,Tamiru M,et al.MutMap+:Genetic Mapping and Mutant Identification without Crossing in Rice[J].PLoS One,2013,8(7):e68529.
(责任编辑:刘忠丽)
Identification and Analysis of Copper Deficiency Sensitive Mutant in Arabidopsis
DU Yalin
(Key Laboratory of Biology and Genetic Improvement of Horticultural Crops(Northeast Region),Ministry of Agriculture,College of Horticultural,Northeast Agricultural University,Harbin,Heilongjiang150030,China)
To understand the Cu deficiency response mechanism in plants further,a Arabidopsis(Col)copper deficiency(-Cu)sensitive mutant named cds-1was screened and identified by using ethyl methane sulfonate(EMS)mutagenesis,cytology and ICP-MS technique.Results:The root length elongation of cds-1was inhibited under-Cu condition,while it could be partially restored to the wild type phenotype under high Cu conditions.The length of root hair and root diameter of cds-1mutant were also different from the wild type phenotype under-Cu condition.Cu assay results showed that the cds-1mutant and Col plants had similar root and shoot Cu content.Genetic analysis showed that the mutant phenotype was controlled by two recessive genes.
mutant;arabidopsis;copper;EMS
Q944.1
A
1001-3601(2016)08-0345-0080-04
2016-01-11;2016-07-21修回
黑龙江省青年科学基金项目“黄瓜耐低氮相关基因表达谱分析及重要基因克隆”(QC2010089)
杜亚琳(1980-),女,实验师,硕士,从事园艺作物生物技术研究。E-mail:duyalin123@163.com
