胃肠道间质瘤病理及转移灶免疫组织化学表达
2016-07-01徐志强唐大荣
徐志强 唐大荣
[摘 要] 目的:利用免疫组化检测CD117、CD34、DOG-1、SMA、S-100、p53、Ki-67、PCNA等蛋白在胃肠道间质瘤(GIST)中的表达及临床意义。方法:对89例确诊为GIST的石蜡标本,运用免疫组织化学方法检测CD117、CD34、DOG-1、SMA等蛋白表达,对出现肝转移病例,对比原发灶和转移灶的p53、Ki-67、PCNA蛋白的表达。结果:89例 GST中 CD117、CD 34 、DOG-1、SMA 、S-100 的阳性率分别是 95.5% (85/89)、 91.01% (81/89 )、 37.1%(33/89)、23.5%(21/89)、 14.6% (13/89)。转移灶中的Ki-67、PCNA、p53蛋白表达量明显增加(P<0.05)。结论:CD117、CD34、DOG-1、SMA对GIST具有诊断和鉴别意义;p53、Ki-67、PCNA对GIST判断预后有一定价值。
[关键词] 胃肠道间质瘤;病理
中图分类号:R735.2 文献标识码:B 文章编号:2095-5200(2016)03-073-03
[Abstract] Objective: Using immunohistochemical technique to to detect CD117、CD34、Dog-1、SMA、S-100、p53、Ki-67、PCNA in gastric stromal tumor (GIST). Methods: Detected 89 cases.To compare the expression of p53、Ki-67、 PCNA of primary foci and metastatic foci. Results: The positive expression rate of CD117, CD 34, Dog - 1, SMA, S-100 was 95.5% (85/89), 91.01% (81/89), 37.1% (33/89), 23.5% (21/89), 14.6% (13/89).In the metastatic foci,the expression of Ki-67/PCNA/p53 protein was significantly increased (P<0.05). Conclusion:CD117, CD34, Dog-1, SMA have diagnostic of GIST.p53, Ki - 67, PCNA reflect the prognosis of GIST.
[Key words] gastric stromal tumor; pathological
胃肠道间质瘤是起源于中胚层的间质肿瘤。1983年,Mazurt等[1]运用电镜技术发现胃肠道间叶肿瘤无平滑肌等超微结构,运用免疫组织化学法进一步研究,发现这组肿瘤无肌性或神经分化特征,而是一种非定向分化的间质细胞,于是将其命名为胃肠间质瘤(GIST)。1998年,Hirota等[2]发现GIST能特异性表达标记物KIT蛋白(CD117 ),而KIT蛋白表达来源于c-kit原癌基因突变。2003年,Heinrich等[3]发现部分GIST有血小板衍生生长因子受体α(plate let derived growth factor receptor alpha,PDGFRA)基因突变。本文利用免疫组织化学法检测我院89例组织病理明确的胃肠道间质瘤病例的CD117、CD34、DOG-1、SMA、S-100表达情况,分析上述指标对GIST的诊断价值。
大量报道指出[4-6],GIST预后极差,40%~90%的手术病人出现术后复发和转移的症状。而肿瘤抑制因子(53)、细胞增殖核抗原(PCNA)及细胞增殖指数(Ki-67)这三个蛋白指标与GIST的预后密切相关。在收集的89例病例中,5例发生肝转移,运用免疫组织化学方法对比5例原发灶和转移灶的p53、Ki-67、PCNA蛋白的表达,了解这些指标对GIST预后判断价值。
1 材料和方法
1.1 标本来源
收集我院从2013年1月至2015年6月期间临床资料完整、经手术和病理检查诊断明确的GIST 病例89例。记录患者年龄、性别、肿瘤部位、 肿瘤大小、 肿瘤有无转移等基本资料,GIST病理诊断由两位病理医师复阅切片,不一致病例由第三名高年资医师评估,讨论达成共识。
1.2 材料及免疫组织化学实验方法
CD117、CD34、DOG-1、SMA、S-100、p53、Ki-67等抗体及柠檬酸盐修复液购自福州迈新生物技术有限公司;DAB显色试剂盒购自北京中杉金桥生物公司。
免疫组化步骤为1)脱蜡和水化;2)抗原修复;3)免疫组织化学染色, 3%H2O2滴加在组织上,室温静置10min;PBS洗3次各5min;滴加正常山羊血清封闭液,室温20min;滴加Ⅰ抗50μL, 4℃过夜;PBS洗3次各5min;滴加Ⅱ抗50μL,37℃20min;PBS洗3次各5min;DAB显色2~3min,在显微镜下掌握染色程度;自来水冲洗5min;苏木精复染3min,盐酸酒精分化3s;自来水冲洗10min;脱水、透明、封片、镜检。4)结果判读标准为CD117、CD34、SMA、S-100、p53、Ki-67、PCNA以细胞核内出现黄色或棕黄色颗粒为阳性细胞;DOG-1以胞浆出现黄色或棕黄色颗粒为阳性细胞。阳性结果的判断标准按照染色程度和显色细胞的数量结合进行归类:细胞显色比例 < 5%(-);细胞显色的比例在 5%~25%之间,呈现为淡黄色(+);细胞显色的比例在25%~50%之间,呈现为黄色(++);细胞显色的比例 > 50% ,呈现棕黄色(+++)。
1.3 统计学处理
使用SPSS11.0软件系统,计数资料进行χ2检验或Fisher`s确切概率法检验,相关比较采用Spearman等级相关分析,P<0.05为差异有统计学意义。
2 结果
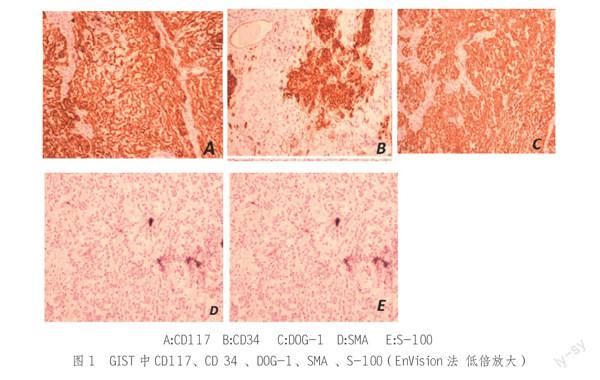
2.1 原发灶中CD117、CD 34 、DOG-1、SMA 、S-100
表达
免疫组织化学结果(图1)显示,在89例 GIST中 CD117、CD 34、DOG-1、SMA、S-100 的阳性率分别是 95.5% (85/89)、 91.01% (81/89 )、 37.1%(33/89)、23.5%(21/89)、 14.6% (13/89)。可见CD 117和CD 34 在GIST组织中阳性表达较高,而肌源性 SMA 或者神经源性肿瘤标记物S-100 在GST中表达较低。
2.2 原发灶、转移灶中p53、PCNA、Ki-67表达
免疫组织化学结果(图2)显示,p53、PCNA蛋白在原发部位中不表达,在转移灶中表达量明显增加(P<0.05);在原发部位Ki-67增殖指数约13%,在转移灶中增加到约89%(P<0.05)。
3 讨论
胃肠道间质瘤最常见发生部位为胃(60%),其次为小肠(30%)、十二指肠(5%)、大肠(4%)[7]。临床特征以消化道出血、腹痛、肿瘤阻塞为主。GIST组织病理学分型可以分为3种[8]:梭形细胞型、上皮细胞型、混合型。梭形细胞型约占70%,上皮细胞型约占20%,混合型约占10%。
目前认为GIST很大程度是由于C-kit基因发生突变引起。C-kit基因是酪氨酸激酶受体,编码CD117蛋白。GIST患者C-kit基因外显子突变,导致基因过表达,从而使CD117蛋白表达增加。CD34 蛋白是骨髓造血前体细胞的特殊性抗原,在原始造血干细胞、内皮细胞、肌纤维母细胞都可以看到阳性表达。本组实验,89例GIST患者中CD117、CD34的阳性表达率高,而肌源性的SMA和神经源性肿瘤标记物S-100阳性表达率低。CD117阳性、CD34阳性可以作为GIST诊断依据[9],而SMA和S-100低表达可以用来排除平滑肌源性肿瘤、神经源性肿瘤。
然而在实验中我们观察到,C-kit仍有5%左右的阴性表达率。C-kit阴性通常与PDGFRA相关基因突变相关。Rizzardi C等[10]提出C-kit阴性的GIST,存在PDGFRA基因14外显子缺失,导致疾病发生。但是膜通道蛋白DOG-1蛋白[11-12]在C-kit阴性GIST中可以表达[13]。DOG-1的免疫组织化学在瘤细胞的胞浆和胞膜均有表达,因为敏感性和特异性很高,DOG-1在GIST诊断中越来越受重视。本研究表明,DOG-1可以作为C-kit阴性的胃肠道间质瘤的一个重要诊断指标。
胃肠道间质肿瘤的预后差,易发生转移[14-15],P53与PCNA在转移灶的表达量明显增加预示着GIST预后差。原因可能是p53调控cyclin依赖激酶抑制因子(p21),而p21与PCNA结合抑制PCNA的活性。当GIST发生恶性转移时,p53表达增加,打乱这条通路,同时直接激活PCNA,从而促进细胞增殖。
Ki-67[16]作为增殖指数,与细胞有丝分裂密切相关。有观点认为,在判定GIST预后因素中,Ki-67蛋白比PCNA更具特异性和准确性。然而,Ray等[17]提出相反意见,他们认为对于GIST预后判断,PCNA更具优势。从本实验结果看,PCNA和Ki-67在转移灶中表达均增加,对预测疾病的复发和患者生存率均具有一定价值。但是对PCNA和Ki-67 在临床应用的优先级,仍存在争论。
总之,GIST在形态学上显示为非定向性肿瘤,因此准确诊断是一个复杂过程。借助于免疫组织化学,通过检测CD117、CD34、DOG-1、SMA、S-100等蛋白指标可以明确GIST诊断。p53、Ki-67、PCNA蛋白的高表达可以直接反映GIST预后,为临床治疗提供参考。
参 考 文 献
[1] Mazur MT,Clark HB.Gastric stromal tumors.Reappraisal of histogenesis[J].Am J Surg Pathol,1983,7(6):507-519.
[2] Hirota S, Isozaki K, Moriyama Y et al. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors[J]. Science, 1998,279(5350): 577–580.
[3] Heinrich MC, Corless CL, Demetri GD, et al. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor[J].Clin Oncol, 2003,21(23): 4342-4349.
[4] DeMatteo RP, Lewis JJ, Leung D et al.Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival[J]. Ann Surg 2000,231(1): 51-58.
[5] RobertsP J,Eisenberg B.Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease[J]. Eur J Cancer, 2002,38(5): 37–38.
[6] STURGEON C,CHEJFEC G,ESPAT NJ. Gastrointestinal stromal tumors: a spectrum of disease[J]. Surg Oncol,2003,12(1):21-26.
[7] Miettinen M,Lasot a J.Gastrointestinal stromal tumors-definition,clinical,histological,immunohistochemical,and molecular genetic features and differential diagnosis[J]. Virchows Arch,2001,438(1):1-12.
[8] Liegl-AtzwangerB,Fletcher JA,Fletcher CD.Gastrointestina-l stromal tumors[J]. Virchows Arch, 2010,456(2):111-127.
[9] 林海峰,徐国森,佟丹丹,等.胃肠道间质瘤的免疫组化观察与临床病理意义的研究[J].现代肿瘤医学,2013,21(6):1299 -1303.
[10] Rizzardi C, Marzinotto S, Avellini C,et al. A KIT-negative, DOG1-positive epithelioid GIST of the stomach harboring a novel PDGFRA exon 14 single nucleo-tide deletion[J]. Anticancer Res, 2012,32(5):1775-1778 .
[11] Sepe PS, Moparty B, Pitman MB, et al. EUS-guided FNA for the diagnosis of GI stromal cell tumors:sensitivity and cytologic yield[J]. Gastrointest Endosc,2009,70(2):254-261.
[12] Liegl B, Hornick JL, Corless CL,et al. Monoclonal antibody DOG-1 shows higher sensitivity than KIT in the diagnosis of gastrointestinal stromal tumors, including un-usual subtypes[J]. Am J Surg Pathol,2009,33(3): 437-446 .
[13] HUANG Z,LI Y,ZHAO H,et al. Prognositic factors and clinicopathologic characteristics of small gastrointestinal stromal tumor of the stomach: a retrospective analysis of 31 cases in one center[J]. Cancer Biol Med,2013,10(3):165-168.
[14] KIKUCHI H,YAMASHITA K,KAWABATA T,et al. Immunohistochemical and genetic features of gastric and metastatic liver gastrointestinal stromal tumors: sequential analyses[J]. Cancer Sci,2006,97(2):127-132.
[15] Feakins RM. The expression of p53 and bcl-2 in gastrointestinal stromal tumours is associated with anatomical site, and p53 expression is associated with grade and clinical outcome[J]. Histopathology,2005,46(3): 270-279.
[16] 艾力·赛丁,克力木·阿不都热依木,张成,等.CD117、CD 34、 SMA、S-100和Ki-67在胃肠道间质瘤中的表达及意义[J].现代肿瘤医学,2015,23(14):2004-2008.
[17] RAY R,TAHAN SR,ANDREWS C,et al. Stromal tumors of the stomach:prognostic value of the PCNA index[J]. Mod Pathol,1994,7(1):26-30.
