TWS119通过抑制STAT3磷酸化促进γδT细胞CCR5的表达①
2016-06-29孙蕾清陈永强吕小婷陈复兴刘军权周忠海
徐 晶 孙蕾清 陈永强 郑 璐 吕小婷 陈复兴 刘军权 周忠海
(解放军第97医院中心实验室,徐州221004)
·生物治疗·
TWS119通过抑制STAT3磷酸化促进γδT细胞CCR5的表达①
徐晶孙蕾清陈永强郑璐吕小婷陈复兴刘军权周忠海
(解放军第97医院中心实验室,徐州221004)
[摘要]目的:研究糖原合酶激酶-3β抑制剂4,6-二取代吡咯并嘧啶(TWS119)促进γδT细胞趋化因子受体CCR5表达的分子机制。方法:用TWS119诱导从健康人外周血中分离培养获得γδT细胞48 h后,用流式细胞仪检测γδT细胞CCR5的表达;Western blot检测GAPDH和p-STAT3的表达。结果:培养10 d后的γδT细胞纯度达到85.79%±5.01%。TWS119浓度在0~8.0 μmol/L范围内能显著促进趋化因子受体CCR5的表达,且剂量依赖性抑制STAT3的磷酸化。同时,用STAT3磷酸化抑制剂Stattic (0.5 μmol/L)预处理γδT细胞也可以促进CCR5的表达,并能协同增强TWS119促进趋化因子受体CCR5的表达。结论:TWS119通过抑制STAT3磷酸化促进γδT细胞CCR5的表达。
[关键词]TWS119;CCR5;γδT细胞;STAT3
4,6-二取代吡咯并嘧啶(TWS119)是糖原合酶激酶-3β (Glycogen synthase kinase-3β,GSK-3β)抑制剂,具有调节细胞增殖、分化和凋亡等生物学效应[1,2]。近年来研究发现TWS119体外可以诱导培养获得记忆性干细胞样T细胞(Memory stem cell-like T cell,TSCM)和早期分化细胞,这群细胞体内具有较强抗肿瘤活性,跟其在体内具有较强的增殖、分化能力及归巢黏附分子与趋化因子受体的表达有关[3,4]。我们研究发现TWS119体外可促进NK细胞和γδT细胞与归巢相关分子CD62L的表达[5,6]。CCR5 为趋化因子CC受体家族成员,对单核/巨噬细胞、T淋巴细胞和NK细胞等均有较强的趋化、募集和免疫过程[7,8]。因此,本研究想探讨TWS119能否促进γδT细胞趋化因子受体CCR5的表达及其分子机制,旨在为临床治疗获得向肿瘤组织高趋向性的γδT细胞。
1材料与方法
1.1材料TWS119购自Sigma公司;STAT3抑制剂Stattic购自Selleck Chemicals[实验时用二甲亚砜(DMSO)溶解,实验组DMSO终体积分数≤0.1%,对照组中加入相同浓度的DMSO];RPMI1640和小牛血清购自Gibco 公司;Western及IP细胞裂解液试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶试剂盒、Western及IP细胞裂解液、PVDF膜和BCIP/NBT碱性磷酸酯酶显色试剂盒均购自碧云天生物技术研究所;兔抗人p-STAT3、GAPDH一抗和碱性磷酸酶标记抗兔二抗购自Bioworld 公司;人淋巴细胞分离液购自天津灏洋生物制品科技有限责任公司;重组人白细胞介素-2(rhIL-2)和唑来磷酸购自诺华制药公司;荧光抗体FITC-γδTCR和PE-CCR5购自eBioscience;人AB型血浆购自徐州市中心血站。
1.2方法
1.2.1γδT细胞的培养与鉴定从健康人抽取外周血15 ml,用淋巴细胞分离液分离人外周血单个核细胞(Peripheral blood mononuclear cell,PBMCs)。用生理盐水洗涤后,将PBMCs加入γδT细胞培养基(含10%小牛血清、5% AB血清、5 μmol/L唑来磷酸和300 U/ml rhIL- 2)中,于37℃、5%CO2培养箱中培养并定期补加培养基。将培养10 d的γδT细胞用倒置显微镜观察形态,用FITC-γδTCR 抗体标记γδT细胞后,流式细胞仪鉴定γδT细胞纯度。
1.2.2流式细胞仪检测TWS119对γδT细胞CCR5表达的影响将γδT细胞悬液,接种于6孔培养板,3.0×105/3 ml/孔,然后加入TWS119(终浓度分别为0、0.5、1.0、2.0、4.0、8.0 μmol/L)或Stattic (0.5 μmol/L)。置于37 ℃、5%CO2培养箱中培养48 h后,收集细胞并用PBS洗涤1次,分别向每管细胞中加入10 μl的anti-γδTCR-FITC和anti-CCR5-PE,室温避光孵育15 min,PBS洗涤后,重悬于0.5 ml的PBS溶液中,用流式细胞仪检测γδT细胞表面CCR5的表达,试验重复3次。
1.2.3Western blot分析蛋白的表达将经不同浓度TWS119或Stattic (0.5 μmol/L)处理48 h的γδT细胞,收集后用Western及IP细胞裂解液50 μl充分裂解提取蛋白,BCA法测样品蛋白浓度后用8% SDS-PAGE分离,然后将蛋白转移到PVDF膜上,用5%的脱脂奶粉封闭2 h,一抗(1∶500)4℃封闭过夜,二抗(1∶1 000)37℃孵育2 h。然后用BCIP/NBT碱性磷酸酯酶显色试剂盒,按照操作手册进行显色。结果用数码相机进行拍照记录,试验重复3次。
2结果
2.1γδT细胞鉴定将分离获得人外周血单个核细胞,用γδT细胞完全培养基于37 ℃、5%CO2培养箱中培养,2 d后γδT细胞开始增殖,到第10天后出现许多大小不同的细胞集落,细胞成梭形(图1A、B)。用流式细胞仪鉴定结果:γδT细胞比率为(85.79±5.01)% 如图1C。以上结果提示γδT 细胞培养成功,可用于后续实验。
2.2TWS119促进γδT细胞趋化因子受体CCR5的表达CCR5是表达于γδT淋巴细胞表面的主要趋化因子受体蛋白之一,介导 CCR5+γδT细胞的趋化、募集和免疫过程。本实验研究结果如图2显示,TWS119作用γδT细胞48 h后,能显著促进γδT细胞表面CCR5受体的表达,且具有剂量依赖性(P<0.05,P<0.01)。
2.3TWS119对γδT细胞中p-STAT3蛋白表达的影响将不同浓度TWS119培养的γδT细胞经Western blot 检测结果显示,随着 TWS119 浓度增加,γδT细胞内p-STAT3表达量逐渐减少,即TWS119能抑制STAT3磷酸化,且具有一定的剂量依赖性(图3)。

图1 γδT细胞鉴定Fig.1 Identification of γδT cells

图2 TWS119对γδT细胞CCR5表达的影响Fig.2 Effect of TWS119 on expression of CCR5 in γδT cellsNote: *.P<0.05;**.P<0.01.
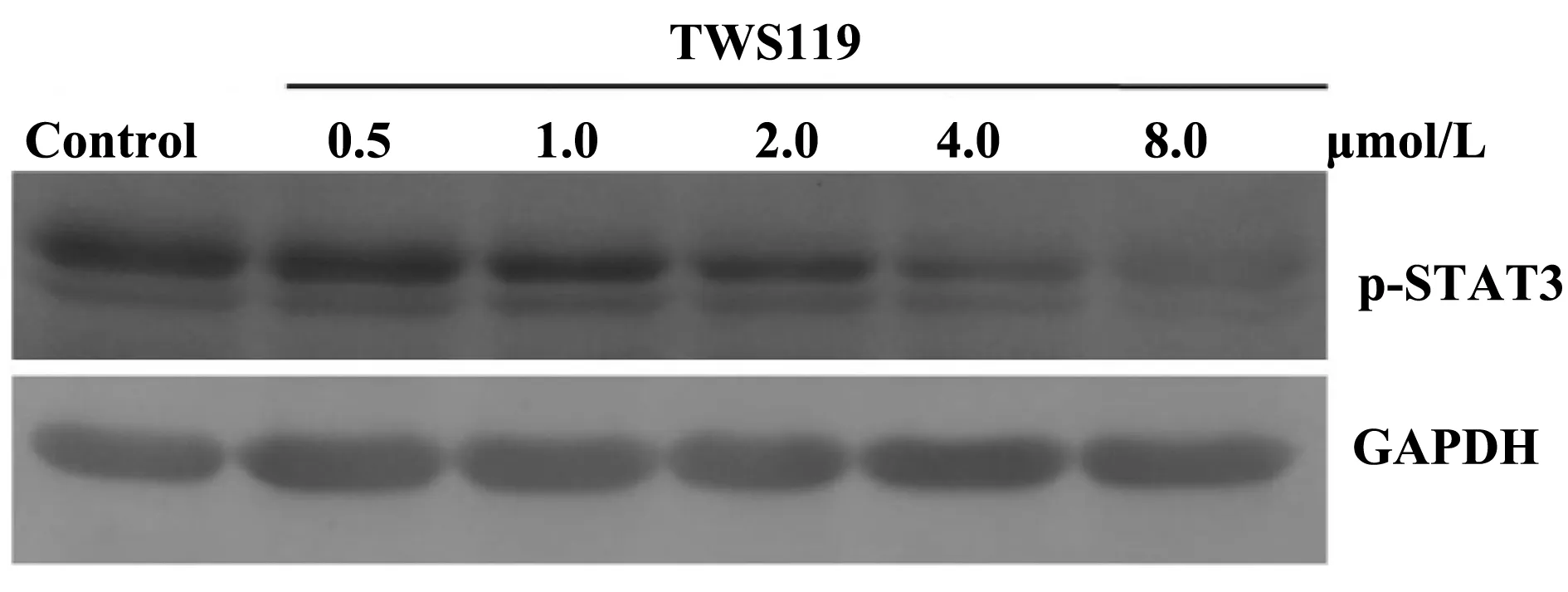
图3 TWS119对γδT细胞中p-STAT3蛋白表达的影响Fig.3 Western blot analysis of p-STAT3 expression in γδT cells
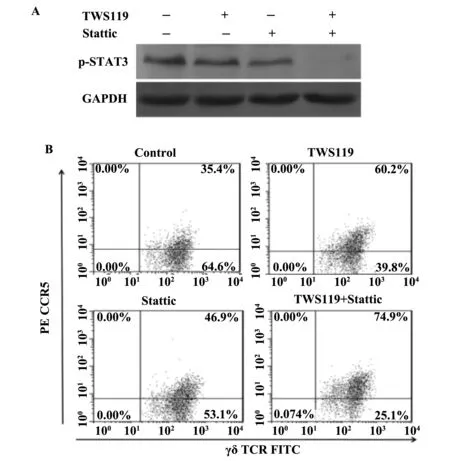
图4 STAT3抑制剂Stattic对γδT细胞CCR5表达的影响Fig.4 Effect of Stattic on expression of CCR5 in γδT cells
2.4STAT3抑制剂Stattic对γδT细胞CCR5表达的影响为了验证TWS119通过抑制STAT3磷酸化来促进γδT细胞CCR5的表达,我们用TWS119和STAT3特异性抑制剂Stattic分别和联合作用γδT细胞48 h后,蛋白水平检测结果显示, 2.0 μmol/L的TWS119和0.5 μmol/L的Stattic能明显抑制p-STAT3的表达,而且两者联合作用时具有一定的叠加或协同抑制作用(图4A)。流式细胞仪检测γδT细胞CCR5表达结果显示,STAT3特异性抑制剂Stattic能显著提高γδT细胞CCR5表达,对照组CCR5阳性表达率为(35.89±2.52)%,TWS119(2.0 μmol/L) 组为(61.14±2.98)%, Stattic(0.5 μmol/L) 组为(47.27±1.84)%;Stattic与TWS119联合组CCR5阳性表达率为(75.31±3.08)%,提示TWS119通过抑制STAT3磷酸化来促进γδT细胞CCR5表达,可能其他信号通路也有一定的参与(图4B)。
3讨论
趋化因子属于细胞因子超家族的一类小分子物质,主要由白细胞分泌,通过与靶细胞膜上相应的受体结合而发挥生物学作用。CCR5 为趋化因子 CC 受体家族成员,属于G蛋白偶联受体,CCR5 可以在多种细胞上表达,如NK 细胞、巨噬细胞、单核细胞、树突状细胞和T淋巴细胞等,与其配体 CCL3 ( MIP-1α) 、CCL4 ( MIP-1β) 和CCL5( RANTES)结合后,可激活膜内G 蛋白,并引起胞内Ca2+浓度上升及蛋白激酶C的活化,从而表现出白细胞的趋化性及炎症反应等各种生理功能[7,8]。γδT细胞是T淋巴细胞中表达γδTCR的一个亚群,研究人员发现体外扩增的 γδT 细胞表面趋化因子受体 CCR5表达显著高于αβT 细胞,这可能与其在机体内抗感染、抗肿瘤和免疫监视等方面起重要作用有关[9,10]。本研究中发现TWS119能显著促进γδT细胞趋化因子受体CCR5的表达,且具有剂量依赖性,提示用TWS119诱导培养的γδT细胞回输到体内后可能具有更好的肿瘤组织趋向性。另外,γδT细胞还具有抗原提呈功能,荷载肿瘤抗原的γδT细胞高表达CCR5可能会增强其诱发机体适应性抗肿瘤免疫能力,为γδT细胞肿瘤疫苗的临床应用提供支持[11]。
STAT3是信号转导与转录活化因子(Signal transducers and activators of transcription,STAT)家族的重要成员,存在于细胞浆与酪氨酸磷酸化信号通道偶联的双功能蛋白,在胞外信号的刺激下可激活STAT3即STAT3磷酸化,之后发生二聚化进入胞核,识别并结合于特定的DNA启动子序列,激活靶基因的转录,从而调控细胞的增殖、分化和凋亡等过程[12,13]。我们实验中发现TWS119能抑制γδT细胞中STAT3蛋白的磷酸化。为了研究STAT3信号通路与CCR5表达之间的关系。我们分别用2.0 μmol/L 的TWS119和0.5 μmol/L的 STAT3抑制剂Stattic单独和联合处理γδT细胞48h后结果发现,它们均能抑制STAT3蛋白的磷酸化的同时并能促进CCR5表达,两者联合时结果具有一定的叠加或协同作用,提示STAT3信号通路参与γδT细胞CCR5的表达。
本研究结论是用TWS119体外培养γδT细胞时通过抑制STAT3的磷酸化信号通路来促进趋化因
子受体CCR5的表达。为体外扩增在体内具有肿瘤组织趋向性的CCR5+γδT细胞提供准确的作用靶点和一定的实验依据。
参考文献:
[1]Ding S,Wu TY,Brinker A,etal.Synthetic small molecules that control stem cell fate[J].Proc Natl Acad Sci USA,2003,100(13):7632-7637.
[2]Gattinoni L,Ji Y,Restifo NP.Wnt/beta-catenin signaling in T-cell immunity and cancer immunotherapy[J].Clin Cancer Res,2010,16(19):4695-4701.
[3]Gattinoni L,Lugli E,Ji Y,etal.A human memory T cell subset with stem cell-like properties[J].Nat Med,2011,17(10):1290-1297.
[4]Forget MA,Huon Y,Reuben A,etal.Stimulation of Wnt/β-catenin pathway in human CD8+T lymphocytes from blood and lung tumors leads to a shared young/memory phenotype[J].PLoS One,2012,7(7):e41074.
[5]陈永强,郑璐,刘军权,等.糖原合酶激酶3β抑制剂TWS119对γδT细胞增殖及表型的影响[J].中国免疫学杂志,2015,31(6):748-752.
[6]陈永强,郑璐,刘军权,等.糖原合酶激酶3β抑制剂TWS119激活NK细胞Wnt /β-catenin信号通路促进CD62L表达[J].细胞与分子免疫学杂志,2015,35(1):44-48.
[7]Griffith JW,Sokol CL,Luster AD.Chemokines and chemokine receptors:positioning cells for host defense and immunity[J].Annu Rev Immunol,2014,32:659-702.
[8]González-Martín A,Gómez L,Lustgarten J,etal.Maximal T cell-mediated antitumor responses rely upon CCR5 expression in both CD4(+) and CD8(+) T cells[J].Cancer Res,2011,71(16):5455-5466.
[9]康宁,殷珊珊,汤龙,等.体外扩增γδ T 细胞的肿瘤组织趋向性[J].基础医学与临床,2011,31(11):1210-1216.
[10]Vantourout P,Hayday A.Six-of-the-best:unique contributions of γδ T cells to immunology[J].Nat Rev Immunol,2013,13(2):88-100.
[11]Khan MW,Eberl M,Moser B.Potential use of γδ T cell-based vaccines in cancer immunotherapy[J].Front Immunol,2014,5:512.
[12]Kane A,Deenick EK,Ma CS,etal.STAT3 is a central regulator of lymphocyte differentiation and function[J].Curr Opin Immunol,2014,28:49-57.
[13]Herrmann A,Kortylewski M,Kujawski M,etal.Targeting Stat3 in the myeloid compartment drastically improves the in vivo antitumor functions of adoptively transferred T cells[J].Cancer Res,2010,70:7455-7464.
[收稿2016-01-13修回2016-03-23]
(编辑张晓舟)
TWS119 upregulates CCR5 expression of γδT cells by inhibiting STAT3 phosphorylation
XU Jing,SUN Lei-Qing,CHEN Yong-Qiang,ZHENG Lu,LV Xiao-Ting,CHEN Fu-Xing,LIU Jun-Quan,ZHOU Zhong-Hai.
Department of Central Laboratory,97th Hospital of PLA,Xuzhou 221004,China
[Abstract]Objective:To investigate the mechanisms of TWS119 induced CCR5 expression in hunman γδT cells.Methods: After treatment with various concentrations of TWS119 for 48h,the expression of CCR5 in γδT cells were detected by flow cytometry.The p-STAT3 and GAPDH expression were examined by Western blot analysis.Results: TWS119 could upregulate the expression of CCR5 in dose dependent manner.Western blot analysis revealed that TWS119 inhibit phosphorylation of STAT3,but had no significant impact on GAPDH.In addition,pretreatment of γδT cells with 0.5 μmol/L STAT3 specific phosphorylation inhibitor Stattic could upregulate the expression of CCR5 and enhance the TWS119 induced CCR5 expression.Conclusion: TWS119 could upregulate CCR5 expression of γδT cells by inhibiting STAT3 phosphorylation in vitro.
[Key words]TWS119;CCR5;γδT cells;STAT3
doi:10.3969/j.issn.1000-484X.2016.06.012
作者简介:徐晶(1990年-),女,技师,主要从事分子免疫学方面的研究,E-mail:920213370@qq.com。 通讯作者及指导教师:郑璐(1985年-),女,主管技师,主要从事分子免疫学方面研究,E-mail:xsdzhenglu@163.com。 周忠海(1973年-),男,副主任医师,主要从事肿瘤免疫治疗方面的研究,E-mail:zhouzhonghai298@aliyun.com。
中图分类号R392.12Q253
文献标志码A
文章编号1000-484X(2016)06-0825-04
①本文受南京军区医学科技创新研究基金(14MS032) 资助。
