铜矿重金属污染对土壤微生物群落多样性和酶活力的影响
2016-06-28张雪晴张琴程园园荚荣
张雪晴,张琴,程园园,荚荣
安徽大学生命科学学院,安徽 合肥 230601
铜矿重金属污染对土壤微生物群落多样性和酶活力的影响
张雪晴,张琴,程园园*,荚荣*
安徽大学生命科学学院,安徽 合肥 230601
摘要:重金属污染导致土壤环境质量的恶化,而土壤微生物的群落多样性和土壤酶活力是评估污染程度的重要指标。该研究选择了安徽铜陵铜矿附近受重金属复合污染的4个土壤样本,评估和比较了样本中5种重金属(砷、镉、锌、铅和铜)的污染程度;研究和分析了土壤细菌和真菌群落的多样性以及土壤酶活力。结果表明,(1)从样本S1到S4,综合污染指数分别为0.71、3.85、4.37和8.47;S1样本尚未受到重金属污染,而S2、S3和S4样本受到不同程度重金属砷、镉、锌和铜的污染;以镉污染为主,不存在铅污染。(2)从样本S1到S4,随着综合污染程度的增加,土壤中脲酶、磷酸酶和脱氢酶的酶活力均呈现降低的趋势,且磷酸酶和脱氢酶的酶活力与镉、锌和铅的浓度呈显著负相关,而脲酶酶活力与重金属浓度没有明显的相关性。(3)随着综合污染指数的上升,细菌和真菌群落的多样性均下降,且真菌群落物种丰富度的变化明显于细菌。该研究对矿区土壤重金属生物治理及环境修复具有重要意义。
关键词:铜矿;土壤;重金属;微生物群落多样性;土壤酶活力
引用格式:张雪晴, 张琴, 程园园, 荚荣. 铜矿重金属污染对土壤微生物群落多样性和酶活力的影响[J]. 生态环境学报, 2016,25(3): 517-522.
ZHANG Xueqing, ZHANG Qin, CHENG Yuanyuan, JIA Rong. The Impact of Heavy Metal Contamination on Soil Microbial Diversity and Enzyme Activities in A Copper Mine [J]. Ecology and Environmental Sciences, 2016, 25(3): 517-522.
随着工业的发展,某些地区土壤中重金属含量上升,致使土壤生态环境恶化,对土壤生物的多样性产生重大的影响(Khan et al.,2008;Pan et al.,2011;Gilbert et al.,2012)。矿山的开采可导致土壤被重金属污染,直接或间接影响人体的健康。已有报道表明,采矿区或其附近土壤受到金属砷(As)、镉(Cd)、锌(Zn)、铅(Pb)和铜(Cu)等不同程度的污染(Jung,2008;胡淼等,2014),因此,研究矿区土壤中重金属污染状况对保护生态环境和人类健康具有显著意义。
相对于植物,土壤微生物对土壤环境变化的响应更为灵敏,并且在维护生态系统的结构和稳定性方面发挥着重要作用。此外,通过与植物的相互作用,微生物还会影响重金属离子的迁移(Belimov et al.,2009)。由于土壤中微生物种类多样,数量庞大,以及代谢活动旺盛,土壤中微生物被认为是衡量土壤质量的灵敏的、重要的指标(Khan et al.,2010;Zhang et al.,2015)。
土壤中的酶主要来自土壤微生物,土壤微生物的活性直接影响土壤的酶活力(Burns et al.,2013)。土壤中的酶在生物地球化学循环、土壤的结构维持和污染物解毒的代谢和反应过程中起着重要的催化作用,并为微生物和植物的生长提供某些化合物(Zhang et al.,2015)。因此,土壤酶活力常被用作评估土壤质量的指标,同时也可以反映土壤中的微生物群落状态(Chung et al.,2015)。在众多和重金属污染相关的土壤酶中,脲酶、磷酸酶和脱氢酶最具代表性(Jyot et al.,2015;Tejada et al.,2008)。
实验室条件下分析短期重金属污染对微生物多样性和土壤酶活力的影响已有较多研究,但长期暴露于重金属的土壤污染相关研究较少。铜陵是我国有名的铜矿基地,矿产资源丰富,但在矿产资源大量开发的同时,也给当地环境带来了影响,尤其是重金属污染已成为破坏农田土壤环境的重要因素(樊霆等,2013)。因此,本研究选择了安徽铜陵铜矿的土壤样本,通过土壤微生物的群落多样性以及土壤酶活力的分析,反映其重金属污染程度,为土壤污染的质量评价、生物治理及环境修复提供实验依据和理论指导。
1 材料与方法
1.1 采样与分析
铜陵市位于安徽省中部,矿产资源丰富。狮子山是铜陵最具代表性的铜金多金属矿山,也是铜陵最大的矿床,位于铜陵市东边。该矿山从1958年开始基建,到2002年开采完毕(胡新付等,2011)。因为矿山的开采,该地区土壤环境受到了很大影响,重金属污染程度不尽相同,其中镉的污染较为严重(杨西飞,2007)。
采用GPS定位,在狮子山附近较大的耕地进行采样,每隔1 km设置1个采样点,利用内径5 cm 的PVC管,采用5点混合法采集表层土壤(0~20 cm)样本,每个样本分成2份,分装于封口袋中,一份放入冰盒作为新鲜样,另一份作为风干样。新鲜样品用于微生物的测量,风干样品用于重金属和理化性质的测量(国家环境保护总局,2005)。
1.2 重金属和pH的测定
风干的样品用HNO3和H2O2消解后,用原子吸收分光光度法测定As、Cu、Zn、Pb和Cd的含量。称取20 g土壤,加入50 mL去离子水,振荡摇匀,静置2~3 h,用pH计测上清液pH。
1.3 土壤重金属污染评价方法
土壤重金属污染评价方法用单因子指数法(Pi)和尼梅罗综合污染指数法(Pc)(Brady et al.,2014;Islam et al.,2015)。
1.3.1 单因子指数法
单因子指数计算公式为:

式中,Pi是土壤中金属i的环境质量指数;Ci是金属i的实际测量值(mg·kg-1);Si是土壤中金属i的评价标准值(mg·kg-1)(GB 15618─1995)。
1.3.2 尼梅罗综合污染指数法
尼梅罗综合污染指数计算公式为:

式中,(Ci/Si)max是土壤污染指数的最大值;(Ci/Si)ave是土壤污染指数的平均值。
1.4 酶活力测定
根据已报道的方法测定脲酶、磷酸酶和脱氢酶的活力(Jyot et al.,2015)。脲酶、磷酸酶和脱氢酶的活力分别用1 kg土壤在1 h内生成的NH3-N的质量、1 kg土壤在1 h内生成的p-硝基苯酚(p-NP)的质量、1 kg土壤在1 d内生成的三苯基四氮唑氯化物(TPF)的质量表示。
1.5 DNA提取和PCR
取0.2 g冻干的土样,用土壤DNA提取试剂盒(上海生工)抽提土壤样品的DNA。引物GC-Fung (5'-GC-clamp-CATTCCCCGTTACCCGTTG-3')和NS1(5'-GTAGTCATATGCTTGTCTC-3')扩增真菌18S rDNA,扩增片段长度为550 bp(May et al.,2001)。引物357F-GC(5'-GC-clamp-CCTACGGGAGGCAGCAG-3')和518R(5'-ATTACCGCGGCTGCTGG-3')扩增细菌16S rDNA 的V3可变区,扩增片段长度为250 bp(Yu et al.,2004)。用凝胶电泳检验PCR产物后用于DGGE分析。
1.6 DGGE分析
取10 μL 18S rDNA PCR的产物进行DGGE分析。采用变性梯度为20%~40%、浓度为6%的聚丙烯酰胺凝胶,在1×TAE缓冲液中150 V和60 ℃条件下电泳8 h。取10 μL 16S rDNA PCR的产物进行DGGE分析。采用变性梯度为35%~55%、浓度为8%的聚丙烯酰胺凝胶(化学变性剂为100%尿素7 mol·L-1和40%(V/V)的丙烯酰胺),在1×TAE缓冲液中150 V和60 ℃条件下电泳5 h。电泳完毕后,采用银染法染色,并且利用Bio-Rad公司的Gel-Doc2000凝胶成像系统拍照。
根据电泳条带的丰度和密度计算戴斯系数,得到相似矩阵,并构建聚类图,分析样品间微生物种群的相似性(Nicol et al.,2003)。根据电泳图谱中样品条带数目及每个条带的强度(灰度),对各样品中微生物多样性指数(H′)、均匀度(E)和丰富度(S)等指标进行分析(秦燕燕等,2009)。具体算法如下:
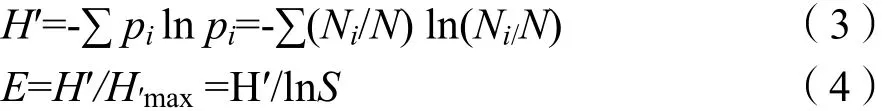
其中,pi为样品中单一条带的强度在该样品所有条带总强度中所占的比率,N为DGGE图谱单一泳道上所有条带的丰度,Ni为第i条带的丰度;S是某样品中所有条带数目总和。
1.7 平板计数法
用平板计数法对土壤中异养细菌、放线菌、丝状真菌和酵母的活细胞数计数。分别配制牛肉膏蛋白胨培养基、高氏一号培养基、察氏培养基和麦芽汁培养基培养细菌、放线菌、霉菌和酵母菌(姚万春等,2011;邓晓,2012)。可培养的细胞数用菌落形成单位(CFU)表示。
1.8 数据分析
用Origin 8.0计算平均值和标准差,用t-检验比较平均值,显著水平为P<0.05。用SPSS作皮尔森相关性分析。DGGE图谱采用Quantity one软件对每个样品的电泳条带数目、条带密度进行数字化分析。
2 结果与讨论
2.1 土壤性质
4个土壤样品中As、Cd、Zn、Pb和Cu的含量如表1所示。4个土壤样品中各金属的单因素指数和综合污染指数的计算结果如表2所示。单因素指数法的土壤分类标准如下:Pi≤1表示清洁;Pi>1表示污染。Pi值越大,表示污染越严重。土样1(S1)中5种金属的Pi值都小于1,说明S1中5种金属的含量均在标准范围内,未受污染。其它3个样品中,Pb的单因子指数均在正常范围内,说明不存在Pb污染。土样2(S2)中As、Cd和Cu含量超标,土样3(S3)和土样4(S4)中As、Cd、Zn和Cu都超标。综合污染指数法的土壤分类标准如下:0.7

表1 4个土壤样品的理化性质和金属含量Table 1 Physicochemical properties and heavy metal content of four soil samples

表2 4个土壤样品的环境质量指数Table 2 Environmental quality index of heavy metals in 4 soil samples
2.2 土壤酶活力
土壤酶活力反应了微生物和植物对环境的响应,土壤中化肥、金属离子和化学污染物均会影响土壤中酶的活力。同时,土壤中的酶对土壤生态环境、物理化学性质、土壤肥力和健康也有一定的影响。本研究分析了土壤中脱氢酶、磷酸酶和脲酶的活力,这三者是常用的衡量土壤健康的指标(Jyot et al.,2015)。脲酶水解尿素,会导致土壤中的N流失(Upadhyay,2012)。磷酸酶在磷酸盐循环中有重要作用,它调节营养物质的吸收和植物生长(Nannipieri et al.,2011)。因此,脲酶和磷酸酶主要影响土壤的肥力。脱氢酶主要存在于细胞,氧化土壤有机质。因为脱氢酶参与呼吸作用,所以它的活力是土壤微生物活性和土壤健康的重要指标。
3种酶的活力测定结果如表3所示。S4的3种酶的活力均最低,而且S4的综合污染指数也最高。用皮尔森相关系数进一步分析重金属浓度和酶活力间的相互关系,结果如表4所示,磷酸酶和脱氢酶的活力与Cd、Zn和Pb的浓度呈极显著负相关关系,与Cu的浓度呈负相关关系。由此表明,脱氢酶和磷酸酶可以作为土壤Cd、Zn和Pb污染指示剂。脲酶活力仅仅与As浓度表现出较弱的负相关关系,与其它金属浓度没有表现出明显的相关性。

表3 土壤样品中的酶活力Table 3 Enzyme activities of soil samples

表4 土壤酶活力和重金属浓度的皮尔森相关性分析Table 4 Pearson correlation coefficient of enzyme activity and heavy metal concentrations
2.3 微生物多样性
DGGE可以快速地对多个样本的微生物群落多样性进行分析。图1a是4个土样细菌16S rDNA的V3可变区扩增产物的DGGE电泳图,图1b是量化的电泳图,图1c是聚类分析后得到的系统树图。图1c显示了4个土壤样本中细菌群落的相似性,可见S1的细菌群落与其它3个样本差异最大,S2 和S3的细菌群落相似度最高,该结果与用综合污染指数的评估结果相一致。S1的Pc值最小,S4的Pc值最大。这一结果表明,重金属的综合污染程度对细菌群落多样性产生明显影响。
表5显示了各样本中细菌的群落多样性。S1的丰富度为25,香农指数(Shannon-Wiener)为3.2086。S4的香农指数、丰富度(Richness)和均匀度(Evenness)都是最低的,尤其是丰富度,仅为21,说明重金属污染程度的加大,引起细菌物种数量的下降,导致细菌群落多样性降低。

图1 细菌16s rDNA的PCR产物DGGE电泳图(a)和量化图(b);样品间细菌的聚类图(c)Fig. 1 DGGE profiles of bacterial 16S rDNA (a) and quantitative figure(b); clustering figure of bacteria in samples (c)

表5 各样本的细菌多样性分析Table 5 Bacterial diversity analysis of samples
4个土壤样本中真菌18S rDNA扩增产物的DGGE电泳图见图2a,图2b为量化的电泳图,图2c为聚类分析后得到的系统树图。从系统树图2c可看出,S2和S3中的真菌群落相似度最高,为69%,S1中真菌群落与其他3个样本的真菌群落差异较大。这一结果表明,真菌群落受到了重金属的明显影响。

图2 真菌18s rDNA的PCR产物DGGE电泳图(a)和量化图(b);样品间真菌的聚类图(c)Fig. 2 DGGE profiles of fungal 18S rDNA (a) and quantitative figure(b);clustering figure of fungal in samples (c)

表6 各样品的真菌多样性分析Table 6 Fungal diversity analysis of samples
表6显示了各样本中真菌的群落多样性。数据显示,从S1到S4,随着土壤重金属的综合污染指数逐渐增大,香农指数和丰富度均逐渐下降,表明真菌群落的多样性下降。与细菌相比,从S1到S4,均匀度有些改变,可能是随着土壤重金属的综合污染指数增大,造成某些真菌种类的失去而另外一些耐受重金属的真菌种类富集,4个样本物种个体数目分配的均匀程度发生了变化。数据显示,从S1到S4,真菌群落的物种丰富度分别为30、28、25 和24,而细菌群落的物种丰富度分别为25、25、25和21。说明真菌群落的多样性指数减小主要是由于其物种丰富度的变化而引起的,且真菌群落物种丰富度的变化明显于细菌。施晓东等(2003)综述了重金属污染土壤的微生物响应,表明低浓度的重金属有促进微生物数量的作用,高浓度则有抑制作用;微生物对高浓度重金属的敏感性,通常是放线菌>细菌>真菌。张晓宇等(2010)研究了重金属Cd污染对旱田土壤微生物群落的影响,结果显示,微生物对Cd的敏感程度为细菌>放线菌>真菌。谢学辉等(2012)以德兴铜矿尾矿重金属污染土壤为研究对象,表明不同重金属浓度对微生物多样性的影响不是简单的线性关系;重金属污染可能改变原有微生物群落内种群间的关系,新的耐受菌种产生,而原优势种群失去优势作用。

表7 土壤样品中原核和真核微生物的数量Table 7 Numbers of prokaryotic and eukaryotic microorganisms in soil samples. Values are mean of three replicates ± SD 108cfu·g-1
微生物主要分为细菌、放线菌、霉菌和酵母菌四大类。用平板培养法对土壤中四大类可培养微生物进行计数,进一步分析土壤中微生物的丰富度。表7显示,土壤中的细菌、放线菌、霉菌和酵母菌的数量都达到了1×107~1×108CFU·g-1。其中,细菌数量最大,真菌数量略少于细菌。S4样本的可培养微生物总数最小,这与用综合污染指数法评估土壤污染程度的结果相符合。从S1到S4,可培养细菌的数量随土壤重金属污染程度的增加逐渐下降,而可培养的放线菌、霉菌和酵母菌的数量变化没有规律性。另外,这3类微生物数量在样本之间的变化,也并未与其多样性指数的结果一致。分析其原因,一方面,微生物的分离培养方法有技术上的局限性,且土壤中存在多数不可培养微生物,因此,这种传统的方法不能准确反映微生物多样性的实际存在状态;另一方面,矿区土壤是一个复杂的环境,含有复合重金属,且包含多种结构的有机化合物,如腐殖酸、腐殖酸样物、酚类化合物等(Fortin et al.,2004),土壤微生物在受重金属影响的同时,也受其它因素的影响。正如谢学辉等(2012)的研究结果,对于长期重金属污染的野外实地样品,不同重金属浓度影响微生物多样性可能不是实验室研究的简单线性关系。但是,土壤微生物群落多样性能够表征土壤生态系统群落结构和稳定性,是最有潜力的敏感性生物指标之一(孙波等,1997)。
3 结论
本文分析了铜陵铜矿土壤样本中的微生物群落多样性和土壤酶活力。结果显示,从样本S1到S4,土壤重金属综合污染程度加大,细菌和真菌群落的多样性均下降,且真菌丰富度的变化明显于细菌,土壤酶活力也随之减低。磷酸酶和脱氢酶的活力随着Cd、Zn和Pb浓度的升高而明显下降,因此,磷酸酶和脱氢酶可以作为预测土壤重金属Cd、Zn 和Pb污染的有效指标之一。由此可见,利用微生物群落多样性表征矿区重金属污染土壤的环境质量具有一定的可行性,但仍有待进一步深入研究。
参考文献:
BELIMOV A A, PUHALSKY I V, SAFRONOVA V I, et al. 2009. Geochemical behavior of heavy metals in a Zn-Pb-Cu mining area in the State of Mexico (central Mexico) [J]. Environmental Monitoring and Assessment, 155(1-4): 355-72.
BRADY J P, AYOKO G A, MARTENS W N, et al. 2014. Enrichment,distribution and sources of heavy metals in the sediments of Deception Bay, Queensland, Australia [J]. Marine Pollution Bulletin, 81(1): 248-255.
BURNS R G, DEFOREST J L, MARXSEN J, et al. 2013. Soil enzymes in a changing environment: Current knowledge and future directions [J]. Soil Biology and Biochemistry, 58: 216-234.
CHUNG H, KIM M J, KO K, et al. 2015. Effects of graphene oxides on soil enzyme activity and microbial biomass [J]. Science of Total Environment, 514: 307-313
FORTIN N, BEAUMIER D, LEE K, et al. 2004. Soil washing improves the recovery of total community DNA from polluted and high organic content sediments [J]. Journal of Microbiological Methods, 56(2): 181-91.
GILBERT N, FULTHORPE R, KIRKWOOD A E. 2012. Microbial diversity,tolerance, and biodegradation potential of urban wetlands with different input regimes [J]. Canadian Journal of Microbiology, 58(7): 887-897.
ISLAM M S, AHMED M K, HABIBULLAH-AL-MAMUN M, et al. 2015. Potential ecological risk of hazardous elements in different land-use urban soils of Bangladesh [J]. Science of the Total Environment,512-513: 94-102.
JUNG M C. 2008. Heavy metal concentrations in soils and factors affecting metal uptake by plants in the vicinity of a Korean Cu-W mine [J]. Sensors-Basel, 8(4): 2413-2423.
JYOT G, MANDAL K, SINGH B. 2015. Effect of dehydrogenase,phosphatase and urease activity in cotton soil after applying thiamethoxam as seed treatment [J]. Environmental Monitoring and Assessment, 187(5): 298.
KHAN S, CAO Q, ZHENG Y M, et al. 2008. Health risks of heavy metals in contaminated soils and food crops irrigated with wastewater in Beijing, China [J]. Environmental Pollution, 152(3): 686-92.
KHAN S, HESHAM A E L, QIAO M, et al. 2010. Effects of Cd and Pb on soil microbial community structure and activities [J]. Environmental Science and Pollution Research, 17(2): 288-296.
MAY L A, SMILEY B, SCHMIDT M G.2001. Comparative denaturinggradient gel electrophoresis analysis of fungal communities associated with whole plant corn silage [J]. Canadian Journal of Microbiology,47(9): 829-841.
NANNIPIERI P, GIAGNONI G, LANDI L, et al. 2011. Role of phosphatase enzymes in soil [M]. Berlin: Springer: 215-243.
NICOL G W, GLOVER L A, PROSSER J I. 2003. Spatial analysis of archaeal community structure in grassland soil [J]. Applied and Environmental Microbiology, 69(12): 7420-7429.
PAN J, YU L. 2011. Effects of Cd or/and Pb on soil enzyme activities and microbial community structure [J]. Ecological Engineering, 37(11): 1889-1894.
TEJADA M, MORENO J L, HERNÁNDEZ M T, et al. 2008. Soil amendments with organic wastes reduce the toxicity of nickel to soil enzyme activities [J]. European Journal of Soil Biology, 44(1): 129-140.
UPADHYAY LSB. 2012. Urease inhibitors: A review [J]. Indian Journal of Biotechnology, 11(4): 381-388.
YU Z T, MORRISON M. 2004. Comparisons of different hypervariable regions of rrs genes for use in fingerprinting of microbial communities by PCR-denaturing gradient gel electrophoresis [J]. Applied and Environmental Microbiology, 70(8): 4800-4806.
ZHANG J, QIN J, ZHAO C C, et al. 2015. Response of bacteria and fungi in soil microcosm under the presence of pesticide endosulfan [J]. Water,Air & Soil Pollution, 226(4): 1-9.
ZHANG Q, ZHOU W, LIANG G Q, et al. 2015. Distribution of soil nutrients, extracellular enzyme activities and microbial communities across particle-size fractions in a long-term fertilizer experiment [J]. Applied Soil Ecology, 94: 59-71.
GB 15618─1995. 中华人民共和国国家标准土壤环境质量标准[S].
HJ/T 167─2004. 土壤环境监测技术规范[S].
国家环境保护总局. 2005. 土壤环境监测技术规范(HJ/T 167-2004)[M].北京: 中国环境科学出版社.
邓晓. 2012. 香蕉枯萎病区土壤微生物多样性研究[D]. 海南: 海南大学: 16.
樊霆, 叶文玲, 陈海燕,等. 2013. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, (10):1727-1736.
胡淼, 吴家强, 彭佩钦,等. 2014. 矿区耕地土壤重金属污染评价模型与实例研究[J]. 环境科学学报, 34(2): 423-430.
胡新付, 周贵斌, 徐晓春. 2011. 安徽铜陵狮子山铜矿床探采对比研究[J]. 安徽地质, 21(1): 27-31.
秦燕燕, 李金花, 王刚, 等. 2009. 添加豆科植物对弃耕地土壤微生物多样性的影响 [J]. 兰州大学学报: 自然科学版, 45(3): 55-60.
施晓东, 常学秀. 2003. 重金属污染土壤的微生物响应[J]. 生态环境,12(4): 498-499.
孙波, 赵其国, 张桃林, 等. 1997. 土壤质量与持续环境——Ⅲ.土壤质量评价的生物学指标[J]. 土壤, 29(5): 225-234.
谢学辉, 范凤霞, 袁学武, 等. 2012. 德兴铜矿尾矿重金属污染对土壤中微生物多样性的影响[J]. 微生物学通报, 39(5): 624-637.
杨西飞. 2007. 铜陵矿区农田土壤及水稻的重金属污染现状研究[D]. 合肥: 合肥工业大学: 75.
姚万春, 唐玉明, 任道群, 等. 2011. 白酒曲药微生物分离培养基的选择研究[J]. 酿酒, 38(3): 39-41.
张晓宇, 晋日亚, 白红娟. 2010. 重金属Cd污染对旱田土壤微生物群落的影响[J]. 工业安全与环保, 36(11): 31-32.
The Impact of Heavy Metal Contamination on Soil Microbial Diversity and Enzyme Activities in A Copper Mine
ZHANG Xueqing, ZHANG Qin, CHENG Yuanyuan*, JIA Rong*
School of Life Sciences, Anhui University, Hefei 230601, China
Abstract:Contamination of heavy metals results in deterioration of soil health, which can be assessed by the diversity of microbial community and the activity of soil enzymes. In this study, four soil samples were collected from a copper mine in Tongling City of China, and were further analyzed for evaluating the contamination of five metals (arsenic, cadmium, zinc, lead and copper), the diversity of bacteria and fungi as well as the activity of soil enzymes. Our results indicated that: (1) the comprehensive pollution index was 0.71, 3.85, 4.37 and 8.47 for sample 1 to 4 (S1~S4), respectively, indicating that S1 was uncontaminated while S2, S3 and S4 were contaminated to different extent; cadmium was the main metal while no lead was detected in four samples; (2) the activity of urease, phosphatase and dehydrogenase decreased with the increase of the comprehensive pollution index of four samples; the activity of phosphatase and dehydrogenase was negatively correlated to the concentration of cadmium, zinc and lead, while the urease activity showed no significant correlation with these metals; (3) the diversity of bacteria and fungi decreased with the increase of the comprehensive pollution index, and the change of fungi abundance was more obvious than that of bacteria. This study will contribute to the bioremediation of heavy metal contamination in mining areas.
Key words:copper mine; soil; heavy metals; microbial diversity; soil enzymes activity
DOI:10.16258/j.cnki.1674-5906.2016.03.022
中图分类号:X172
文献标志码:A
文章编号:1674-5906(2016)03-0517-06
基金项目:国家自然科学基金项目(31571286);国家环保公益性行业科研专项项目(201009041);安徽省高等学校自然科学研究项目(KJ2015A010)
作者简介:张雪晴(1990年生),女,硕士研究生,研究方向为应用与环境微生物学。E-mail: ahuzxq@yeah.net
*通信作者:荚荣,女,教授,研究方向为应用与环境微生物学。E-mail: ahujiarong@163.com。程园园,女,副教授,研究方向为应用与环境微生物学。E-mail: chengyy@ahu.edu.cn
收稿日期:2016-01-06
