进展性肝纤维化与2型糖尿病周围神经病变的关系
2016-06-28谢春晓贾国瑜王璐李强王绍程杨玲邸阜生
谢春晓,贾国瑜,王璐,李强,王绍程,杨玲,邸阜生
进展性肝纤维化与2型糖尿病周围神经病变的关系
谢春晓1,贾国瑜2,王璐2,李强2,王绍程2,杨玲1,邸阜生2
摘要:目的研究进展性肝纤维化与2型糖尿病周围神经病变(DPN)之间的关系。方法选取近3年(2013年2月—2015年2月)在天津市第三中心医院住院的2型糖尿病(T2DM)患者173例(男89例,女84例),根据非酒精性脂肪性肝病纤维化评分(NFS)分为3组:A组(NFS -1.455)49例,B组(-1.455<NFS<0.676)95例,C组(NFS 0.676)29例。比较3组DPN、感觉神经病变(SNCA)和运动神经病变(MNCA)的发生率,并分析3种疾病的影响因素。DPN、SNCA和MNCA由神经电图确诊,肝纤维化严重程度由NFS确定。结果A、B、C组患者DPN、SNCA、MNCA的发生率分别为69.4%、78.9%、86.2%,65.3%、73.7%、86.2%和38.8%、49.5%、65.5%,组间差异均无统计学意义。Logistic回归分析示高NFS为DPN、SNCA、MNCA的独立危险因素。结论非酒精性脂肪性肝病导致的肝纤维化与DPN发生率的增加有关,高NFS是导致T2DM患者发生DPN、SNCA、MNCA的独立危险因素。
关键词:糖尿病,2型;脂肪肝;糖尿病神经病变;非酒精性脂肪性肝病;进展性肝纤维化;肝脂含量;糖尿病周围神经病变
作者单位:1天津医科大学三中心临床学院(邮编300170);2天津市第三中心医院、天津市人工细胞重点实验室
非酒精性脂肪性肝病(NAFLD)是2型糖尿病(T2DM)较为常见的伴发症,包括单纯性脂肪肝、脂肪性肝炎、脂肪性肝纤维化及肝硬化。与非糖尿病人群相比,T2DM患者发生NAFLD的风险增高,且更易发展为肝纤维化,甚至肝硬化[1-2]。国外一些小样本的对T2DM患者肝脏穿刺活检的研究估计,非酒精性脂肪性肝炎(NASH)的患病率为63%~87%,且中重度肝纤维化占22%~60%[3-6]。国内也有研究证实,随着糖尿病病程的延长,肝脏脂肪含量(liver fat content,LFC)逐渐减少,NAFLD向进展性肝纤维化发展,糖尿病是NAFLD由单纯性脂肪变性向肝纤维化进展的危险因素[7]。许多研究显示,在T2DM患者中,NAFLD与糖尿病性周围神经病变(DPN)之间存在一定的相关性[8-11],但是,作为NAFLD更高级别表现形式的肝纤维化,其与DPN的关系尚鲜有文献报道。本研究通过对173例T2DM患者的资料进行分析,初步阐述了NAFLD肝纤维化与DPN之间的关系。
1 对象与方法
1.1研究对象回顾性查阅近3年(2013年2月—2015年2月)在天津市第三中心医院住院的1 419例T2DM患者资料,根据入选和排除标准,最终符合条件的患者173例。糖尿病及空腹血糖调节受损的诊断符合2010年美国糖尿病协会(ADA)糖尿病的诊断标准;NAFLD的诊断符合2010年中华医学会修订的NAFLD诊疗指南;DPN的诊断符合2010年美国ADA糖尿病周围神经病诊断标准。排除标准:(1)1型糖尿病、妊娠期糖尿病和其他特殊类型的糖尿病。(2)糖尿病急性并发症,包括糖尿病酮症酸中毒、非酮症高渗性糖尿病昏迷、乳酸酸中毒及低血糖昏迷。(3)严重的心、肺、脑、肝、肾疾病患者。(4)恶性肿瘤病史者。(5)超过5年的长期饮酒史,折合乙醇量男性>140 g/周,女性>70 g/周。(6)自身免疫性肝炎、病毒性肝炎、药物性肝病及肝豆状核变性等可引起脂肪肝的疾病。(7)合并除糖尿病外其他原因所致的神经病变(包括药物或毒物中毒、结缔组织病及其他代谢疾病或遗传疾病等)。(8)严重精神疾患史。根据非酒精性脂肪性肝病纤维化评分(NAFLD fibrosis score,NFS)[12]将173例患者分为3组:A组(NFS -1.455)49例,B组(-1.455<NFS<0.676)95例,C组(NFS 0.676)29例。患者NFS 0.676可确诊为进展性肝纤维化,NFS -1.455可排除进展性肝纤维化,-1.455<NFS<0.676的患者既不能确诊也不能排除进展性肝纤维化。1.2研究方法记录173例患者体质量、身高、血压、臀围(HC)、腰围(WC),并计算其体质量指数(BMI)和腰臀比(WHR)。清晨空腹静脉取血,空腹血浆葡萄糖(FBG)由葡萄糖氧化酶法测定;空腹胰岛素(FINS)及空腹C肽(fasting C-peptide,FCP)由放射免疫法测定;计算胰岛素抵抗指数HOMA-IR=FBG(mmol/L)×FINS(mIU/L)/22.5。糖化血红蛋白(HbA1c)由高压液相色谱法测定;总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)由酶化学法测定;游离脂肪酸(FFA)由酶比色法测定;丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、γ-谷氨酰转肽酶(γ-GGT)和碱性磷酸酶(ALP)由酶速率法测定;内脏脂肪面积由电阻抗法测定;超敏C反应蛋白(hs-CRP)由散色比浊法测定。LFC测定:由同一位超声医师应用同一型号机器(飞利浦公司HD-11型B型超声检测仪)进行肝脏超声检查,选取质量较高的图像进行存储,利用image J软件处理图像并计算LFC(%)=62.592×标化肝肾回声比值+ 168.076×标化肝脏回声衰减系数-27.863[13-14]。NFS=-1.675+ 0.037×年龄(岁)+0.094×BMI(kg/m2)+1.13×空腹血糖调节受损(或)糖尿病(是=1,否=0)+0.99×AST/ALT-0.013×血小板计数(×109/L)-6.6×白蛋白(Alb,g/L)[12,14]。DPN的测定:由同一位神经内科医师借助Keypoint 4肌电图诱发电位仪(Medtronic Co.,Denmark),检测同侧正中神经、尺神经、胫后神经、腓总神经感觉运动传导。
1.3统计学方法应用统计软件SPSS 17.0对数据进行分析。计量资料采用x ±s表示,多组间比较采用单因素方差分析;计数资料采用例表示,组间比较采用卡方检验;应用Lo⁃gistic回归对DPN、感觉神经病变(SNCA)、运动神经病变(MNCA)的影响因素进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 3组患者一般临床资料比较3组患者性别比例、BMI、WHR、舒张压(DBP)差异无统计学意义;C组年龄高于A组和B组,糖尿病病程长于A组(P<0.05);B组年龄、收缩压(SBP)高于A组,糖尿病病程长于A组(P<0.05),见表1。

Tab. 1 Comparison of clinical parameters between three groups表1 3组间一般临床资料比较
2.2 3组糖脂代谢、肝功能及炎症指标比较C组TC、TG、LDL-C、LFC、ALT、ALP、Alb、血红蛋白(Hb)、白细胞计数(WBC)均低于A组,且TC、LDL-C、Alb、Hb、WBC低于B组(均P<0.05);B组TG、LFC、AST、ALT、ALP、Alb均低于A组(均P<0.05)。各组间FBG、FINS、FCP、HOMA-IR、HbA1c、HDL-C、FFA、内脏脂肪面积、γ-GGT、hs-CRP差异无统计学意义,见表2。
2.3 3组DPN发生率比较A、B、C 3组DPN发生率分别为69.4%(34/49)、78.9%(75/95)、89.7%(26/29),3组发生率差异无统计学意义(χ2=4.468,P=0.107)。
2.4 3组SNCA发生率比较A、B、C 3组SNCA发生率分别为65.3%(32/49)、73.7%(70/95)、86.2% (25/29),3组发生率差异无统计学意义(χ2=4.085,P=0.130)。
2.5 3组MNCA发生率比较A、B、C 3组MNCA发生率分别为38.8%(19/49)、49.5%(47/95)、65.5% (19/29),3组发生率差异无统计学意义(χ2=5.223,P=0.073)。
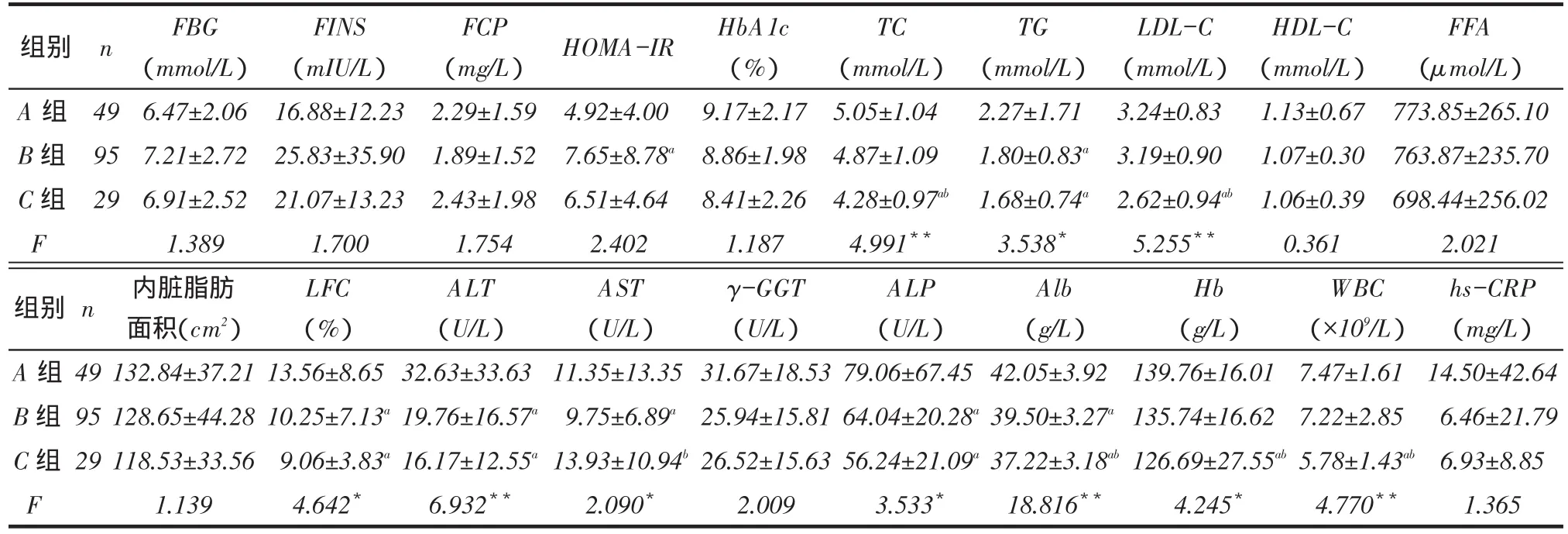
Tab. 2 Comparison of parameters of glucose and lipid metabolism, liver function and inflammatory between three groups表2 3组间糖脂代谢、肝功能及炎症指标比较 (x ±s)
2.6 DPN、SNCA、MNCA影响因素分析分别以是否患有DPN、SNCA、MNCA为因变量(患病=1,未患病=0),以年龄、糖尿病病程、SBP、LFC、TG、TC、LDL-C、Alb、ALT、ALP、WBC、NFS等指标为自变量,进行Logistic回归分析。结果显示NFS、年龄是DPN的独立影响因素,见表3;NFS、TC、TG、LFC是SNCA的独立影响因素,见表4;NFS是MNCA的独立影响因素,见表5。
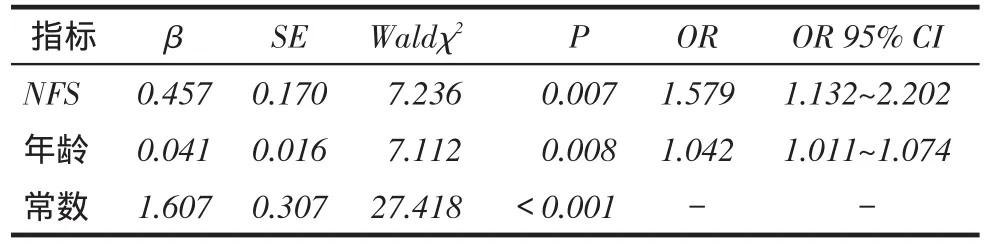
Tab. 3 Analysis of the influencing factors of DPN in patients with T2DM表3 T2DM患者DPN影响因素分析
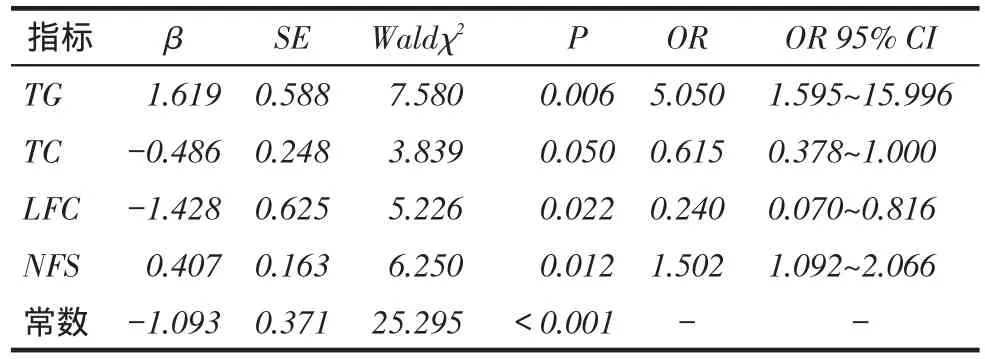
Tab. 4 Analysis of the influencing factors of SNCA in patients with T2DM表4 T2DM患者SNCA影响因素分析

Tab. 5 Analysis of the influencing factors of MNCA in patients with T2DM表5 T2DM患者MNCA影响因素分析
3 讨论
NAFLD包括单纯性脂肪肝、脂肪性肝炎、肝纤维化及肝硬化。韩国一项前瞻性研究显示,NAFLD患者肝纤维化的严重程度与糖尿病发生率的增加密切相关[15]。糖尿病是NAFLD发展为NASH及肝纤维化的危险因素,NAFLD与糖尿病形成恶性循环。
目前有关NAFLD与糖尿病性微血管并发症(糖尿病肾病、DPN及糖尿病视网膜病变等)之间的研究仍存在争议。有研究提示NAFLD是糖尿病性微血管并发症的危险因素[8-9],NAFLD与糖尿病性微血管并发症呈负相关[10-11]。而另有研究显示NAFLD与糖尿病性微血管并发症(如糖尿病肾病)不存在相关性[16]。这些研究几乎均采用超声的方法确定NAFLD,但超声只能粗略地估计LFC的多少,不能确定患者是否存在NASH或肝纤维化。有研究表明随着糖尿病的进展,NAFLD患者LFC减少,而其分型向肝纤维化甚至肝硬化进展[4]。有关NAFLD与糖尿病微血管并发症的研究多为横断面研究,其所获得的描述性资料是在某一时点或在一个较短时间内收集的,因此无法辨别在这些研究中非NAFLD患者是从未罹患过NAFLD,还是随着糖尿病病程的延长其肝脏脂肪被消耗,进而发展为进展性肝纤维化?此类研究主要关注的是LFC,而忽略了NAFLD的分型,导致其研究结果同质性较差,结果可信度不高。
早在20世纪70年代就有有关肝脏病变与神经病变的研究,多数研究表明在排除了酒精和糖尿病等因素后,慢性肝病(主要是肝硬化)依然可以导致周围神经和自主神经病变[17-18],即肝脏病变可以作为独立危险因素引起机体神经病变。然而在T2DM的背景下,NAFLD肝纤维化是否可以作为独立危险因素影响DPN的发生、发展仍不清楚。
本文对NAFLD肝纤维化与DPN发生率之间的关系进行了研究,结果显示,3组间DPN、SNCA、MN⁃CA发生率无明显差异,但与不合并进展性肝纤维化的患者(A组)相比,合并进展性肝纤维化的患者(C组)DPN、SNCA、MNCA的发生率均有增加的趋向,这种结果可能与纳入样本较小有关。多因素分析显示,NFS在DPN、SNCA、MNCA的发生中均有意义。
关于肝纤维化导致DPN发生的机制尚不明确,笔者认为可能有以下几点:(1)NAFLD患者多合并高胰岛素血症,高胰岛素血症可伴随着脂质分解增多,FFA过多,过多的FFA的β氧化生成大量活性氧族(ROS),通过氧化应激和炎症因子等作用,使非酒精性单纯性脂肪肝(NAFL)进展到NASH,甚至肝纤维化,此过程产生的炎症因子等可以损害微血管,导致神经病变的发生。(2)合并进展性肝纤维化的T2DM患者年龄较大、糖尿病病程较长,其运动耐量降低,由运动带来的收益减少,加之血糖控制不稳定,导致神经病变更易发生;相反,未合并进展性肝纤维化的糖尿病患者相对年轻,LFC更多,这促使该人群更注重生活方式的改善,加强运动,低脂饮食,进而达到良好的血糖控制,减少了一系列糖尿病并发症的发生。
综上所述,进展性肝纤维化是导致DPN发生率增加的独立危险因素,肝纤维化作为NAFLD的更高级形式应引起临床医生的重视,对T2DM患者LFC、肝纤维化及其动态变化的关注与糖尿病并发症同等重要,预测并及时处理肝纤维化可能为糖尿病并发症的防治提供新的视角。
参考文献
[1] Sobhonslidsuk A, Pulsombat A, Kaewdoung P, et al. Non-alcoholic fatty liver disease (NAFLD) and significant hepatic fibrosis defined by non-invasive assessment in patients with type 2 diabetes [J]. Asian Pac JCancer Prev, 2015, 16(5):1789-1794.
[2] Nakahara T, Hyoqo H, Yoneda M, et al. Type 2 diabetes mellitus is associated with the fibrosis severity in patients with nonalcoholic fatty liver disease in a large retrospective cohort of Japanese patients[J]. J Gastroenterol, 2014, 49(11):1477-1484. doi: 10.1007/s00535-013-0911-1.
[3] Leite NC, Villela-Nogueira CA, Pannain VL, et al. Histopathologi⁃cal stages of nonalcoholic fatty liver disease in type 2 diabetes: prev⁃alences and correlated factors[J]. Liver Int, 2011, 31(5): 700-706. doi: 10.1111/j.1478-3231.2011.02482.x.
[4] Gupte P, Amarapurkar D, Agal S, et al. Non-alcoholic steatohepati⁃tis in type 2 diabetes mellitus[J]. J Gastroenterol Hepatol, 2004, 19 (8):854-858.
[5] Amarapurka DN, Amarapurkar AD, Patel ND, et al. Nonalcoholic steatohepatitis (NASH) with diabetes: predictors of liver fibrosis[J]. Ann Hepatol, 2006, 5 (1):30-33.
[6] Prashanth M, Ganesh HK, Vima MV, et al. Prevalence of nonalco⁃holic fatty liver disease in patients with type 2 diabetes mellitus[J]. JAssoc Physicians India, 2009, 57:205-210.
[7] Zhang LS, Bian H, Yan HM, et al. The relationship between liver fat content and liver disease outcome in patients with type 2 diabetes [J]. Chin J Endocrinol Metab, 2014, 30(1):3-7.[张林杉,卞华,颜红梅,等. 2型糖尿病患者肝脏脂肪含量与肝病结局的相关性研究[J].中华内分泌代谢杂志,2014,30(1):3-7]. doi:10.3760/cma.j. issn.1000-6699.2014.01.002.
[8] Targher G, Chonchol M, Bertolini L, et al. Increased risk of CKD among type 2 diabetics with nonalcoholic fatty liver disease [J]. J Am Soc Nephrol, 2008, 19(8): 1564-1570. doi: 10.1681/ASN.2007101155.
[9] Targher G, Bertolini L, Rodella S, et al. Non-alcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and proliferative/laser-treated retinopathy in type 2 diabetic patients [J]. Diabetologia, 2008, 51(3): 444-450.
[10] Kim BY, Jung CH, Mok JO, et al. Prevalence of diabetic retinopathy and nephropathy are lower in Korean type 2 diabetic patients with non-alcoholic fatty liver disease [J]. J Diabetes Investig, 2014, 5(2): 170-175. doi: 10.1111/jdi.12139.
[11] Lv WS, Sun RX, Gao YY, et al. Nonalcoholic fatty liver disease and microvascular complications in type 2 diabetes[J]. World J Gastro⁃enterol, 2013, 19(20): 3134-3142. doi: 10.3748/wjg.v19.i20.3134.
[12] Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD [J]. Hepatology, 2007, 45(4):846-854.
[13] Xia MF, Yan HM, He WY, et al. Standardized ultrasound hepatic/re⁃nal ratio and hepatic attenuation rate to quantify liver fat content: an improvement method [J]. Obesity (Silver Spring), 2012, 20(2): 444-452. doi: 10.1038/oby.2011.302.
[14] Yang L, Jia GY, Xie CX, et al. Relationship between plasma sCD36 and Type 2 diabetes mellitus combined with nonalcoholic fatty liver disease [J]. Tianjin Med J, 2014,42(12):1209-1212.[杨玲,贾国瑜,谢春晓,等.血浆sCD36与2型糖尿病非酒精性脂肪肝的关系[J].天津医药, 2014, 42(12):1209-1212]. doi:10.3969/j.issn.0253-9896.2014.12.016.
[15] Chang Y, Jung HS, Yun KE, et al. Cohort study of non-alcoholic fat⁃ty liver disease, NAFLD fibrosis score, and the risk of incident dia⁃betes in a Korean population [J]. Am J Gastroenterol, 2013, 108 (12): 1861-1868. doi: 10.1038/ajg.2013.349.
[16] Zhan YT, Zhang C, Li L, et al. Non-alcoholic fatty liver disease is not related to the incidence of diabetic nephropathy in type 2 diabe⁃tes [J]. Int J Mol Sci, 2012, 13(11):14698- 14706. doi: 10.3390/ ijms131114698.
[17] Knill-Jones RP, Goodwill CJ, Dayan AD, et al. Peripheral neuropathy in chronic liver disease: clinical, electrodiagnostic, and nerve biopsy findings [J]. JNeurol Neurosurg Psychiatry, 1972, 35(1): 22-30.
[18] Kharbanda PS, Prabhakar S, Chawla YK, et al. Peripheral neu⁃ropathy in liver cirrhosis [J]. J Gastroenterol Hepatol, 2003, 18(8): 922-926.
(2015-08-11收稿2015-10-30修回)
(本文编辑李鹏)
The relationship between progressive liver fibrosis and diabetic neuropathy
XIE Chunxiao1, JIA Guoyu2, WANG Lu2, LI Qiang2, WANG Shaocheng2, YANG Ling1, DI Fusheng2
1 The Third Central Clinical Medical College of Tianjin Medical University, Tianjin 300170,China; 2 Tianjin Third Central Hospital,Key Laboratory of Regenerative Medicine
Corresponding Author E-mail:difusheng@vip.163.com
Abstract:Objective To study the relationship between advanced liver fibrosis and peripheral neuropathy in patients with type 2 diabetes mellitus (DPN). Methods A total of 173 patients (89 men and 84 women)with type 2 diabetes who hos⁃pitalized in Tianjin Third Central Hospital within nearly three years (2013.02-2015.02) were divided into three groups ac⁃cording to non-alcoholic fatty liver disease (NAFLD) fibrosis score: group A (NFS -1.455), group B (-1.455<NFS<0.676) and group C (NFS 0.676). The prevalence of DPN, sensory nerve conduction abnormalities (SNCA), motor nerve conduction abnormalities (MNCA) were compared, and the influencing factors were analysis between three groups. DPN, MNCA and SN⁃CA were ascertained by electroneurogram, and the severity of liver fibrosis was ascertained by NAFLD fibrosis score. Re⁃sults The prevalence rates of DPN, SNCA and MNCA were 69.4%, 78.9%, 86.2%, 65.3%, 73.7%, 86.2%, 38.8%, 49.5% and 65.5% in group A, group B and group C. There was no significant statistical difference between the three groups. Logistic regression analysis indicated that high NFS was an independent risk factor of DPN, SNCA and MNCA. Conclusion NAFLD fibrosis has a relationship with the prevalence rate of DPN, which is an independent risk factor of DPN, SNCA and MNCA in patients with T2DM.
Key words:diabetes mellitus, type 2;fatty liver;diabetic neuropathies;non-alcoholic fatty liver disease;advanced fi⁃brosis;liver fat content;diabetic peripheral neuropathy
中图分类号:R575.2,R587.25
文献标志码:A
DOI:10.11958/20150105
基金项目:天津市应用基础与前沿技术研究计划项目(15JCYBJC27700)
作者简介:谢春晓(1988),女,硕士研究生,主要从事脂肪肝及糖尿病并发症相关研究
通讯作者E-mail:difusheng@vip.163.com
