黄连素抑制FSP27基因表达及改善T2DM地鼠内脏白色脂肪组织胰岛素抵抗的研究
2016-06-28李国生刘栩晗李欣宇高政南黄澜刘亚莉
李国生,刘栩晗,李欣宇,高政南,黄澜,刘亚莉
黄连素抑制FSP27基因表达及改善T2DM地鼠内脏白色脂肪组织胰岛素抵抗的研究
李国生1,刘栩晗2,李欣宇2,高政南2,黄澜1,刘亚莉1
摘要:目的研究黄连素(BBR)对2型糖尿病(T2DM)中国地鼠内脏白色脂肪组织(VWAT)中脂肪特异蛋白27 (FSP27)和PR结构域蛋白16(PRDM16)信号通路基因mRNA表达的影响并探讨相关机制。方法以高脂饮食诱导肥胖胰岛素抵抗(OIR)地鼠模型,然后给予小剂量链脲佐菌素建立T2DM地鼠模型,对照组喂以普通饲料。造模完成后随机分成对照组、OIR组、肥胖T2DM组和T2DM BBR组。BBR治疗9周后,应用实时定量PCR方法检测各组地鼠VWAT中FSP27和PRDM16信号通路及其靶基因的mRNA表达改变。结果与对照组相比,OIR组和肥胖T2DM组地鼠VWAT中PRDM16、CtBP-1、CtBP-2、C/EBPβ、PPARγ、PGC1α、PGC-1β及棕脂组织特异基因UCP-1、Cidea、Elovl3、PPARα及Acox、Cpt1和Acadm的mRNA表达降低,而FSP27和白脂组织特异基因Resistin、MEST和Serpina3k的mRNA表达增加。BBR治疗降低肥胖T2DM组地鼠VWAT中FSP27的表达而增强PRDM16信号通路效应,诱导棕脂组织特异基因mRNA的表达,诱导VWAT棕色化基因表型,改善脂诱性胰岛素抵抗。结论BBR降低FSP27表达而增加PRDM16的表达与其诱导VWAT棕色化的分子机制相关,有助于增强产热耗能,改善VWAT的异常脂代谢,改善脂诱性VWAT胰岛素抵抗,恢复VWAT的功能。
关键词:黄连素;糖尿病, 2型;脂肪组织;胰岛素抵抗;脂肪特异蛋白27;PR结构域蛋白16;白色脂肪组织棕色化
作者单位:1大连医科大学附属第一医院病理科(邮编116011);2大连医科大学附属大连市中心医院内分泌科
白色脂肪和棕色脂肪可以共存并且形成脂肪组织的异质性特征[1],两者可发生可逆的表型相互转化[2]。过剩的能量沉积于脂肪组织将形成肥胖。脂肪组织,尤其是内脏白色脂肪组织(VWAT)的异常脂沉积和白色脂肪转化造成的脂诱性胰岛素抵抗是高脂饮食性肥胖导致2型糖尿病(T2DM)的重要机制[3]。诱导白色脂肪棕色化是近年来防治肥胖T2DM的新策略和研究热点[4]。黄连素(Berberine, BBR)是我国传统糖尿病治疗药物黄连的主要生物活性成分,表现棕色脂肪表型诱导效应[5],但对BBR诱导VWAT棕色化而治疗脂诱性VWAT胰岛素抵抗(FIVWATIR)的机制了解甚少。本研究观察了BBR对T2DM地鼠VWAT中脂肪特异蛋白27(fatspecific protein 27,FSP27)和PR结构域蛋白16(PR domain containing 16,PRDM16)信号通路基因mRNA表达的影响,探讨其诱导VWAT棕色化的分子机制。
1 材料与方法
1.1材料
1.1.1实验动物60只清洁级26周龄健康中国地鼠购自四川省医学科学院实验动物研究所,雌雄各半,饲以普通饲料,平均血糖(4.11±0.42)mmol/L,平均体质量(123.0±9.7)g。
1.1.2药品与试剂血脂检测试剂盒购自Randox公司。鼠胰岛素、瘦素和脂联素酶联免疫吸附测定(ELISA)试剂盒购自美国Linco公司。RNA提取试剂盒(RNeasy Mini Kit)和逆转录试剂盒(Omniscript Reverse Transcription Kit)购自德国Qiagen公司。HotStarTaqTMDNA聚合酶购自TaKaRa公司。RNase inhibitor和Oligo-dT购自美国Promea公司。实时荧光定量PCR反应试剂盒(iQ SYBR Green PCR Kit)购自美国Bio-rad公司。链脲佐菌素(STZ)和BBR购自Sigma公司。其余常用试剂购自北京鼎国生物技术公司。
1.1.3仪器实时荧光定量PCR仪(美国Bio-rad公司)。稳豪One-Touch血糖仪(美国强生公司)。日立8060全自动生化分析仪(日本日立公司)。
1.2方法
1.2.1建立动物模型、分组及治疗按照笔者既往的方法并结合其他学者的经验建立肥胖胰岛素抵抗(OIR)和肥胖T2DM中国地鼠模型[6-7]。现简述如下:健康地鼠60只,按随机数字表法随机分为对照组10只和高脂饮食组50只,饲养4周后,高脂饮食喂养的地鼠自发形成OIR模型,随后将OIR地鼠按随机数字表法随机分成2组,一组40只按40 mg/kg的剂量腹腔注射1% STZ(溶于无菌柠檬酸缓冲液),建立T2DM模型。另一组10只及对照组10只注射等量的无菌柠檬酸缓冲液,注射方式和剂量相同。处理后,各组地鼠继续维持原饮食2周。T2DM和OIR地鼠依据空腹血糖、空腹胰岛素和口服葡萄糖耐量试验(OGTT)确定。同时满足下列3项标准:(1)胰岛素敏感指数降低,即胰岛素的敏感性降低。(2)OGTT曲线下面积(AUC) 26。(3)72 h后空腹血糖9 mmol/L为T2DM模型地鼠。造模完成后共得到29只肥胖T2DM地鼠。按随机数字表法随机分为肥胖T2DM组和T2DM BBR组,每组10只。最后各实验组地鼠为对照组、OIR组、肥胖T2DM组和T2DM BBR组,每组10只。T2DM BBR组每只每日灌服BBR(溶于羧甲基纤维素/PBS溶液)的剂量为150 mg/kg,对照组、OIR组和肥胖T2DM组灌服相应剂量的羧甲基纤维素/PBS溶液,治疗9周。给药期间对照组给予普通饲料,其余各组给予高脂饲料。实验完成时,各实验组禁食不禁水12 h,在禁食后9.5 h时称体质量并同时给药,在给药后2.5 h时,留取血液标本并处死,迅速分离肠系膜脂肪组织、双侧肾周围脂肪垫和附睾旁或子宫旁脂肪组织等VWAT,称质量,大部分脂肪保存于-80℃备用,少部分脂肪固定于中性福尔马林溶液。
1.2.2 OGTT及胰岛素敏感性评价各实验组禁食不禁水12 h后,灌服2 g/kg葡萄糖,在0、30、60、120和180 min取血检测血糖及胰岛素。糖耐量AUC= 1/2空腹测定值+60 min测定值+120 min测定值+1/2 180 min测定值。胰岛素敏感性计算与评价:QUICKI=1/(lgI0+ lgG0),其中I0为空腹胰岛素,单位mU/L,G0为空腹血糖,单位mg/dL(1 mmol/L=18 mg/dL);HOMA-IR或IRHOMA=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/ 22.5;G0×I0(G0为空腹血糖,其单位是mmol/L,I0为空腹胰岛素,单位mU/L)[8-9]。
1.2.3血液生化检测应用日立8060全自动生化分析仪根据三酰甘油(TG)、游离脂肪酸(FFAs)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)试剂盒操作说明检测血脂水平。血糖采用稳豪血糖仪检测。血瘦素、胰岛素和脂联素按照相应ELISA试剂盒操作说明检测。
1.2.4脂肪组织形态学观察VWAT固定于中性福尔马林溶液,脱水,包埋,制片,光镜观察。
1.2.5实时定量PCR检测取各实验组冻存脂肪组织30 mg,按RNeasy Mini Kit说明书操作提取总RNA。检测RNA浓度、纯度并鉴定其完整性,然后进行逆转录。实时定量PCR按iQ SYBR Green Mix Kit说明书操作检测样本目标基因。PCR检测反应条件为:95℃3 min预变性,95℃10 s,59℃45 s,45个循环。扩增完成后,应用反应产物的熔解曲线检测其均一性。每个反应均重复3次。设立阴性对照。扩增前,每对引物的扩增效率经检测均接近于1。使用2- Ct方法计算样本目标基因的相对表达水平。内参基因为β-actin。检测的基因如下:PRDM16、C末端结合蛋白-1(C-terminalbinding protein-1,CtBP-1)、CtBP-2、CCAAT/增强子结合蛋白β(CCAAT/enhancer-binding protein β,C/EBP β)、过氧化物酶体增殖物激活受体(PPAR)γ、PPARγ共激活体(PPARγ coactivator 1α,PGC)-1α、PGC-1 β、解偶联蛋白-1(uncoupling protein-1,UCP-1)、细胞死亡诱导DFFA样效应子a(cell death-inducing DFFA-like effector a,Cidea)、极长链脂肪酸延长子3(elongation of very long chain fatty acid- 3,Elovl3)、PPARα、酰基辅酶A氧化酶(Acyl-CoA oxidase,Acox)、肉碱棕榈酰转移酶1(Carnitine-palmitoyl transferase 1,Cpt1)、中链酰基辅酶A脱氢酶(Medium-chain acyl-CoA dehydrogenase, Acadm)、抵抗素(Resistin)、中胚层特异性转录子(Mesodermspecific transcript,MEST)和Serpina3k。引物序列见表1。
1.3统计学方法采用SPSS 17.0进行分析,计量数据以均数±标准差表示,组间比较采用t检验和单因素方差分析,组间多重比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1各组地鼠的代谢特征实验完成时各实验组地鼠的表型和代谢特征,见表2、3。与对照组相比,OIR组和肥胖T2DM组表现肥胖,VWAT质量增加,血脂异常;肥胖T2DM组血糖明显升高;OIR组血胰岛素明显升高;OIR组和肥胖T2DM组血浆脂联素降低而瘦素增高;OIR组和肥胖T2DM组OGTT异常。OIR组和肥胖T2DM组的胰岛素敏感指数(QUICKI)降低,胰岛素抵抗指数(HOMA-IR)升高。BBR治疗后,与肥胖T2DM组比较,BBR降低VWAT质量,改善血脂、血糖,增高脂联素而降低瘦素,改善OGTT,增加胰岛素敏感指数,降低胰岛素抵抗指数。

Tab. 1 Primers used for real-time RT-PCR表1实时荧光定量PCR引物
2.2各组地鼠VWAT形态学改变与对照组比较,OIR组和T2DM组VWAT脂肪细胞体积增大,大脂肪细胞数量增多。T2DM BBR组VWAT脂肪细胞体积减小,大脂肪细胞数量降低,见图1。
2.3各组地鼠VWAT中FSP27和PRDM16信号通路及相应靶基因的基因mRNA表达改变见表4。与对照组相比,OIR组和肥胖T2DM组的PRDM16、 CtBP-1、CtBP-2、C/EBPβ、PPARγ、PGC-1α、PGC-1β及棕脂组织特异基因UCP-1、Cidea、Elovl3、PPARα、Acox、Cpt1和Acadm的mRNA表达降低,而FSP27和白脂组织特异基因Resistin、MEST和Serpina3k 的mRNA表达增高。与对照组相比,T2DM BBR组PRDM16、CtBP-1、CtBP-2、C/EBPβ、PPARγ、PGC-1α、PGC-1β、UCP-1、Cidea、Elovl3、PPARα、Acox、Cpt1 和Acadm的mRNA表达增高,FSP27、Resistin、MEST和Serpina3k的mRNA表达降低。与肥胖T2DM组比较,T2DM BBR组PRDM16、CtBP-1、CtBP-2、C/EBPβ、PPARγ、PGC-1α、PGC-1β、UCP-1、Cidea、Elovl3、PPARα、Acox、Cpt1和Acadm的mRNA表达增高,FSP27、Resistin、MEST和Serpina3k的mRNA表达降低。

Tab. 2 Metabolic characterization of hamsters in four groups表2各组地鼠的代谢表型特征 (n=10, x ±s)

Tab. 3 Oral glucose tolerance tests and islet function tests of hamsters in four groups表3各组地鼠OGTT及胰岛功能试验 (n=10, x ±s)

Fig. 1 Lipid accumulation in visceral white adipose tissue of hamsters in four groups(HE,×200)图1各组地鼠内脏白色脂肪组织的脂沉积(HE,×200)
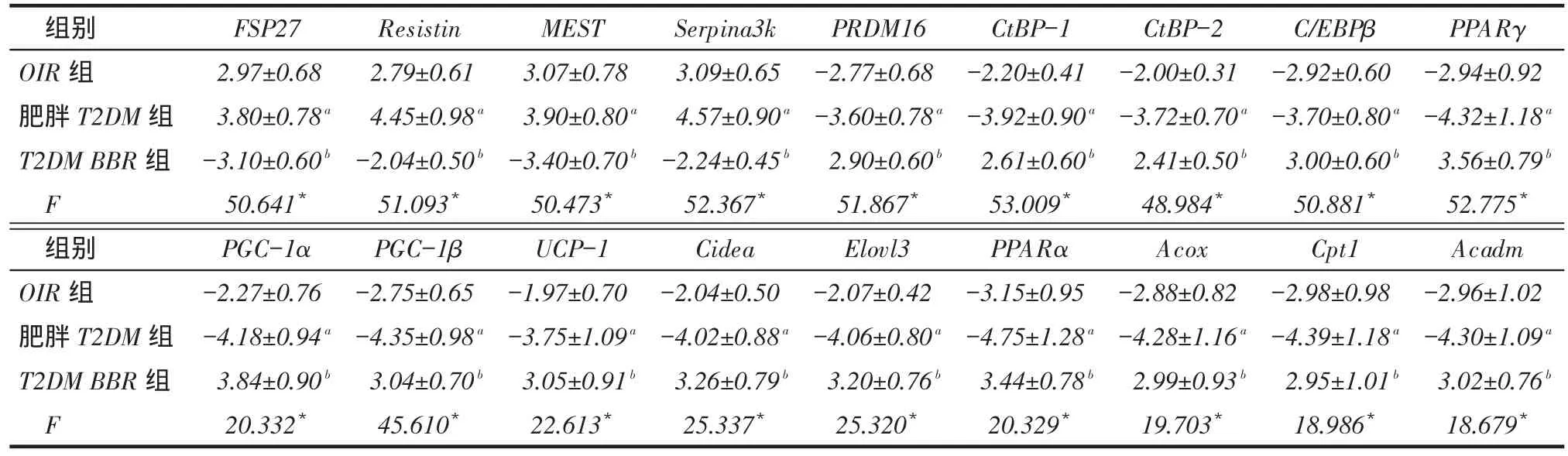
Tab. 4 Comparison of relative quantification of differentially expressed genes of VWAT FSP27 and PRDM16 signal pathway in hamsters between three groups表4各组地鼠内脏白色脂肪组织FSP27和PRDM16信号通路基因相对表达比较 (n=10, x ±s)
3 讨论
脂肪组织主要由白色脂肪和棕色脂肪构成,白色脂肪储存过剩的能量,棕色脂肪产热耗能,两者共同维持能量平衡。白色脂肪和棕色脂肪按不同比例共存构成脂肪组织的异质性,并在遗传和环境因素变化时发生可逆的相互转分化[10]。脂肪组织,尤其是VWAT脂沉积导致脂肪组织白色转分化和FIVWATIR形成有助于肥胖T2DM的发生。因此,诱导白色脂肪组织棕色化的转分化重新编程过程将为治疗肥胖相关T2DM提供新的治疗策略。BBR作为白色脂肪棕色化诱导剂,成为T2DM药物治疗机制研究的新热点。本研究显示FSP27调控白/棕脂组织转换通路(PRDM16信号通路)参与BBR诱导VWAT棕色化的分子机制,从而改善T2DM地鼠FIVWATIR。
PRDM16作为棕色脂肪选择性诱导因子,是锌指蛋白转录因子,也是开启棕色脂肪分化程序的分子开关。PRDM16表达增高会抑制白色脂肪选择性基因的表达,而诱导棕色脂肪选择性基因的表达,有助于白色脂肪棕色化,反之则反。在棕色脂肪分化程序中,PRDM16与CtBPs(CtBP-1和-2)形成复合体,结合白色脂肪细胞特异基因如Resistin、MEST 和Serpina3k等的启动子,抑制其表达,进而抑制脂肪组织白色化,改善胰岛素抵抗。同时PRDM16与C/EBPβ结合,增加PPARγ和PGC-1s (-1α和-1β)的表达,PRDM16招募并直接结合PGC- 1s到PRDM16/CtBPs复合体,替代CtBPs,使PRDM16与PPARγ、C/EBPβ、PGC-1s等形成复合体,促进棕色脂肪选择性基因UCP-1、Cidea、Elovl3和PPARα等的转录表达。增加表达的Elovl3有助于棕色脂肪增生。增加表达的Cidea有助于增加UCP-1活性。增加表达的PPARα有助于增加脂肪酸氧化[11- 12]。FSP27是细胞死亡诱导DFF45样效应因子(CIDE)家族成员,是调控并维持白色脂肪均一性的决定因子,在白色脂肪组织中表达较高,具有促进脂肪细胞脂储集的作用。FSP27是脂肪组织多种代谢相关基因及信号通路的调节因子,尤其是调节PRDM16、C/EBPβ、PGC1α和PPARγ等与脂肪分化相关的调控基因的表达,而调控并维持白色脂肪组织的均一性。当FSP27表达降低时,诱导PRDM16的表达,开启PRDM16诱导的棕色脂肪分化程序,诱导棕色脂肪选择性基因的表达,而抑制白色脂肪选择性基因表达,获得棕色脂肪基因表型特征,反之则反。增加表达的FSP27同时抑制C/EBPβ、PGC1α和PPARγ的表达,而抑制PRDM16信号通路的多个重要基因表达,从而抑制棕色脂肪选择性基因的表达。增加表达的白色脂肪选择性基因Resistin和Serpina3k有助于胰岛素抵抗的形成。增加表达的MEST有助于增加脂肪细胞的大小和脂肪细胞脂的含量,促进脂沉积,损伤脂肪酸氧化和产热。因此,增加表达的FSP27有助于促进脂肪组织的脂沉积、“白色化”和维持白色脂肪组织的均一性[13]。
本研究显示,在OIR组和肥胖T2DM组地鼠VWAT中,升高表达的FSP27,抑制PRDM16的表达,诱导白色脂肪选择性基因的表达;同时抑制C/EBPβ、PGC1α和PPARγ的表达,抑制PRDM16信号通路的多个重要基因表达,从而抑制棕色脂肪选择性基因的表达。最终,增加脂肪组织脂合成和脂沉积,损伤脂肪酸氧化和产热耗能,有助于脂肪组织“白色化”并维持其均一性,诱发并加重FIVWATIR,损伤VWAT功能。治疗后,BBR表现出抑制FSP27表达的效应,诱导PRDM16的表达,开启PRDM16诱导的棕色脂肪分化程序,增加表达的PRDM16抑制白色脂肪选择性基因的表达,同时诱导棕色脂肪选择性基因的表达,促进“白色化”内脏脂肪组织向棕色脂肪表型方向的转分化,获得棕色脂肪基因表型特征,具有产热耗能的能力,将储存的能量转化为热能。因此,BBR可减轻“白色化”VWAT脂沉积,改善VWAT的异常脂代谢,改善异常脂血症,因而改善FIVWATIR,增强胰岛素敏感性,进而有助于改善非脂肪组织如肝脏、骨骼肌、胰岛中的异常脂沉积,最终实现防治T2DM发生发展的作用。然而,形态学未表现明显确切的棕色脂肪形态,可能与BBR改善失代偿的VWAT功能后而表现的增强储脂功能有关,有可能与BBR治疗时间有关,或存在其他信号通路调节机制,还需进一步研究。
综上所述,BBR治疗抑制FSP27的表达,诱导PRDM16的表达,开启PRDM16诱导的棕色脂肪分化程序,诱导VWAT棕色化,增强产热耗能,减轻“白色化”VWAT脂沉积,改善VWAT的异常脂代谢,改善FIVWATIR,增加胰岛素敏感性并恢复VWAT的功能。因此,FSP27有望成为治疗T2DM的分子靶点。
参考文献
[1] Frontini A, Vitali A, Perugini J, et al. White-to-brown transdiffer⁃entiation of omental adipocytes in patients affected by pheochromo⁃cytoma[J].Biochim Biophys Acta, 2013, 1831(5):950- 959. doi: 10.1016/j.bbalip.2013.02.005.
[2] Rosenwald M, Perdikari A, Rülicke T, et al. Bi-directional intercon⁃version of brite and white adipocytes[J]. Nat Cell Biol, 2013, 15(6): 659-667.doi: 10.1038/ncb2740.
[3] Kim S, Popkin BM. Commentary: understanding the epidemiology of overweight and obesity--a real global public health concern[J]. Int JEpidemiol, 2006, 35(1): 60-67.
[4] Moisan A, Lee YK, Zhang JD, et al. White-to-brown metabolic con⁃version of human adipocytes by JAK inhibition[J]. Nat Cell Biol, 2015, 17 (1): 57-67. doi: 10.1038/ncb3075.
[5] Zhang Z, Zhang H, Li B, et al. Berberine activates thermogenesis in white and brown adipose tissue[J]. Nat Commun, 2014, 25(5):5493. doi: 10.1038/ncomms6493.
[6] Li GS, Liu XH, Zhu H, et al. Observation on stability and establishment of type 2 diabetic Chinese hamster models induced by streptozotocin and diet enriched with fat and energy[J]. Chinese Journal of Compar⁃ative Medicine, 2007, 17 (9): 497-500. [李国生,刘栩晗,朱华,等.链脲佐菌素和高脂饮食诱导2型糖尿病中国地鼠模型的建立和稳定性观察[J].中国比较医学杂志, 2007, 17(9): 497-500].
[7] Ma CY, Yu HY, Wang HJ, et al. Hypoglycemic mechanism of total saponins of momordica charantia in type 2 diabetes mellitus rats[J]. Tianjin Med J, 2014, 42(4): 321-324. [马春宇,于洪宇,王慧娇,等.苦瓜总皂苷对2型糖尿病大鼠降血糖作用机制的研究[J].天津医药,2014,42(4):321-324]. doi: 10.3969/j.issn.0253-9896.2014.04.010.
[8] Wu L, Zhou W, Liu J. Expression of Akt and GLUT-4 in adipose tissue of women with gestational diabetes mellitus and pregnant women with excessive weight gain[J]. Med JChin PLA, 2014, 39 (10): 819-822. [伍丽,周玮,刘建. Akt和GLUT-4在妊娠糖尿病与孕期体重过度增长孕妇脂肪组织中的表达变化[J].解放军医学杂志, 2014, 39(10):819-822]. doi:10.11855/j.issn.0577-7402.2014.10.12.
[9] Liu Y, Mei WQ, Li ZC, et al. Effect of melatonin on expression of leptin in subcutaneous fat tissue in insulin-resistant rats[J]. Med J Chin PLA, 2014, 39 (1): 15-19. [刘颖,梅伟群,李志琛,等.褪黑素对胰岛素抵抗大鼠皮下脂肪组织瘦素表达的作用观察[J].解放军医学杂志, 2014, 39(1):15-19]. doi: 10.11855/j.issn.0577-7402.2014.01.04.
[10] Smorlesi A, Frontini A, Giordano A, et al. The adipose organ: whitebrown adipocyte plasticity and metabolic inflammation[J]. Obes Rev, 2012, 13(Suppl 2):83-96. doi: 10.1111/j.1467-789X.2012.01039.x. [11] Villanueva CJ, Vergnes L, Wang J, et al. Adipose subtype-selective recruitment of TLE3 or Prdm16 by PPARγ specifies lipid storage versus thermogenic gene programs[J]. Cell Metab, 2013, 17(3):423-435. doi: 10.1016/j.cmet.2013.01.016.
[12] Lee YH, Jung YS, Choi D. Recent advance in brown adipose physi⁃ology and its therapeutic potential[J]. Exp Mol Med, 2014, 46:e78. doi:10.1038/emm.2013.163.
[13] Li D, Zhang Y, Xu L, et al. Regulation of gene expression by FSP27 in white and brown adipose tissue[J]. BMC Genomics, 2010,11:446. doi: 10.1186/1471-2164-11-446.
(2015-07-13收稿2015-11-24修回)
(本文编辑李国琪)
临床研究
The investigation on the inhibitive effect of berberine on gene expression of FSP27 to improve visceral white adipose tissue insulin resistance in type 2 diabetic hamsters
LI Guosheng1, LIU Xuhan2, LI Xinyu2, GAO Zhengnan2, HUANG Lan1, LIU Yali1
1 Department of Pathology, The First Affiliated Hospital of Dalian Medical University, Liaoning 116011, China; 2 Department of Endocrinology, Dalian Municipal Central Hospital of Dalian Medical University Corresponding Author E-mail: xuhanliu281277@hotmail.com
Abstract:Objective To study the effects of berberine (BBR) on the gene mRNA expression of fat-specific protein 27 (FSP27) and PR domain containing 16 (PRDM16) signal pathway in visceral white adipose tissues (VWAT) from type 2 dia⁃betic (T2DM) Chinese hamsters, and explore the related mechanisms. Methods The obese insulin-resistant (OIR) hamster model was induced by high-fat diet, and T2DM hamster model was created by OIR hamster model injected with low-dose streptozotocin. The control group was fed with standard laboratory chow. After the induction, the hamsters were randomly di⁃vided into control, OIR, obese T2DM and BBR-treated T2DM groups. After nine-week BBR treatment, real-time quantita⁃tive PCR was used to measure the gene mRNA expression changes of VWAT FSP27 and PRDM16 signal pathway and their target genes from different groups. Results Compared with control group, the gene mRNA expressions of PRDM16, CtBP-1, CtBP-2, C/EBPβ, PPARγ, PGC1α, PGC-1β and brown adipose tissue-specific genes such as UCP-1, Cidea, Elovl3, PPARα, and Acox, Cpt1 and Acadm were decreased and that of FSP27 and white adipose tissue-specific genes including Resistin, MEST and Serpina3k were increased in VWAT in OIR and obese T2DM groups. BBR treatment down-regulated FSP27 expression, enhanced PRDM16 signal pathway, and induced the gene mRNA expression of brown adipose tissue-spe⁃cific genes in VWAT of obese T2DM group to develop browning gene phenotype of VWAT, and then improved fat-induced insulin resistance. Conclusion The decreased FSP27 expression and increased PRDM16 expression are involved in the molecular mechanisms of browning of visceral white adipose tissues induced by BBR, and which contributes to improve ab⁃normal lipids metabolism and fat-induced insulin resistance in VWAT by enhancing consumption of energy as heat to re⁃store VWAT function.
Key words:berberine; diabetes mellitus, type 2; adipose tissue; insulin resistance; fat-specific protein 27; PR domain containing16; browningof white adipose tissues
中图分类号:R587
文献标志码:A
DOI:10.11958/20150041
作者简介:李国生(1974),男,副主任医师,博士,主要从事糖尿病病因及治疗机制研究
通讯作者E-mail:xuhanliu281277@hotmail.com
