神经导向因子Netrin-1对血管内皮细胞生长因子蛋白表达的影响
2016-06-28李敬华王素莉沈继春
李敬华 王素莉 沈继春
武警后勤学院附属医院内分泌科 天津 300162
神经导向因子Netrin-1对血管内皮细胞生长因子蛋白表达的影响
李敬华王素莉沈继春
武警后勤学院附属医院内分泌科天津300162
【摘要】目的研究神经导向因子Netrin-1与血管内皮细胞生长因子蛋白表达之间的关系。方法选取无特定病原体(SPF)级Wistar大鼠,从其骨髓腔中分离获得间充质干细胞(MSCs)后37 ℃、5% CO2培养至传代4次。采用Transwell法进行细胞迁移实验,分为空白组、VEGF组、Netrin-1组及Netrin-1加VEGF组,培养12 h后显微镜观察并计算每孔细胞数目,培养1周后测定管腔周长、管腔数目及分支点数目。将转染Netrin-1重组子后的MSCs细胞悬液、未转染的MSCs细胞悬液接种于大鼠腹部皮下,以Matrigel胶作为空白对照组,移植10 d、20 d、30 d后取出胶栓,免疫组化法检测VEGF表达水平。结果在细胞迁移及小管形成实验中,VEGF组与Netrin-1组细胞迁移数量、小管形成中的管腔周长、管腔数目及分支点数目无明显变化,差异无统计学意义(P>0.05);而VEGF加Netrin-1组与VEGF组或Netrin-1组比较,细胞迁移数升高,管腔周长变长,管腔数目和分支点数目均明显增多,差异具有统计学意义(P<0.01)。体内血管生成实验中,移植转染Netrin-1重组子的MSCs与移植普通MSCs相比,MSCs/Netrin-1组的VEGF蛋白水平更高,差异具有统计学意义(P<0.01)。结论Netrin-1和VEGF促进血管生成的能力相当,两者结合更能促进血管生成。神经导向因子Netrin-1促进血管内皮细胞生长因子蛋白表达。
【关键词】Netrin-1;血管内皮细胞生长因子;血管生成
Netrin-1是细胞分泌型可溶性蛋白,具有神经细胞轴突导向和细胞迁移诱导作用,由于机体内神经和血管相互伴行,所以Netrin-1不但可以调节神经系统的发育,还参与血管系统的发育[1]。Netrin-1在脉管系统形成发育的初期,可以促进不同内皮细胞的有丝分裂、黏附以及细胞迁移,是一种血管生成调节因子[2-3]。血管生成与新生与促血管生成因子密切相关,如血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(bFGF)、血小板源性生长因子(PDGF)等[4]。VEGF通过与特异性受体(如VEGF-1、VEGF-2、neuropilin-1、neuropilin-2等)结合激活一系列细胞信号通路,促进血管内皮细胞有丝分裂及血管形成[5]。近年研究证实,Netrin-1与VEGF的功能相关[6-7]。但Netrin-1与VEGF蛋白表达之间的关系仍少有报道。本研究通过转染Netrin-1基因重组子入间充质干细胞(mesenchymal stem cells,MSCs)并表达出Netrin-1蛋白,移植转染Netrin-1基因重组子的MSCs与转染空载体的MSCs到大鼠皮下组织,移植10、20、30 d后检测Netrin-1与VEGF蛋白表达及微血管形成数量情况,分析Netrin-1与VEGF蛋白表达之间的关系。
1材料与方法
1.1研究对象、主要试剂和仪器4周龄的健康雄性Wistar大鼠,体质量150~200 g,清洁级。
主要试剂:Netrin-1蛋白、VEGF蛋白:美国BM。Trypsin-EDTA、细胞培养皿、细胞培养板、巴斯德管:美国Gibco。MesenCult培养基、DMEM培养基、淋巴细胞分离液:加拿大StemCellTechnllogies。兔抗鼠Netrin-1抗体、羊抗兔二抗、大鼠Netrin-1酶联免疫试剂盒:USCN公司。
主要实验设备和仪器:手术器械、细胞计数板:上海医疗器械公司。流式细胞仪:德国BD公司生产。CO2培养箱3336型:美国SHEL公司。低温高速离心机:德国EPPENDORF。超低温冰箱:美国Forma Scientific公司。
1.2研究方法
1.2.1MSCs细胞的分离和培养:SPF(Specific Pathogen Free,无特定病原体)级Wistar大鼠颈椎脱臼处死后,无菌条件下分离股骨、腓骨,75%酒精消毒后去除肌肉组织,剪除干骺端,用PBS冲洗骨髓腔,制成细胞悬液。加Percoll淋巴细胞分离液离心处理获得单个核细胞。用15%血清加DMEM培养基在37 ℃,5% CO2饱和湿度培养箱内培养至细胞贴壁,传代4次。
1.2.2将Netrin-1基因重组质粒转染到MSCs,并表达出Netrin-1蛋白:将4 mL MSCs传代细胞悬液置于四孔板内,计算4 mL细胞悬液含有细胞数(约16×109个),按每2×108个细胞需要Netrin-1基因重组子12.5 μmol及转染液3 μL的比例加入后混合,于25 ℃恒温培养24 h。
1.2.3Transwell细胞迁移试验:将Transwell小室置于24孔培养板中,小室上层加入MSC培养基,37 ℃下平衡1 h。0.35%胰蛋白酶结合0.02% EDTA分离MSCs,用无血清DMEM培养基重悬细胞至浓度为每mL 1×l05个。取100 μL(1×l04)加入Transwell小室的上室,下室内不加或加入Netrin-1(50 ng/mL)和(或)VEGF(10 ng/mL)的MSC培养液600 μL,分别为空白(阴性)对照组、Netrin-1组、VEGF(阳性)组及Netrin-1加VEGF组,每组6个复孔,共4组于培养箱中培养12~18 h。后用吸管吸出培养基,PBS溶液洗涤小室3~5次后取出小室滤膜,用3.5%甲醛固定5~10 min,1.5%结晶紫染色5~10 min后,干燥滤膜。100~200倍光镜下观察滤膜细胞,每个小室随机选择4~5个视野,计数每个视野的细胞数目,取平均值。细胞数目的多少反映其迁移能力的高低。
1.2.4小管形成:未转染的MSCs在MesenCult Medium培养,分为4组即空白对照组(阴性对照),VEGF组(10 ng/mL VEGF,阳性对照),Netrin-1组(50 ng/mL Netrin-1),Netrin-1加VEGF组培养。1周后测定管腔周长、管腔数目及分支点数目。
1.2.5体内血管生成:将转染后的MSCs细胞悬液(2×106个细胞)接种于大鼠腹部皮下并用苦味酸标记。实验动物分为3组:空白对照组(Matrigel胶)、MSCs组(Matrigel胶+未转染的MSCs)、MSCs/Netrin-1组(Matrigel胶+转染Netrin-1重组子的MSCs),每组6只大鼠。移植10、20、30 d后,取出胶栓固定染色,检测VEGF表达水平。
1.2.6ELISA法检测MSCs细胞悬液中Netrin-1蛋白:适当稀释Netrin-1蛋白标样后,将酶标液加入平板孔中,另设空白对照组(不加抗原物质),每孔90 μL,4 ℃储存12 h。每孔分别加100 μL 1.5% PBS/T20-BSA、100 μL抗血清、100 μL兔抗鼠Netrin-1抗体、100 μL HRP的底物缓冲液,每加一种物质前先用PBS洗版2次,5 min/次,加入后于37 ℃培养1~2 h。最后用60 μL 20%的H2SO4终止反应后,从酶联免疫检测仪上读取OD值。
1.2.7免疫组化法检测:VEGE蛋白水平:将Matrigel胶板从大鼠体内取出后,浸泡于15%福尔马林液35 ℃固定处理1 h后取出,利用酒精浓度梯度脱水、脱蜡、制片;微波修复后,加入非免疫性动物血清,35 ℃培养15 min;吸管吸弃血清后加入一抗、链霉菌抗生素-过氧化酶溶液,35 ℃培养15 min;采用二氨基联苯胺溶液、苏木素、DAB溶液分别进行组织胶板显色、复染、再显色5~10 min,显微镜下观察,阳性显色为棕黄色;BX51成像系统下成像,VEGF蛋白光密度值(IOD)采用Image Pro-Plus 5.1软件处理。
1.3统计学处理采用SPSS 17.0统计软件处理数据,计数资料以率(%)表示,采用2检验,计量资料以±s表示,采用t检验,体外Transwell细胞迁移实验、小管形成实验、体内血管生成实验中,组间或组内比较采用方差分析,P<0.05为差异具有统计学意义。
2结果
2.1转染后MSCs中Netrin-1表达水平将Netrin-1基因重组到质粒上转染到MSCs中,在一定时间段内,随着时间延长,Netrin-1分泌逐渐增多,在第4天时达最高,以后Netrin-1分泌量又逐渐降低。见图1。
2.2细胞迁移与空白组比较,VEGF组、Netrin-1组以及Netrin-1+VEGF组细胞迁移数量均有明显的增多,差异具有统计学意义(P<0.05)。Netrin-1+VEGF组与VEGF组或Netrin-1组比较,细胞迁移数升高,差异有统计学意义(P<0.05);Netrin-1组与VEGF组比较,细胞迁移数变化不大,差异无统计学意义(P>0.05)。见图2。
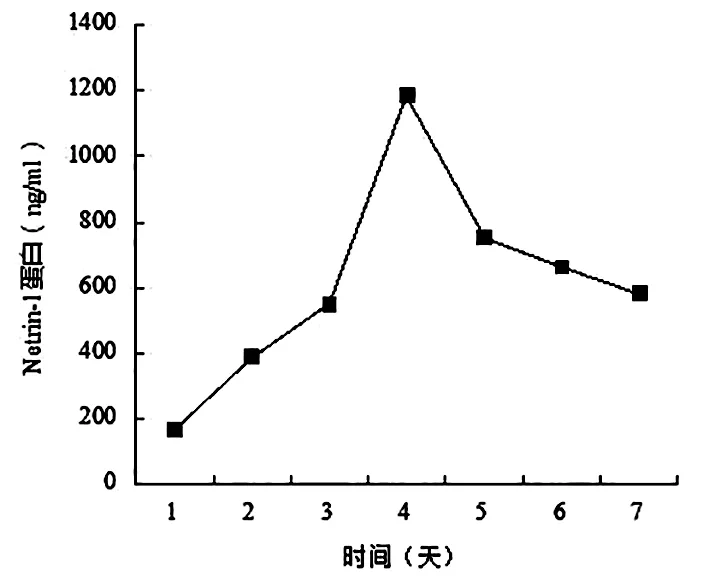
图1 MSCs中Netrin-1蛋白的分泌
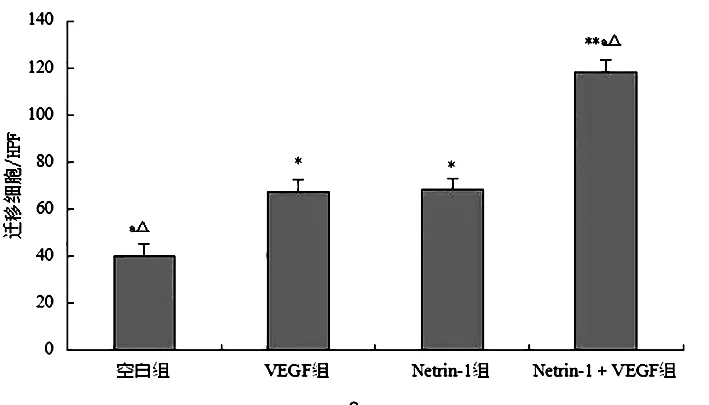
注:与空白组比较,*P<0.05,**P<0.01;与VEGF组比较,P<0.01;与Netrin-1组比较,△P<0.01
图2体外MSCs迁移数量
2.3体外小管形成与VEGF组比较,Netrin-1组的管腔周长、管腔数目以及分支点无明显变化,差异无统计学意义(P>0.05),Netrin-1+VEGF组的管腔周长、管腔数目以及分支点明显增多,差异有统计学意义(P<0.01)。与Netrin-1组比较,Netrin-1+VEGF组的管腔周长、管腔数目以及分支点也明显增多,差异有统计学意义(P<0.05)。见表1。

表1 MSCs小管形成水平评价
注:与VEGF组比较,*P<0.05,**P<0.01;与Netrin-1组比较,△P<0.05,△△P<0.01
2.4体内血管生成与空白组比较,移植后第10天、20天MSCs组和MSCs/Netrin-1组的VEGF蛋白水平较高,差异具有统计学意义(P<0.05)。与MSCs组比较,MSCs/Netrin-1组的VEGF蛋白水平更高,差异具有统计学意义(P<0.01)。见表2。
表2 VEGF蛋白表达水平
注:与空白组比较,*P<0.05,**P<0.01;与MSCs组比较,△P<0.05,△△P<0.01
3讨论
与神经元的生长方式类似,生长中的血管丛最前方的端细胞通过伸出的丝状伪足探测细胞外基质中的VEGF,芽生的毛细血管顺VEGF浓度梯度生长,相邻内皮的端细胞融合形成管腔,产生新的血管分支[8]。大量研究表明,MSCs能保持干细胞部分特性,在体外具有分化成为血管壁结构成分的能力,体内能促进缺血血管新生[9-11]。因此,将MSCs进行基因修饰或联合细胞因子移植(如Netrin-1)对治疗缺血性疾病有重要意义。
本文结果显示,VEGF组与Netrin-1组的体外细胞迁移数量相差不大,而Netrin-1+VEGF组分别与VEGF组与Netrin-1组比较,细胞迁移数量明显上升(P<0.01)。其原因可能是:Netrin-1与VEGF协同作用,促进MSCs的迁移。Netrin-1与位于MSCs细胞膜上的UNC5C(Netrin-1的受体)结合,信号传导至细胞内,促进上皮细胞的增殖并向损伤处移动[12]。另有研究[13]表明,机体黏膜在缺氧时,缺氧诱导因子(hypoxia inducible factor 1 alpha,HIF-1α)通过诱导Netrin-1基因表达,促进中性粒细胞以及内皮细胞的迁移,及时修复机体受损的皮肤黏膜。体外小管形成实验结果显示,VEGF组与Netrin-1组比较,管腔周长、管腔数目以及分支点无明显变化(P>0.05);Netrin-1+VEGF组与VEGF组或Netrin-1组比较,管腔周长、管腔数目以及分支点明显增多(P<0.01)。其原因可能为:Netrin-1与VEGF协同作用,促进小管形成,其机制与细胞迁移相似。Netrin-1+VEGF组的MSCs迁移能力以及小管形成能力明显增加,因此,在动物体内可以诱导移植的MSCs进入缺血区域,加速局部小管的形成,促进缺血区的血管形成,从而改善缺血症状[14]。
体内血管生成实验结果显示,移植转染Netrin-1重组子的MSCs与移植普通MSCs相比,VEGF蛋白表达水平具有显著变化。与MSCs组比较,MSCs/Netrin-1组的VEGF蛋白水平更高(P<0.01)。其原因可能为:一方面,Matrigel胶占据组织细胞周围的氧气空间,使MSCs处于低氧状态,刺激MSCs表达HIF-1α,HIF-1α刺激周围细胞分泌VEGF,从而导致VEGF水平升高,诱导MSCs分化加速血管形成;另一方面,Netrin-1不但能与MSCs上的受体结合促进血管生成,还能促进VEGF表达水平[15]。
综上所述,VEGF和Netrin-1对血管生成均有促进作用,且Netrin-1能够促进VEGF的表达,为利用MSCs进行基因修饰或联合细胞因子移植(如Netrin-1)治疗缺血性疾病如糖尿病引起的下肢缺血性疾病提供实验依据。
4参考文献
[1]柯先金,李倩,丁新生.神经导向因子Netrin-1及其受体的作用研究现状[J].神经损伤与功能重建,2011,6(2):142-146.
[2]Masuda T,Watanabe K, Sakuma C,et al. Netrin-1 acts as a repulsive guidance cue for sensory axonal projections toward the spinal cord[J] .J Neurosci, 2008, 28(41):10 380-10 385.
[3]Rodrigues S, De Wever O,Bruyneel E, et al.Opposing roles of netrin-1 and the dependence receptor DCC in cancer cell invasion, tumor growth and metastasis[J].Oncogene,2007, 26(38):5 615-5 625.
[4]Kajdaniuk D, Marek B, Foltyn W, et al.Vascular endothelial growth factor (VEGF)-part 1 :in physiology and pathophysiology[J]. Endokrynologia Polska, 2011, 62(5): 444-455.
[5]沈颉.血管内皮生长因子在血管外膜成纤维细胞的表达研究[J].当代医学,2012,18(24):24-26.
[6]Lee HK, Seo IA, Seo E, et al.Netrin-1 induces proliferation of Schwann cells through Unc5b receptor[J]. Biochem Biophys Res Commun,2007,362(4): 1 057-1 062.
[7]何章彪,曹翠萍,刘卫华,等.Netrin-1及VEGF在食管鳞癌组织中的表达水平及其相关性研究[J].重庆医学,2013,17(6):34-39.
[8]Takahashi S.Vascular endothelial growth factor (VEGF),VEGF receptors and their inhibitors for antiangiogenic tumor therapy[J].Biological Pharmaceutical Bulletin,2011,34(12): 1 785-1 788.
[9]Al-Khaldi A,Al-Sabti H, Galipeau J.Therapeutic angiogenesis using autologous bone marrow stromal cells: improved blood flow in a chronic limb ischemia model[J]. Ann Thorac Surg, 2003,75(6): 204-209.
[10]辛毅,李娜,黄益民,等.小鼠骨髓间充质干细胞定向诱导分化血管内皮细胞的实验研究[J].新乡医学院学报,2014,1(8):114-119.
[11]黄凤.经穴注射BMSCs联合益气活血方对DM后肢缺血大鼠血管再生作用机制研究[D].北京:北京中医药大学,2014.
[12]Sebastien K, Celine G, Fabrice A,et al. Evaluation of the colorectal cancer risk conferred by rare UNC5C alleles[J]. World J Gastroenterol,2014,20(1): 236-239.
[13]Rosenberger P, Schwab JM, Mirakaj V ,et al.Hypoxia-inducible factor-dependent induction of netrin-1 dampens inflammation caused by hypoxia[J].Nat Immunol,2009,10(2):195-202.
[14]李倩.神经导向因子Netrin-1对间充质干细胞血管形成能力的作用研究[D].江苏南京:南京医科大学,2009.
[15]柯先金,李倩,朱剑,等.神经导向因子Netldn-1促进骨髓间充质干细胞的血管生成作用[J].中华内分泌代谢杂志,2012,28(9):750-753.
(收稿2015-04-02)
Positive impact of Netrin-1 on the expression of VEGF protein
LiJinghua,WangSuli,ShenJichun
DepartmentofEndocrinology,AffiliatedHospitaloftheArmedPoliceLogisticsCollege,Tianjin300162,China
【Abstract】Objective To study the relation between Netrin-1 (nerve guidance factor) and VEGF (vascular endothelial growth factor) protein. Methods SPF (specific pathogen free) Wistar rats were selected as objects, mesenchymal stem cells (MSCs) were acquired from rats' bone marrow cavity and were cultured under the situation of 37 ℃ and 5% CO2 until 4 generations. According to Transwell method, we used cell migration assays to divided rats into 4 groups: control group, VEGF group, Netrin-1 group and VEGF+Netrin-1 group. Then the number of cells per hole were calculated and observed by microscopy after 12h culture. In addition, the perimeter, the number of lumens and the number of branch points were measured after one-week culture. MSCs cells suspension transfected by Netrin-1 recombinant plasmid and non-transfected MSCs cells suspension were inoculated at rats' abdominal subcutaneous tissues. At the same time, we regarded Matrigel glue as blank control group, then pulled the glue emboli out after 10-, 20-, 30-day transplantation to test the expression level of VEGF. Results In cell migration and tube formation assays, cell migration number, the lumen perimeter, cavity number and branch number of the formed tube showed no significant differences between VEGF group and Netrin-1 group (P>0.05); Additionally, compared with VEGF group or Netrin-1 group, the number of cell migration, cavity and branch points were increased and the lumen perimeter was elongated in VEGF+Netrin-1 group with obviously statistical differences (P<0.01). In vivo angiogenesis assay, compared with non-transfected MSCs suspension group, MSCs/Netrin-1 group transfected by Netrin-1 recombinant had higher expression level of VEGF protein with statistically significant difference (P<0.01). Conclusion Both Netrin-1 and VEGF are capable of promoting angiogenesis, and their combination can have better effect. Netrin-1 promotes the expression of VEGF protein.
【Key words】Netrin-1; Vascular endothelial growth factor; Angiogenesis
【中图分类号】R-33
【文献标识码】A
【文章编号】1673-5110(2016)09-0003-04
