肝动脉灌注化疗及栓塞术中运用伊立替康与表阿霉素治疗不可切除肝癌的疗效分析
2016-06-27廖学斌黄梦君贺长林
廖学斌,黄梦君,贺长林
(都江堰市人民医院,a普外科,b肿瘤科,四川 都江堰 611830)
肝动脉灌注化疗及栓塞术中运用伊立替康与表阿霉素治疗不可切除肝癌的疗效分析
廖学斌a,黄梦君b,贺长林a
(都江堰市人民医院,a普外科,b肿瘤科,四川 都江堰611830)
摘要:目的比较肝动脉灌注化疗及栓塞术(TACE)中运用伊立替康与表阿霉素治疗不可切除肝癌的疗效。方法 选取行TACE治疗的不可切除肝癌患者100例,根据化疗方案不同分为伊立替康组(n=35)与表阿霉素组(n=65)。比较近期治疗效果、无进展生存期与总生存期、TACE后不良反应。结果两组患者近期疗效及TACE后不良反应比较差异无统计学意义(P>0.05)。伊立替康组中位无进展生存期为11.2个月,长于表阿霉素组(9.3个月),但差异无统计学意义(P>0.05);伊立替康组BCLC分级B亚组无进展生存期长于表阿霉素组(P<0.05)。伊立替康组患者1、2年生存率分别为85.7%、45.7%,均高于表阿霉素组(66.2%,21.5%)。伊立替康组及BCLC分级B亚组患者总生存期均长于表阿霉素组(P<0.05)。结论与表阿霉素传统化疗方案相比,TACE中运用伊立替康可延长不可切除肝癌患者的总生存期,且不良反应无差异。
关键词:肝肿瘤;表柔比星;化学疗法,肿瘤,局部灌注;化学栓塞,治疗性;治疗结果;伊立替康
大部分原发性肝细胞癌患者在明确诊断时已错失了根治性手术切除的机会[1]。对于不可手术切除的肝癌患者,肝动脉灌注化疗及栓塞术(transarterial chemoembolization,TACE)已成为延长生存时间的有效治疗手段之一[2]。本研究比较TACE中运用伊立替康与表阿霉素治疗不可切除肝癌的疗效。
1资料及方法
1.1一般资料选取2008年4月至2014年12月于都江堰市人民医院行动脉灌注化疗及栓塞术治疗的原发性肝癌患者100例,根据患者动脉灌注化疗及栓塞术中运用的化疗方案不同,分为伊立替康组与表阿霉素组。纳入标准:(1)所有患者均经病理学检查确诊为原发性肝细胞癌[3];(2)原发性肝癌临床诊断符合卫生部2011年版《原发性肝癌诊疗规范》[4];(3)肝功能Child-Pugh分级[5]为A或B级;(4)入组前血常规提示白细胞计数及血小板计数在正常范围内;(5)原发性肝癌无手术根治切除指征[6]。伊立替康组患者35例,其中男31例,女4例,年龄45~76岁,平均年龄(60.5±9.3)岁,合并HBV感染24例,肝功能Child-Pugh分级为A级28例,B级7例,肝癌最大直径3.1~15.6 cm,平均最大直径为(8.4±3.9)cm,单个肝癌病灶18例,多个肝癌病灶17例;表阿霉素组患者65例,其中男53例,女12例,年龄43~79岁,平均年龄(57.4±11.6)岁,合并HBV感染52例,肝功能Child-Pugh分级为A级55例,B级10例,肝癌最大直径2.8~16.3 cm,平均最大直径为(7.8±4.2)cm,单个肝癌病灶36例,多个肝癌病灶29例。年龄、性别、HBV感染、Child-Pugh分级、肝癌最大直径、肝癌病灶数量在伊立替康组与表阿霉素组间比较差异无统计学意义(P>0.05),具有可比性。见表1。
1.2治疗方法行动脉灌注化疗及栓塞术前所有患者均予止呕、镇痛、细胞保护剂等对症治疗。伊立替康组患者行动脉灌注化疗及栓塞术的化疗方案[7]为伊立替康200 mg(130~180 mg·m-2)+5-氟尿嘧啶1 000 mg(500~600 mg·m-2)。表阿霉素组患者化疗方案[8]为阿霉素50 mg(30~40 mg·m-2)+顺铂40 mg(20~30 mg·m-2)+5-氟尿嘧啶1 000 mg(500~600 mg·m-2)。每位患者的化疗药物用量先根据其体表面积大小来计算,再根据患者既往全身静脉化疗用药情况和患者目前的身体耐受情况确定最终的化疗药物用量。选择肝癌的供血动脉,先将伊立替康和表阿霉素的一半用量和5-氟尿嘧啶、顺铂的全部用量直接灌注,再将伊立替康和表阿霉素剩余的一半用量分别与超液态碘化油混合,形成化疗栓塞颗粒后在透视下漂入肝癌肿块内,当形成血管铸型、静脉显影或栓塞颗粒轻度返流后表示化疗栓塞完成[9],最后在肝癌供血动脉内漂入明胶海绵颗粒。所有患者在动脉灌注化疗及栓塞术后均积极配合免疫增强和护肝等对症治疗。

表1 两组患者一般资料比较/例(%)
1.3评价指标包括近期治疗效果、无进展生存期与总生存期、TACE后不良反应。近期治疗效果根据治疗前和治疗后1个月上腹部增强CT或MRI对比和修订后RECIST标准评定[10]:(1)完全缓解:动脉强化期未见肝癌病灶;(2)部分缓解:动脉强化期可见的肝癌病灶直径总和缩小超过30%;(3)疾病稳定:动脉强化期可见的肝癌病灶直径总和缩小小于30%或增加小于20%;(4)疾病进展:动脉强化期可见的肝癌病灶直径总和增加超过20%或出现新的肝癌病灶。治疗1个月后评定为非疾病进展的患者有再次行动脉灌注化疗及栓塞术的手术指征,若无Ⅳ度不良反应可继续使用当前化疗药物用量。评定为完全缓解的患者无需继续治疗,可3个月随访1次。总生存期的研究终点为患者随访期间内死亡或到达末次随访时间,即2015年12月31日。不良反应包括恶心呕吐、腹泻、骨髓抑制、肝功能损害、栓塞化疗后反应。
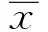
2结果
2.1两组患者近期治疗效果比较完全缓解率、部分缓解率、疾病稳定率、疾病进展率、缓解率在两组患者治疗1个月后比较差异无统计学意义(P>0.05)。见表2。

表2 两组患者近期治疗效果比较/例(%)
2.2两组患者无进展生存期与总生存期比较随访期间内,伊立替康组患者中位无进展生存期为11.2个月,长于表阿霉素组(9.3个月),但差异无统计学意义(P>0.05);伊立替康组BCLC分级B亚组患者无进展生存期长于表阿霉素组,差异有统计学意义(P<0.05)。见图1。伊立替康组患者1年、2年生存率分别为85.7%、45.7%,均高于表阿霉素组(66.2%、21.5%),差异有统计学意义(χ2=4.416,6.332;P=0.036,0.012)。伊立替康组所有患者及BCLC分级B亚组患者总生存期均长于表阿霉素组,差异有统计学意义(P<0.05)。见图2。
2.3两组患者TACE后不良反应比较骨髓抑制是两组患者TACE后最多见的不良反应,发热、肝区疼痛等栓塞化疗后反应次之。恶心呕吐、腹泻、骨髓抑制、肝功能损害、栓塞化疗后反应等不良反应在伊立替康组与表阿霉素组患者间比较差异无统计学意义(P>0.05)。见表3。
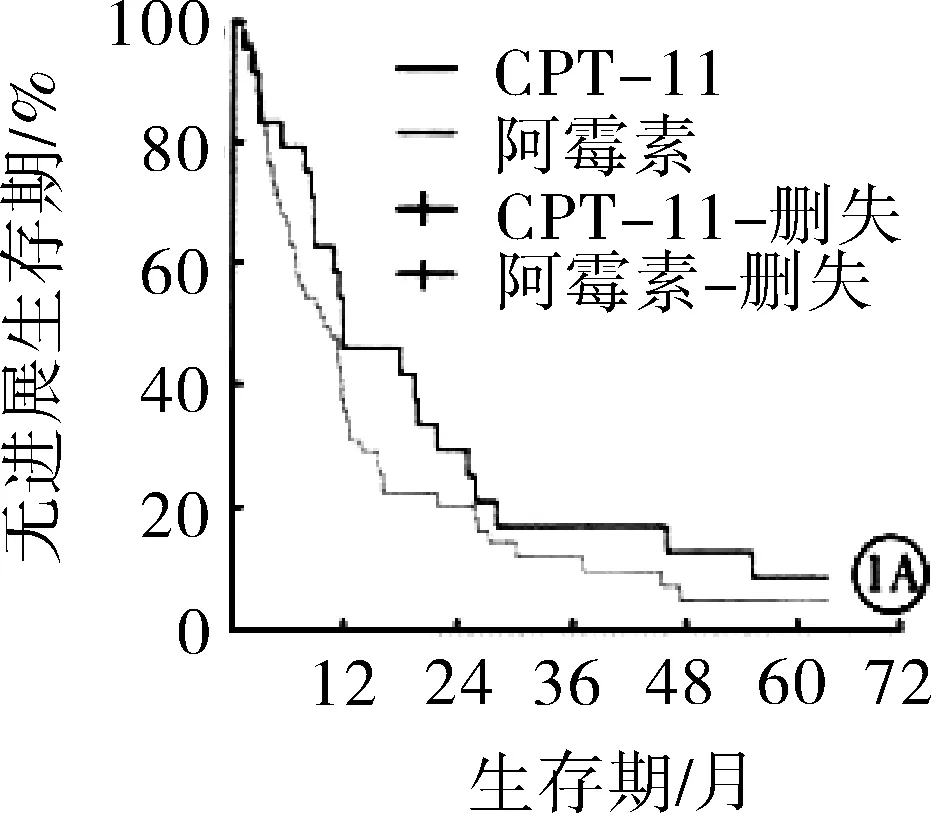
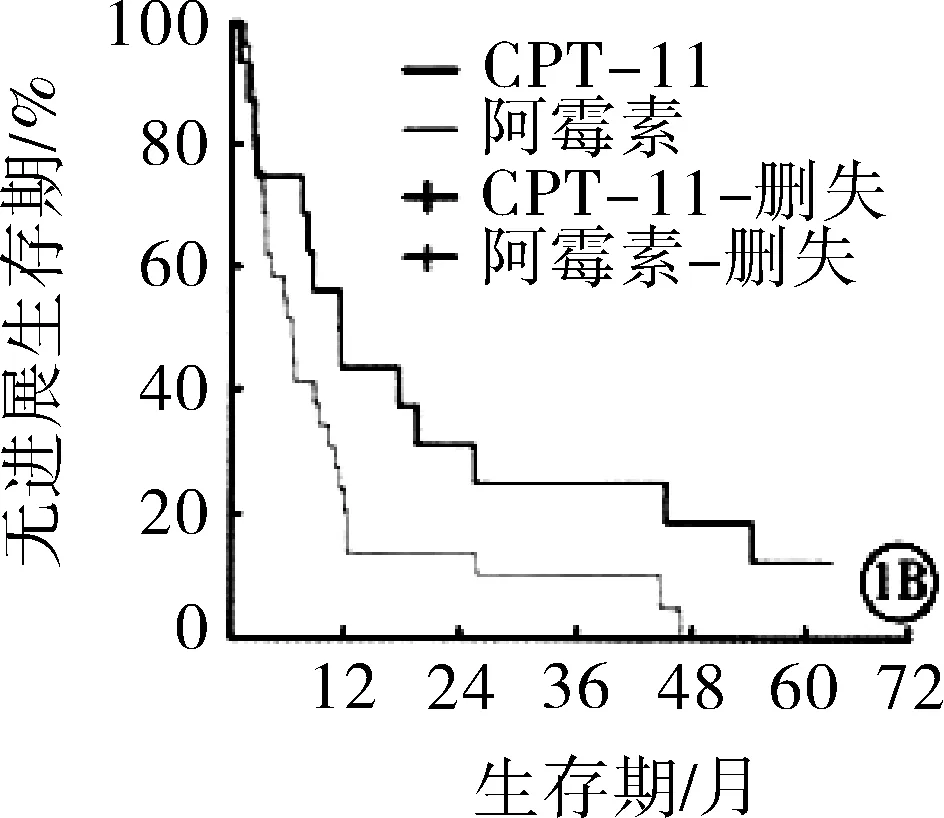
注:A:所有患者无进展生存期比较;B:BCLC分级B亚组患者无进展生存期比较CPT-11:伊立替康。
图1两组患者无进展生存期比较
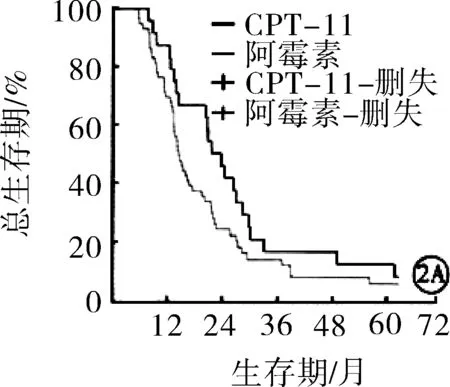
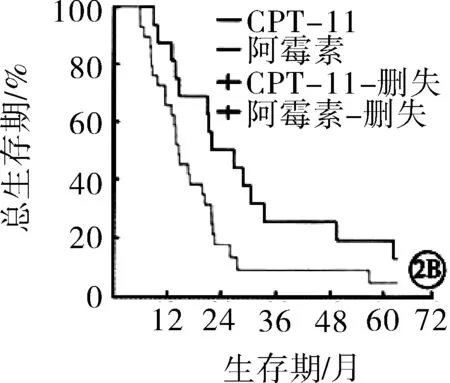
注:A:所有患者总生存期比较;B:BCLC分级B亚组患者总生存期比较CPT-11:伊立替康。
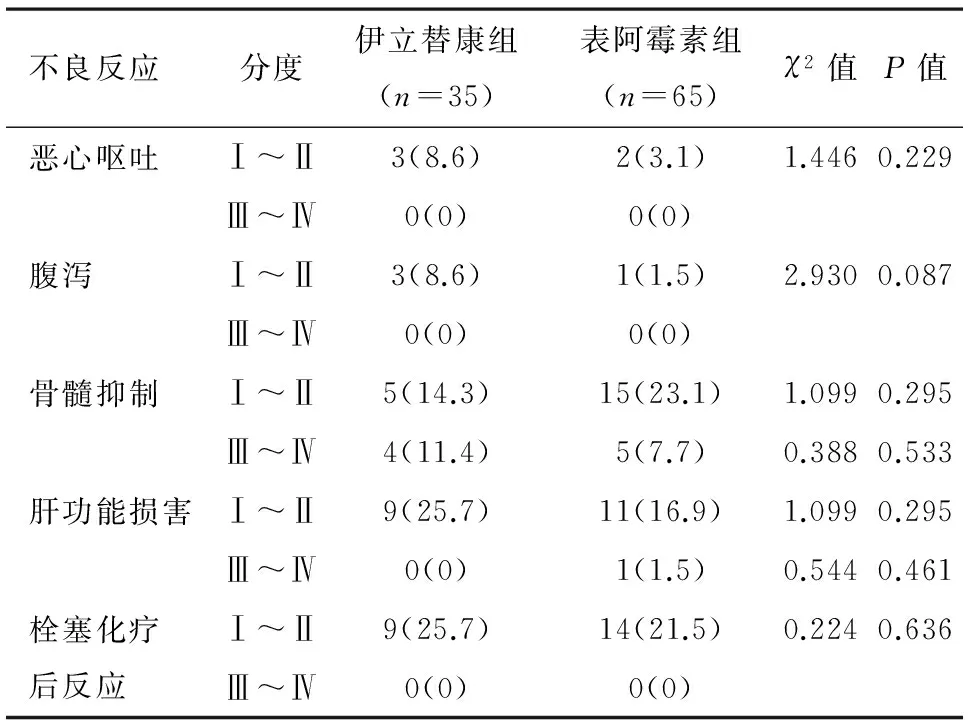
图2 两组患者总生存期比较
3讨论
肝动脉灌注化疗及栓塞术已成为不可切除的原发性肝细胞癌患者综合治疗的主要治疗方法之一[11]。大量临床研究证实[12-13],与最佳对症支持治疗相比,肝动脉灌注化疗及栓塞术在提高不可切除肝癌患者的疗效及延长生存时间上具有明显的优势。但是对于肝动脉灌注化疗及栓塞术选用何种化疗药物在临床上并没有受到足够的重视,故目前仍然没有制定出可供临床上参考和选择的TACE化疗药物标准[14]。既往临床上广泛使用的TACE化疗药物是表阿霉素[15],但随着伊立替康、顺铂、吉西他滨等化疗新药物的开发成功和临床推广,越来越多临床试验表明化疗新药物比传统化疗药物在肝癌治疗上更有优势[16-17]。其中伊立替康在肝癌体外敏感试验和许多肝癌临床试验中均发挥出良好的抗肝癌作用[18]。但在不可切除的原发性肝细胞癌患者行肝动脉灌注化疗及栓塞术中应用伊立替康的相关报道还较少[19]。
本研究结果显示,与传统化疗方案表阿霉素相比,在肝动脉灌注化疗及栓塞术应用伊立替康可延长不可切除的肝癌患者的总生存期,而胃肠道反应、骨髓抑制、肝肾毒性等TACE后不良反应比较差异无统计学意义。本研究中完全缓解率、部分缓解率、疾病稳定率、疾病进展率在两组患者治疗1个月后比较差异无统计学意义,其可能原因为在早期治疗时相比灌注化疗,该阶段的栓塞治疗占的地位更重要,灌注化疗的治疗效果主要体现在远期的延长无进展生存期和总生存期上。本研究也发现,在BCLC分级B亚组中,伊立替康组患者的无进展生存期和总生存期均长于表阿霉素组,进一步说明了伊立替康应用于TACE中的优势,但仍需后续大量临床试验来证实该结论。Tatjana等[20]研究表明,影响不可切除肝癌患者无进展生存期和总生存期的一个特别重要的因素是肝癌的CLIP评分,CLIP评分越低,提示患者预后越好。
综上所述,与肝动脉灌注化疗及栓塞术中应用传统化疗方案表阿霉素相比,在不可切除肝癌患者中运用以伊立替康为主的化疗方案可延长患者的总生存期,且TACE后不良反应在二者间比较无差异,患者耐受性较好,可逐步在临床上推广。但本研究仍存在一些问题和不足之处。由于本研究属于回顾性研究,选取的样本量在两组间差别较大,以表阿霉素为主的传统化疗方案为主,故本研究得出的结论只是一个初步探讨,说明伊立替康在肝动脉灌注化疗及栓塞术中具有潜在的治疗不可切除肝癌患者优势。因此,仍需要进一步大样本多中心随机对照试验来证实本研究得出的初步结论。
参考文献
[1]张孔志,余文昌,陈示光,等.TACE 联合放疗对原发性肝癌合并门静脉癌栓患者生存的影响[J].中国肿瘤临床,2012,39(1):35-37.
[2]Cotoi CG,Khorsandi SE,Plesea IE,et al.Histological aspects of post-TACE hepatocellular carcinoma[J].Rom J Morphol Embryo,2012,53(3):677-682.
[3]迟秀婷,沈加林.肝癌TACE治疗效果的影像学评估[J].介入放射学杂志,2013,22(8):694-697.
[4]Vesselle G,Quirier-Leleu C,Velasco S,et al.Predictive factors for complete response of chemoembolization with drug-eluting beads (DEB-TACE) for hepatocellular carcinoma[J].Eur Radiol,2015,1(2):385-389.
[5]Farinati F,Giacomin A,Vanin V,et al.TACE treatment in hepatocellular carcinoma: what should we do now?[J].J Hepatol,2012,57(1):221-222.
[6]范文哲,杨建勇,吕明德,等.TACE联合经皮热消融治疗大肝癌的疗效及预后分析[J].中华医学杂志,2011,91(31):2190-2194.
[7]孙建,简志祥,区应亮,等.术后预防性TACE对具有不同高危复发因素肝癌患者的临床价值[J].实用医学杂志,2011,27(12):2148-2150.
[8]Song L,Zhang Y,Zhao G,et al.Complete remission of diffuse hepatocellular carcinoma in a young adult after GSP-TACE: A case report[J].World J Surg Oncol,2014,12(1):1-4.
[9]Bhalakia N,Shaw CM,Brown DB.Efficacy of TACE in elderly patients with hepatocellular carcinoma [J].J Vasc Interv Radiol,2014,25(3):S24.
[10] 赵静,于鸿,吴荻,等.新型伊立替康衍生物ZBH-1208的体外抗肿瘤活性及机制研究[J].中国实验诊断学,2015,5(2):181-186.
[11] 徐璐,杜临安.肝动脉化疗栓塞联合射频消融治疗乏血供大肝癌的疗效分析[J].安徽医药,2015,19(6):1111-1114.
[12] Pascale F,Bedouet L,Baylatry M,et al.Comparative chemosensitivity of VX2 and HCC cell lines to drugs used in TACE[J].AnticancerRes,2015,35(12):368-372.
[13] Schiffman SC,Metzger T,Dubel G,et al.Precision hepatic arterial irinotecan therapy in the treatment of unresectable intrahepatic cholangiocellular carcinoma: Optimal tolerance and prolonged overall survival[J].Ann Surg Oncol,2011,18(2):431-438.
[14] 黄兴凤.伊立替康联合沙利度胺治疗晚期原发性肝癌27例临床护理[J].齐鲁护理杂志,2014,11(10):68-69.
[15] 吴爽,张阳,李斌,等.伊立替康节拍式化疗联合索拉非尼对小鼠移植性肝癌的作用[J].大连医科大学学报,2012,34(6):558-561,577.
[16] Takemura N,Saiura A,Koga R,et al.Repeat hepatectomy for recurrent liver metastasis from gastric carcinoma[J].World J Surg,2013,37(11):2664-2670.
[17] Eichler K,Zangos S,Mack MG,et al.First human study in treatment of unresectable liver metastases from colorectal cancer with irinotecan-loaded beads (DEBIRI)[J].Int J Oncol,2012,41(4):1213-1220.
[18] Moss RA,Cruz JE,Saksena R,et al.The power of genes a case of unusually severe systemic toxicity after localized hepatic chemoembolization with irinotecan-eluted microspheres for metastatic colon cancer[J].Ann Pharmacother,2014,48(14):1646-1650.
[19] 刘昕,汪世存,吕维富,等.18 F-FDG PET/CT对肝癌患者TACE术后预后的相关性分析[J].安徽医药,2014,18(11):2106-2109.
[20] Tatjana GR,Naguib NNN,Katrin E,et al.Transarterial chemoembolization of unresectable systemic chemotherapy-refractory liver metastases from colorectal cancer: Long-term results over a 10-year period[J].Int J Cancer,2014,134(5):1225-1231.
Comparison of curative effects of irinotecan and pharmorubicin for TACE in patients with unresectable hepatocellular carcinoma
LIAO Xue-bina,HUANG Meng-junb,HE Chang-lina
(a.DepartmentofGeneralSurgery,b.DepartmentofOncology,People’sHospitalofDujiangyan,Sichuan611830,China)
Abstract:Objective To compare the curative effects of irinotecan and pharmorubicin for TACE in patients with unresectable hepatocellular carcinoma.Methods 100 patients with unresectable hepatocellular carcinoma undergoing transarterial chemoembolization from April 2008 to December 2014 in People’s Hospital of Dujiangyan were assigned into irinotecan group (n=35) and pharmorubicin group (n=65).Recent therapeutic effect,progression free survival and overall survival,adverse reaction after TACE of patients in two groups were compared.Results There was no statistically significant difference in recent therapeutic effect and adverse reaction after TACE between two groups (P>0.05).The median progression free survival of irinotecan group was 11.2 months,longer than that in pharmorubicin group (9.3 months),but the difference was not statistically significant (P>0.05).The median progression free survival of BCLC hierarchical B subgroup in irinotecan group was longer than that in pharmorubicin group (P<0.05).The 1-year and 2-year survival rates were 85.7%,45.7%,higher than those in pharmorubicin group (66.2%,21.5%).The overall survival of irinotecan group and BCLC hierarchical B subgroup in irinotecan group were longer than those in pharmorubicin group (P<0.05). Conclusions Compared with the traditional chemotherapy of epirubicin,irinotecan in TACE can prolong the overall survival of patients with unresectable hepatocellular carcinoma and there is no difference in adverse reactions.
Key words:Liver Neoplasms;Epirubicin;Chemotherapy,Cancer,Regional Perfusion;Chemoembolization,Therapeutic;Treatment Outcome;rinoteca
doi:10.3969/j.issn.1009-6469.2016.05.049
(收稿日期:2016-01-28,修回日期:2016-03-05)
