“黄优1号”条斑紫菜新品系遗传背景和营养成分分析*
2016-06-27汪文俊梁洲瑞刘福利孙修涛姚海芹李晓蕾王飞久
曹 原,汪文俊,梁洲瑞,刘福利,孙修涛,姚海芹,李晓蕾,王飞久
(1.中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,山东青岛 266071;2.上海海洋大学水产与生命学院,上海 201306;3.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东青岛 266000)
“黄优1号”条斑紫菜新品系遗传背景和营养成分分析*
曹原1,2,3,汪文俊1,3**,梁洲瑞1,3,刘福利1,3,孙修涛1,3,姚海芹1,2,3,李晓蕾1,2,3,王飞久1,3
(1.中国水产科学研究院黄海水产研究所,农业部海洋渔业可持续发展重点实验室,山东青岛266071;2.上海海洋大学水产与生命学院,上海201306;3.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验室,山东青岛266000)
摘要:【目的】丰富我国北方紫菜(Pyropia)栽培种质,培育优良新品系。【方法】以山东长岛县砣矶岛野生紫菜作为亲本,经过选育,分别采集在南通、日照和砣矶岛海区栽培的“黄优1号”紫菜成体进行遗传背景(rbcL和细胞色素C氧化酶Ⅰ亚基(Cycochrome oxidase subunit Ⅰ,CO Ⅰ)基因)和营养成分(藻胆蛋白、叶绿素a Chl a、类胡萝卜素Car和可溶性蛋白TSPs)分析。【结果】依据rbcL基因序列(约1 200 bp)进行遗传多样性分析,仅砣矶岛养殖绳上全沉水生长的野生紫菜群体与其他品系(群体)具有1.1%的遗传差异,而其栽培群体(“黄优1号”)的rbcL基因序列与对照条斑紫菜品系完全一致;依据CO Ⅰ基因序列(约680 bp),仅南通的两栽培品系(“黄优1号”和培育品系2)具有2 bp差异,其他品系(群体)的CO Ⅰ基因序列与对照条斑紫菜完全一致。日照海区栽培的“黄优1号”紫菜其营养物质含量比其他海区栽培的“黄优1号”紫菜、野生亲本以及培育品系2高;南通海区栽培的“黄优1号”条斑紫菜品质一般,大部分营养物质含量均低于日照栽培藻体。【结论】由rbcL和CO Ⅰ基因序列推断砣矶岛岸边和养殖绳上的野生紫菜大部分为条斑紫菜,选育品系“黄优1号”为条斑紫菜;在不同海区进行栽培的“黄优1号”条斑紫菜营养成分均优于其野生亲本;初步研究结果表明该品系更适于在日照海区栽培。
关键词:条斑紫菜藻胆蛋白叶绿素a可溶性蛋白rbcL基因CO Ⅰ基因
0引言
【研究意义】据2001年刊登在联合国粮农组织网站上的文章统计,大型海藻年产值约5.6亿美元,其中仅紫菜(Pyropia)创造的价值就占1.18亿美元[1]。因此,紫菜作为产值最大的栽培海藻,培育优质、高产的品种(系)对其开发利用起关键作用。【前人研究进展】藻胆蛋白、类胡萝卜素(Car)、叶绿素(Chl a)和可溶性蛋白(TSPs)含量都是评价紫菜品质的重要指标。藻胆蛋白是红藻、蓝藻和某些甲藻中一类特有的光合作用天然色素,可分为藻红蛋白、藻蓝蛋白、别藻蓝蛋白3大类[2]。藻胆蛋白具有很高的开发利用价值,既可以作为天然色素用于工业生产,也可以制成荧光试剂用于医学等领域[3]。叶绿素是较早开发的一种金属卟啉化合物天然绿色色素,在临床治疗、食品、日用化工上都有很大用途[4]。藻胆蛋白和叶绿素组成不仅关系到紫菜品质,它们作为主要的光合作用色素还影响紫菜的生长速度以及产量。类胡萝卜素作为重要的氧化还原物质,对紫菜的逆境应急反应具有重要贡献。紫菜是一类高蛋白的优质海洋蔬菜,其蛋白质含量约占藻体干重的20%~40%。可溶性蛋白的含量是衡量紫菜营养价值的重要指标之一。许多可溶性蛋白是植物中酶的重要组成部分,参与植物多种生理生化代谢过程的调控,与其生长发育、成熟衰老、抗病性、抗逆性密切相关[5]。紫菜除了有很高的经济价值外,还有很高的科学研究价值。紫菜是定植于潮间带的大型海藻,随着潮汐作用,周期性的经历海水和空气两种截然不同的环境变化。涨潮时,藻体淹没在海水里,低潮时,藻体干出失水[6]。不同海域所经历的潮汐周期不等,所受的胁迫不同,其适应过程的基因表达模式也可能存在差异。此外,紫菜藻体外形较为简单,且随生长环境等呈现差异,因此,仅根据外部形态无法准确进行种质鉴定,尤其对于遗传混杂的野生群体。分子生物学研究基础薄弱,不利于紫菜养殖业的发展[7]。【本研究切入点】为丰富紫菜栽培种质,培育优质高产新品种,我们从从未进行紫菜栽培的长岛海区采集优质紫菜作为亲本,初步培育出优质品系“黄优1号”。为了解“黄优1号”紫菜在品质上对比其亲本的优越性,掌握不同栽培海区对新品系品质的影响。【拟解决的关键问题】本文以条斑紫菜优质品系为对照,比较不同海区栽培的“黄优1号”品系与野生亲本在遗传背景(rbcL和细胞色素C氧化酶Ⅰ亚基(Cytochrome oxidase subunit Ⅰ,COⅠ)基因)和营养成分(藻胆蛋白、叶绿素a、类胡萝卜素和可溶性蛋白)含量上的差异,以期为进一步优化培育“黄优1号”品系,直至形成性状优良、遗传稳定的栽培新品种奠定基础。
1材料与方法
1.1材料
以分别采自生长在山东长岛县砣矶岛岸边经历周期性干出日晒的野生紫菜与生长在养殖绳上全沉水生活的野生紫菜为种菜,采用选育手段,培育出后代,然后分别在不同海区进行栽培,藻体长成后,采集样本进行比较分析,以日照海区的优质条斑紫菜品系为对照。样品来源与特征见表1,其中,培育品系1a~c为“黄优1号”在不同海区的栽培群体。
表1本研究中7个品系(群体)的来源与特征
Table 1The origin and characteristics of the 7 varieties (groups) in this study
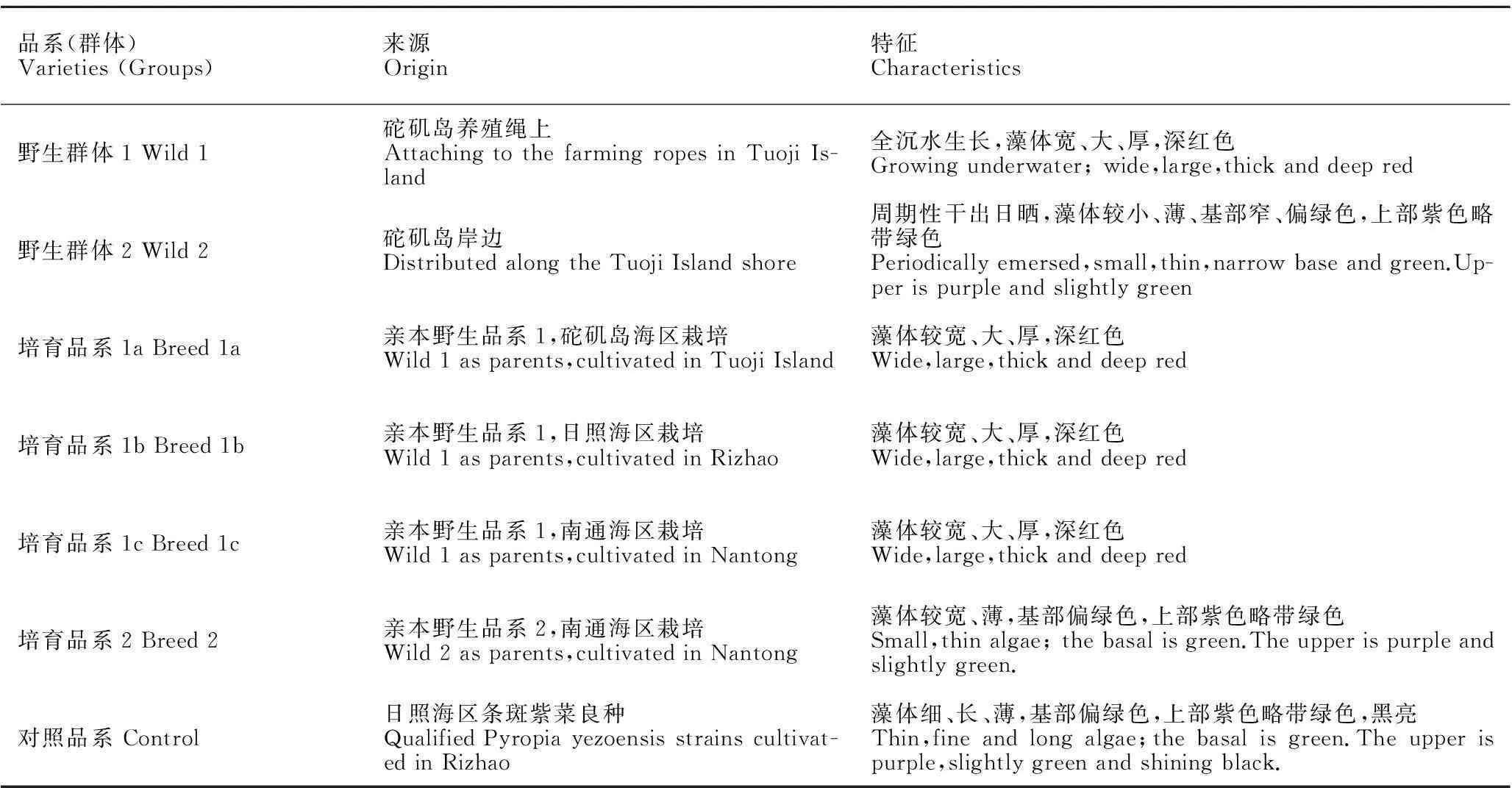
品系(群体)Varieties(Groups)来源Origin特征Characteristics野生群体1Wild1砣矶岛养殖绳上AttachingtothefarmingropesinTuojiIs-land全沉水生长,藻体宽、大、厚,深红色Growingunderwater;wide,large,thickanddeepred野生群体2Wild2砣矶岛岸边DistributedalongtheTuojiIslandshore周期性干出日晒,藻体较小、薄、基部窄、偏绿色,上部紫色略带绿色Periodicallyemersed,small,thin,narrowbaseandgreen.Up-perispurpleandslightlygreen培育品系1aBreed1a亲本野生品系1,砣矶岛海区栽培Wild1asparents,cultivatedinTuojiIsland藻体较宽、大、厚,深红色Wide,large,thickanddeepred培育品系1bBreed1b亲本野生品系1,日照海区栽培Wild1asparents,cultivatedinRizhao藻体较宽、大、厚,深红色Wide,large,thickanddeepred培育品系1cBreed1c亲本野生品系1,南通海区栽培Wild1asparents,cultivatedinNantong藻体较宽、大、厚,深红色Wide,large,thickanddeepred培育品系2Breed2亲本野生品系2,南通海区栽培Wild2asparents,cultivatedinNantong藻体较宽、薄,基部偏绿色,上部紫色略带绿色Small,thinalgae;thebasalisgreen.Theupperispurpleandslightlygreen.对照品系Control日照海区条斑紫菜良种QualifiedPyropiayezoensisstrainscultivat-edinRizhao藻体细、长、薄,基部偏绿色,上部紫色略带绿色,黑亮Thin,fineandlongalgae;thebasalisgreen.Theupperispurple,slightlygreenandshiningblack.
考马斯亮蓝试剂CBB的配置:称取100 mg考马斯亮蓝G-250,溶于50 mL 90%(V/V)乙醇中,加入85%(W/V)的磷酸100 mL,最后用蒸馏水定容到1 000 mL,此溶液在常温下可放置一个月。
1.2方法
1.2.1基因克隆与测序
1.2.1.1基因组DNA提取
选用天根(TIANGEN)植物基因组DNA提取试剂盒 (DP305-02)提取7种紫菜品系(群体)的基因组DNA,每个品系(群体)取5棵分别提取DNA进行基因克隆、测序和序列分析。
1.2.1.2基因组片段的PCR扩增与回收
用于扩增7种紫菜品系(群体)的1,5-二磷酸羧化酶/加氧酶(Rubisco)大亚基基因(rbcL)和CO Ⅰ基因片段的引物分别为rbcL F:5′-GTAATTCCATATGCTAAAATGGG-3′,rbcL R:5′-ATCTTTCCATAGATCTAAAGC-3′;CO ⅠF:5′-TCAACAAATCATAAAGATATTGG-3′,CO ⅠR:5′-ACTTCTGGATGTCCAAAAAAYCA-3′。引物由生工生物工程(上海)股份有限公司合成,制备成浓度为100 μmol/L的储存液,分装置于-20℃。PCR反应体系总体积为25 μL,包含1×Taq MasterMix(Dye)(康为世纪),引物0.4 μmol/L,DNA模板5 ng。以上反应均设阴性对照,即不加DNA模板的反应体系,以排除DNA污染的情况。PCR产物经过TAE琼脂糖凝胶电泳检测后,于紫外灯下切割目的条带,用DNA胶回收试剂盒进行产物纯化回收,送北京天一辉远生物科技有限公司进行测序。CO Ⅰ基因片段较短(约680 bp),采用单向测序;rbcL基因片段较长(约1 200 bp),采用双向测序。
1.2.2藻胆蛋白含量测定
藻胆蛋白含量测定方法参照文献[8],略有改动。称取适量藻体,液氮研磨,然后加入10倍(V/W)0.05 mol/L磷酸缓冲液(pH值为6.8);室温放置3 min后置于-20℃冷冻40 min,室温解冻,反复冻融3次,在4℃放置3 h;4℃,3 500 g离心10 min,取上清稀释一定倍数;分别于650 nm、618 nm、560 nm处测定吸光度值(A)。提取过程必须在避光条件下进行。每个品系(群体)取3个重复。计算公式如下:
CR-PE(藻红蛋白)=0.123A560-0.07A618+0.015A650;
CR-PC(藻蓝蛋白)=0.187A618-0.089A650;
CAPC(别藻蓝蛋白)=0.171A650-0.006A560-0.004A618;
Content=C*V*n。
其中,Content:藻胆蛋白的含量(mg);C:藻胆蛋白的质量浓度(mg/mL);V:稀释后的待测液体积(mL);n:上清液稀释倍数。
1.2.3叶绿素a和类胡萝卜素含量测定
叶绿素a(Chl a)和类胡萝卜素(Car)用100%甲醇提取;4℃条件下,避光自提24 h,然后5 000 g离心10 min取上清,稀释一定倍数;分别于750 nm、665 nm、652 nm、510 nm、480 nm处测定吸光度值(A)。每个品系(群体)取3个重复。根据Parsons和Strickland[9]的公式计算Chl a和Car的含量。
1.2.4可溶性蛋白含量测定
可溶性蛋白(TSPs)的测定方法参照文献[10],略有改动。取0.05 g藻体研磨,蒸馏水定容至5 mL,室温自提40 min;4 000 g离心10 min得到提取液(V);取1 mL提取液+5 mL考马斯亮蓝试剂(CBB)混匀,静置2 min,于595 nm 处测定其吸光度(A),并通过标准曲线查得蛋白质含量,对照液为1 mL蒸馏水+5 mL CBB。每个品系(群体)取3个重复。计算公式如下:
TSPs含量(mg/g)=(C*V/a)/W,
式中,C:每管蛋白质含量(mg);V:提取液总体积(mL);a:测定所取液体积(mL);W:样品鲜重(g)。
1.3数据处理
用OriginPro8.5作图进行品系之间不同物质含量的对比,并用SPSS进行显著性差异分析。用ClustalX和MEGA4.1进行遗传多样性分析。
2结果与分析
2.1遗传多样性分析
经过基因组总DNA提取、基因片段特异性的PCR扩增和纯化、PCR扩增产物的回收以及DNA测序,得到不同品系(群体)的rbcL和COⅠ基因序列。然后利用ClustalX软件对几个品系的两个基因片段进行剪切和编辑。由于品系(群体)间的基因相似度高,多态性低,构建系统进化树可信度较低,所以我们仅进行序列比对。结果发现,获得的7个紫菜品系(群体)CO Ⅰ基因片段长680 bp,仅南通栽培的培育品系2和“黄优1号”出现两个碱基的变异,其他品系(群体)与对照条斑紫菜序列完全一致。获得的rbcL基因片段长约1 200 bp,经过ClustalX比对发现13个差异位点(10处转换,3处颠换),且差异均存在于野生群体1中,野生群体2、培育品系2、“黄优1号”与对照条斑紫菜的rbcL基因序列完全一致(表2)。这说明砣矶岛的野生紫菜中条斑紫菜较多。养殖绳上的紫菜其遗传多样性水平比岸边生长的高,野生群体1中rbcL序列差别较大的个体是否为其他紫菜物种,还需结合形态、生殖特性、生活史和其他分子标记进一步验证,因为rbcL基因序列发生变异的个体其COⅠ基因序列却完全相同。总之,“黄优1号”和培育品系2均为条斑紫菜。
表27紫菜品系(群体)基于rbcL基因序列计算的遗传距离
Table 2Genetic distances among seven Pyropia varieties (populations) based on rbcL gene fragments
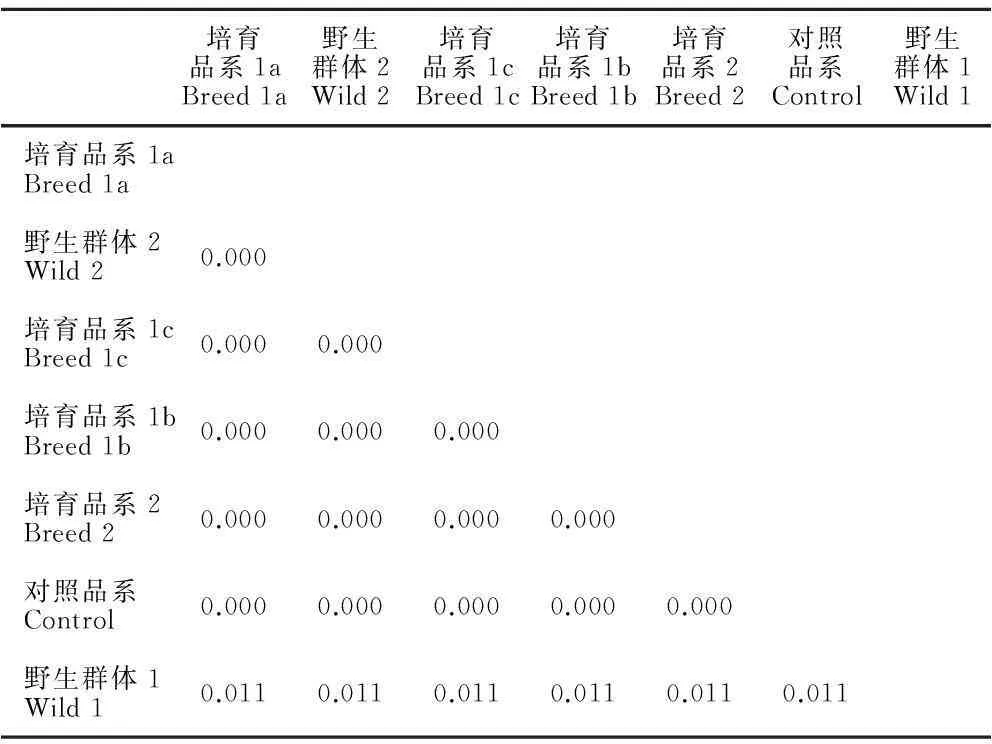
培育品系1aBreed1a野生群体2Wild2培育品系1cBreed1c培育品系1bBreed1b培育品系2Breed2对照品系Control野生群体1Wild1培育品系1aBreed1a野生群体2Wild20.000培育品系1cBreed1c0.0000.000培育品系1bBreed1b0.0000.0000.000培育品系2Breed20.0000.0000.0000.000对照品系Control0.0000.0000.0000.0000.000野生群体1Wild10.0110.0110.0110.0110.0110.011
2.2营养成分含量
由图1a~c可知,“黄优1号”在不同海区栽培藻体的藻胆蛋白含量均高于其亲本野生群体1,其中于日照海区培育的藻体其各类藻胆蛋白含量最高,呈显著性差异(P<0.05)。但日照海区栽培的“黄优1号”藻胆蛋白含量相较于作为同海区优质条斑紫菜对照品系略低,但与之差异不显著(P>0.05)。
以砣矶岛岸上野生群体2为种菜,其选育后代培育品系2的藻胆蛋白含量却小于其野生群体,尤其是藻红蛋白,呈显著性差异(P<0.05)。相较于日照栽培藻体,“黄优1号”在南通的栽培藻体具有显著较低的藻胆蛋白含量。南通与砣矶岛地区同期水温相差约5~6℃,而日照与砣矶岛地区同期温差较小,说明通过选育的手段从北方野生种质中筛选的紫菜品系可适当南移,但不适合移至温差过大的南方海域进行栽培。这可能也解释了不同海区栽培的同一品系“黄优1号”,来自日照海区的栽培藻体其藻胆蛋白含量高于南方海区栽培藻体的原因。
日照海区栽培的“黄优1号”藻体的Chl a和Car含量高于其他品系(群体)(P<0.05)(图1d~e),而其他品系(群体)的Chl a含量均较低。野生群体2的Chl a含量比其后代培育品系2高很多,与之前藻胆蛋白(图1a~c)结果类似。同时,其Chl a和Car含量比同海区优质条斑紫菜对照品系分别高出47.7%和106.4%。影响Chl a含量的因素很多,主要有氮、磷、水温、透明度和降水等[11],结果说明日照海域的总环境相较于同期的南通、砣矶岛来说,更适合“黄优1号”生长。
经显著性差异分析发现,7个紫菜品系(群体)根据TSPs含量,可以分为两个子集,野生群体2、培育品系1b和对照品系为一个子集,其余品系为一个子集,子集之间存在显著性差异(P<0.05)(图1f)。其中,培育品系1b比对照品系的可溶性蛋白含量更高,这说明日照海区栽培的“黄优1号”相较于同海区生长的优质条斑紫菜品质更高。
依据本研究分析的几大物质含量,可见选育品系“黄优1号”的品质高于其亲本,且遗传背景单一、稳定(基于相同的rbcL和COⅠ序列)。说明从野生群体中采用选育手段培育品质更佳的栽培品系(群体)具有可行性。而不同海区对“黄优1号”栽培藻体的品质有很大影响,三海区中以日照海区最优(图1)。与同海区(日照)栽培的对照品系条斑紫菜相比,“黄优1号”紫菜具有更高的TSPs、Chl a、Car含量,较低的藻胆蛋白含量和藻胆蛋白∶TSPs比值(P<0.05)。
同在南通海域栽培的“黄优1号”和培育品系2的各物质含量相差不大,这说明来自北方的紫菜种质不适于生长在温差较大的南方海域。而“黄优1号”在其亲本发源地砣矶岛进行栽培,各物质含量虽高于野生亲本,但比日照海区栽培藻体低很多,可能由于两海区的水质状况不同造成,具体原因还有待进一步研究。

图1不同品系(群体)间营养成分含量对比
Fig.1Comparison of nutrition among different strains (populations)
3讨论
我国已记录的紫菜有24种(3坛紫菜养殖变种),包含从冷温带到暖温带的特征种类[12]。我国进行规模化栽培的紫菜种类主要为坛紫菜和条斑紫菜[13]。中国现代紫菜栽培业发起于20世纪六、七十年代,经过数十年的发展,形成江苏条斑紫菜主产区和浙江、福建坛紫菜主产区,年栽培面积近600 km2,占大型经济海藻总栽培面积的50%以上[13]。紫菜栽培采用半浮动筏式或支柱式,只能在浅海进行。在海区有限的情况下,长期、密集栽培同一种紫菜导致病烂频发、品质下降。这说明同一种紫菜在多年的栽培生产中,历经累代选育,导致遗传背景单一、抗病能力下降。虽然我们拥有多个生产品系,但这些品系基本上是从栽培种菜中选择或加以诱变再选育而来。而且,条斑紫菜野生资源主要分布于山东以北,其主产区在江苏,栽培种质与野生种质的遗传交换被完全地理隔离。加上条斑紫菜栽培前期壳孢子幼体放散大量的无性孢子(单孢子,archeospore),单孢子甚至成为生产中主要的苗种来源[14]。野生资源的缺乏和大量的无性繁殖进一步导致栽培种质遗传背景单一化。山东半岛紫菜野生资源丰富,种类较多,从中开发新的具有生产潜能的种质对保持栽培紫菜的遗传多样性、丰富紫菜产品的种类、提高紫菜产业的抗风险能力具有重要意义。
基于将优质野生种质引入生产培育新的栽培品系目的,我们从从未进行紫菜栽培的长岛县砣矶岛海域采集到野生紫菜种质。从形态外观和生长方式上,将该海区的野生种质区分为野生群体1和野生群体2,其中前者比后者藻体大、宽,肉眼观察颜色更红,口感也佳,与现有栽培品系相比差别巨大,因此成为我们的重点关注对象。前期通过大量的研究工作,攻克了野生群体1生产性育苗关键技术,初步培育出性状一致、稳定的新品系“黄优1号”,在日照地区与对照品系比对,产量相当。
由于野生紫菜遗传背景混杂,仅从外观上难以进行精确的种质鉴定和遗传背景评估,比如条斑紫菜和甘紫菜[15]。本研究中的培育品系来源于长岛的野生紫菜,生长在养殖绳上的和生长在岸边的藻体在形态和口感上差别显著。为了明确亲本所属物种、了解砣矶岛野生紫菜群体的遗传多样性及其培育后代的遗传变化情况,本文对野生亲本和培育品系进行遗传多样性分析。rbcL和COⅠ基因具有进化速率适中的特点,是进行种属系统进化研究的良好标记[16-17]。因此,本文采用rbcL和COⅠ基因分析几种品系(群体)之间的遗传距离。Rubisco存在于所有高等植物的叶绿体中,参与卡尔文循环中CO2的固定,是光合植物叶片中含量最丰富的蛋白质,也是光合作用中的关键酶[18],它主要由8个大亚基和8个小亚基组成,其中大亚基由叶绿体DNA编码,这段基因即为rbcL基因。COⅠ基因是线粒体DNA上的一段蛋白质编码基因。结果发现,野生群体2和“黄优1号”的rbcL和COⅠ基因序列与对照条斑紫菜品系完全相同,可以断定为条斑紫菜。而野生群体1中除了条斑紫菜,40%个体的rbcL基因与其他品系(群体)具有1.1%的遗传差异(表2),是否为其他种还需结合其他手段进行鉴定。
通过营养成分分析,发现不同海区栽培的“黄优1号”藻体各物质含量普遍比野生群体高或相当,其中日照海区“黄优1号”栽培藻体内几种营养物质的含量均远大于南通和砣矶岛海区的栽培藻体。相较于同海区优质条斑紫菜对照品系,其叶绿素和可溶性蛋白的含量更高;藻胆蛋白含量和藻胆蛋白∶TSPs比值较低,但两者之间并无显著性差异(P<0.05)。低光下紫菜藻体积累藻胆蛋白,以提高光能利用效率,另外还充当氮的主要储存库,占TSPs的比例可达70%以上[15]。“黄优1号”的亲本野生群体1生长在养殖绳上,整个生命周期营沉水生活,而对照品系经过多代“插竿式”栽培方式,在生长过程中,经历周期性的干露日晒,其适应的光照强度明显高于野生群体1。在日照海区,“黄优1号”与对照品系的栽培方式一致,均经历周期性的干露日晒,相同的光照条件于对照品系而言是合适的,对“黄优1号”而言可能产生高光胁迫。藻胆蛋白作为紫菜主要的外周捕光色素,是感应光强变化的重要指示物质,低光下含量较高,高光下含量降低。推测这可能是导致“黄优1号”中藻胆蛋白含量比对照品系中低的原因。藻胆蛋白是TSPs的主要成分之一,相同栽培条件下,“黄优1号”比对照品系具有较低的藻胆蛋白,较高的TSPs,说明“黄优1号”中其他蛋白积累效率明显高于对照品系。
总之,与亲本以及对照品系比较,无论是产量还是营养价值,“黄优1号”可与之相当甚至更高,说明从野生种质中仅采取选育的手段即可培育出比亲本性状显著优良的品系,但仅用选育手段培育的藻体其耐高温性状的提高不明显。由本研究结果推测,“黄优1号”经过后续几代的栽培,一方面进一步强化选育的目标性状,同时适应了“插竿式”栽培方式后,将比目前日照海区的主导条斑紫菜推广品系具有更高的营养价值和更大的应用价值。
参考文献:
[1]FAO.FAO Yearbook of Fishery Statistics:Aquaculture Production.Vol.92/2 ,2001/ FAO[M].Bethesda,Maryland:Lexis Nexis,2003.
[2]曾呈奎,王素娟,刘思俭,等.藻类栽培学[M].上海:上海科技出版社,1985:135-211.
ZENG C K,WANG S J,LIU S J,et al.Algae Culture[M].Shanghai:Shanghai Scientific & Technical Publishers,1985:135-211.
[3]高洪峰,曹文达,纪明候.坛紫菜中藻胆蛋白的性质和化学组成研究[J].海洋与湖沼,1993,24(4):351-355.
GAO H F,CAO W D,JI M H.Study on the properties and chemical composition of Pyropia haitanensis[J].Oceanologia et Limnologia Sinica,1993,24(4):351-355.
[4]史银飞,严桂芹,李一平.蚕沙叶绿素的提取工艺研究[J].畜牧与饲料科学,2009,30(4):72-74.
SHI Y F,YAN G Q,LI Y P.Research on the extraction technology of chlorophyll from silkworm excrement[J].Animal Husbandry and Feed Science,2009,30(4):72-74.
[5]邓丽莉,潘晓倩,生吉萍,等.考马斯亮蓝法测定苹果组织微量可溶性蛋白含量的条件优化[J].食品科学,2012,33(24):185-189.
DENG L L,PAN X Q,SHENG J P,et al.Optimization of experimental conditions for the determination of water soluble protein in apple pulp using Coomassie brilliant blue method[J].Food Science,2012,33(24):185-189.
[6]ZOU D H,GAO K S.Effects of desiccation and CO2concentrations on emerged photosynthesis in Porphyra haitanensis (Bangiales,Rhodophyta),a species farmed in China[J].Eur J Phycol,2002,37:587-592.
[7]MAGNE F.Impotrancc of basic research in applied phycology[J].Hydrobiologia,1993,260(1):25-29.
[8]张少斌,依晓楠,林英,等.螺旋藻藻胆蛋白不同提取方法的比较[J].吉林农业大学学报,2007,29(4):381-383.
ZHANG S B,YI X N,LIN Y,et al.A comparison of different methods of extracting phycobiliprotein from Spirulina[J].Journal of Jilin Agriculture University,2007,29(4):381-383.
[9]PARSONS T T,STRICKLANDJDH.Discussion of spe-
ctrophotometric determination of marine-plant pigments,with revised equations for ascertaining chlorophylls and carotenoids[J].Journal of Marine Research,1963,21:155-163.
[10]吕娓娓.条斑紫菜丝状体对重金属胁迫的响应及抗性基因GST的克隆与表达[D].大连:辽宁师范大学,2009.
LV W W.The Responses of Conchocel of Pyropia yezoensis to Heavy Metal Stress and Cloning and Expression of the Resistant Gene GST[D].Dalian:Liaoning Normal University,2009.
[11]王飞儿,吕唤春,陈英旭,等.千岛湖叶绿素a浓度动态变化及其影响因素分析[J].浙江大学学报:农业与生命科学版,2004,30(1):22-26.
WANG F E,LV H C,CHEN Y X,et al.Analysis of the spatial and temporal changes in chlorophyll-a concentration in Qiandao Lake and its impact factors[J].Journal of Zhejiang University:Agric &Life Sci,2004,30(1):22-26.
[12]郑宝福.中国海藻志(第一册)[M].北京:科学出版社,2009,2:65-105.
ZHENG B F.Flora Algarum Marinarum Sinicarum(Vol.1)[M].Beijing:Science Publishing House,2009,2:65-105.
[13]许璞,张学成,王素娟,等.中国主要经济海藻的繁殖与发育[M].北京:中国农业出版社,2013.
XU P,ZHANG X C,WANG S J,et al.Reproduction and Development of Major Economic Marine Algae in China[M].Beijing:China Agriculture Press,2013.
[14]李世英.条斑紫菜单孢子及其幼苗的生态特性与应用研究[J].海洋科学集刊,1989,30:81-92.
LI S Y.Studies on the ecological characteristics and application of Porphyra yezoensis monospore and seeding[J].Marine Science Bulletin,1989,30:81-92.
[15]GREEN L A,NEEFUS C D.Effects of temperature,
light level,photoperiod,and ammonium concentration on Pyropia leucosticta (Bangiales,Rhodophyta) from the Northwest Atlantic[J].J Appl Phycol,2015,27:1253-1261.
[16]黄瑶,李朝銮,马诚,等.叶绿体DNA及其在植物系统学研究中的应用[J].植物学通报,1994,11(2):11-25.
HUANG Y,LI C L,MA C,et al.Chloroplast DNA and its application to plant systematic studies[J].Chinese Bulletin of Botany,1994,11(2):11-25.
[17]付景,张迎春.27种瓢虫mtDNA-COⅠ基因序列分析及系统发育研究(鞘翅目:瓢虫科)[J].昆虫分类学报,2006,28(3):179-186.
FU J,ZHANG Y C.Sequence analysis of mtDNA-COⅠ gene and molecular phylogeny on twenty-seven species of coccinellids (Coleoptera:Coccinellidae)[J].Entomotaxonomia,2006,28(3):179-186.
[18]ANDERSSON I,BACKLUND A.Structure and function of rubisco[J].Plant Physiol Biochem,2008,46:275-291.
(责任编辑:陆雁)
Genetic and Nutrient Analysis of New Pyropia yezoensis Strain “Huangyou No.1”
CAO Yuan1,2,3,WANG Wenjun1,3,LIANG Zhourui1,3,LIU Fuli1,3,SUN Xiutao1,3,YAO Haiqin1,2,3,LI Xiaolei1,2,3,WANG Feijiu1,3
(1.Key Laboratory of Sustainable Development of Marine Fishery of Ministry of Agriculture,Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Qingdao,Shandong,266071,China;2.College of Fisheries and Life Science of Shanghai Ocean University,Shanghai,201306,China;3.Qingdao National Laboratory for Marine Science and Technology,Laboratory for Marine Fisheries Science and Food Production Processes,Qingdao,Shandong,266000,China)
Abstract:【Objective】New and high qualified Pyropia strains were screened to enrich the Pyropia strains resources in north China and provide fundamental data for their successful cultivation.【Methods】New strain of “Huangyou No.1” was obained by selective breeding of the wild germplasm from the farming ropes of Tuoji Island and cultivated in Nantong,Rizhao,and Tuoji Island,respectively.The genetic background (based on rbcL and COⅠ genes) and nutrient components (phycobiliprotein,chlorophyll a,carotenoid and soluble protein) were analyzed in “Huangyou No.1” from different farming areas together with its parent,the control stain of Pyropia yezoensis in Rizhao,the wild Pyropia from the shore of Tuoji Island and its cultivated offsprings.【Results】Based on the sequence of rbcL gene (about 1 200 bp),there were about 1.1% variation occurring in the population of the wild Pyropia growing on farming rope,compared to the other populations.All the other 6 populations had completely same rbcL gene sequence.According to genetic diversity analysis of COⅠ gene sequence (about 680 bp),only two cultivars(“Huangyou No.1” and Breeding 2) of Nantong had 2 bp difference,and the others were completely consistent.The nutrient content of “Huangyou No.1” cultivated in Rizhao was generally higher than the other cultivars and their wild germplasm,and the quality of seaweed cultivated in the Nantong was the lowest.【Conclusion】Based on the rbcL and COⅠ gene sequence,most of the wild Pyropia on Tuoji Island were Pyropia yezoensis,and the nutrient compositions of the “Huangyou No.1” cultivated in different areas were superior to that of its wild parents.The results show that “Huangyou No.1” is more applicable for cultivation in the sea area of Rizhao.
Key words:Pyropia yezoensis,phycobiliprotein,chlorophyll a,soluble protein,rbcL genes,COⅠ genes
收稿日期:2016-04-23
作者简介:曹原(1991-),女,在读研究生,主要从事紫菜新品种培育研究。 **通讯作者:汪文俊(1979-),女,博士,副研究员,主要从事海藻遗传育种与开发利用研究,E-mail:wjwang@ysfri.ac.cn。
中图分类号:Q319,S917
文献标识码:A
文章编号:1005-9164(2016)02-0131-07
*中国水产科学研究院基本科研业务费专项资金项目(2015A02)和中央级科研院所(黄海所)基本科研业务费专项资金项目(20603022013023)资助。
广西科学Guangxi Sciences 2016,23(2):131~137
网络优先数字出版时间:2016-05-11
网络优先数字出版地址:http://www.cnki.net/kcms/detail/45.1206.G3.20160511.0933.004.html
