小球藻(Chlorella vulgaris)抗铵品系的紫外诱变选育*
2016-06-27曹晓菲丰圣伟宋新伟
曹晓菲,丰圣伟,宋新伟,徐 涤
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,海洋生命学院,山东青岛 266003)
小球藻(Chlorella vulgaris)抗铵品系的紫外诱变选育*
曹晓菲,丰圣伟,宋新伟,徐涤**
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,海洋生命学院,山东青岛266003)
摘要:【目的】获得耐受高铵浓度的优良养殖小球藻(Chlorella vulgaris)品系,可以有效防止其在养殖过程中被轮虫,纤毛虫等污染生物吞食。 【方法】首先对小球藻进行紫外线诱变,然后用高浓度NH4HCO3作为筛选压力对其进行筛选。【结果】筛选到具有生长优势的小球藻突变株B4和C6,培养12 d,在NH4HCO3浓度为800 mg/L、1 000 mg/L、1 200 mg/L条件下, B4和C6的生物量比出发藻株分别提高41.18%和9.54%,32.64%和29.41%,37.74%和22.85%; 对比出发藻株,B4和C6的最大光能转化效率有显著提高。【结论】突变株B4和C6在高铵培养条件下更能显示生长优势,且它们的生长优势可能来自光合效率的提高。
关键词:小球藻紫外诱变抗高铵光能转化效率
0引言
【研究意义】小球藻(Chlorella vulgaris)为单细胞绿藻,其生长速度快,能利用光能自养也能在异养条件下生长繁殖[1]。小球藻蛋白含量可高达50%以上,而且其必需氨基酸组成符合联合国粮农组织的标准[2]。除了蛋白质以外,小球藻还含有丰富的维生素(VA、VB12、VC)、矿物质和脂肪酸[3]。同时,丰富的叶绿素、有生物活性的糖蛋白以及生长因子,使得小球藻除了具有丰富的营养价值外还具有多种医疗功能,小球藻也成为理想的健康食品,具有较高的经济价值和培养价值[4]。但是,淡水小球藻在开放的养殖环境中易受到轮虫、纤毛虫等原生动物及其他微型藻类的影响,故小球藻生物污染的防治成为其规模化养殖所面临的主要问题之一[5]。【前人研究进展】据报道,在开放式培养过程中,大约4~5 d 培养液中就会出现吞食小球藻的轮虫,严重的还可能导致整个培养的失败[6-7]。目前用于抑制或杀灭敌害生物的药物有化学药品和中草药两大类[8],但往往敌害生物对药物的耐受力优于培养的藻细胞,因此效果并不理想。研究发现,轮虫对于培养基中的铵浓度较敏感,例如文献[9]报道,当培养基中碳铵浓度为250 mg/L时,24 h内轮虫数量就可下降到0。相反,小球藻对铵氮浓度的耐受性较高。因此通过诱变和高铵浓度筛选的方式选育抗高铵浓度的小球藻品系是实现小球藻安全高产的简便而有效的途径。紫外诱变育种是使用最早的物理诱变方法,紫外照射可引起DNA与蛋白质的交联、DNA链的断裂以及嘧啶二聚体的形成,因其操作简便、干净、快捷,在工业微生物和农业植物中得到广泛的应用[10]。将紫外诱变与人工选择相结合即可培育出满足实际生产需求的各种优良品种,例如付峰等[11]利用紫外诱变对龙须菜的果孢子进行诱变并筛选得到优势的突变株;叶丽等[12]对三角褐指藻进行紫外诱变,并获得脂肪酸优于出发藻株的突变体。【本研究切入点】通过诱变和高铵浓度筛选的方式选育抗高铵浓度的小球藻品系鲜见报道。【拟解决的关键问题】通过紫外线照射诱变小球藻(C.vulgaris),再以高浓度的NH4HCO3作为筛选压力筛选具有生长优势的突变藻株,为小球藻的大规模健康养殖提供科学参考。
1材料与方法
1.1藻种
小球藻(Chlorella vulgaris,Val)为中国海洋大学海洋生物遗传学与育种教育部重点实验室保存的养殖品种。
1.2培养基
小球藻的培养基为改良的BBM培养基[13]:NH4HCO3400 mg/L,CaCl2·H2O 25 mg/L,MgSO4·7H2O 75 mg/L,K2HPO475 mg/L,KH2PO4175 mg/L,NaCl 25 mg/L,FeSO4·7H2O 4.98 mg/L,H3BO31.142 mg/L,Disodium EDTA 5.0 mg/L,KOH 3.1 mg/L,ZnSO4·7H2O 1.764 mg/L,MnCl2·4H2O 0.288 g/L,CuSO4·5H2O 0.314 mg/L,Co(NO3)2·6H2O 0.098 mg/L,MoO30.142 mg/L。
1.3培养条件
光源为日光灯,光照强度为60 μmol · m- 2· s- 1,光暗周期为12 h/12 h,培养温度为(23±1)℃。小球藻培养时统一使用250 mL三角瓶,每瓶培养基的体积为100 mL。实验开始时取对数生长期的小球藻预培养液,按0.5×106个/mL接种,每天摇瓶3次。
1.4诱变方法及有效剂量
1.4.1诱变方法
取对数生长期的小球藻液10 mL,转速为5 000 r/min,离心5 min,弃上清,用新鲜配制的培养液重新悬浮。血球计数板计数后梯度稀释,吸取200 μL藻液涂布在固体培养基上,将涂布的藻细胞个数控制在约300个/平板,30 W紫外灯距离20 cm处照射。照射时间设为10 s、20 s、40 s、60 s及80 s 5个组,每种剂量做3个重复,以未照射的藻种作为对照组。紫外诱变后避光培养12 h,之后于同上条件培养。
1.4.2致死率计算
12 d后对平板上长出的藻落进行计数,按下面公式计算致死率:致死率=(1-诱变组藻落数/对照组藻落数)×100%。根据照射时间和致死率确定适宜的诱变时间。
1.5具生长优势藻株的筛选
小球藻出发藻株Val培养至对数生长期后用血球计数板进行计数,取约300个细胞涂布于含有1 200 mg/L NH4HCO3的BBM培养基平板。根据预诱变确定的最佳紫外照射时间,对平板上的藻落进行诱变。照射后分别将长出的单藻落,采用平板划线法转移至同上BBM固体培养基,培养至第12天,从平板上挑取4株长势最旺盛的藻株进行单克隆培养,然后分别在400 mg/L、600 mg/L、800 mg/L、1 000 mg/L、1 200 mg/L 5个不同的NH4HCO3浓度下测量其生长曲线。
1.6生长曲线的测定
将筛选出的4个突变藻株和出发藻株Val按相同的起始密度(0.5×105个/mL)分别接种于NH4HCO3浓度为400 mg/L、600 mg/L、800 mg/L、1 000 mg/L、1 200 mg/L的液体培养基中,每个浓度设置3个平行样,连续培养12 d。每2 d取藻液测OD680,绘制生长曲线。
1.7小球藻油脂积累的观察
以出发藻株Val为对照,观察培养过程中抗高铵小球藻藻株的油脂积累情况,实验步骤如下[14]:分别吸取培养至第2天、4天、6天、8天、10天、12天的小球藻藻液1.0~1.5 mL于离心管中,10 000 r/min离心30 s,倒去上清,加入370 μL BBM新鲜培养液使微藻细胞重悬,再加入125 μL DMSO和1 μL尼罗红储备液(1 mg尼罗红粉末溶解于4 mL DMSO),颠倒混匀。用铝箔纸包好离心管以避光,37℃温育15 min。荧光显微镜观察,使用激发光波长为443 nm,尼罗红染色后中性脂发射峰在570 nm附近(黄色-橙色)。
1.8最大光合速率的测定
使用Dual-PAM-100(Walz,德国)测量出发藻株和突变藻株培养至第12天的光系统Ⅱ(PS Ⅱ)的最大光能转化效率(Fv/Fm)。
2结果与分析
2.1紫外诱变时间
将小球藻进行梯度稀释后涂布到BBM固体培养基上,在紫外灯下进行诱变处理,经诱变处理后小球藻的形态发生变化,照射时间越长,其细胞的颜色越浅,死亡后的小球藻细胞内空间消失,原生质体的结构发散。图1为培养至第12天时不同紫外照射时间组的致死率,可以看出,紫外照射对小球藻有明显的致死效应,紫外照射时间为10 s时其致死率为41.7%,随着小球藻暴露在紫外灯下时间的延长,致死率也随之增加,当时间增至60 s时,致死率为85.8%,而当紫外照射时间增加到80 s时,其致死率已经高达95.3%。当紫外诱变的致死率在80%~90%时为最佳诱变剂量,因此本实验选择紫外照射60 s对小球藻出发藻株进行诱变处理。

图1不同紫外照射时间下小球藻的致死率
Fig.1The mortality of Chlorella at different exposure time to UV
2.2小球藻抗铵藻株的筛选
经紫外线诱变和高铵(1 200 mg/L的NH4HCO3)的筛选,选择培养基上长出的零星藻落即为初步的抗高铵小球藻藻株。我们选择4个藻落体积较大的克隆作为候选藻株,代表其生长迅速。这4个藻株分别为B4、C6、C7和D2。
2.3抗铵小球藻的生长曲线
如图2所示,突变株C7和D2在各个NH4HCO3浓度中其细胞密度均小于出发藻株,而B4和C6的终细胞密度除了NH4HCO3浓度为600 mg/L时稍低于出发藻株,在其他的浓度NH4HCO3培养基均大于出发藻株。与出发藻株相比,当NH4HCO3为400 mg/L时,B4的生物量增长3.31%,C6的生物量增长14.79%。当NH4HCO3为800 mg/L时,B4的生物量增长41.18%,C6的生物量增长9.54%。当NH4HCO3为1 000 mg/L时,B4的生物量增长32.64%,C6的生物量增长29.41%。当NH4HCO3为1 200 mg/L时,B4的生物量增长37.74%,C6的生物量增长22.85%。而且在培养过程中发现,当培养基中NH4HCO3浓度大于600 mg/L时,出发藻株和突变株C7和D2的藻液会出现贴壁和沉淀状态,而突变株B4和C6始终藻液均匀,无贴壁现象,说明突变株B4和C6为理想的抗高铵并具生长优势的诱变藻株。
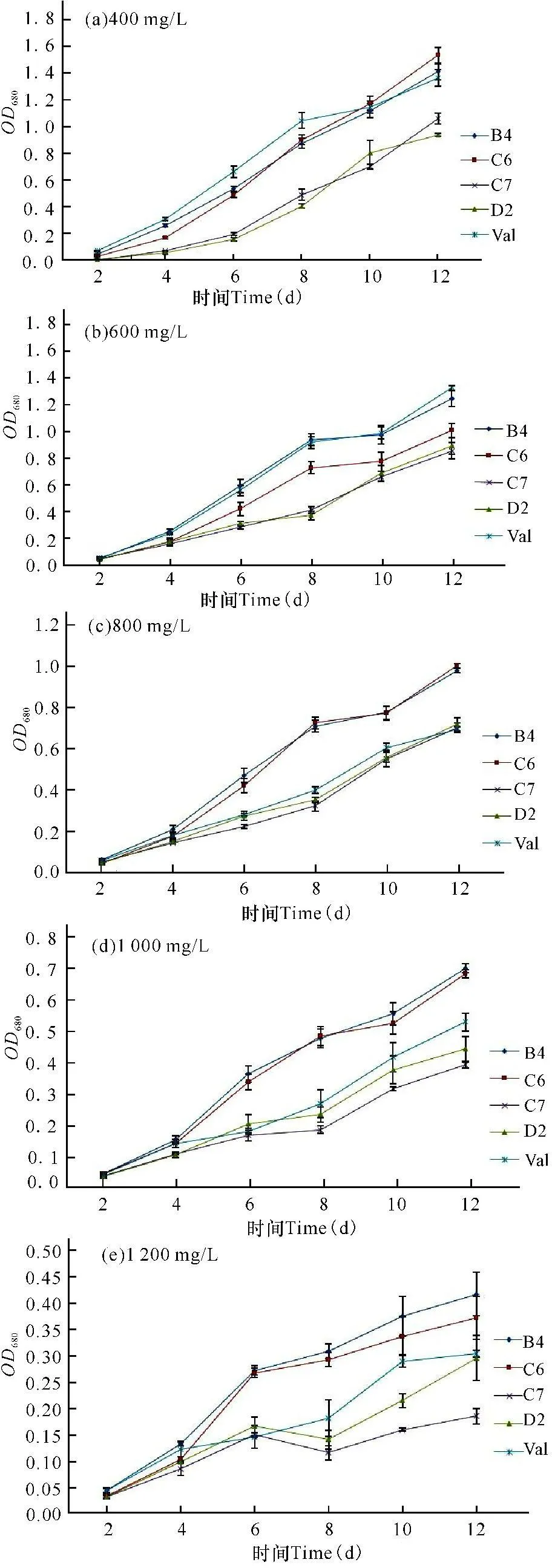
图2不同NH4HCO3浓度下出发株及各诱变株的生长状况比较
Fig.2Comparison of growing speed of original and mutated strains under different concentration of NH4HCO3
2.4藻株的油脂积累
尼罗红染色剂是一种亲脂性的恶嗪类荧光染料,能进入细胞与胞内中性脂结合并发出荧光检测信号,其强度与细胞的中性脂含量呈线性关系[15],因此我们利用尼罗红染色对微藻油脂的积累量进行即时的显微观察。一般来说,藻类对油脂的积累是对外界胁迫的一种响应,当微藻生长受到限制时就会出现这种储存物的积累。从图3看出,在含有不同浓度的NH4HCO3的培养基中,培养至第12天,无论诱变株B4和C6,还是对照组出发株都没有油滴出现,说明它们都保持在旺盛的生长状态,没有受到限制。

图3培养至第12天小球藻细胞内的油脂积累情况
Fig.3Nile red fluorescent observation of lipid accumulation for Chlorella vulgaris strains after being cultivated for 12 days
2.5出发藻株和诱变藻株最大光合速率比较
如图4所示,诱变藻株B4和C6的最大光能转化效率随着培养基中NH4HCO3浓度的升高都明显高于出发藻株, 其中NH4HCO3浓度为1 200 mg/L时的差异最大,P值分别为0.000997和0.008766,均小于0.01,差异显著。
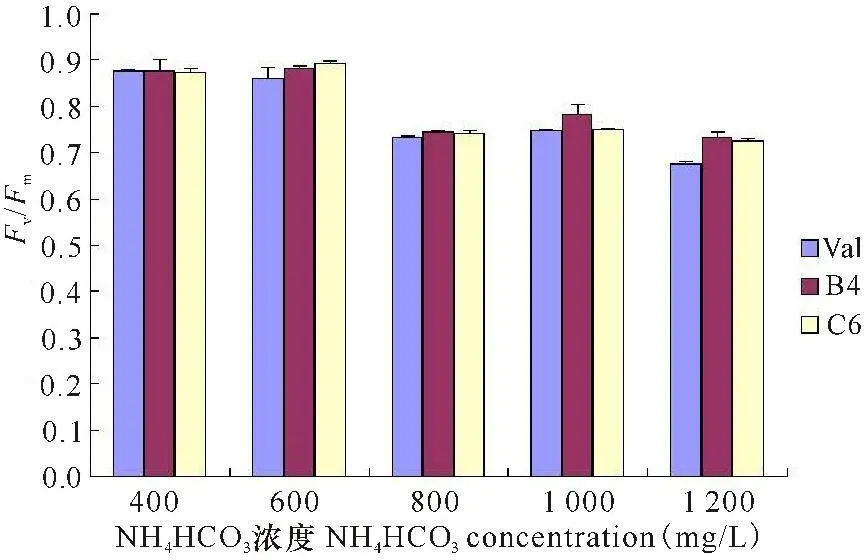
图4第12天小球藻突变株和出发株的光能转化效率
Fig.4Fv/Fmof original and mutated Chlorella strains at day 12th
3结论
选育生长速度快、蛋白含量高、抗生物污染的小球藻藻种一直是小球藻大规模生产技术的重点,本文通过紫外诱变筛选得到的小球藻突变株B4和C6,在高NH4HCO3浓度中均能保持较快的生长速率,当NH4HCO3浓度为800 mg/L、1 000 mg/L、1 200 mg/L时,其最终生物量比出发藻株分别提高了41.18%和9.54%,32.64%和29.41%,37.74和22.85%。但在NH4HCO3浓度为400 mg/L和600 mg/L时,两个突变株的生长速率或者与出发藻株无明显差异,或者略低于出发藻株,说明这两个在高铵浓度筛选压力筛选出来的突变株在高铵培养条件下更能显示其生长优势。同时,尼罗红显微观察证明,突变藻株B4和C6能快速生长,而最大光合速率的检测还揭示了它们的生长优势可能来自光合效率的提高。
参考文献:
[1]刘世名,孟海华,梁世中,等.生物反应器高密度异养培养小球藻[J].华南理工大学学报:自然科学版,2000,28(2):81-86.
LIU S M,MENG H H,LIANG S Z,et al.High density heterotrophic culture of Chlorella vulgaris in bioreactor[J].Journal of South China University of Technology:Natural Science Edition,2000,28(2):81-86.
[2]胡开辉,汪世华.小球藻的研究开发进展[J].武汉工业学院学报,2005,2(3):27-30.
HU K H,WANG S H.Development and progress of Chlorella vulgaris[J].Journal of Wuhan Polytechnic University,2005,2(3):27-30.
[3]杨鹭生,李国平,陈林水.蛋白核小球藻粉的蛋白质、氨基酸含量及营养评价[J].亚热带植物学,2003,32(1) :32-38.
YANG L S,LI G P,CHEN L S.Analysis of the contents of protein and amino acid in the powder of Chlorella pyrenoidosa and its nutritive value[J].Subtropical Plant Science,2003,32(1):32-38.
[4]郝宗娣,刘洋洋,续晓光,等.小球藻(Chlorella)活性成分的研究进展[J].食品工业科技,2010,31(12):369-372.
HAO Z D,LIU Y Y,XU X G,et al.Research progress on active components of Chlorella[J].Science and Technology of Food Industry,2010,31(12):369-372.
[5]WANG H,ZHANG W,CHEN L,et al.The contamination and control of biological pollutants in mass cultivation of microalgae[J].Bioresource Technology,2013,128(1):745-750.
[6]HOTOS G N.Growth,filtration and ingestion rate of the rotifer Brachionus plicatilis fed with large (Asteromonas gracilis) and small (Chlorella sp.) celled algal species[J].Aquaculture Research,2003,34(10):793-802.
[7]BOROWITZKA M A.Culturing microalgae in outdoor ponds[J].Algal Culturing Techniques,2005,218:205-219.
[8]菅玉霞,郭文,潘雷,等.单细胞藻类培养中敌害生物的综合防治方法[J].齐鲁渔业,2008,25(2):53.
JIAN Y X,GUO W,PAN L,et al.Systematical methods for preventing harmful animals in unicellular algae cultivation[J].Shandong Fisheries,2008,25(2):53.
[9]董美斌,于文英.控制螺旋藻中轮虫为害的理化培养条件研究[J].江西农业学报,2007,19(12):87-90.
DONG M B,YU W Y.Study on physical and chemical conditions for controlling rotifer in Spirulina[J].Acta Agriculturae Jiangxi,2007,19(12):87-90.
[10]MEIRELES L A,CATARINA G A,XAVIER M F.Increase of the yields of eicosapentaenoic and docosahexaenoic acids by the microalga Pavlova lutheri following random mutagenesis[J].Biotechnol Bioeng,2003,81:50-55.
[11]付峰,隋正红,常连鹏,等.龙须菜果孢子的紫外诱变及优势突变体的筛选[J].中国海洋大学学报:自然科学版,2014,44(3):50-56.
FU F,SUI Z H,CHANG L P,et al.UV-irradiation mutation on carpospores of Gracilariopsis lemaneiformis and screening of thermo-tolerant strains[J].Periodical of Ocean University of China,2014,44(3):50-56.
[12]叶丽,蒋霞敏,毛欣欣,等.温、光、盐对三角褐指藻紫外诱变株生长、总脂及脂肪酸的影响[J].生态学杂志,2015,34(2):454-462.
YE L,JIANG X M,MAO X X,et al.Effects of temperature,light intensity and salinity on the growth,total lipid and fatty acid of Phaeodactylum tricornutum mutant[J].Chinese Journal of Ecology,2015,34(2):454-462.
[13]BOLD H C.The morphology of Chlamydomonas chl-
amydogama sp.Nov[J].Bulletin of the Torrey Botanical Club,1949,122:101-108.
[14]CHEN W,ZHANG C,SONG L,et al.A high through-
put Nile red method for quantitative measurement of neutral lipids in microalgae[J].J Microbiol Methods,2009,77:41-47.
[15]LIU Z Y,WANG G C,ZHOU B C.Effect of iron on growth and lipid accumulation in Chlorella vulgaris[J].Bioresource Technology,2008,99(11):4717-4722.
(责任编辑:尹闯)
UV Mutagenesis and Screening for Ammonium Tolerant Strains of Chlorella vulgaris
CAO Xiaofei,FENG Shengwei,SONG Xinwei,XU Di
(The Key Laboratory of Marine Genetics and Breeding,Ministry of Education,College of Marine Life Sciences,Ocean University of China,Qingdao,Shandong,266003,China)
Abstract:【Objective】Breeding the new strains of Chlorella vulgaris that have a tolerance to high concentration of ammonium can efficiently avoid being eaten by the contamination animals such as rotifer,ciliate and so on during cultivation. 【Methods】The original strain of Chlorella vulgaris was first mutated by exposing to UV light and then was screened by the high concentration of ammonium in media.【Results】Two mutants,B4 and C6,were acquired with better growth rate than the original one.The biomass of strains B4 and C6 after being cultivated for 12 d increased 41.18% and 9.54%,32.64% and 29.41%,37.74% and 22.85%,respectively,under different ammonium concentration,which was 800 mg/L,1 000 mg/L,and 1 200 mg/L.The Fv/Fm results also proved a significant improvement on their maximum light conversion efficiency.【Conclusion】The mutants B4 and C6 showed growing advantages under higher ammonium concentration, which may be gained from the enhancement of photosynthesis efficiency.
Key words:Chlorella vulgaris,UV mutagenesis,high ammonium tolerant,Fv/Fm
收稿日期:2015-02-25
作者简介:曹晓菲(1991- ),女,硕士研究生,主要从事藻类培养及分子生物学研究。 **通讯作者:徐涤(1972- ),博士,副教授,主要从事藻类遗传学研究,E-mail:dixu@ouc.edu.cn。
中图分类号:Q943.2
文献标识码:A
文章编号:1005-9164(2016)02-0120-05
*北海市科学研究与技术开发计划项目(201203024)资助。
广西科学Guangxi Sciences 2016,23(2):120~124
网络优先数字出版时间:2016-05-11
网络优先数字出版地址:http://www.cnki.net/kcms/detail/45.1206.G3.20160511.0919.002.html
