植物乳杆菌和非淀粉多糖复合酶对断奶仔猪生长性能、粪便微生物菌群及血清指标的影响
2016-06-27柴建民魏荣贵刘希峰刘金兰刁其玉张乃锋
柴建民 魏荣贵 刘希峰 刘金兰 崔 凯 刁其玉 张乃锋*
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点实验室,北京100081;2.北京市畜牧兽医总站,北京100107;3.北京市大兴区动物卫生监督管理局,北京102600;4.北京市房山区畜禽良种繁育推广中心,北京102444)
植物乳杆菌和非淀粉多糖复合酶对断奶仔猪生长性能、粪便微生物菌群及血清指标的影响
柴建民1魏荣贵2*刘希峰3刘金兰4崔凯1刁其玉1张乃锋1*
(1.中国农业科学院饲料研究所,农业部饲料生物技术重点实验室,北京100081;2.北京市畜牧兽医总站,北京100107;3.北京市大兴区动物卫生监督管理局,北京102600;4.北京市房山区畜禽良种繁育推广中心,北京102444)
摘要:本试验旨在研究饲粮中添加植物乳杆菌(Lactobacillus plantarum)和非淀粉多糖(NSP)复合酶对断奶仔猪生长性能、粪便微生物菌群及血清指标的影响,从而达到代替抗生素的目的。试验采用单因素完全随机设计,选择28日龄健康断奶仔猪192头,平均体重为(7.15±0.36) kg,随机分为4个组,每组6个重复,每个重复8头猪。对照组(CT组)饲喂在基础饲粮中添加40 mg/kg杆菌肽锌的饲粮;试验组分别饲喂在基础饲粮中添加1 g/kg植物乳杆菌(PT组)、1 g/kg NSP复合酶(ZT组)、1 g/kg植物乳杆菌+1 g/kg NSP复合酶(PZT组)的饲粮。试验期35 d。结果表明:1)各组间断奶仔猪的试验末重、平均日增重、平均日采食量及料重比均无显著差异(P>0.05)。2)各组间断奶仔猪粪便中乳酸菌数量、大肠杆菌数量及乳酸菌/大肠杆菌均无显著差异(P>0.05)。但与对照组相比,PZT组断奶仔猪粪便中乳酸菌数量和乳酸菌/大肠杆菌有增加趋势(0.05≤P<0.10),大肠杆菌数量有降低趋势(0.05≤P<0.10)。3)各组间断奶仔猪的血清生化指标、免疫指标均无显著差异(P>0.05)。由此可知,饲粮中复合添加植物乳杆菌和NSP复合酶可促进肠道菌群平衡,有益于仔猪健康生长,从而达到替代抗生素的目的。
关键词:仔猪;益生菌;酶制剂;抗生素;生长性能;血清指标
仔猪早期断奶时机体的免疫抗体水平和细胞免疫能力均下降,病原菌容易在肠道内增殖,不利于仔猪的健康生长。实际生产中往往选择抗生素来治疗和预防仔猪疾病,来达到减缓应激和促进生长的目的。然而,由于抗生素的残留特性及细菌对其的耐药性等副作用,抗生素会使动物肠道内菌群平衡失调,从而影响动物的生长进而富集到人体,并对人体产生一定的危害。因此,寻找抗生素替代品显得尤为重要。
益生菌是抗生素的最佳替代品之一,对猪生长性能的提高及疾病防治具有积极作用[1]。益生菌中的植物乳杆菌(Lactobacillusplantarum)能通过改善肠道菌群平衡,达到减少动物疾病发生及提高动物生长性能的目的[2-3]。研究认为,饲喂植物乳杆菌可以提高断奶仔猪的生长性能和免疫功能[4-5]。董晓丽等[6]试验证明,饲喂植物乳杆菌复合制剂对断奶仔猪生长性能无影响,但可提高仔猪免疫功能。酶制剂可通过提高消化道的酶活性和促进乳酸菌增殖,分解饲料原料的细胞壁,降解饲粮中非淀粉多糖(NSP)及抗营养因子等成分,提高玉米-豆粕型饲粮的消化率[7]。唐明红[8]研究证明益生菌和酶制剂(组合淀粉酶、组合蛋白酶和组合NSP酶等)组合添加可以极显著提高保育仔猪的日增重,极显著降低保育仔猪的腹泻率。
多聚糖酶促进饲粮中抗营养因子的降解,产生的低聚糖可以作为益生元促进益生菌繁殖,但目前的研究主要集中在添加一种聚糖酶,而有关添加复合酶的研究甚少。另外,益生菌和酶制剂分别能促进断奶仔猪生长、提高消化率及免疫力,达到替代抗生素的生产目的。然而,目前有关益生菌和酶制剂联合使用在肉鸡上的报道较多,但在断奶仔猪上的报道较少,且试验研究大多集中在单一物质添加的效果研究,有关益生菌和酶制剂复合添加的试验研究很少。为此,本试验选用益生菌和酶制剂制备成复合制剂,旨在研究其对断奶仔猪生长性能、粪便微生物菌群及血清指标的影响,为酶制剂和益生菌代替抗生素在仔猪上的应用提供理论依据。
1材料与方法
1.1试验材料
植物乳杆菌:活菌数≥2×108CFU/g,所用菌粉由中国农业科学院饲料研究所提供。
NSP复合酶:由北京中农兴饲料科技有限公司提供,主要由β-葡聚糖酶(β-glucanase,活性≥8 000 U/g)、β-木聚糖酶(β-xylanase,活性≥70 000 U/g)、β-甘露聚糖酶(β-mannanase,活性≥150 000 U/g)和蛋白酶(protease,活性≥1 500 U/g)等组成。
1.2试验设计
试验采用单因素完全随机设计,选择28日龄健康断奶仔猪192头,平均体重为(7.15±0.36) kg,随机分为4个组,每组6个重复,每个重复8头猪。4个组分别为:对照(CT)组,饲喂基础饲粮+抗生素(40 mg/kg杆菌肽锌);植物乳杆菌(PT)组,饲喂基础饲粮+1 g/kg植物乳杆菌;NSP复合酶(ZT)组,饲喂基础饲粮+1 g/kg NSP复合酶;植物乳杆菌和NSP复合酶复合(PZT)组,饲喂基础饲粮+1 g/kg植物乳杆菌+1 g/kg NSP复合酶。饲养试验时间为仔猪保育期,试验期35 d。
1.3试验饲粮及饲养管理
参照NRC[9](1988)仔猪回肠表观可消化氨基酸模式配制玉米-豆粕型基础饲粮,基础饲粮组成及营养水平见表1。
试验在北京市房山种猪场完成,仔猪饲养栏舍为封闭、漏缝地板式猪舍。粉料饲喂,乳头式饮水器,仔猪自由采食和饮水,免疫和驱虫程序按照猪场饲养管理程序进行。
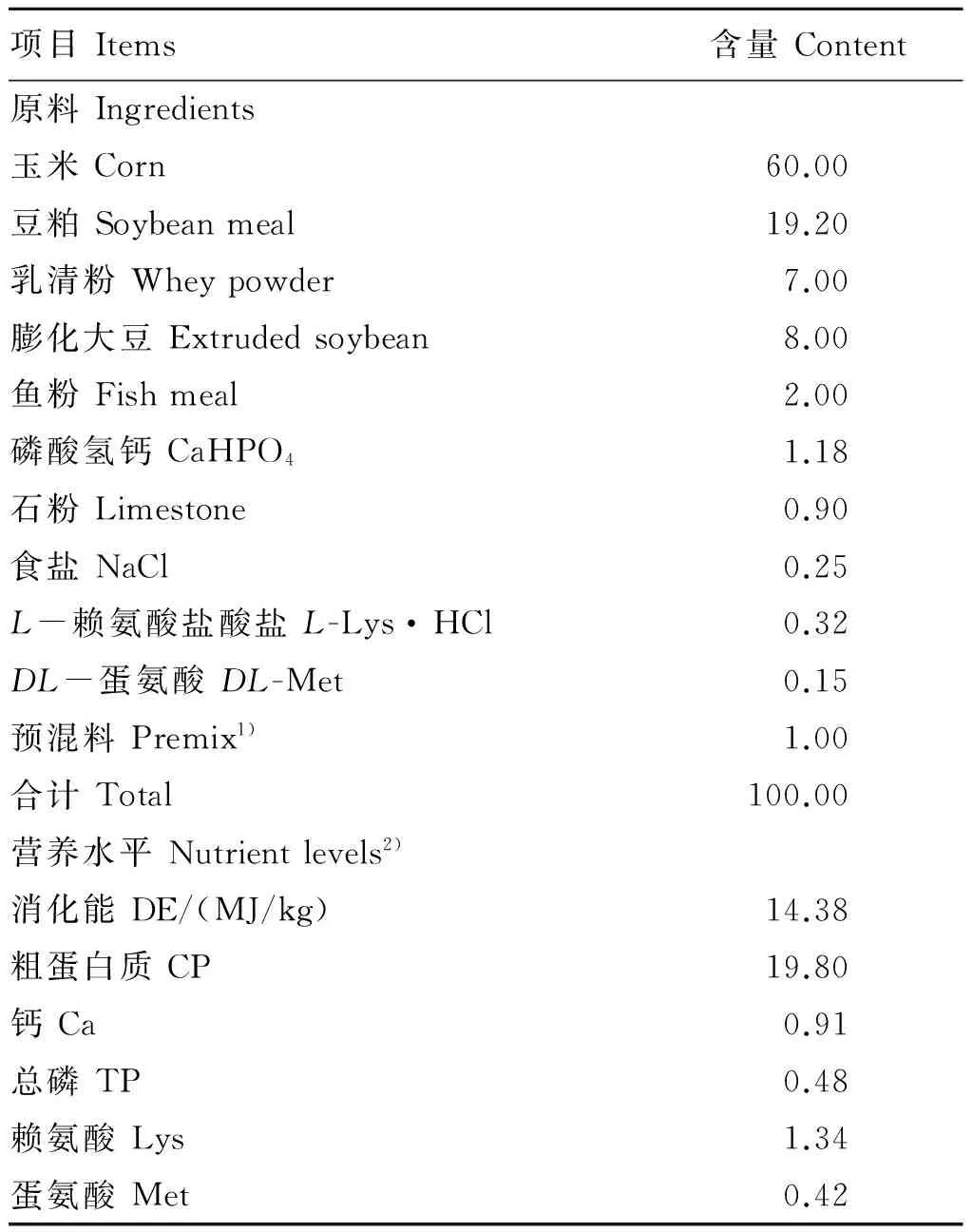
表1 基础饲粮组成及营养水平(干物质基础)
1)预混料为每千克饲粮提供Premix provided the following per kg of diets:VA 5 512 IU, VD 640 IU, VK32.2 IU, VE 20 IU, VB11.5 mg, VB25.5 mg, VB62.2 mg, VB1227.6 μg,D-泛酸D-pantothenic acid 14.8 mg, 烟酸nicotinic acid 30.3 mg, 生物素biotin 0.05 mg, 胆碱 choline 500 mg, Cu 50 mg, Fe 100 mg, Mn 10 mg, Zn 50 mg, I 0.85 mg, Se 0.25 mg。
2)营养水平均为实测值。Nutrient levels were all measured values.
1.4测定指标及方法
1.4.1生长性能
分别于试验始末晨饲前以重复为单位空腹称重,用以计算平均日增重(average daily gain,ADG)。试验期间每天以重复为单位记录饲粮投喂量,每天称量剩料量,根据饲粮投喂量和剩料量计算平均日采食量(average daily feed intake,ADFI)。然后根据平均日增重和平均日采食量计算料重比(feed/gain,F/G)。
1.4.2直肠粪便微生物菌群数量
采用平板计数法检测直肠粪便微生物数量。于试验最后1天早上称重前从每个重复随机选取1头猪,用无菌的小勺取直肠粪便样品冷藏,并立刻带回实验室进行检测。在无菌操作台内称取1.0 g粪样与9 mL灭菌生理盐水配制成1∶10稀释液(即配制成10-1稀释液),振荡3~5 min,用微量移液器准确吸取该稀释液1 mL至盛有9 mL灭菌生理盐水试管中,用涡旋振荡器振荡1~2 min,配制成10-2稀释液,依次进行10-3~10-7稀释。将直肠粪样的10-5~10-7稀释液涂布于乳酸菌培养基(MRS)固体培养基中计数粪样中乳酸菌(Lactobacillus)的数量;10-3~10-5稀释液涂布于麦康凯培养基中计数大肠杆菌(E.coli)的数量。大肠杆菌在37 ℃有氧培养24 h,乳酸菌在37 ℃有氧培养36 h。每个稀释梯度重复3次,最后取3次计数的平均值。粪便微生物的数量用每克粪便中含菌落总数的对数[lg(CFU/g)]表示[6]。
1.4.3血清生化相关指标及免疫相关指标
于试验最后1天,每个重复随机选取1头仔猪,于前腔静脉采血10 mL,3 000 r/min离心20 min,分离血清,-20 ℃保存,用全自动生化分析仪(日立7600,日本)测定血清总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素氮(UN)、葡萄糖(GLU)、总胆固醇(TC)和游离脂肪酸(NEFA)含量。
血清免疫球蛋白G(IgG)、胰岛素生长因子Ⅰ(IGF-Ⅰ)、胰岛素(INS)和生长激素(GH)含量应用猪免疫球蛋白酶联免疫反应试剂盒进行检测,试剂盒由南京建成生物工程研究所提供,具体操作按试剂盒说明进行。
1.5数据处理
试验数据采用Excel 2007进行整理,采用SAS 9.2统计软件的one-way ANOVA程序进行单因素方差分析,差异显著则用Duncan氏法进行多重比较。P<0.05为差异显著,0.05≤P<0.10为有提高或降低的趋势。
2结果
2.1植物乳杆菌和NSP复合酶对断奶仔猪生长性能的影响
由表2可知,各组间断奶仔猪试验始重无显著差异(P>0.05),符合试验要求。各组间断奶仔猪的试验末重、平均日增重、平均日采食量及料重比均无显著差异(P>0.05)。
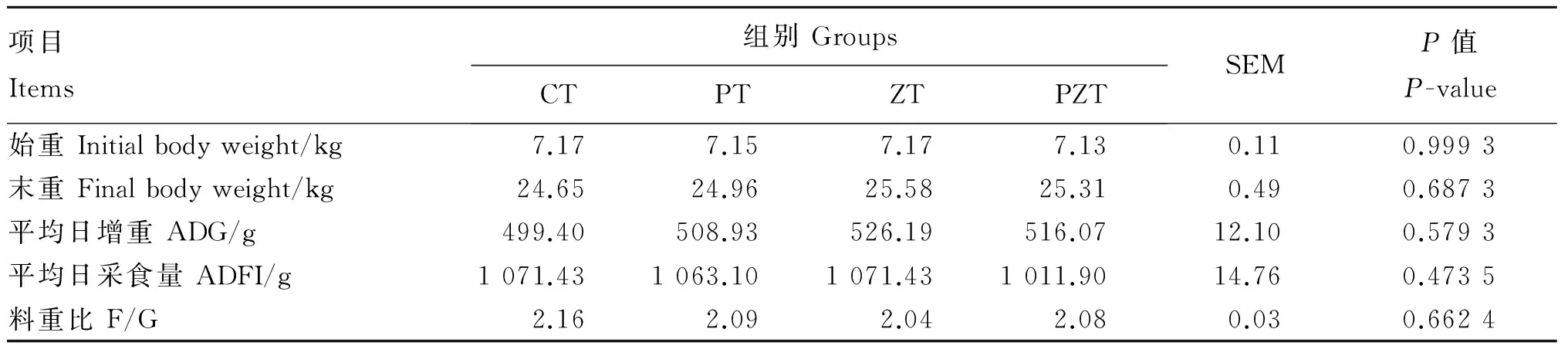
表2 植物乳杆菌和NSP复合酶对断奶仔猪生长性能的影响
2.2植物乳杆菌和NSP复合酶对断奶仔猪粪便微生物菌群的影响
由表3可知,各组间断奶仔猪粪便中乳酸菌数量、大肠杆菌数量及乳酸菌/大肠杆菌均无显著差异(P>0.05)。但与对照组相比,PZT组断奶仔猪粪便中乳酸菌数量和乳酸菌/大肠杆菌有增加趋势(0.05≤P<0.10),大肠杆菌数量有降低趋势(0.05≤P<0.10)。
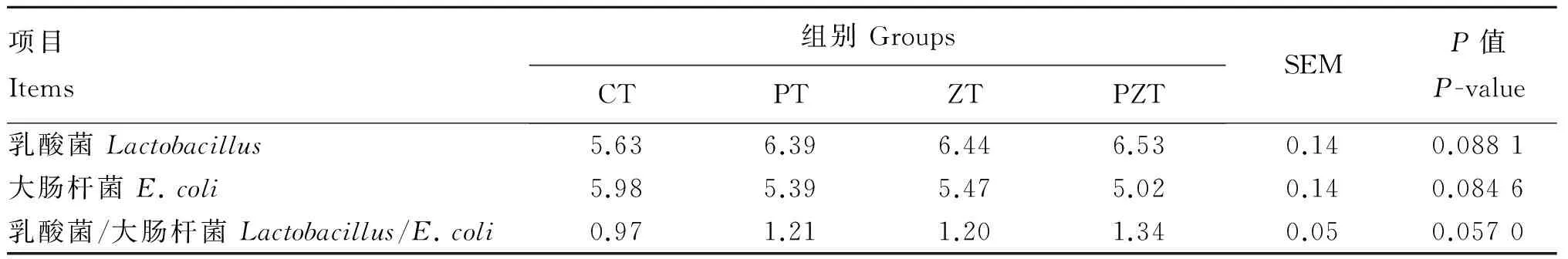
表3 植物乳杆菌和NSP复合酶对断奶仔猪粪便微生物菌群的影响
2.3植物乳杆菌和NSP复合酶对断奶仔猪血清指标的影响
由表4可知,各组间断奶仔猪的血清生化指标、免疫指标均无显著差异(P>0.05)。
3讨论
3.1饲粮中添加植物乳杆菌和NSP复合酶对断奶仔猪生长性能的影响
仔猪断奶期间,受到饲粮、环境和管理等各种应激因素的影响,通常会发生仔猪食欲降低、营养物质摄取减少、肠道消化酶活性降低、饲料利用率降低和腹泻等情况,其主要原因是仔猪肠道微生态平衡被破坏。本试验中对照组添加的抗生素杆菌肽锌,它是杆菌肽(由地衣芽孢杆菌产生的多肽类抗生素)与锌的复合物,有很好的稳定性,对革兰氏阳性菌有很强的杀菌作用,能提高宿主的饲料利用率,促进宿主生长,但是也容易引起动物肠道菌群失调和耐药性增强。在仔猪饲粮中添加益生菌可以调节肠道微生态平衡,促进营养物质消化吸收,缓解仔猪断奶应激[10-11]。而在断奶仔猪饲粮中添加酶制剂可以弥补这一时期内源性酶活性下降的缺陷,帮助其消化吸收营养物质,特别是有助于降低NSP等抗营养因子对仔猪消化的不良影响,增强机体抵抗力,达到促进生长的目的[8]。

表4 植物乳杆菌和NSP复合酶对断奶仔猪血清指标的影响
本试验以抗生素组作为阳性对照组,结果发现各组断奶仔猪的体重、平均日增重、平均日采食量和料重比均无显著差异,说明饲粮中添加植物乳杆菌和NSP复合酶均可达到替代抗生素的目的。董晓丽等[6]报道,断奶仔猪(35~70日龄)饲粮中添加植物乳杆菌与添加抗生素,仔猪的体重、平均日增重、平均日采食量和料重比均无显著差异。马艳凤[12]研究表明,添加酶制剂(木聚糖酶和β-甘露聚糖酶)仔猪的平均日增重和饲料转化率均与添加抗生素无显著差异。与本试验中单独添加植物乳杆菌和NSP复合酶效果相一致,但本试验中联合添加植物乳杆菌和NSP复合酶断奶仔猪的生长性能也与添加抗生素无显著差异。这可能是因为,植物乳杆菌和NSP复合酶的添加量与单独添加组添加量一致,植物乳杆菌和NSP复合酶的添加量和比例不适宜,导致两者配伍效果不明显,不能发挥最大的益生效果。对于益生菌来说,足够的活菌数是发挥有效作用的重要因素。Yu等[4]研究表明,断奶仔猪饲粮中添加5.8×107CFU/g发酵乳杆菌时足够呈现最佳效果,过高或过低都不能获得最佳效果。张乃锋等[2]结果证明,生长猪饲粮中植物乳杆菌适宜添加剂量为1×109CFU/kg。同样,Zhou等[13]试验证明,在饲粮中添加0.1 g/kg β-葡聚糖酶不影响仔猪的生长性能。马艳凤[11]试验表明,在玉米-豆粕型饲粮中添加0.1%酶制剂效果最佳。因此,对于饲粮中植物乳杆菌和NSP复合酶的添加量和比例需要进一步研究和证明,探索最佳的配比。
3.2饲粮中添加植物乳杆菌和NSP复合酶对断奶仔猪粪便微生物菌群的影响
衡量肠道健康的主要代表菌群为乳酸菌和大肠杆菌,其数量比值是评价消化道微生态平衡的主要指标[14]。仔猪断奶期间,肠道乳酸菌数量减少而大肠杆菌数量增加,成为引起腹泻的主要原因[15-16]。许多研究证实,断奶仔猪饲喂益生菌后,腹泻率和粪便中大肠杆菌数量减少。董晓丽等[6]和Le等[17]研究证明,在饲粮中添加植物乳杆菌复合益生菌后,可以显著降低断奶仔猪粪便大肠杆菌的数量。李学俭[18]试验证明,断奶仔猪玉米-豆粕型饲粮中添加β-甘露聚糖酶可以提高肠道内乳酸菌和双歧杆菌的数量并降低大肠杆菌数量。Zhou等[13]研究证明断奶仔猪饲喂β-葡聚糖酶可以减少粪便中大肠杆菌数量。本试验中,与对照组相比,植物乳杆菌和NSP复合酶复合组断奶仔猪粪便中乳酸菌数量和乳酸菌/大肠杆菌有增加趋势(0.05≤P<0.10),大肠杆菌数量有降低趋势(0.05≤P<0.10)。这说明植物乳杆菌和NSP复合酶联合使用能有效的改善肠道菌群。酶制剂在肠道内有助于营养物质降解为糖类,促进乳酸菌的增殖,乳酸菌发酵糖类为有机酸,降低肠道pH,抑制大肠杆菌生长和繁殖,从而达到改善肠道菌群的目的。在饲粮中添加益生菌和酶制剂可以从根本上解决肠道菌群失衡问题。
3.3饲粮中添加植物乳杆菌和NSP复合酶对断奶仔猪血清指标的影响
血清生化指标能反映动物体内物质代谢和某些组织器官机能变化,也可反映动物体内营养物质的沉积情况[19]。血清总蛋白由白蛋白和球蛋白组成,是反映动物营养水平的重要指标。血清球蛋白能与机体内外来的特异性抗原产生免疫反应而保护机体,其在血清中含量的高低在一定程度上反映了动物机体的免疫状况[20]。白蛋白/球蛋白的下降说明机体提升了特异性免疫应答水平,增强了抗病力。本试验中,各组间断奶仔猪血清总蛋白、白蛋白、球蛋白含量均无显著差异,说明饲粮中添加植物乳杆菌和NSP复合酶能达到与添加杆菌肽锌相同的效果。董晓丽等[6]试验证明,饲喂乳酸菌复合制剂断奶仔猪血清总蛋白和白蛋白含量与饲喂抗生素无显著差异。李学俭[18]试验证明,饲粮中添加一定量的酶制剂可以提高血清中白蛋白和总蛋白的含量,但与添加抗生素无显著差异。
血清尿素氮是反映蛋白质在体内代谢利用情况和饲粮氨基酸平衡的重要参数,其含量升高表明蛋白质分解代谢加强[21]。血清葡萄糖是动物进行生命活动的直接供能物质,与动物的日增重和饲粮营养水平均有很大的相关关系[22]。血清总胆固醇和游离脂肪酸含量可反映动物机体对脂类物质的利用状况,当动物处于应激状态时,机体脂肪分解供能导致血清中总胆固醇和游离脂肪酸含量升高。本试验结果表明,各组断奶仔猪血清生化指标无显著差异。这可能是断奶后经过35 d的饲喂,仔猪断奶应激早已消失,而添加植物乳杆菌和NSP复合酶仔猪的营养物质消化吸收利用情况与添加抗生素是一致的,结合饲料转化率结果更进一步说明添加益生菌和NSP复合酶可以替代抗生素。范成莉[23]研究证明,饲粮中添加NSP复合酶对断奶仔猪血清中总胆固醇和甘油三酯含量无显著影响。
血清免疫球蛋白是体液免疫系统的主要成分,免疫球蛋白G在系统免疫反应中起着重要作用,是体液免疫反应的主要抗体。本试验中各组断奶仔猪的血清免疫球蛋白G含量无显著差异,各组动物免疫功能相当。其原因可能是断奶后35 d,仔猪逐渐适应了周围环境和饲粮,断奶应激逐渐减缓,肠道微生物区系趋于稳定。而在断奶应激恢复过程中,添加植物乳杆菌和NSP复合酶达到与添加杆菌肽锌一样的效果,且在免疫功能恢复和提高方面更有优势。Kin等[24]在仔猪饲粮中添加益生菌复合剂,结果发现不影响血清免疫球蛋白含量。韩国青[25]研究报道,添加一定量的酶制剂可以提高血清中免疫球蛋白A和免疫球蛋白G的含量,但差异不显著。
血清胰岛素生长因子Ⅰ和生长激素与动物生长和增重密切相关[22],血清胰岛素是动物体内降低血糖的重要激素。本试验中各组断奶仔猪的血清胰岛素生长因子Ⅰ、生长激素、胰岛素含量均无显著差异。研究表明,一定量的酶制剂可以提高血清胰岛素生长因子Ⅰ的含量,但随着酶制剂添加量的增加,反而呈现降低的趋势[18]。这说明血清中胰岛素生长因子Ⅰ、生长激素和胰岛素含量与饲粮益生菌和酶制剂的添加量有关,特别是益生菌和酶制剂联合添加更需要进一步的研究。
4结论
① 添加植物乳杆菌和NSP复合酶能使断奶仔猪粪便中大肠杆菌数量降低,乳酸菌数量增加,说明其能够促进肠道微生态平衡,有益于仔猪健康。
② 添加植物乳杆菌和NSP复合酶能使断奶仔猪生长性能和血清指标达到与添加杆菌肽锌相当的效果。
参考文献:
[1]LEE J S,AWJI E G,LEE S J,et al.Effect ofLactobacillusplantarumCJLP243 on the growth performance and cytokine response of weaning pigs challenged with enterotoxigenicEscherichiacoli[J].Journal of Animal Science,2012,90(11):3709-3717.
[2]张乃锋,王杰,崔凯,等.植物乳杆菌GF103对生长猪生长性能、营养物质消化率及粪便微生物数量的影响[J].动物营养学报,2015,27(6):1853-1860.
[3]GIANG H H,VIET T Q,OGLE B,et al.Growth performance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with potentially probiotic complexes of lactic acid bacteria[J].Livestock Science,2010,129(1/2/3):95-103.
[4]YU H F,WANG A N,LI X J,et al.Effect of viableLactobacillusfermentumon the growth performance,nutrient digestibility and immunity of weaned pigs[J].Journal of Animal and Feed Sciences,2008,17(1):61-69.
[5]GIANG H H,VIET T Q,OGLE B,et al.Growth performance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with a complex of lactic acid bacteria alone or in combination withBacillussubtilisandSaccharomycesboulardii[J].Livestock Science,2012,143(2/3):132-141.
[6]董晓丽,张乃锋,周盟,等.复合菌制剂对断奶仔猪生长性能、粪便微生物和血清指标的影响[J].动物营养学报,2013,25(6):1285-1292.
[7]WALSH G A,POWER R F,HEADON D R.Enzymes in the animal-feed industry[J].Trends in Biotechnology,1993,11(10):424-430.
[8]唐明红.微生态制剂与酶制剂配合使用对保育仔猪腹泻率和生长性能的影响[J].饲料工业,2015,36(12):32-35.
[9]NRC.Nutrient requirements of swine[S].10th ed.Washington,D.C.:National Academy Press,1998.
[12]马艳凤.糙米、小麦代替玉米及添加酶制剂对断奶仔猪生长性能和消化率的影响研究[D].硕士学位论文.北京:中国农业科学院,2002.
[13]ZHOU T X,JUNG J H,ZHANG Z F,et al.Effect of dietary β-glucan on growth performance,fecal microbial shedding and immunological responses after lipopolysaccharide challenge in weaned pigs[J].Animal Feed Science and Technology,2013,179(1/2/3/4):85-92.
[14]CASTILLO M,MARTE S M,MANZANILLA E G,et al.Quantification of total bacteria,enterobacteria and lactobacilli populations in pig digesta by real-time PCR[J].Veterinary Microbiology,2006,114(1/2):165-170.
[15]FAIRBROTHER J M,NADEAU É,GYLES C L.Escherichiacoliin postweaning diarrhea in pigs:an update on bacterial types,pathogenesis,and prevention strategies[J].Animal Health Research Reviews,2005,6(1):17-39.
[16]CASTILLO M,MARTE S M, ANGUITA M,et al.Adaptation of gut microbiota to corn physical structure and different types of dietary fibre[J].Livestock Science,2007,109(1/2/3):149-152.
[17]LE BON M,DAVIES H E,GLYNN C,et al.Influence of probiotics on gut health in the weaned pig[J].Livestock Science,2010,133(1/2/3):179-181.
[18]李学俭.β-甘露聚糖酶对断乳仔猪生长性能的影响及其机理的研究[D].博士学位论文.沈阳:沈阳农业大学,2008.
[19]WANG J P,YOO J S,KIM H J,et al.Nutrient digestibility,blood profiles and fecal microbiota are influenced by chitooligosaccharide supplementation of growing pigs[J].Livestock Science,2009,125(2/3):298-303.
[20]林谦,戴求仲,宾石玉,等.益生菌与酶制剂对黄羽肉鸡血液生化指标和免疫性能影响的协同效应研究[J].饲料工业,2012,33(14):31-36.
[21]LIU H,JI H F,ZHANG D Y,et al.Effects ofLactobacillusbrevispreparation on growth performance,fecal microflora and serum profile in weaned pigs[J].Livestock Science,2015,178:251-254.
[22]ZHAO X J,LI L,LUO Q L,et al.Effects of mulberry (MorusalbaL.) leaf polysaccharides on growth performance,diarrhea,blood parameters,and gut microbiota of early-weanling pigs[J].Livestock Science,2015,177:88-94.
[23]范成莉.β-葡聚糖、木聚糖复合酶对断奶仔猪生长轴激素的影响及其机理研究[D].博士学位论文.杭州:浙江大学,2008.
[24]KIM K H,INGALE S L,KIM J S,et al.Bacteriophage and probiotics both enhance the performance of growing pigs but bacteriophage are more effective[J].Animal Feed Science and Technology,2014,196:88-95.
[25]韩国清.添加β-甘露聚糖酶对仔猪生长发育影响的试验研究[D].硕士学位论文.北京:中国农业大学,2007.
(责任编辑李慧英)
Effects ofLactobacillusplantarumand Non-Starch Polysaccharide Compound Enzyme on Growth Performance,Fecal Microbial Flora and Serum Parameters of Weaned Piglets
CHAI Jianmin1WEI Ronggui2*LIU Xifeng3LIU Jinlan4CUI Kai1DIAO Qiyu1ZHANG Naifeng1*
(1. Key Laboratory of Feed Biotechnology of the Ministry of Agriculture, Feed Research Institute,Chinese Academy of Agricultural Sciences, Beijing 100081, China; 2. Animal Husbandry and Veterinary Station of Beijing, Beijing 100107, China; 3. Animal Health Administration in Beijing Daxing District, Beijing 102600, China; 4. Livestock and Poultry Seed-Breeding Extension Center in Beijing Fangshan District, Beijing 102444, China)
Abstract:This experiment was conducted to investigate the effects of Lactobacillus plantarum and non-starch polysaccharide (NSP) compound enzymes on growth performance, fecal microbial flora and serum parameters of weaned piglets to achieve the purpose of substituting antibiotics. According the single-factor completely randomized design, one hundred and ninety-two 28-day-old healthy weaned piglets with average body weight of (7.15±0.36) kg were randomly divided into 4 groups with 6 replicates per group and 8 weaned piglets per replicate. The weaned piglets in control group (CT group) were fed the diet supplemented with 40 mg/kg bacitracin zinc, the others in the experimental groups were fed the diet supplemented with 1 g/kg Lactobacillus plantarum (PT group), 1 g/kg NSP compound enzyme (ZT group), 1 g/kg Lactobacillus plantarum+1 g/kg NSP compound enzymes (PZT group), respectively. The test lasted for 35 days. The results showed as follows: 1) no significant differences were found in final body weight, average daily gain, average daily feed intake and feed/gain of weaned piglets among all groups (P>0.05). 2) The numbers of Lactobacillus and E. coli and Lactobacillus/E. coli in faces of weaned piglets had no significant differences among all groups (P>0.05). However, the numbers of Lactobacillus and Lactobacillus/E. coli in faces of weaned piglets in PZT group were higher than those in CT group (0.05≤P<0.10), whereas the number of E. coil in faces of weaned piglets in PZT group was lower than that in CT group (0.05≤P<0.10). 3) The serum biochemical and immune parameters of weaned piglets had no significant differences among all groups (P>0.05). Thus, dietary Lactobacillus plantarum and NSP compound enzymes can promote the balance of intestinal flora, has benefit to piglet health, and to achieve the purpose of substituting antibiotics.[Chinese Journal of Animal Nutrition, 2016, 28(6):1859-1866]
Key words:piglets; probiotics; enzymic preparations; antibiotics; growth performance; serum parameters
doi:10.3969/j.issn.1006-267x.2016.06.029
收稿日期:2015-12-18
基金项目:现代农业产业技术体系北京市创新团队建设资金(GWZJ-2009-08)
作者简介:柴建民(1988—),男,河北邯郸人,硕士研究生,从事动物营养与生理研究。E-mail: chaijianmin2012@163.com *通信作者:魏荣贵,高级畜牧师,E-mail: wrgyf@126.com;张乃锋,副研究员,硕士生导师,E-mail: zhangnaifeng@caas.cn
中图分类号:S828;S816.7
文献标识码:A
文章编号:1006-267X(2016)06-1859-08
*Corresponding authors: WEI Ronggui, senior engineer, E-mail: wrgyf@126.com; ZHANG Naifeng, associate professor, E-mail: zhangnaifeng@caas.cn
