鹿出血性肠炎病原菌的分离和鉴定
2016-06-27李自青赵立峰山西大同大学医学院山西大同07009山西大同大学呼吸病与职业病研究所山西大同07009天津市北辰区养殖业发展服务中心天津北辰00400
李自青,赵立峰,刘 宏(1.山西大同大学医学院,山西大同07009;2.山西大同大学呼吸病与职业病研究所,山西大同07009;.天津市北辰区养殖业发展服务中心,天津北辰00400)
鹿出血性肠炎病原菌的分离和鉴定
李自青1,2,赵立峰3,刘宏1,2
(1.山西大同大学医学院,山西大同037009;2.山西大同大学呼吸病与职业病研究所,山西大同037009;3.天津市北辰区养殖业发展服务中心,天津北辰300400)
摘要:通过对死于出血性肠炎的圈养鹿的病原菌进行分离鉴定,为研制产气荚膜梭菌β-毒素单价和多价疫苗奠定基础。采集山西省内不同地区鹿场因出血性肠炎而死亡鹿的病料32例,经病原微生物分离培养、生化试验和血清型鉴定,分离得到C型产气荚膜梭菌,并测定分离菌所产毒素对小鼠的最小致死量。PCR扩增C型产气荚膜梭菌β-毒素基因,构建重组质粒pMD18-T-J28-C,进行酶切鉴定和核苷酸序列分析。结果32株分离菌中有6株是C型产气荚膜梭菌,占18.7%;其余均为A型,占81.3%。筛选出毒力最强的菌株J28-C,最小致死量(MLD)为5.0×105CFU/mL。PCR扩增和核苷酸序列分析表明,经PCR得到了特异性的β毒素基因片段。表明造成山西省鹿出血性肠炎的病原菌为A型和C型产气荚膜梭菌,以A型为主。
关键词:出血性肠炎;C型产气荚膜梭菌;分离;鉴定
产气荚膜梭菌广泛存在于土壤、人和动物的肠道及粪便中。根据菌体产生的外毒素,将其分成A、B、C、D、E 5型。A型主要产生α毒素,能引起食物中毒和气性坏疽,C型主要引起动物和人类的坏死性肠炎。产气荚膜梭菌是动物出血性肠炎的主要病原菌[1],动物一旦发病,死亡率很高,治疗效果不理想,因此最有效的方法是采用疫苗预防。该研究采集32例山西省内不同地区的鹿场因出血性肠炎而死亡鹿病料,进行病原体的分离和鉴定,并克隆出C型产气荚膜梭菌特异的β毒素基因片段,旨在为制备单价或多价灭活疫苗奠定基础。
1 材料与方法
1.1死亡鹿病料采集病料共32例,分别来自灵石县夏门鹿场,昔阳县大寨鹿场,山西药物培植场南樊、里册等鹿场因出血性肠炎而死亡的鹿,收集病死鹿小肠内容物置于冰壶,-20℃保存。
1.2动物ICR品系小鼠,体重10~12 g,购自北京维通利华实验动物技术有限公司。
1.3菌株和分型血清C59-2产气荚膜梭菌,B、C、D、E产气荚膜梭菌分型血清,购自中国兽医药品监察所;受体菌大肠杆菌DH5α,质粒载体pMD18-T,购自Promega公司。
1.4分离纯化细菌死亡鹿小肠内容物涂片,经革兰染色后用显微镜观察菌体形态。取疑似产气荚膜梭菌的菌落接种在血平板上,37℃下恒温培养18~24 h,观察在平板上是否出现α、β双溶血环。挑取有清晰双溶血环的典型菌落进行纯培养。
1.5生化试验纯培养菌落进行生化试验,包括卵磷脂试验、硝酸盐还原试验、石蕊牛乳发酵试验、明胶液化试验、H2S试验、糖发酵试验和吲哚试验等。
1.6血清型鉴定试验用分离纯化的产气荚膜梭菌纯培养物与分型血清做血清型鉴定试验,鉴定分离菌株的血清型。
1.7毒力测定纯化的细菌培养物取上清液按10-1,10-2,10-3,10-4稀释,分别尾静脉注射体重10~12 g小鼠,每组5只,每只0.2 mL(5.0×108CFU/mL),同时设立对照,根据小鼠死亡情况确定各分离菌的最小致死剂量(minimum lethal dose,MLD)。
1.8分离菌和标准菌株染色体DNA的提取和PCR扩增DNA提取按文献[2]方法进行。引物根据GenBank中的β-毒素基因序列进行设计[3]。P1:5′-CGCCTGCAGCCAATGATATAGG TAAAAC-3′;P2:5′-CCGGAATTCTTAATAGC TGTTACTTT⁃GTG-3′。P1和P2上分别有酶切位点Pst I和EcoR I。PCR反应条件:96℃预变性5 min;94℃变性40 s,52℃退火40 s,72℃延伸80 s,33个循环;扩增片段大小约为700 bp。将扩增产物克隆至载体pMD18-T中,构建重组质粒pMD18-TJ28-C,酶切鉴定正确后进行测序。
2 结果
2.1革兰染色镜检结果病死鹿肠道取样均可见一种经革兰染色呈阳性的细菌,短杆状、两端钝圆、单个或呈双排列、有荚膜、粗大正直,有时在菌体近端或中央观察到有芽孢,呈现卵圆形,与C型产气荚膜梭菌标准菌株形态相符(见图1,图2)。
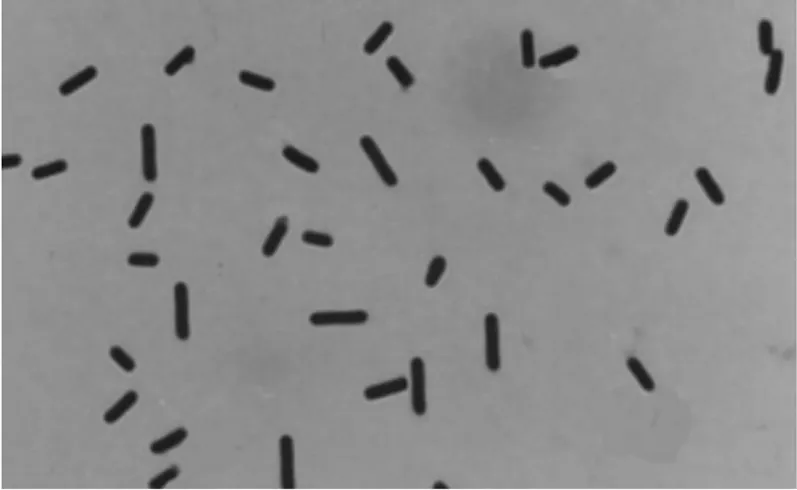
图1 C型产气荚膜梭菌C59-2菌株形态

图2 分离的产气荚膜梭菌菌株形态
2.2细菌生长特性和菌落的形态分离菌在血平板上培养后,菌落呈灰白色、圆形隆起、表面光滑、周围有双溶血环、外环不完全溶血,内环完全溶血;在25℃有氧条件中放置1 h后变成草绿色或灰绿色。分离菌在厌氧肉肝胃酶消化汤试管中生长时,可见产生大量气体,液面上有白色泡沫,初步判断分离菌是产气荚膜梭菌。
2.3生化试验结果对分离的32株菌株的15项生化指标测定结果表明,能发酵麦芽糖、棉子糖、葡萄糖、蔗糖、乳糖、淀粉;明胶液化试验、硝酸盐还原试验、H2S试验、石蕊牛乳试验、卵磷脂酶试验均为阳性;甘露醇、水杨苷、靛基质及吲哚试验为阴性。符合产气荚膜梭菌的生化和生理特征。
2.4血清型鉴定结果分离的32株细菌中,其中6株菌的毒素可以被B、C型抗毒素血清中和,而不能被D、E型抗毒素血清中和,可以确定这6株的血清型是C型,占18.7%。其余26株菌的毒素都能被B、C、D、E型抗毒素血清中和,表明26株菌株的血清型都是A型。
2.5最小致死量测定结果对分离的C型产气荚膜梭菌进行毒力测定,筛选出毒力最强菌株,MLD 为10-3稀释倍数(5.0×105CFU/mL),命名为J28-C。
2.6PCR扩增和序列分析经PCR技术,从C型产气荚膜梭菌染色体中扩增700 bp的β毒素基因片段(见图3),经EcoR I / Pst I酶切后,插入载体pMD18-T相应的酶切位点中,构建重组质粒pMD18-T-J28-C,经EcoRⅠ/ Pst I酶切鉴定(见图4)和核苷酸序列测定,证实该克隆质粒含有β毒素基因片段,与Hauer报道的序列一致[3]。
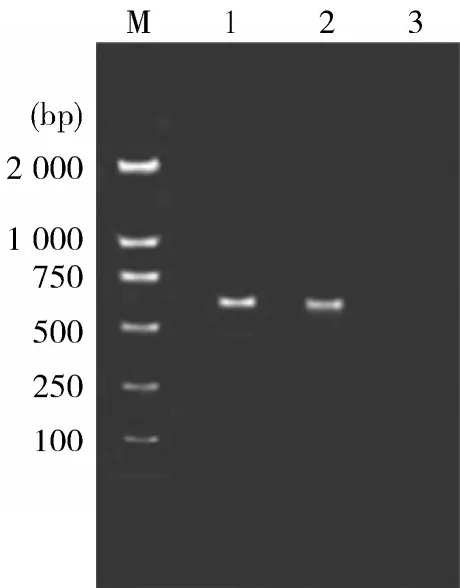
图3 β毒素基因的PCR扩增产物

图4 重组质粒pMD18-T-J 28-C的酶切电泳
3 讨论
鹿出血性肠炎是以胃肠道出血为主要特征的一种疾病,其发病较急、病程较短,死亡率非常高[4]。产气荚膜梭菌5个毒素型都有致病性,但究竟是由一种还是几种毒素类型共同作用引起的鹿出血性肠炎观点还不一致。高文伟[5]等对山西省鹿出血性肠炎的病料分析发现,主要由A型产气荚膜梭菌引起,代振洲[6]等则认为是由C型和D型引起。本试验采集山西省不同地区鹿场32例因出血性肠炎而死亡鹿的病料,分离培养病原体发现,有6例为C型产气荚膜梭菌,占18.7%,其余的为A型,约81.3%。研究结果表明,山西省内引起鹿出血性肠炎流行的病原菌是产气荚膜梭菌A型和C型,但以A型为主。从而为今后山西省内鹿出血性肠炎的综合防制提供了依据。
产气荚膜梭菌β毒素是由B型和C型菌产生的致死性毒素,是引起动物和人类肠炎和肠毒血症的主要致病因子[7]。Schumacher V L等[8]研究发现,产气荚膜梭菌β毒素诱导内皮细胞的损伤在猪发生产气荚膜梭菌C型肠炎的早期阶段起着重要作用。许崇波等[9]从C型产气荚膜梭菌中分别克隆出β1和β2基因,并构建了α-β1-β2融合基因,发现融合蛋白具有较好的免疫原性。本研究从C型产气荚膜梭菌染色体中成功克隆了β-毒素基因,构建了重组质粒pMD18-T-J28-C,经酶切鉴定和核苷酸序列分析,表明β-毒素的基因结构和编码序列是正确的。为下一步研制产气荚膜梭菌β-毒素单价和多价基因工程苗奠定基础。
参考文献:
[1]钟震宇,张林源,唐宝田.2000-2009年北京南海子麋鹿出血性肠炎发生特点分析[J].畜牧与兽医,2013,45(4):56-58.
[2] Sting R.Detection of beta2 and major toxin genes by PCR in Clos⁃tridium perfringens field isolates of domestic animals suffering from enteritis or enterotoxaemia[J] .Berl Munch Tierarztl Wochen⁃schr,2009,122(9-10):341-347.
[3] Hauer P J,Yeary T J,Rosenbusch R F . Cloning and molecular characterization of the beta toxin(phospholipase C)gene of Clos⁃tridium haemo lyticum [J].Anaerobe,2004,10(4):243-254.
[4]何成伟.梅花鹿产气荚膜梭菌病的诊断报告[J].中国兽医杂志,2011,47(1):43-44.
[5]高文伟,郭宏伟,任家琰,等.A型产气荚膜梭菌的分离及鉴定[J].畜牧兽医科学,2007,23(7):28-32.
[6]代振洲,潘亚文,董军,等.鹿肠毒血症的诊断与防治[J].当代畜牧,2010,11:27-28.
[7] van Asten A J,Nikolaou G N,Gröne A.The occurrence of cpb2 toxigenic Clostridium perfringens and the possible role of the be⁃ta2-toxin in enteric disease of domestic animals,wild animals and humans[J].Vet J,2010,183(2):135-140.
[8] Schumacher V L,Martel A,Pasmans F,et al.Endothelial binding of beta toxin to small intestinal mucosal endothelial cells in early stages of experimentally induced Clostridium perfringens type C enteritis in pigs [J].Vet Pathol,2013,50(4):626-629.
[9]许崇波,陈向东,许崇利,等.C型产气荚膜梭菌α、β1、β2毒素基因融合及免疫原性研究[J].浙江大学学报(农业与生命科学版),2008,34(4):379-384.
Isolation and Characterization of the Pathogens within Deers Died from Hemorrhagic Enteritis
LI Zi-qing1,2,ZHAO Li-feng3,LIU Hong1,2
(1.Medical College of Shanxi Datong University,Datong,037009,Datong 037009,China;
2.Respiratory and Occupational Disease Research Institute of Shanxi Datong University,Datong 037009,China;
3.The service center for development of aquaculture industry in beechen district in tianjin,Tianjin 300400,China)
Abstract:Isolating and identifying the pathogens within deer died from hemorrhagic enteritis,and providing information for developing beta toxin gene engineering subunit vaccine and bacterial toxin polyvalent vaccine.Samples were collected from 32 cas⁃es of cervus hemorrhagic enteritis in Shanxi province,and the major microbial pathogen were isolated and examined microscopical⁃ly,and then identified through serum reaction.A Beta-toxin gene was amplified by PCR and The recombinant plasmid pMD18-TJ28-C was constructed.The recombinant plasmid pMD18-T-J28-C was studied in detail by restriction endonucleases analysis and nucleotide sequencing.The results showed that 6 of 32 isolated were Clostridium perfringens type C,accounting for 18.7%,and the rest were type A,about 81.3%.The most virulent strain J28-C was selected and its minimum lethal dose(MLD)was 5.0×105CFU. Further,PCR and sequence analysis showed that the recombinant pMD18-T-J28-C possessed a positive beta-toxin gene sequenc⁃es,and a reading frame.Hemorrhagic enteritis in Shanxi province is caused by Clostridium perfringens of type A and C,and type A is the major pathogen.
Key words:Hemorrhagic colitis;Type C Clostridium perfringens;Isolation;Characterization Corresponding author:LIU Hong
中图分类号:S852.63
文献标志码:A
文章编号:0529-6005(2016)05-0032-03
收稿日期:2015-05-27
基金项目:大同市科技攻关计划项目(201361)
作者简介:李自青(1980-),女,硕士,讲师,主要从事分子生物学与肿瘤免疫学研究,E-mail:liziqing_1234@163.com
通讯作者:刘宏,E-mail:a-liuhong@163.com
