实时剪切波弹性成像在肝癌热消融应用中的初步体会
2016-06-25王秋程孙一欣哈尔滨医科大学附属肿瘤医院超声科黑龙江哈尔滨150081
董 婧,程 文,王秋程,张 磊,孙一欣哈尔滨医科大学附属肿瘤医院超声科,黑龙江 哈尔滨 150081
实时剪切波弹性成像在肝癌热消融应用中的初步体会
董 婧,程 文,王秋程,张 磊,孙一欣
哈尔滨医科大学附属肿瘤医院超声科,黑龙江 哈尔滨 150081
[摘要]背景与目的:热消融[射频消融(radiofrequency ablation,RFA)和微波消融(microwave ablation,MWA)]是治疗肝癌最常用的微创技术,实时剪切波弹性成像(real-time shear wave elastography,SWE)是一种新型的超声弹性成像技术。本研究将SWE应用于肝癌热消融中,旨在研究肝癌热消融前后病灶及其周围肝实质的硬度变化,初步探讨SWE在肝癌热消融疗效评价中的应用价值。方法:2014年10月—2015年4月因肝癌于哈尔滨医科大学附属肿瘤医院行超声引导下RFA或MWA且达到完全消融的36例患者(共39个病灶)。患者于消融前后分别行SWE检查,分别记录病灶及其周围肝实质的杨氏模量平均值(SWE-mean)、最小值(SWE-min)、最大值(SWE-max)、标准差(SWE-SD)。经统计学分析,比较消融前后病灶及其周围肝实质的硬度变化及两种消融方式下消融灶的硬度差异。结果:① 消融前后,病灶的SWE-mean为(30.09±11.67)kPa vs (52.11±17.56)kPa,SWE-min为(10.46±8.22)kPa vs (20.57±11.42)kPa,SWE-max为(51.50±20.84)kPa vs (88.54±27.75)kPa,SWE-SD为(10.63±4.30)kPa vs (16.89±7.72)kPa,差异有统计学意义(P<0.05);② 消融前后,病灶周围肝实质的SWE-mean为(8.84±2.82)kPa vs (8.91±2.78)kPa,SWE-min为(4.77±1.95)kPa vs (4.69±1.90)kPa,SWE-max为(13.82±3.79)kPa vs (14.34±3.97)kPa,SWE-SD为(3.24±1.32)kPa vs(3.37±1.29)kPa,差异无统计学意义(P>0.05);③ 消融后,RFA及MWA的SWE-mean为(45.55±10.91)kPa vs (60.59±20.99)kPa,SWE-min为(18.95±8.86)kPa vs (25.93±10.93)kPa,SWE-max为(76.58±15.51)kPa vs (104.01±32.59)kPa,SWE-SD为(13.82±3.52)kPa vs (20.85±9.77)kPa,差异有统计学意义(P<0.05)。结论:SWE可以定量评价病灶的硬度,消融后病灶硬度大于消融前,MWA后消融灶硬度大于RFA后,两种消融方式对病灶周围肝实质的硬度影响不明显。SWE在肝癌热消融中的应用前景可期。
[关键词]实时剪切波弹性成像;肝癌;射频消融;微波消融
Correspondence to: CHENG Wen E-mail: chengwen69@yahoo.com
1 资料和方法
1.1 研究对象
2014年10月—2015年4月因肝癌于哈尔滨医科大学附属肿瘤医院行超声引导下RFA或MWA且达到完全消融(患者消融术后1个月复查超声造影、增强CT或增强MRI,消融灶3期均无增强视为达到完全消融)的36例患者(共39个病灶)。其中男性27例,女性9例。年龄34~75岁,平均年龄(54.06±9.62)岁。所有病灶均经过超声引导下穿刺活检病理证实为原发性肝细胞癌。遵循患者及家属意愿选择消融方式,其中20例(共22个病灶)行RFA,16例(共17个病灶)行MWA。所有研究对象均符合肝癌热消融的适应证,病灶深度距离探头10 cm之内,且远离心脏及大血管。该研究中的操作均征得患者知情同意,并经过本院伦理委员会批准。
1.2 仪器
剪切波弹性成像仪器为法国Supersonic Imagine Aixplorer型,凸阵探头频率为1.0~6.0 MHz。超声引导仪器为德国Siemens Sequoia 512型,凸阵探头频率为3.5~5.0 MHz。射频消融仪器为美国Valleylab Cool-Tip射频治疗系统,根据病灶具体情况选择应用Cool-Tip转换器。微波消融仪器为南京康友医疗科技有限公司Ky-2000型微波仪,工作频率2 450.0 MHz,输出功率为l~100 W。
1.3 方法
1.3.1 剪切波弹性成像方法
患者于消融术前行剪切波弹性成像,患者仰卧位,右臂上抬至头部,充分暴露腹部,常规超声扫查肝脏,清晰显示病灶最大切面时,嘱患者屏气,切换仪器至SWE模式,不对探头施压,取样框应包括全部病灶(若病灶过大时则取部分病灶)及周围肝实质。待弹性图像稳定3~4帧时,冻结图像,弹性取样框内基本或大部分充满颜色且无明显噪声时认为取样成功,启动Q-BOX及Q-BOX Ratio,第一感兴趣区为病灶中心区域,第二感兴趣区为病灶周围(距病灶边缘1~2 cm)肝实质区域,存储图像,分别记录病灶及其周围肝实质的杨氏模量平均值(SWE-mean)、最小值(SWE-min)、最大值(SWE-max)以及标准差(SWE-SD)。此过程重复5次,分别记录以上测量值,并取5次结果的平均值。
患者于消融术后48 h再次行剪切波弹性成像检查,方法同上。
近年来,随着社会转型的不断推进,改革进入深水期,与此同时社会矛盾纠纷也呈现多发高发态势。社会矛盾纠纷的多元化解机制建设呼之欲出,在实践过程中,调解、仲裁、行政裁决、行政复议、诉讼等多项纠纷解决制度发挥着各自的作用,为多元矛盾纠纷化解机制建构打下坚实基础。
1.3.2 RFA方法
选择合适的体位,连接好电极和主机之间的射频线和电极板,术前预先将电极贴膜贴至患者双侧大腿无毛发部位。行全身麻醉,局部皮肤进行常规消毒,铺无菌洞巾。在超声引导下将射频针置入病灶,根据病灶具体情况选择射频用针及消融时间,按仪器操作进行RFA治疗。在消融过程中,应监测生命体征。消融完成后,拔针时进行针道消融,防止术后出血和肿瘤沿针道种植。
1.3.3 MWA方法
选择合适的体位,术前预先通电测试仪器,确保微波仪器正常工作。在超声引导下将微波针置入病灶,根据病灶大小选择微波用针、消融时间及功率。消毒、麻醉、消融过程监测生命体征和拔针时针道消融等方法同射频消融。
1.4 统计学处理
2 结 果
2.1 消融前后病灶杨氏模量值之间的比较
病灶消融后的SWE-mean、SWE-min、SWE-max、SWE-SD均大于消融前,差异有统计学意义(P<0.05,表1,图1、2)。
2.2 消融前后病灶周围肝实质杨氏模量值之间的比较
消融后病灶周围肝实质的SWE-mean、SWE-min、SWE-max、SWE-SD与消融前相比,差异无统计学意义(P>0.05,表2)。
表1 消融前、后病灶的杨氏模量值Tab.1 SWE values of lesions before and after thermal ablation (kPa,±s)

表1 消融前、后病灶的杨氏模量值Tab.1 SWE values of lesions before and after thermal ablation (kPa,±s)
Item Number of lesions SWE-mean SWE-min SWE-max SWE-SD Before ablation 39 30.09±11.67 10.46±8.22 51.50±20.84 10.63±4.30 After ablation 39 52.11±17.56 20.57±11.42 88.54±27.75 16.89±7.72 t value -8.510 -7.161 -9.491 -5.001 P value 0.000 0.000 0.000 0.000
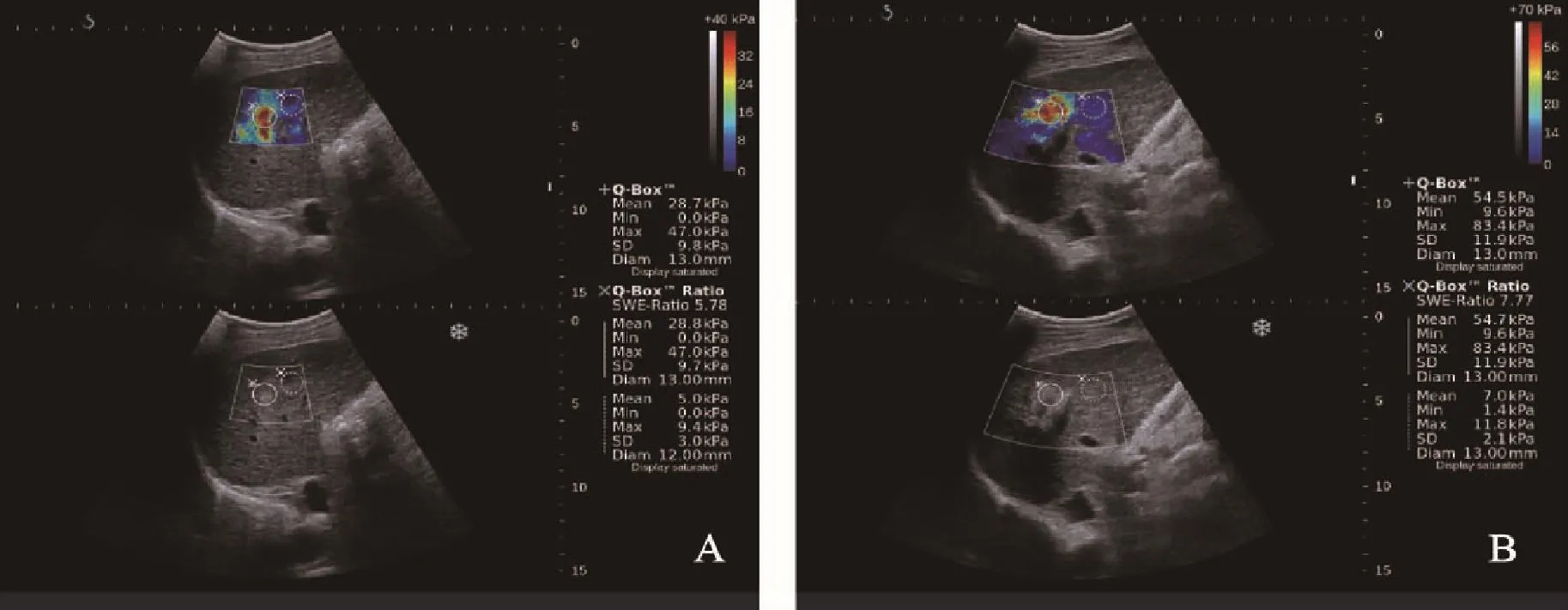
图1 RFA前后SWE图Fig.1 SWE figure before and after RFA

图2 MWA前后SWE图Fig.2 SWE figure before and after MWA
表2 消融前、后病灶周围肝实质的杨氏模量值Tab.2 SWE values of liver parenchyma around the lesions before and after thermal ablation (kPa,±s)
表2 消融前、后病灶周围肝实质的杨氏模量值Tab.2 SWE values of liver parenchyma around the lesions before and after thermal ablation (kPa,±s)
Item Number of lesions SWE-mean SWE-min SWE-max SWE-SD Before ablation 39 8.84±2.82 4.77±1.95 13.82±3.79 3.24±1.32 After ablation 39 8.91±2.78 4.69±1.90 14.34±3.97 3.37±1.29 t value -0.385 0.331 -1.593 -0.846 P value 0.702 0.743 0.119 0.403
2.3 MWA后与RFA后消融灶杨氏模量值之间的比较
MWA后的SWE-mean、SWE-min、SWE-max、SWE-SD均大于RFA后,差异有统计学意义(P<0.05,表3)。
表3 MWA后及RFA后消融灶的杨氏模量值Tab.3 SWE values of lesions after MWA and RFA (kPa,±s)

表3 MWA后及RFA后消融灶的杨氏模量值Tab.3 SWE values of lesions after MWA and RFA (kPa,±s)
Item Number of lesions SWE-mean SWE-min SWE-max SWE-SD After MWA 17 60.59±20.99 25.93±10.93 13.82±3.79 3.24±1.32 After RFA 22 45.55±10.91 18.95±8.86 14.34±3.97 3.37±1.29 t value 2.687 2.204 3.202 2.828 P value 0.013 0.034 0.004 0.011
3 讨 论
肝癌是最常见的恶性肿瘤之一,手术切除为首选治疗方法。然而,由于肝功能差等诸多因素限制,只有少部分患者能够进行外科手术治疗[3]。超声引导下RFA和MWA因其创伤小、操作简便和安全有效的优点被广泛应用于临床。但肝癌消融术后的复发率较高,肿瘤残留是消融术后肿瘤短期复发的主要因素之一[4],因此通过便捷有效快速的影像学方法来评价肿瘤消融疗效对患者的预后及后续治疗意义重大。
组织的弹性是人体的重要物理性质之一,当组织发生病变时其弹性也会发生变化。近年来,各种弹性成像技术已被逐渐应用于肝癌热消融中。SWE具有客观定量检测、感兴趣区域大、快速、高效、易操作、可重复性强和受消融所产生气体影响小等优点[5],能够客观反映组织的弹性,可更好地应用于肝癌的热消融中。
本研究将SWE应用于RFA及MWA中,主要从消融前后病灶的硬度变化方面加以探讨。结果表明,无论是RFA还是MWA后消融灶的硬度均大于消融前,与国内外相关的体外及体内研究一致[6]。RFA及MWA消融区中心在光镜下表现为细胞完全破坏、崩解,呈无结构均质深蓝染状,二者都是使组织蛋白质变性、脱水和固缩以达到凝固性坏死,这是病灶消融后变硬的主要原因之一,也就是说病灶凝固性坏死的硬度要比癌组织硬度大。Kwon等[7]评估了38例行肝细胞癌消融术的患者,发现其中8例复发,复发灶均较消融灶软。因此有望从消融灶硬度变化上判断消融疗效,即其是否达到了完全凝固性坏死。如果一个消融灶部分区域较软,那么是否可以考虑这部分消融灶消融不完全或没有达到完全凝固性坏死。若此观点进一步得到证实,SWE以其无创、便捷、受消融产生的气体影响小、可较清晰显示消融范围及硬度的优势,可在消融过程中及时发现消融灶较软的区域并给予补充治疗,尽可能避免患者短期内原位二次消融治疗,可减少患者创伤,减轻经济负担,对患者预后意义重大。
本研究还关注了病灶消融前后其周围肝实质的硬度变化,因消融范围要超过病灶的大小,故选取距病灶边缘1~2 cm且避开大血管的肝实质为感兴趣区。结果表明,无论是RFA后还是MWA后消融灶周围肝实质的硬度与消融前相比均无显著变化,说明两种消融方式均不会对消融灶周围肝实质产生明显的影响。MWA及RFA是治疗肝脏肿瘤安全、有效的方式,临床应用广泛[8-9]。
本研究还将RFA后消融灶的杨氏模量值与MWA后消融灶的杨氏模量值进行比较,发现MWA后消融灶的各项杨氏模量值均大于RFA后,分析其原因可能与二者的消融原理不同有关。RFA的原理是体内组织离子在高频电流的作用下随电流变化的方向振动,使电极附近的组织离子因电流的作用相互摩擦产热,最终导致组织凝固性坏死。MWA的原理是通过微波使组织吸收大量的微波能,作用于组织内部而迅速产生大量热量,使肿瘤瞬时热凝固坏死。MWA在体内组织内主要是通过蛋白质、水等极性分子的旋转摩擦产热来进行热消融的。据文献[10-11]报道,MWA具有消融频率高、升温快、穿透力强和受血流灌注影响小等特点,故MWA的热效率、瘤内温度较RFA更高,MWA使组织碳化较RFA更明显。这可能是MWA后消融灶硬度大于RFA后的原因之一。章建全等[12]体外猪肝实验探讨了消融灶的硬化程度与其坏死程度间的关系,并认为可以从硬化的程度推断其凝固坏死的程度。结合本研究结果,RFA 和MWA的消融灶硬度存在差异,是否可以推测两种消融方式的凝固坏死程度存在差异,而这种差异对患者预后及消融效果远期评价是否存在某种影响,有待长期随访后进一步研究和讨论。
本研究尚存在很多不足。首先,病例数较少,可能存在测量误差,需扩大样本量进一步研究以得到更加客观可靠的研究结果。其次,尚未完成长期随访,未完成复发灶与残留灶杨氏模量信息方面的研究。本研究中存在的很多推测,需在长期随访研究中进一步得到验证。最后,SWE技术尚存在局限,对位置较深、临近心脏大血管等位置的病灶图像填充效果不理想,不能一起入组研究讨论。
SWE在肝癌热消融中的应用尚处于初步研究阶段,有学者还将其应用于肿瘤消融监测[13]及消融范围评估[14]上,而本研究主要从消融灶硬度方面加以探讨,均取得一定的研究结果。综上所述,SWE在肝癌热消融中的应用前景可期。
[参 考 文 献]
[1]FERRAIOLI G, TINELLI C, BELLO B D, et al.Accuracy ofreal-time shear wave elastography for assessing liver fibrosis in chronic hepatitis C: a pilot study [J].Hepatology, 2012,56(6): 2125-2133.
[2]COSGROVE D, PISCAGLIA F, BAMBER J, et al.EFSUMB guidelines and recommendations on the clinical use of ultrasound elastography.Part 2: Clinical applications[J].Ultraschall Med, 2013, 34(3): 238-253.
[3]苏晓妹, 朱亚杰, 张 涛, 等.超声下微波治疗肝功能分级差的小肝癌[J].介入放射学杂志, 2012, 21(10): 825-828.
[4]花永强, 陈 颢, 孟志强, 等.超声引导射频消融治疗肝脏恶性肿瘤302例肿瘤残留危险因素分析[J].中国癌症杂志, 2014, 24(2): 119-127.
[5]CUI X W, FRIEDRICH-RUST M, MOLO C D, et al.Liver elastography, comments on EFSUMB elastography guidelines 2013[J].World J Gastroenterol, 2013, 19(38): 6329-6347.
[6]MARIANI A, KWIECINSKI W, PERNOT M, et al.Real time shear waves elastography monitoring of thermal ablation: in vivo evaluation in pig livers[J].J Surg Res, 2014, 188(1):37-43.
[7]KWON H J, KANG M J, CHO J H, et al.Acoustic radiation force impulse elastography for hepatocellular carcinomaassociated radiofrequency ablation[J].World J Gastroenterol, 2011, 17(14): 1874-1878.
[8]SIMO K A, SEREIKA S E, NEWTON K N, et al.Laparoscopic-assisted microwave ablation for hepatocellular carcinoma: safety and efficacy in comparison with radiofrequency ablation[J].J Surg Oncol, 2011, 104(7):822-829.
[9]DING J, JING X, LIU J, et al.Comparison of two different thermal techniques for the treatment of hepatocellular carcinoma[J].Eur J Radiol, 2013, 82(9): 1379-1384.
[10]WRIGHT A S, SAMPSON L A, WARNER T F, et al.Radiofrequency versus microwave ablation in a hepatic porcine model[J].Radiology, 2005, 236(1): 132-139.
[11]BHARDWAJ N, STRICKLAND A D, AHMAD F, et al.Liver ablation techniques: a review[J].Surg Endosc, 2010, 24(2):254-265.
[12]章建全, 刁宗平, 卢 峰, 等.离体猪肝微波消融灶的弹性变化及其病理意义[J].中华超声影像学杂志, 2011,20(1): 76-79.
[13]MARIANI A, KWIECINSKI W, PERNOT M, et al.Real time shear waves elastography monitoring of thermal ablation: in vivo evaluation in pig livers[J].J Surg Res, 2014, 188(1):37-43.
[14]SUGIMOTO K, OSHIRO H, OGAWA S, et al.Radiologicpathologic correlation of three-dimensional shear-wave elastographic findings in assessing the liver ablation volume after radiofrequency ablation[J].World J Gastroenterol,2014, 20(33): 11850-11855.
Preliminary experience with real-time shear wave elastography monitoring of thermal ablation of liver cancer
DONG Jing, CHENG Wen, WANG Qiucheng, ZHANG Lei, SUN Yixin (Department of Ultrasound, Harbin Medical University Cancer Hospital, Harbin 150081, Heilongjiang Province, China)
[Key words]Real-time shear wave elastography; Liver cancer; Radiofrequency ablation; Microwave ablation
[Abstract]Background and purpose: Thermal ablation (radiofrequency ablation, RFA/microwave ablation,MWA) is the most commonly used minimally invasive technique for the treatment of liver cancer.Real-time shear wave elastography (SWE) is a new type of ultrasonic imaging technology, which was used in our study to monitor thermal ablation of liver cancer.This study aimed to investigate the stiffness change of liver cancer and that of surrounding liver parenchyma before and after thermal ablation, and to evaluate the application of SWE for monitoring thermal ablation for liver cancer.Methods: From Oct.2014 to Apr.2015, a total number of 36 patients, with 39 lesions, were treated with RFA or MWA and got complete response.SWE examination was performed before and after ablation.The SWE-mean, SWE-min, SWE-max, SWE-SD of lesions and the surrounding liver parenchyma were measured.Statistical analysis was made to compare the stiffness changes of liver cancer with those of the surrounding liver parenchyma before and after thermal ablation, and to determine whether there were differences between two different ablation modes.Results: Before and after ablation, the SWE-mean of lesions was (30.09±11.67) kPa vs (52.11±17.56) kPa,SWE-min was (10.46±8.22) kPa vs (20.57±11.42) kPa, SWE-max was (51.50±20.84) kPa vs (88.54±27.75) kPa, SWESD was (10.63±4.30) kPa vs (16.89±7.72) kPa; There were statistically significant differences (P<0.05).Before and after ablation, the SWE-mean of surrounding liver parenchyma was (8.84±2.82) kPa vs (8.91±2.78) kPa, SWE-min was (4.77±1.95) kPa vs (4.69±1.90) kPa, SWE-max was (13.82±3.79) kPa vs (14.34±3.97) kPa, SWE-SD was (3.24±1.32)kPa vs (3.37±1.29) kPa; There were no statistically significant differences (P>0.05).After ablation, the SWE-mean of RFA and MWA was (45.55±10.91) kPa vs (60.59±20.99) kPa, SWE-min was (18.95±8.86) kPa vs (25.93±10.93) kPa,SWE-max was (76.58±15.51) kPa vs (104.01±32.59) kPa, SWE-SD was (13.82±3.52) kPa vs (20.85±9.77) kPa; There were statistically significant differences (P<0.05).Conclusion: SWE can quantitively analyze the stiffness of lesions.The ablation zone became stiffer after RFA or MWA, and the ablation zone of MWA was stiffer than that of RFA.Two kinds of ablation methods did not significantly affect the stiffness of liver parenchyma around the lesion.SWE could potentially be used to monitor thermal ablation of liver cancer.
DOI:10.3969/j.issn.1007-3969.2016.02.005
中图分类号:R735.7
文献标志码:A
文章编号:1007-3639(2016)02-0145-06
通信作者:程文 E-mail:chengwen69@yahoo.com
收稿日期:(2015-08-28 修回日期:2015-11-22)
