化学释疑六则
2016-06-23安徽省灵璧一中王树西
安徽省灵璧一中 王树西
化学释疑六则
安徽省灵璧一中王树西
在化学学习中,许多同学常受到一些问题的困扰,但在教辅材料或网上又很难找到合理、翔实的答案,本文选取聚乙烯和聚氯乙烯的区分,超酸和魔酸,医用酒精浓度的选择依据,SiCl4、NCl3及CCl4的水解不同的原因、ⅤA族~ⅦA族元素氢化物的酸性变化原因及金属粉末为何多显黑色6个比较典型的问题加以解释,希望能对同学们的学习有所帮助。
1.为什么不能用聚氯乙烯塑料盛装食品?如何判断塑料的原料是聚乙烯还是聚氯乙烯?
聚乙烯(PE)是乙烯的聚合物,无毒,化学稳定性好,耐寒,耐辐射,可做食品和药物的包装材料,可制作食具、医疗器械,用作电子工业的绝缘材料等。聚氯乙烯(PVC)是氯乙烯的聚合物,可制成包装材料、防雨用品、电缆、电线的绝缘层、人造革制品、水管和输送耐腐蚀性流体管及各种贮槽的衬里和地板等。聚氯乙烯本身无毒,但其单体有剧毒。判断聚氯乙烯制品是否有毒,一要看残留单体是否脱除到一定的要求;二要看加入的助剂是否有毒。若氯乙烯单体含量过高,尤其是在微波、高温等环境下,容易分解出对人体有致癌作用的物质;同时增塑剂、稳定剂若使用不当,也会对人体造成一定的危害。鉴别方法:①聚乙烯密度小于水,在水中会漂浮;而聚氯乙烯密度大于水,在水中会下沉。②PE保鲜膜,黏性较差,用手一搓,很容易就打开了;而PVC保鲜膜则黏性较好,用手揉搓后,不易展开。③点燃PE保鲜膜,火焰呈黄色,离开火源不会熄灭,会滴下像蜡烛油一样的液体,散发一股蜡烛味;而PVC保鲜膜不易点燃,离开火源后会熄灭,燃烧时有一股难闻的刺激性气味。
2.王水可溶解Pt、Au,它是不是最强的酸?
王水不是最强的酸,相同条件下超酸和魔酸的酸性要比王水强。酸性超过纯硫酸的酸或酸性介质叫作超酸或超强酸。魔酸是由两种或两种以上的含氟化合物组成的溶液。如氢氟酸和五氟化锑以1∶0.3(物质的量之比)混合时,它的酸性是浓硫酸的1亿倍;按1∶1混合时,它的酸性是浓硫酸的10亿倍,能溶解不溶于王水的高级烷烃(如蜡烛)。魔酸既能溶解蜡烛,又能使烷烃、烯烃等发生一系列化学变化,这是普通的酸不能实现的。如正丁烷在魔酸的作用下,可以发生C—H键断裂的反应,生成氢气;可以发生C—C键断裂的反应,生成甲烷;还可以发生异构化反应,生成异丁烷。魔酸具有高强酸性和很大的介电常数,能使很弱的碱质子化,能使非电解质变为电解质,因此是良好的催化剂,可使本来难以发生的反应在较温和的条件下进行,所以在饱和烃的裂解、重聚、异构化和烷基化反应中被广泛应用。
3.酒精为什么能用于消毒?为什么医用酒精的浓度为75%?
酒精能消毒是因为它能够吸收细菌蛋白的水分,使其脱水发生变性,从而达到杀灭细菌的目的。要使细菌蛋白变性,就要让蜷曲、螺旋的蛋白质分子长链舒展、松弛,其中的关键是要破坏形成蜷曲和螺旋的各种力。酒精分子有两个末端,一端是憎水基(—C2H5),可以破坏蛋白质内部憎水基团之间的吸引力,一端是亲水基(—OH),但它难以破坏蛋白质外部的憎水基团之间的吸引力。水分子虽然可以松弛蛋白质亲水基团之间的吸引力,但它即使进入细菌内部,也无法破坏其蛋白质中憎水基团之间的吸引力。无水酒精对细菌蛋白的脱水过于迅速,使细菌表面蛋白质变性凝固,形成了一层坚固的硬膜,阻止酒精进一步渗入细菌内部,以致削弱了它的杀菌能力,所以纯酒精或水都不足以使细菌内的蛋白质变性。浓度为75%的酒精与细菌的渗透压相近,可以在细菌表面蛋白变性之前渗入细菌体内,使细菌所有的蛋白质脱水、变性凝固,最终杀死细菌。当酒精浓度低于75%时,由于渗透性降低,会使杀菌能力降低。
4.非金属卤化物绝大多数易水解,为什么SiCl4和NCl3水解产物类别不同,而CCl4却不能水解?
非金属卤化物都是共价化合物,其能够水解的必要条件是中心原子有空轨道或孤对电子。SiCl4的中心原子Si具有3d空轨道,能够发生亲核型水解反应,即水分子中的氧原子上的孤对电子“进攻”中心原子Si的空轨道,SiCl4接受来自水分子的电子并生成一个配位中间体SiCl4(OH2),再脱去一个HCl分子,然后再发生多次水解,逐步生成水解产物,反应式为SiCl4+3H2O=H2SiO3+4HCl。
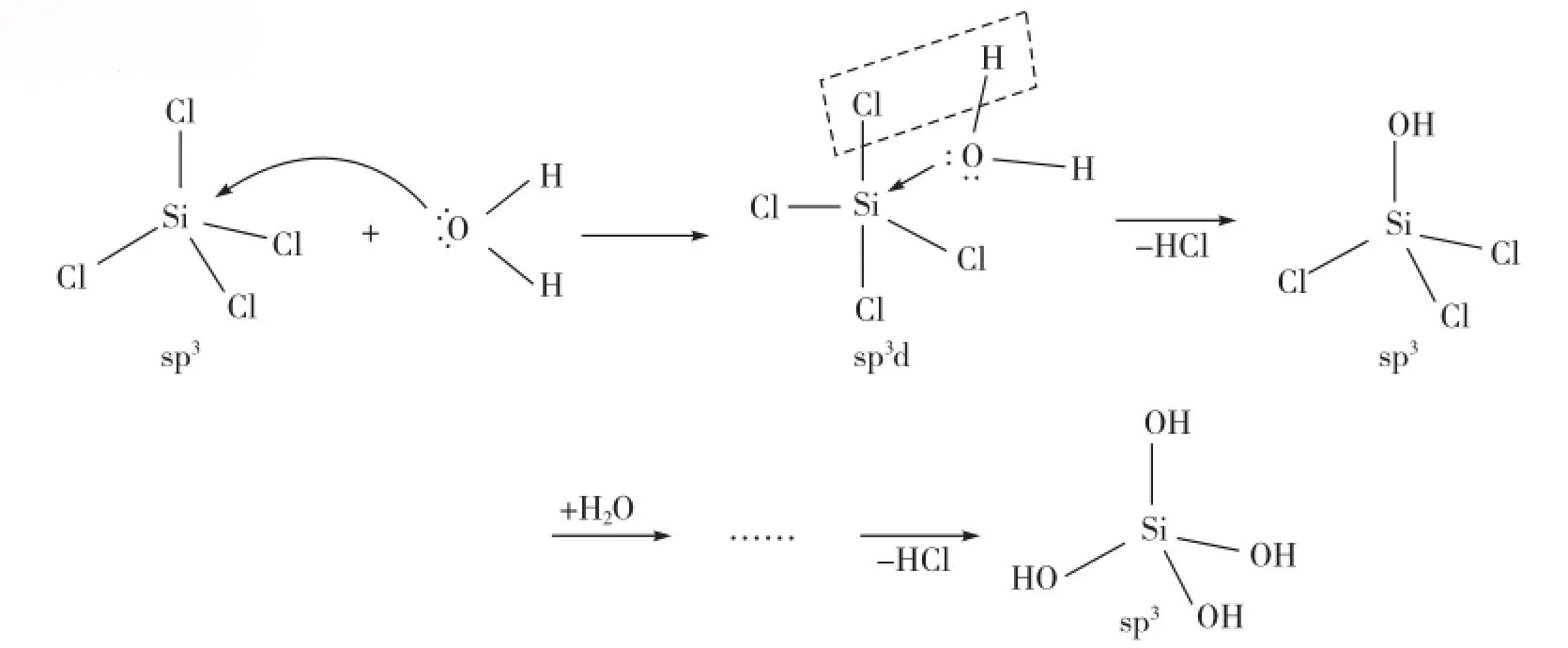
原理如下:
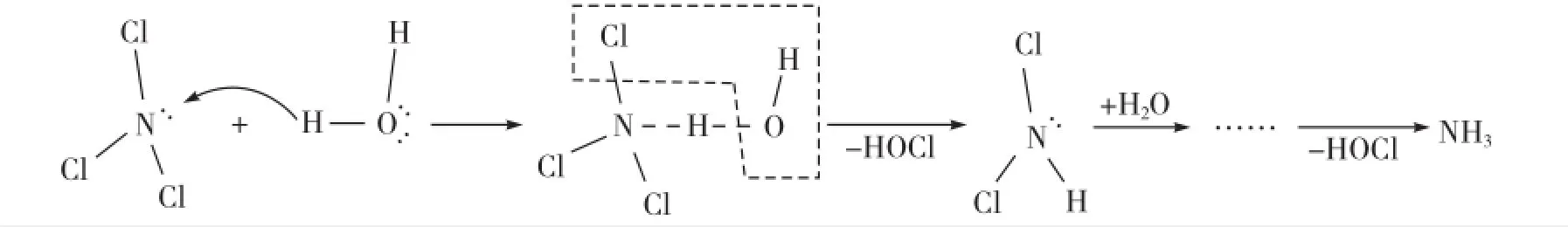
与SiCl4不同,NCl3的中心原子N具有孤对电子,发生的是亲电型水解反应,即水分子中的氢原子“进攻”中心原子N上的孤对电子,生成Cl3N…H…OH,然后再发生键的断裂,生成水解产物:NCl3+3H2O=NH3+3HClO。原理如下:
在CCl4中,由于C原子只能利用2s和2p轨道成键,成键数最多是4,已达到饱和,致使C原子无法接受水中氧原子的电子,因此不能发生水解。如果卤化物的中心原子尚未达到最高配位数(第二周期是4,第三、四周期是6,第五周期是8),则可水解。非金属卤化物的水解分为三种情况:①不与水反应。如:CCl4、CF4、SF6、SeF6等;②与水反应生成非金属含氧酸和卤化氢。如:BCl3、SiCl4、PCl5等;③与水反应生成非金属氢化物和卤素含氧酸。如:NCl3、Cl2O等。
5.为什么元素周期表中无论是同周期还是同主族,ⅤA~ⅦA元素氢化物的酸性都是随原子序数增大而增强?
通过比较ⅤA~ⅦA族元素氢化物水溶液的酸性可以发现:无论是同周期还是同主族,ⅤA~ ⅦA族元素氢化物水溶液的酸性都随原子序数增大而增强(HF>H2O>NH3;H2Te>H2Se>H2S;HI>HBr>HCl>HF)。这种变化规律可从热力学和物质结构两个方面解释。从热力学观点看,氢化物水溶液的酸性变化可用HX→H++X-的倾向大小表示,这种倾向的大小可由ΔG=ΔH-TΔS计算,然后再通过公式ΔG=-RTlnK可求得酸的电离平衡常数。利用上述方法可分别求得KHF=10-3、KHCl=108、KHBr=1010、KHI=1011,由此可知HF是弱酸,而HCl、HBr、HI是强酸,且酸性依次增强。另外,物质结构的方面可从与H直接相连的原子的电子密度角度加以解释:同周期的氢化物(NH3、H2O、HF),由于N、O、F的化合价逐渐降低,所带负电荷依次减少,电子密度越来越小,因此相应的氢化物酸性依次增强。同主族的氢化物(H2S、H2Se、H2Te)中,S、Se、Te的最外层电子数相同,而原子半径依次增大,导致其电子密度越来越小,因此相应的氢化物酸性逐渐增强。
6.物质为什么会显示不同的颜色?金属粉末为何多显黑色?
物质的颜色与它对光的选择性吸收、透过、反射、折射和散射有关。由于物质的本性和形态不同,对光的吸收、透过、反射等情况也就不同,物质因而呈现不同的颜色。当物质选择性吸收白光中某种波长的光时,就呈现出与之互补的颜色,即人们观察到的颜色。物质对光的选择性吸收是由物质的微观结构(即构成物质的分子或离子的电子层结构)决定的,特别是外层电子及其构型。当分子或离子的基态能量和各种激发态能量之差在可见光范围(ΔE=1.7~3.1 eV)内时,物质就会吸收可见光,使外层电子从基态跃迁到激发态,此时物质就会呈现出颜色。ΔE越小,物质的颜色越趋向紫色;ΔE越大,就越趋向红色。当ΔE<1.7 eV或ΔE>3.1 eV时,由于处于不可见光区,所以物质不显颜色。但物质的颜色还受光的散射、干涉、衍射等其他光学现象的影响,而这些光学现象又与物体颗粒大小、表面状态等因素有关,正因为如此,人们看到的颜色并不一定是物质直接反射或透射的光,而可能是经过光与物质反复作用或光与光相互作用的结果。金属粉末几乎都显黑色,就是由于金属粉末对反射光多次散射、吸收所造成的。
