红鳍东方鲀(Takifugu rubripes)干扰素调节因子2基因的克隆及原核表达
2016-06-23孙赛红马普孙鹤孔德荣李慧仇雪梅姜志强刘海映刘洋刘圣聪孟雪松王秀利
孙赛红马普孙鹤孔德荣李慧仇雪梅姜志强刘海映刘洋刘圣聪孟雪松王秀利
(1. 大连海洋大学 农业部北方海水增养殖重点实验室,大连 116023;2. 大连海洋大学水产与生命学院,大连 116023;3. 大连海洋大学海洋科技与环境学院,大连 116023;4. 大连天正实业有限公司,大连 116011)
红鳍东方鲀(Takifugu rubripes)干扰素调节因子2基因的克隆及原核表达
孙赛红1,2马普2孙鹤2孔德荣2李慧2仇雪梅2姜志强1刘海映3刘洋2刘圣聪4孟雪松4王秀利1,2
(1. 大连海洋大学 农业部北方海水增养殖重点实验室,大连 116023;2. 大连海洋大学水产与生命学院,大连 116023;3. 大连海洋大学海洋科技与环境学院,大连 116023;4. 大连天正实业有限公司,大连 116011)
干扰素调节因子(Interferon regulatory factor,IRF)是一种多功能的转录因子。采用反转录聚合酶链式反应(RT-PCR)和cDNA末端快速扩增(RACE)技术克隆了红鳍东方鲀干扰素调节因子2(Interferon regulatory factor 2,IRF2)基因的全长cDNA。该基因全长为1 552 bp,其中5'非编码区(5'-UTR)187 bp,3'非编码区(3'-UTR)429 bp,编码区(CDS)为936 bp,共编码311个氨基酸。将IRF2的编码区序列连接到原核表达载体pET32a(+),成功构建了重组体pET32a(+)-IRF2。将重组体pET32a(+)-IRF2转入大肠杆菌感受态细胞BL21(DE3)中,获得了重组表达IRF2的基因工程菌。经IPTG诱导,pET32a(+)-IRF2在BL21中得到了融合表达。通过对表达产物的纯化和Western blotting检测,结果显示红鳍东方鲀IRF2基因在大肠杆菌中的表达效果较高,目的蛋白准确。
红鳍东方鲀;干扰素调节因子2;cDNA末端快速扩增;原核表达
红鳍东方鲀(Takifugu rubripes),是一种重要的近海经济鱼类,由于其肉质细腻、味道鲜美深受人们的喜爱。然而,海水环境中存在的病菌和病毒致使鱼类的皮肤和黏膜不断受到侵袭,这些病原微生物侵入鱼体后导致鱼体发生病变甚至死亡[1],给红鳍东方鲀的大规模养殖造成严重的经济损失。
干扰素调节因子(Interferon regulatory factor,IRF)是一类结构上保守的转录因子家族,可分为4个亚家族:IRF1亚家族、IRF3亚家族、IRF4亚家族和IRF5亚家族[2]。所有IRF N端均包含一个由115个氨基酸残基构成的具有螺旋-转角-螺旋的DNA结合域(DNA binding domain,DBD)。IRF通过DBD结合到特定的DNA基序上[3],使其在转录调控[4]、免疫细胞(如树突状细胞、NK细胞和T细胞)的发育[5-7]、细胞因子的信号转导[8]及抗肿瘤[9]方面起到重要作用。因此对鱼类IRF的研究及其在鱼类疾病防治等方面的应用意义重大。
本研究利用cDNA末端快速扩增(RACE)技术获得了红鳍东方鲀IRF2基因的全长cDNA序列,通过基因重组,转化到大肠杆菌中表达,得到重组IRF2蛋白,旨在进一步研究重组红鳍东方鲀干扰素调节因子2蛋白活性及其在红鳍东方鲀健康养殖上的应用奠定基础。
1 材料与方法
1.1 材料
实验用健康红鳍东方鲀采自大连天正实业有限公司,日龄为266 d。采集红鳍东方鲀肾脏组织,并迅速冻存于液氮中,保存于-80℃超低温冰箱中备用。
1.2 方法
1.2.1 引物设计及合成 根据NCBI的RefSeq 数据库中的红鳍东方鲀干扰素调节因子2(IRF2)的预测序列(GenBank注册号:XM-003978691.1)(此序列的编码区不完整,其cDNA 缺少3'末端),利用生物信息学软件Primer Premier 5.0设计引物(表1)。3'-RACE CDS3用于cDNA第一链的合成,IRF2-GSP3/UPM用于3'-RACE 的PCR扩增,IRF2-NGSP3/NUP用于巢式PCR,F-IRF2/R-IRF2用于编码区(CDS)扩增。引物由生物工程(上海)股份有限公司合成。

表1 本研究所用引物
1.2.2 总 RNA的提取 从-80℃冰箱中取出红鳍东方鲀肾脏组织约0.1 g,按照RNAiso Plus试剂盒(TaKaRa公司)说明书的方法提取总RNA,1%的琼脂糖凝胶电泳检测总RNA的质量,-80℃下保存备用。
变速器内的油环、胶圈、铜套、阀芯其实是代表了油路的密封点和容易失效部位,依照这些关键点,我们就可以保证变速器内油路的完整性,并以系统科学的流程来找到故障根源。
1.2.3 红鳍东方鲀IRF2基因的 3'RACE 按照SMARTerTMRACE-Ready cDNA Amplification Kit说明书(北京全式金生物技术有限公司)将提取的总RNA进行反转录,合成3'-RACE-Ready cDNA。以此cDNA为模板进行第一轮PCR扩增,扩增条件为:94℃预变性5 min;94℃变性30 s,62℃退火30 s,72℃延伸2 min,共30个循环;72℃终延伸7 min。以上述PCR产物为模板,进行巢式PCR,扩增条件为:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸2 min,共30个循环;72℃终延伸7 min。PCR产物用1%琼脂糖凝胶检测,在凝胶成像系统中观察结果并拍照。
1.2.4 PCR产物的回收及测序 PCR产物的回收按照Agarose gel DNA Fragment Recovery Kit ver 2.0(生工生物工程股份有限公司)说明书操作。将回收产物与pMD19-T载体(TaKaRa公司)连接并转化到E.coli DH5α感受态细胞(TaKaRa公司)内,经氨苄青霉素和蓝白斑筛选后随机挑取3个阳性转化子进行菌落PCR鉴定,PCR产物送至生工生物工程(上海)股份有限公司测序。采用DNAstar软件对3'端测序结果和已知序列进行拼接,得到红鳍东方鲀IRF2基因的全长序列。
1.2.5 生物信息学分析 在ExPASy网站(http://web. expasy.org/protparam/)在线进行编码蛋白的理化性质分析;运用Signal P分析信号肽序列;采用GOR在线工具分析红鳍东方鲀IRF2蛋白的二级结构;利用clustalx软件进行多重序列比对分析并采用Mega 5.0软件构建进化树。
1.2.6 红鳍东方鲀IRF2基因原核表达载体的构建 根据IRF2基因ORF序列设计特异引物F-IRF2/ R-IRF2(表1),以3' RACE合成的cDNA为模板进行PCR,扩增条件为:94℃预变性5 min;94℃变性30 s,57℃退火30 s,72℃延伸30 s,共30个循环;72℃终延伸7 min。产物经1%琼脂糖凝胶检测后进行胶回收。将胶回收产物与pMD19-T载体16℃连接4 h,并转化到E.coli DH5α感受态细胞内,经氨苄青霉素和蓝白斑筛选,挑取阳性转化子扩大培养,提取质粒命名为pMD19-T-IRF2,并送至生工生物工程(上海)股份有限公司测序。以质粒pMD19-T-IRF2为模板,用引物F-IRF2/R-IRF2进行PCR扩增红鳍东方鲀IRF2编码区序列。参照Yuan等[14]的原核表达载体构建方法将PCR产物和表达载体pET-32a(+)(本实验室保存)分别进行NcoⅠ和XhoⅠ双酶切后用T4 DNA Ligase 连接,转化至E.coli DH5α感受态细胞内,挑取单菌落扩大培养后提取质粒,质粒经PCR及双酶切鉴定均为阳性后送至生工生物工程(上海)股份有限公司测序,测序正确的阳性重组质粒命名为pET32a(+)-IRF2。
1.2.7 红鳍东方鲀IRF2基因原核表达载体的诱导表达 测序鉴定正确的重组质粒pET32a(+)-IRF2转化至BL21(DE3)感受态细胞(本实验室保存),37℃培养过夜,按1∶100转接至100 mL LB培养基(含Amp)震荡培养。参考方珍珍等[15]原核表达载体的诱导方法,当菌液OD600为0.6左右时以1.0 mmol/L IPTG 37℃诱导4 h,取1 mL菌液离心弃上清,沉淀用100 μL PBS重悬,加入25 μL上样缓冲液煮沸10 min,SDS-PAGE电泳;鉴定目的蛋白的表达情况。
1.2.8 目的融合蛋白的分离纯化及Western blotting鉴定 将100 mL经IPTG诱导后的菌液6 000 r/min离心10 min,弃上清,用50 mL PBS重悬菌体;然后对其超声波破碎(750 W工作9 s,间歇9 s),12 000 r/min离心20 min,取上清;将上清过ProteinIsoTMNi-NTA Resin(全式金生物技术有限公司)纯化目的融合蛋白;将收集的洗脱液转入透析袋内,于PBS中4℃透析过夜;最后参照潘秋丽等[16]的方法将透析产物进行SDS-PAGE凝胶电泳检测。
参照张家林等[17]的Western blotting方法,将纯化的融合蛋白经SDS-PAGE,100 mA下2 h转印至NC膜上。然后将NC膜置于封闭液中浸泡30 min,加入His-tag抗体(天根生化科技有限公司)孵育1 h,加入羊抗鼠IgG-HRP(天根生化科技有限公司)孵育30 min。以上各步骤之间用PBS缓冲液清洗3次,每次10 min。加入显色液显色(约10 min),至目标条带出现后用超纯水清洗终止显色。
2 结果
2.1 RNA提取结果
提取得到红鳍东方鲀肾脏总RNA后,1%琼脂糖凝胶电泳检测,见图1。总RNA 28S RNA和18S RNA条带清晰,经紫外可见分光光度计检测,总RNA满足实验要求。
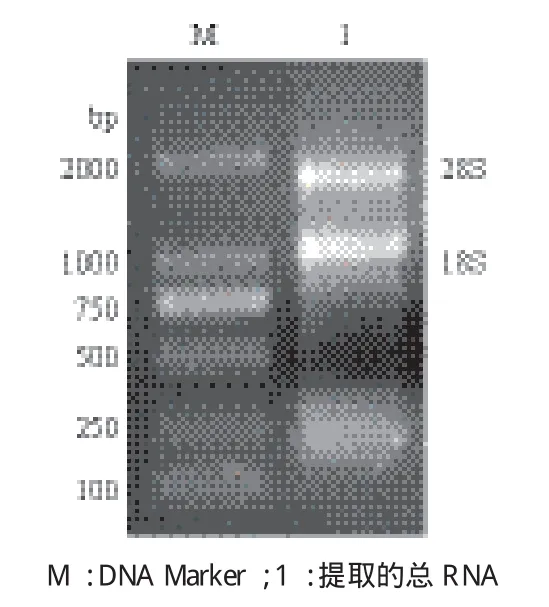
图1 红鳍东方鲀肾脏总RNA
2.2 3'RACE扩增结果
巢式PCR产物经1%琼脂糖电泳(图2),得到了3条清晰条带,大小约为1 000 bp、600 bp和400 bp,其中400 bp左右的条带与预期大小不符,将1 000 bp和600 bp左右的两条带分别切胶回收、克隆与测序,600 bp左右的条带与已知序列可拼接上,长度为581 bp。
2.3 红鳍东方鲀IRF2基因的序列分析
将3' RACE扩增序列与已知部分序列( GenBank注册号:XM-003978691.1)进行拼接得到IRF2的全长cDNA。该基因的cDNA为1 552 bp,其中5'非编码区为187 bp,3'非编码区为429 bp(包含24 bp的Poly A尾),编码区共936 bp,编码311个氨基酸,见图3。已将克隆的红鳍东方鲀IRF2的cDNA序列递交到GenBank数据库,序列注册号为:KF853391。对应的IRF2编码蛋白(GenBank注册号为:AHI85770)的分子量为35.5 kD,等电点为6.56。信号肽预测结果显示无信号肽。
采用GOR在线工具分析TrIRF2氨基酸序列的蛋白二级结构(图4),主要由无规则卷曲、α-螺旋和β折叠3种二级结构原件组成,其中无规则卷曲所占的比例最高,为56.91%(177个氨基酸),延伸链(反平行的折叠形态)占30.87%(96个氨基酸),α-螺旋最少,仅占12.22%(38个氨基酸)。
通过Blast 比对发现所获得的红鳍东方鲀IRF2氨基酸序列与其他物种IRF2氨基酸序列有较高相似性(表2),其中与鳜鱼的相似度最高,达到79%,与乌鳢、斜带石斑鱼等的相似性也均在60%以上。采用Neighborhood-Joining 法构建进化树,结果(图5)显示红鳍东方鲀IRF2与鮸鱼IRF2聚为一支,说明二者亲缘关系最近。
2.4 红鳍东方鲀IRF2基因原核表达载体pET32a(+)-IRF2的鉴定
对重组质粒pET32a(+)-IRF2进行双酶切鉴定,结果(图6)显示,酶切片段长度为957 bp,与预期结果一致,表明成功构建了pET32a(+)-IRF2原核表达载体。将含有目的基因的ORF序列片段的重组质粒进行测序,测序分析表明,IRF2基因已正确连接到pET32a(+)。
2.5 红鳍东方鲀IRF2基因在大肠杆菌BL21(DE3)中的诱导表达
与pET32a(+)空载相比,重组质粒pET32a(+)-IRF2在BL21(DE3)中表达的蛋白图谱明显多出一条特异的诱导表达条带(图7),大小在53.8 kD左右,说明在BL21(DE3)中表达出IRF2融合蛋白。另外,在未诱导的BL21(DE3)菌株里也有少量目的蛋白的表达,这可能是由于pET表达系统中存在目的蛋白的本底表达造成的。除去融合标签蛋白,可推算出实际诱导表达的红鳍东方鲀IRF2蛋白的分子量为35.5 kD,与理论值一致。
2.6 融合蛋白的纯化和Western blot分析结果
利用重组蛋白内含有的His标签,对目的融合蛋白进行纯化,纯化后的蛋白经透析过夜后,进行SDS-PAGE凝胶电泳检测,所得条带比预期目的条带(53.8 kD)稍微偏高(图8),这可能是由于His标签中的碱性氨基酸导致蛋白在电泳过程中移动较慢产生的误差。

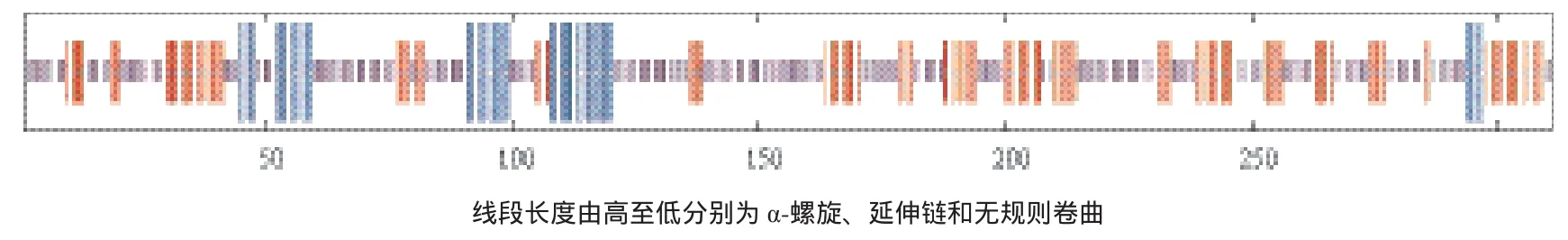
图4 红鳍东方鲀IRF2的二级结构预测
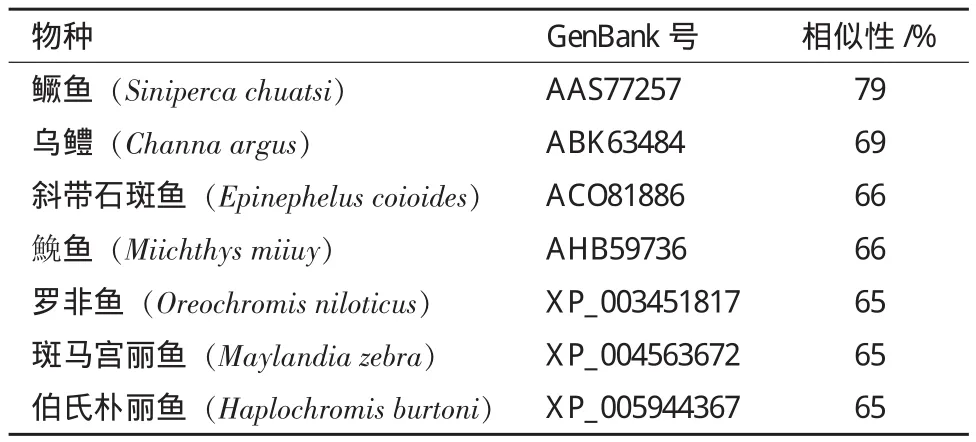
表2 部分物种与红鳍东方鲀IRF2氨基酸序列的相似性
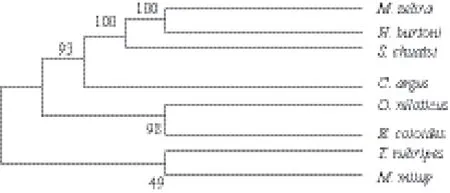
图 5 红鳍东方鲀IRF2系统进化树
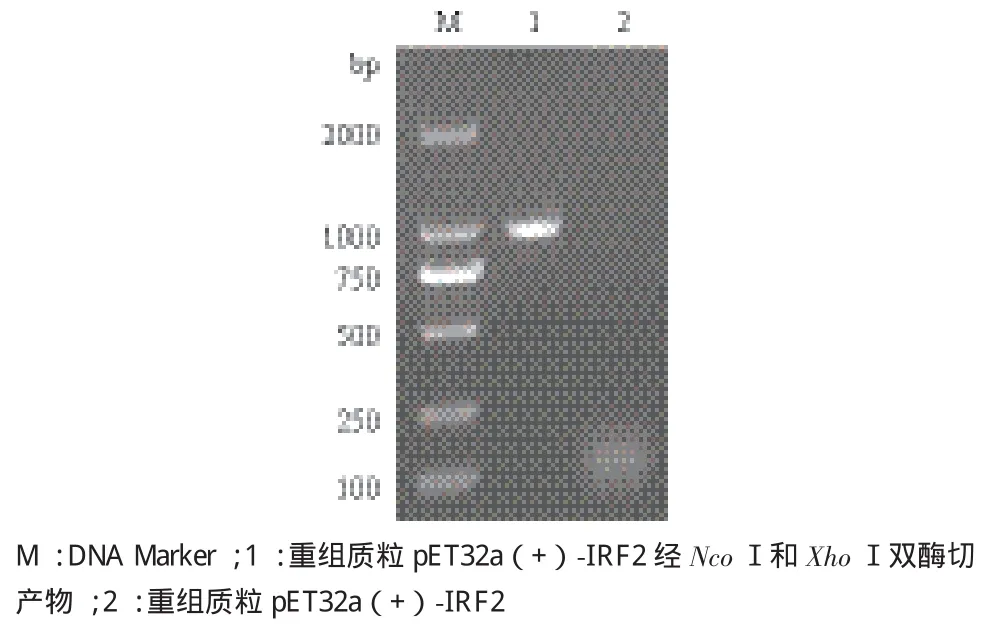
图6 重组质粒pET32a(+)-IRF2的双酶切鉴定
将纯化得到的的IRF2融合蛋白转印到NC膜上经过与抗体发生特异性反应,得到一条与预期的融合蛋白大小相符的特异条带(图9),由此可推断已成功表达出红鳍东方鲀IRF2蛋白。
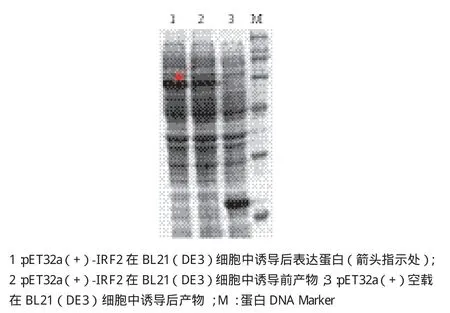
图7 表达蛋白的SDS-PAGE分析
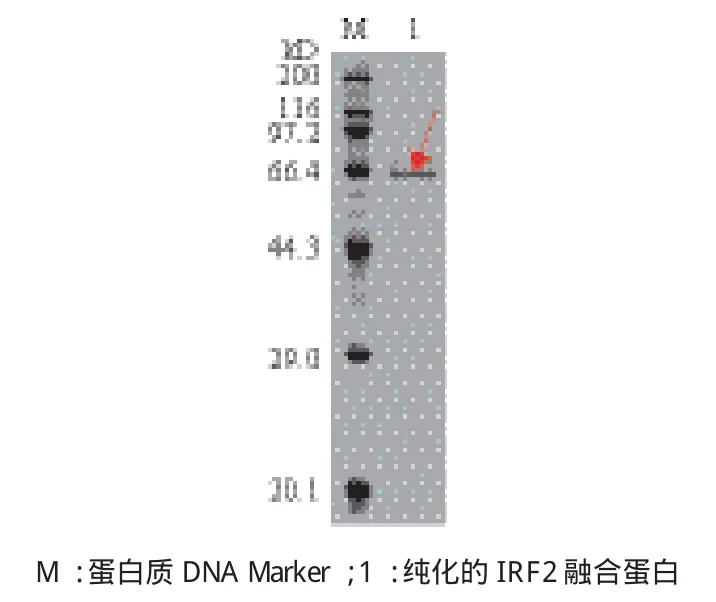
图8 纯化的IRF2融合蛋白的SDS-PAGE分析
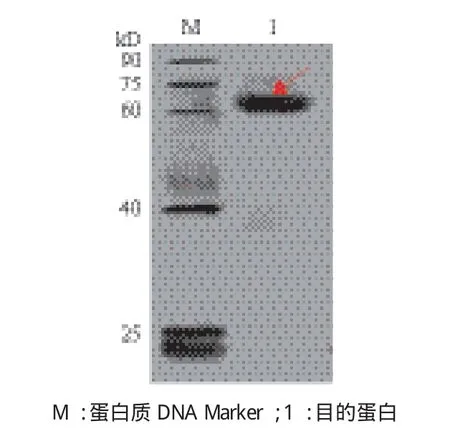
图9 Western blot 分析结果
3 讨论
本研究克隆得到的红鳍东方鲀IRF2全长cDNA为1 552 bp,其编码区共936 bp,编码311个氨基酸,与鳜鱼[10]IRF2(编码299个氨基酸)的相似度最高,达79%。而虹鳟鱼[11]IRF2的ORF长1 035 bp,编码344个氨基酸。大西洋鲑[12]IRF2氨基酸长度为343个氨基酸,含有DBD和IAD2两个结构域。经过多重序列比对分析发现,红鳍东方鲀IRF2与其他物种一样,在其N末端具有一个DNA结合域(DBD)和一个IRF结合域2(IAD2);在其C末端具有一个转录抑制域(TRD),这3个区域非常保守,这与陈晓玲等[18]克隆的褐牙鲆IRF2的序列特征一致。
大肠杆菌因其遗传背景清楚、表达量高和价格低廉等优点,现已有多种以大肠杆菌为表达系统的重组蛋白应用于生产。有关IRFs的体外重组表达,崔鹏飞等[19]将鸡IRF7基因与pET30a连接,在BL21(DE3)中融合表达该蛋白,并将纯化的重组蛋白chIRF7免疫小鼠,制备出鼠抗chIRF7蛋白多克隆抗体。尹经逵等[20]克隆了斜带石斑鱼Epinephelus coioides的IRF1基因,并通过原核表达的方法得到了以可溶性蛋白和包涵体两种形式存在的重组蛋白。张跃等[21]构建了牙鲆Paralichthys olivaceus IRF的表达载体pBVfIRF22,在大肠杆菌中诱导表达后得到一条分子量约12 kD的特异蛋白。本研究在克隆到红鳍东方鲀IRF2基因并对其进行生物信息学分析的基础上,进行了红鳍东方鲀IRF2基因的重组表达。诱导表达的重组蛋白以可溶性形式存在,避免了对蛋白的变性、复性,便于今后对蛋白活性的研究。在进行SDS-PAGE凝胶电泳检测时发现目的条带条带比预期大小稍微偏高,这可能是由于His标签中的碱性氨基酸导致蛋白在电泳过程中移动较慢产生的误差[22]。采用His标签抗体对诱导表达的蛋白进行的Western blotting检测表明重组载体按照正确的翻译框架翻译并表达出His标签和目的蛋白,进一步证明了目的蛋白的准确性。
4 结论
本研究克隆了红鳍东方鲀干扰素调节因子2(IRF2)基因,编码区全长为936 bp,共编码311个氨基酸。构建的重组表达载体pET32a(+)-IRF2经转化和诱导后在大肠杆菌BL21中得以表达。Western blotting分析证明,利用Ni柱分离和纯化得到的融合蛋白即为重组的红鳍东方鲀IRF2。
[1]张文革. 红鳍东方鲀常见病害及防治[J]. 渔业致富指南, 2002, 11:34.
[2]Nguyen H, Hiscott J, Pitha PM. The growing family of interferon regu latory factors[J]. Cytokine Growth Factor Rev, 1997, 8(4): 293-312.
[3]Paun A, Pitha PM. The IRF family, revisited[J]. Biochimie, 2007, 89(6-7): 744-753.
[4]Sato M, Taniguchi T, Tanaka N. The interferon system and interferon regulatory faetor transcription factors——studies from gene knoekout mice[J]. Cytokine Growth Factor Rev, 2001, 12:133-142.
[5]Tsujimura H, Tamura T, Gongora C, et al. ICSBP/IRF-8 retrovirus transduction rescues dendritic cell development in vitro[J]. Blood, 2003, 101:961-969.
[6]Stellacci E, Testa U, Petrucci E, et al. Interferon regnlatory faetor-2 drives megakaryocytic differentiation[J]. Biochem J, 2004, 377:367-378.
[7]Lohoff M, Dunean GS, Ferrick D, et al. Deficieney in the transcription factor interferon regulatory factor(IRF)-2 leads to severely compromised development of natural killer and T helper type l cells[J]. J Exp Med, 2000, 192:325-336.
[8]Negishi H, Fujita Y, Yanai H, et al. Evidence for licensing of IFN-gamma-induced IFN regulatory factor 1 transcription factor by MyD88 in Toll-like receptor-dependent gene induction program[J]. Proc Natl Acad Sci USA, 2006, 103(41):15136-15141.
[9]Doherty GM, Boucher L, Sorenson K et al. Interferon regulatory factor expression in human breast cancer[J]. Ann Surq, 200 1, 233(5):623-629.
[10]Sun B, Chang M, Chen D, et al. Gene structure and transcription of IRF2 in the mandarin fish Siniperca chuatsi with the finding of alternative transcripts and microsatellite in the coding region[J]. Immunogenetics, 2006, 58(9): 774-784.
[11]Collet B, Hovens GC, Mazzoni D, et al. Cloning and expression analysis of rainbow trout Oncorhynchus mykiss interferon regulatory factor 1 and 2 (IRF-1 and IRF2)[J]. Dev Comp Immunol, 2003, 27(2): 111-126.
[12]Bergan V, Kileng O, Sun B, et al. Regulation and function of interf eron regulatory factors of Atlantic salmon[J]. Mol Immunol, 2010, 47(11-12): 2005-2014.
[13]Shi Y, Zhao Z, Yin JK, et al. Interferon regulatory factor-2 in orang espotted grouper ( Epinephelus coioides): Gene, inductive express ion pattern and subcellular localization[J]. Comparative Biochem istry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 155(2): 110-117.
[14]Yuan Y, Wang XL, Guo SP, et al. Gene cloning and prokaryotic expression of recombinant flagellin A from Vibrio parahaemolyticus[J]. Chinese Journal of Oceanology and Limnology, 2010, 28(6):1254-1260.
[15]方珍珍, 景宏丽, 江育林, 等. 草鱼呼肠孤病毒VP5蛋白的表达与纯化[J]. 大连海洋大学学报, 2012, 27(6):508-512.
[16]潘秋丽. 牙鲆三个白介素基因的半定量表达谱及白介素6的原核表达研究[D]. 大连:大连海洋大学, 2011.
[17]张家林, 李强, 叶世根, 李华. 鲤春病毒血症病毒糖蛋白的原核表达及单克隆抗体的制备[J]. 大连海洋大学学报, 2014, 29(5):454-458.
[18]陈晓玲. 大菱鲆干扰素调节因子8(IRF-8)以及褐牙鲆IRF-2和IRF-8的分子特征及其诱导表达分析[D]. 青岛:中国海洋大学, 2013.
[19]崔鹏飞, 邓国华, 韦良孟, 等. 鸡干扰素调节因子7的原核表达及多克隆抗体的制备. [J]动物医学进展, 2013, 34(4):1-4.
[20]尹经逵, 史燕, 朱新平. 斜带石斑鱼干扰素调节因子1基因的克隆及其原核表达[J]. 中国水产科学, 2009, 16(5):668-677.
[21]张跃, 白俊杰, 李英华,等. 牙鲆干扰素调节因子核心区序列的克隆及初步表达[J]. 中国水产科学, 2001, 8(2):10-13.
[22]唐威华, 张景六, 王宗阳, 等. SDS-PAGE法测定His-tag融合蛋白分子量产生偏差的原因[J]. 植物生理学报, 2000, 26(1):64-68.
(责任编辑 李楠)
Cloning and Prokaryotic Expression of Interferon Regulatory Factor 2 from Takifugu rubripes
Interferon Regulatory Factor(IRF)is a transcription factor with multifunctions. The full length cDNA of Takifugu rubripes interferon regulatory factor 2(IRF2)was cloned by RT-PCR and rapid amplification of cDNA ends(RACE). The full-length cDNA of the gene was 1 552 bp,including a 187 bp 5' non-coding region,a 429 bp 3' non-coding region,and 936 bp coding region,and it encoded 311 amino acids. The recombinant pET32a(+)-IRF2 was constructed by ligating code sequence of IRF2 with prokaryotic expression vector pET32a(+). Then,the recombinant genetic engineering bacteria with expressed IRF2 were obtained by transforming pET32a(+)-IRF2 into competent cell Escherichia coli BL21(DE3). pET32a(+)-IRF2 was expressed in BL21 under the induction of IPTG. The results from the detection of the purified products by Western blotting showed that the expression of the IRF2 gene in E. coli was high,and the target protein was accurate.
Takifugu rubripes;interferon regulatory factor 2;rapid amplification of cDNA end;prokaryotic expression
10.13560/j.cnki.biotech.bull.1985.2016.05.014
2015-05-25
国家海洋公益性行业科研专项经费项目(201405003-2),大连市科技计划项目(2014B11NC091)
孙赛红,女,硕士,E-mail:sun.saihong@163.com
王秀利,男,博士,教授,研究方向:海洋动物功能基因;E-mail:xiuliwang417@sina.com
SUN Sai-hong1,2MA Pu2SUN He2KONG De-rong2Li Hui2QIU Xue-mei2JIANG Zhi-qiang1LIU Hai-ying3LIU Yang2LIU Sheng-cong4MENG Xue-song4WANG Xiu-li1,2
(1. Key Laboratory of Mariculture &Stock Enhancement in North China’s Sea,Ministry of Agriculture,Dalian Ocean University,Dalian 116023;2. College of Fisheries and Life Science,Dalian Ocean University,Dalian 116023;3.College of Marine Science and Environment,Dalian Ocean University,Dalian 116023;4. Dalian Tianzheng Industrial Co. Ltd.,Dalian 116011)
