常规磁共振对裸鼠成像的可行性及参数优化
2016-06-23龚明福王卫斌舒通胜
陈 佳,龚明福,杨 华,王卫斌,刘 云,杨 柳,舒通胜
(1.第三军医大学新桥医院放射科,重庆 400037;2.解放军第四二五医院放射科,海南 三亚 572212)
常规磁共振对裸鼠成像的可行性及参数优化
陈 佳1,龚明福1,杨 华1,王卫斌2,刘 云1,杨 柳1,舒通胜1
(1.第三军医大学新桥医院放射科,重庆 400037;2.解放军第四二五医院放射科,海南 三亚 572212)
目的 探讨临床常规磁共振在裸鼠成像中的可行性。方法 采用小关节线圈及专用小动物线圈对裸鼠肝脏进行MR成像,根据伪影、均匀度与对比度,评价两种线圈对裸鼠成像的质量。对裸鼠进行T1mapping和T2mapping成像,根据肝脏的T1、T2值确定扫描序列中的TE值,然后采用浮动的TR值进行扫描,最后调整扫描的其它参数实现序列的优化。结果 在FSE T1WI、SE T1WI、FSE T2WI、GRE T2*WI序列中,小动物线圈和3英寸双环形线圈的图像质量评分分别为2.6±0.54、3.2±0.84、2.6±0.89、2.4±0.55和3.6±0.55、3.8±0.45、3.2±0.84、2.6±0.55,小动物线圈图像的信噪比明显高于3英寸双环形线圈(P< 0.05)。经过序列优化后,图像的细节分辨率,对比度明显提高,图像信号显示更均匀。结论 通过线圈的优选及序列的优化,常规临床磁共振可以进行活体裸鼠磁共振成像。
磁共振成像;裸鼠;可行性;线圈;参数优化
裸鼠是医学研究中重要的的实验动物模型,磁共振成像是观察动物模型的重要方法。常规磁共振仍是目前国内小动物研究的重要成像手段,但由于裸鼠体积小,以常规的方法进行成像,图像质量往往较差,对模型不能满意评价。通过选择合适的成像线圈、优化磁共振扫描序列及扫描参数,有望提高小动物成像质量。本研究采用小关节线圈及专用小动物线圈对裸鼠肝脏进行MR成像,并对成像序列的参数进行优化,以期观察常规磁共振对裸鼠成像实用价值。
1 材料与方法
1.1 线圈的选择 健康成年裸鼠5只,2%戊巴比妥钠按50 mg/kg的剂量进行腹腔注射麻醉,采用自制的裸鼠固定器固定。将裸鼠俯卧位头先进置于扫描床上,在裸鼠于固定架之间的间隙内轻轻放入棉球,在保暖的同时固定裸鼠,降低裸鼠的呼吸运动。先后分别采用3英寸双环形线圈和正交小动物专用线圈于3.0 T磁共振扫描仪扫描,视野(FOV):6 cm×8 cm,矩阵128×256,层厚2 mm,间隔0~0.2 mm,激励次数(NEX)2次。扫描序列及参数为快速自旋回波(FSE)T1WI(TR/TE=380/16.7 ms),自旋回波(SE)T1WI(TR/TE=380/30 ms),快速自旋回波(FSE)T2WI(TR/TE=2000/60.8 ms)和梯度回波(GRE)T2*WI(TR/TE=400/9 ms,FA=20°)。扫描前先对梯度线圈进行匀场,扫描过程中保证裸鼠绝对不动。选取肝脏及背景区进行信号测量,感兴趣区大小约6 mm2,计算信号/噪声比(SNR),结合图像的伪影、均匀度和对比度,评价两个线圈对裸鼠成像的质量。SNR计算公式如下:SNR=S肝-S背/Sd,其中S肝为肝实质信号强度,S背为背景噪声,Sd肝实质信号标准差。图像的均匀度及对比度由两名有经验的磁共振医师进行分析评分,意见分歧时协商达成一致。图像质量采用4级评分标准:Ⅰ级,无伪影,信号均匀,脉管系统与肝实质之间对比度好,整个图像质量好,4分;Ⅱ级,无明显的伪影,对比度较好,图像较均匀,3分;Ⅲ级,边缘可见伪影,图像均匀度一般,图像显示较模糊,2分;Ⅳ级,伪影较明显,图像信号不均匀,严重影响信号测量,图像质量差,1分。最后计算同一线圈同一序列在5只裸鼠的信噪比及评分的均值。
1.2 序列及参数优化 在确定好优选线圈以后,对裸鼠模型的扫描序列进行优化。首先对裸鼠进行T1mapping和T2mapping成像,T1mapping参数为:TR =150 ms、300 ms、600 ms、1200 ms,TE=10 ms,T2mapping参数为:TR=2000 ms,TE=13.7 ms、27.4 ms、41.1 ms、54.8 ms、68.6 ms、82.3 ms、96 ms、109.7 ms。扫描范围覆盖肝脏,在GE公司ADW4.4工作站上采用Functool软件包分析测量肝脏的T1、T2值,根据肝脏的T1、T2值来确定扫描序列中的TE值,然后采用多组TR值进行扫描,扫描方位包括冠状位及轴位,观察图像质量,并记录下扫描时间。最后调整NEX、层厚、层间距等参数,观察图像质量并记录扫描时间。扫描过程、图像观察及分析方法同前。
1.3 统计学方法 采用SPSS 13.0统计软件进行数据处理。计量资料以均数±标准差表示,组间比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 参数的确定 肝脏的T1值约785 ms,高于邻近肌肉的T1值(约528 ms),肝脏的T2值约50 ms,较邻近肌肉的T2值(约30 ms)延长,再以其标准通过浮动TR的方式来获取最佳的参数搭配,我们推荐对裸鼠扫描时采用如下参数:轴位SE T1WI: TR=380 ms,TE=14 ms,NEX=2,Thickness/Space=2.0 mm/0.2 mm;轴位FSE T2WI:TR=3000 ms,TE=65 ms,NEX=3,Thickness/Space=2.0 mm/0.2 mm;轴位GRE T2*WI: TR=540 ms,TE=10 ms,NEX=2,Thickness/Space=2.5 mm/0.5 mm,FA=20°;轴位T2mapping:TR=2400 ms,TE=13.7 ms-109.7 ms,NEX=2,Thickness/Space=2.0 mm/0.2 mm。
2.2 图像质量及评分 图像信噪比及图像质量评分见表1。两种线圈在所有序列采集的图像均能满足观察要求,评分均在2分以上,采用小动物线圈图像的信噪比明显高于3英寸双环形线圈(P< 0.05)。在小动物线圈中,图像的细节分辨率,对比度明显提高,图像信号显示较均匀(图1)。

表1 3英寸双环形线圈和正交小动物专用线圈所得图像信噪比及图像质量评分
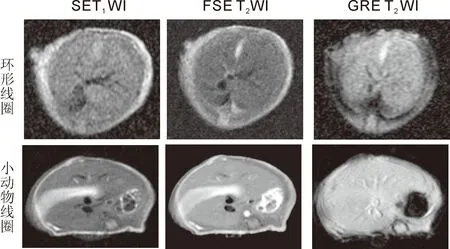
图1 3英寸双环形线圈和正交小动物专用线圈采集裸鼠肝脏图像比较
3 讨论
裸鼠是医学研究中重要的的实验动物模型,尤其在免疫学、肿瘤学等方面有着特殊的价值。了解疾病的发生、发展过程需要我们纵向、动态的观察疾病的状态,这就要求有一个可靠的、无创的检测方法,这个方法至少要满足以下几个标准:①具有足够的空间分辨率和信噪比;②具有足够的对比度以便观察不同组织的形态;③有较高的时间分辨率[1]。
MRI具有极好的软组织分辨率,同时具有较高的时间及空间分辨力,使其成为小动物形态学研究重要的检测工具,尤其是在啮齿类动物(如小鼠、裸鼠)的研究中。近来,MRI已成为临床必不可少的影像检查方法,并且其在临床前研究中的地位也越来越受到重视[2]。然而,由于小鼠太小,所引起的弛豫信号太弱(一只25 g的小鼠,相对一个60 kg的人来说,其信号要弱2500倍),给MRI成像带来了很大的技术挑战。采用同样的硬件,观察人体为10 mm3的体素,在小鼠就变为0.0025 mm3了[3]。
为了解决这个问题,人们开发出场强为4~21 T的小动物专用磁共振成像仪,它可以对小动物进行全面的检测,包括磁共振波谱以及功能磁共振检查等,目前这些机型已经商业化[3]。尽管这些小动物专用磁共振机在高级别的专有实验室内发挥了重要作用,它仍然超出了绝大多数实验室的应用范围。小动物专用磁共振的主要缺点在于其价格昂贵,需要单独占用专门的实验室,需要专门的维护和操作人员,常规科研机构难以支撑。随着近年来动物实验的广泛开展,越来越多的中、低层科研单位也在进行活体动物的MR成像。为了克服专用磁共振的高消费的问题,越来越多的研究人员采用临床常规磁共振进行小动物成像。
对于临床常规MR机器而言,在外磁场恒定的前提下,如何能挖掘这种磁共振的最大能力,扫描得到满足实验需要的图像,是研究人员关心的主要问题。这需要对线圈及磁共振序列进行优化选择[4,5]。目前,大多数基层科研机构采用表面线圈及相控阵线圈进行小动物实验,表面线圈能最大限度接近被检器官,使其充填因子增加,有助于提高MR图像分辨率及信噪比,磁场的不均匀性是采用表面线圈成像的一大缺点,靠近线圈的部位信号强,远离线圈的部位信号会减弱。相控阵列线圈多由多个表面线圈阵列组成的,相对于普通正交线圈,相控阵线圈的信噪比会增加,但常规的相控阵线圈动物实验时填充因子低,不能获得满意的信噪比。小动物专用正交线圈则融合表面线圈和相控阵线圈的优点,它采用相控阵线圈的设计方法,在外形尺寸上最大限度地贴合相应小动物的体表,能达到柔性表面线圈的填充因数,而其中多个小线圈分别接受小区域的磁共振信号,在保证磁场均匀性的同时,能进一步增加图像的信噪比[6]。在本研究中,我们通过T1mapping和T2mapping成像获取了靶区的T1、T2值,以T1、T2值为参考确定TE时间能最大限度的提高靶区的对比度,在此基础上再调整TR值能在提高图像质量的同时,减少试验摸索的次数。
[1] Benveniste H,Blackband S.MR microscopy and high resolution small animal MRI: applications in neuroscience research [J].Progress in neurobiology,2002,67(5): 393-420.
[2] Pillai DR,Heidemann RM,Kumar P,et al.Comprehensive small animal imaging strategies on a clinical 3 T dedicated head MR-scanner; adapted methods and sequence protocols in cns pathologies [J].PloS one,2011,6(2): e16091.
[3] Johnson GA,Cofer GP,Fubara B,et al.Magnetic resonance histology for morphologic phenotyping [J].Journal of Magnetic Resonance Imaging,2002,16(4): 423-429.
[4] 韩鸿宾.掌握磁共振成像序列设计,合理科学运用 MR 技术解决临床与科研工作中的实际问题 [J].中国医学影像技术,2004,20(7): 979-980.
[5] Brockmann MA,Kemmling A,Groden C.Current issues and perspectives in small rodent magnetic resonance imaging using clinical MRI scanners [J].Methods,2007,43(1): 79-87.
[6] 张安君,赵喜,王国年,等.小孔径正交相控阵线圈与临床表面柔性线圈小动物 MRI 成像质量的比较研究 [J].中国中西医结合影像学杂志,2010,8(3): 196-198.
R814.42
A
1672-6170(2016)03-0108-03
2015-09-20;
2015-11-30)
