P16、CyclinD1、PTEN在皮肤基底细胞癌中的表达及意义
2016-06-23严丹,李灵
严 丹,李 灵
(1.成都市第二人民医院皮肤科,四川 成都 610072;2.四川省医学科学院·四川省人民医院皮肤性病研究所,四川 成都 610072)
P16、CyclinD1、PTEN在皮肤基底细胞癌中的表达及意义
严 丹1,李 灵2
(1.成都市第二人民医院皮肤科,四川 成都 610072;2.四川省医学科学院·四川省人民医院皮肤性病研究所,四川 成都 610072)
目的 探讨P16、CyclinD1、PTEN表达与皮肤基底细胞癌(BCC)发生发展的关系。方法 在40例BCC、15例正常皮肤组织中用免疫组化EnVision染色法检测P16、CyclinD1、PTEN的表达情况;用专业图像分析软件(image pro plu6.0,IPP 6.0)进行半定量分析,采用平均光密度值(optical density mean)评价阳性表达结果。结果 与正常皮肤组织比较,皮肤BCC相关组织中P16、PTEN密度值低,CyclinD1的表达明显增高,差异有统计学意义(P< 0.05)。BCC组织中,CyclinD1表达与P16、PTEN负相关(r=-0.502,r=-0.557,P<0.05),P16与PTEN正相关(r=0.758,P<0.05)。结论 P16、PTEN的低表达及CyclinD1的高表达在皮肤BCC的发生、发展中起重要作用。P16、CyclinD1与PTEN三者中的两两相关关系提示了癌基因与抑癌基因的相互协调、相互促进可能是BCC早期分子事件。
P16; CyclinD1; PTEN;
皮肤基底细胞癌(cutaneous basal cell carcinoma,BCC)是人类最常见的皮肤恶性肿瘤,占所有皮肤恶性肿瘤的64%~75%,其发生、发展是多步骤、多因素共同参与的复杂过程。癌基因与抑癌基因的相互协调及促进已成为近年来研究的热点之一。本实验采用免疫组织化学EnVision染色法对BCC中P16、 CyclinD1和PTEN多个基因的表达产物进行分析研究,旨在更深入了解BCC的发生发展,为临床上BCC的诊疗提供参考。
1 资料与方法
1.1 一般资料 四川省人民医院病理科2008~2012年皮肤基底细胞癌组织病理活检蜡块40例,所有标本经由病理科医师核实诊断,均有完整随访资料。其中男 27例,女13例,年龄33~92岁[(61.40±12.60)岁]。其中面部24例,颈部3例,耳部2例,背部及头皮各2例,胸部、腹部各3例,阴茎1例。另选15例手术切除BCC边缘的皮肤组织,作为对照组,经病理医师诊实为正常皮肤组织。
1.2 仪器和试剂 Olympus 光学显微镜;数码相机(model DMLA,Leica Inc,德国);image pro plu6.0图像分析软件(Media Cybernetics公司,美国);P16鼠抗人单克隆抗体(Neomaeker公司,美国); CyclinD1兔抗人单克隆抗体ZA-0101;PTEN鼠抗人单克隆抗体ZM-0221;Envision及DAB显色试剂盒(Dako公司,丹麦)。
1.3 免疫组化方法 将蜡块常规连续切成4 μm厚共4张。1张进行HE染色,其余3张采用免疫组化EnVision染色法。严格按照试剂盒说明方法进行免疫组化染色,所有切片表片、脱水、染色均在相同条件下进行,以已知阳性的皮肤BCC组织作为阳性对照,PBS代替一抗作为阴性对照。
1.4 图像收集分析方式 根据Kraan等[1]采用计算机图像分析系统分别对免疫组化染色切片进行半定量分析。建立统一的图像采集、分隔及处理标准,每次均在开机后20分钟后,在显微镜下相同的曝光时间放大20倍物镜下采集图像。在更换视野或切片时,除了对焦,其他所有的操作都不能有变化。从每张切片中选取一有代表性区域,选取5个不重叠高倍视野,用IPP图像分析软件测定其面积(area)及累积光密度(IOD),累积光密度除以面积得到平均光密度,将平均光密度值作平均及标准差进行统计分析。
1.5 结果判定 P16蛋白染色阳性为细胞核或者浆内出现棕黄色颗粒状物质,其着色度明显比背景非特异染者要深;PETN阳性细胞浆和细胞核为出现深黄或棕黄颗粒; CyclinD1阳性为细胞核与细胞浆内出现深黄或棕黄颗粒,且着色程度明显比非特异性染色要高。
1.6 统计学方法 采用SPSS 20.0统计学软件进行数据分析。计量资料以均数±标准差表示,组间比较采用t检验。关联性分析采用秩相关检验。P< 0.05为差异有统计学意义。
2 结果
2.1 P16染色阳性细胞分布 P16阳性着色呈黄色或棕黄色,表达定位于胞浆或胞核,见图1。癌组织中未见P16表达,癌旁组织正常表皮中可见少量的阳性表达,正常表皮见强阳性表达。
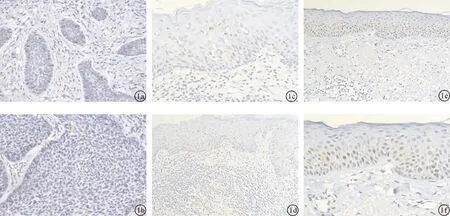
图1 P16免疫组化染色 a:BCC(×100);b:BCC(×200);c:癌旁正常皮肤组织(×100);d:癌旁正常皮肤组织(×200);e:正常表皮组织(×100);f:正常表皮组织(×200)
2.2 CyclinD1染色阳性细胞分布 CyclinD1阳性着色呈明显的黄色及棕黄色,表达定位于细胞核及胞浆,见图2。癌组织中可见CyclinD1的强阳性表达,癌旁组织正常表皮中可见少量阳性表达,正常表皮中未见CyclinD1的阳性表达。
2.3 PTEN染色阳性细胞分布 PTEN阳性着色呈黄色或棕黄色,表达定位于细胞核及胞浆,见图3。癌组织中见PTEN不表达或弱阳性表达,癌旁组织表皮及正常表皮可见PTEN的阳性表达。
2.4 P16、CyclinD1、PTEN在正常皮肤组织及BCC中的表达 基底细胞癌与正常组织中P16、CyclinD1、PTEN三者的表达比较,差异均有统计学意义(P< 0.05),见表1。

图2 CyclinD1免疫组化染色 a:BCC(×100);b:BCC(×200);c:癌旁正常皮肤组织(×100);d:癌旁正常皮肤组织(×200);e:正常表皮组织(×100);f:正常表皮组织(×200)

图3 CyclinD1免疫组化染色 a:BCC(×100);b:BCC(×200);c:癌旁正常皮肤组织(×100);d:癌旁正常皮肤组织(×200);e:正常表皮组织(×100);f:正常表皮组织(×200)
2.5 P16、CyclinD1、PTEN在BCC中关系 P16和CyclinD1的平均光密度值之间呈负相关(r=-0.497,P<0.05),PTEN 和CyclinD1的平均光密度值呈负相关(r=-0.546,P< 0.05);PTEN 和P16的平均光密度值呈正相关(r=0.742,P<0.05);见图4~6。
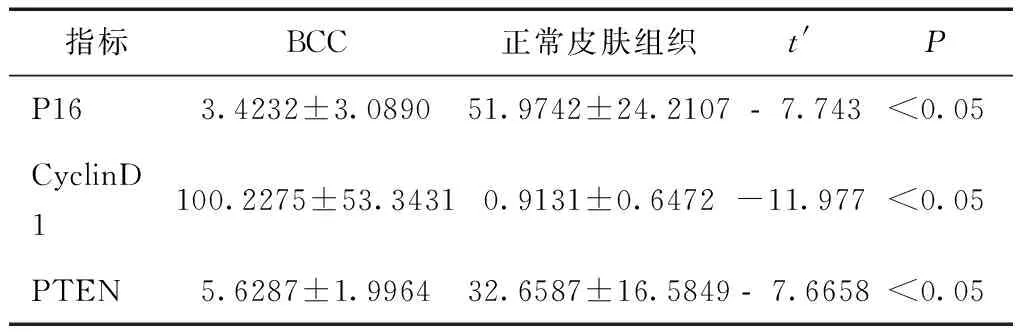
表1 P16、CyclinD1、PTEN在BCC与正常皮肤组织中的平均光密度比较

图4 P16与CyclinD1在癌细胞中光密度均值比较
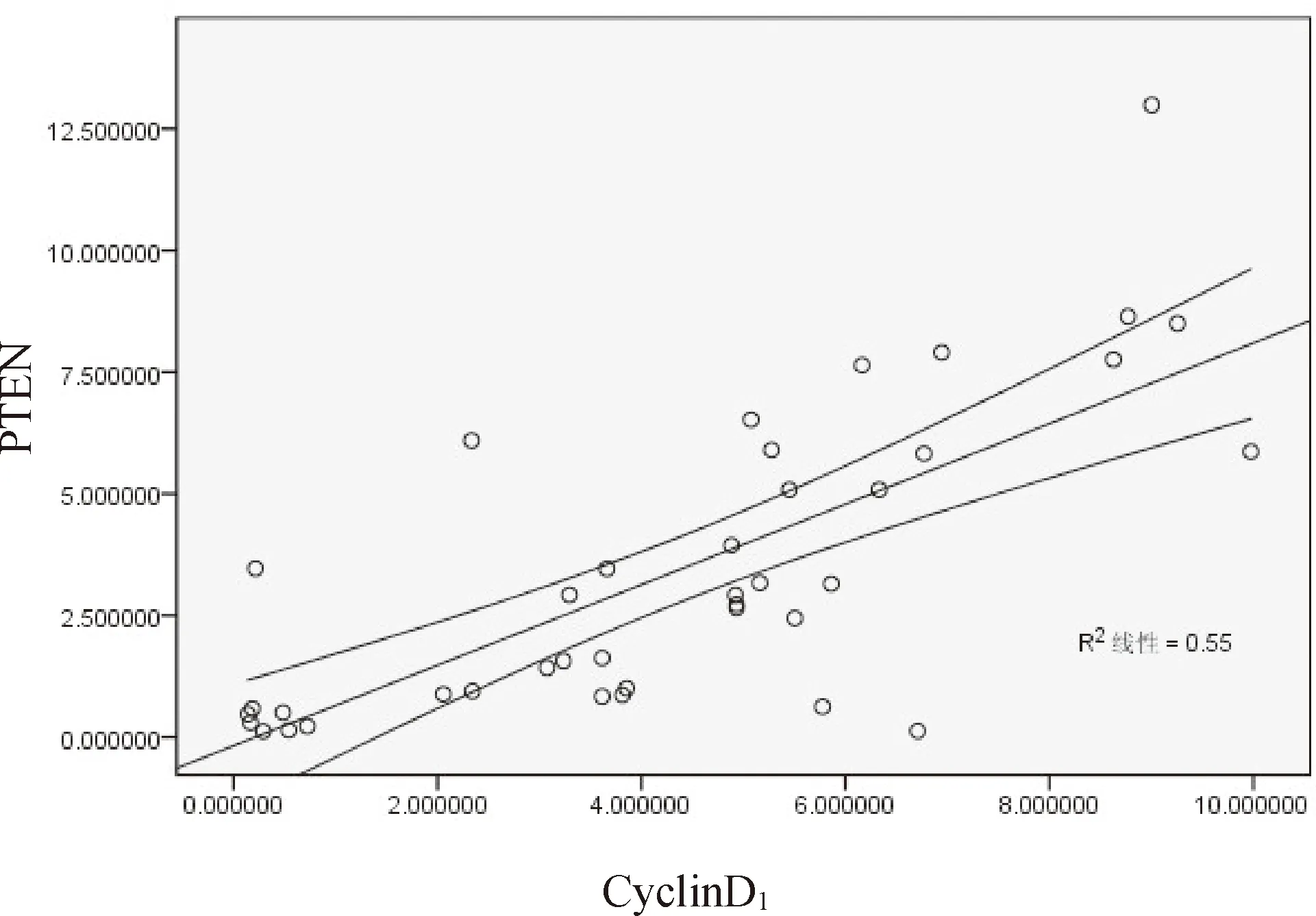
图5 PTEN与CyclinD1在癌细胞中光密度均值比较
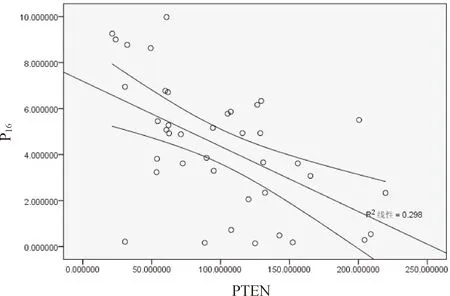
图6 P16与PTEN在在癌细胞中光密度均值比较
3 讨论
免疫组化技术日趋成熟,在前期染色方面采用多种手段,严格控制各项操作步骤,使染色具有较高可重复性,但是良好的染色切片并不代表最终的结果,如何对染色的切片进行标准化定量是一个关键问题。光密度是指在同一照明强度下吸收光的物质的光学密度,是一个对数值,直接与染色物质的量相关的。累积光密度是整个视野内阳性染色的像素强度值全部累加起来得到的值;平均光密度是累积光密度除以一个适当的面积得到的值,这个面积即图片中阳性表达的区域[2]。由此可看出平均光密度将面积因素考虑在内,以BCC为例,癌组织成巢状分布,同样面积的图片照进来的癌巢越多,阳性表达的物质就越多,累积光密度值就越大,照进来的癌巢越少,阳性表达的物质就越少,累积光密度值就越小,这里就很难控制每次拍照都能准确地照进同样多的癌组织,重复性较差。因此我们将累积光密度除以癌巢的面积,得到的一个平均光密度,则无论照进来的癌组织多少都具有可比性。
P16是位于染色体9p21区的多肿瘤抑癌基因,能特异地与细胞周期素依赖激酶4(CDK4)或CDK6紧密结合,抑制对pRb的磷酸化作用,结合转录活化因子E2F,最后阻止细胞周期G1期进展,导致细胞无限制生长[3]。目前研究表明,P16基因的缺失和蛋白水平的下降甚至缺失与很多肿瘤密切相关,并且不同类型肿瘤P16基因缺失的发生率不同。武钦学等[4]采用免疫组化SP法检测34例BCC,11例脂溢性角化病及10例正常皮肤,结果显示P16在BCC中均有不同程度的失表达,脂溢性角化病及正常皮肤正常表达,提示其表达的异常可能与BCC的发生、发展有关,但与表皮良性肿瘤发生无关。本研究显示P16在正常皮肤组织中呈阳性表达,在BCC中表达缺失,表明在皮肤基癌组织中P16的基因变异及蛋白低表达导致其抑癌作用减弱,与BCC的发病相关。外源性P16导入癌组织可引起肿瘤细胞的凋亡,但具体实施尚需进一步研究和探索。
CyclinD1已被公认为一种新的原癌基因[5]。CyclinD1由染色体11q13上的CCND1编码,含有295个氨基酸,有5个外显子,全长15 kb。其与CDk4/CDK6结合形成复合外物,并使之激活,使pRb发生磷酸化,导致E2F释放,进一步激活S期DNA的转录合成,推动细胞从G1期进入S期[6]。CyclinD1还有调节转录的功能,包括许多转录因子和核受体(雌激素受体,雄激素受体、甲状腺激素受体等),它通过提高转录水平或者抑制转录影响细胞的分化导致肿瘤的发生[7]。目前,国内外资料表明,在多种肿瘤中发现了CyclinD1过表达和基因扩增。孙桂彬等[8]应用免疫组化S-P法检测正常胃黏膜、慢性萎缩性胃炎、胃黏膜不典型增生及胃癌组织中PTEN、P16、CyclinD1蛋白的表达情况,提示PTEN、P16表达降低,CyclinD1表达升高,可能是胃癌早期分子事件。王世军等[9]采用免疫组化技术检测凋亡抑制因子livin和CyclinD1在30例外鼻BCC和18例外鼻正常组织中的表达,并观察两者在外鼻BCC表达的相关性,CyclinD1在外鼻BCC组织中阳性表达率明显高于外鼻正常组织,提示其参与外鼻BCC的发生、发展过程。本研究显示:CyclinD1在BCC中有较高的阳性表达,与既往的结果相符,提示CyclinD1异常表达可能与皮肤基癌分化和预后相关。
PTEN作为一种重要的抑癌基因编码蛋白,其突变或丢失,在肿瘤发生发展过程中起重要的作用。它定位于人染色体10q23,含9个外显子,编码双特异性磷酸酯酶蛋白,具有抑癌活性[10]。通过其脂质磷酸酶活性,抑制蛋白激酶B通路,阻断细胞所接受的外界生存增殖信号,使细胞周期阻滞;通过蛋白磷酸酶活性,使局灶黏附激酶(FAK)脱磷酸,从而抑制细胞黏附和迁移[11]。文献报道,将乳癌细胞转入PTEN抑癌基因,可以使肿瘤细胞发生死亡,相反,本应死亡的变异细胞当PTEN基因突变或缺失,将无节制生长,形成肿瘤[12]。郭丽丽等[13]应用免疫组化SP法检测23例BCC、25例SCC和10例正常皮肤组织中PTEN和Fas蛋白的表达,结果BCC和SCC中PTEN表达阳性率明显低于正常皮肤,PTEN蛋白在正常皮肤组织中高表达,而在BCC及SCC中低表达,提示PTEN抑癌基因在皮肤癌中可能发生突变和失活,并参与肿瘤的发生发展。本研究中,PTEN蛋白在BCC的表达水平、表达强度均低于正常皮肤,差异有统计学意义(P< 0.05),与以往的研究结果相符。提示:PTEN低表达,使组织调控细胞增殖功能下降,细胞凋亡减少,组织中的细胞过度增殖堆积,从而导致肿瘤的发生。
孙桂彬等[13]在研究P16和CyclinD1在胃癌及癌前病变表达中得出二者在该肿瘤中表达呈显著负相关。本研究发现二者在BCC中表达呈负相关。由此证明,PTEN可能控制CyclinD1对BCC的分化和转移。武卫等[14]等研究发现在膀胱移行细胞癌中PTEN和CyclinD1呈明显的负相关。徐波等[15]在研究PTEN和 CyclinD1蛋白在结直肠癌组织中的表达中,得出二者在该肿瘤中的表达呈显著负相关。本研究发现二者两两关系与上述结果相同。目前公认的调节细胞周期G1/S期经典途径是P16→CyclinD1→pRb途径,P16可与CyclinD1竞争性结合CDK4抑制CDK4/CyclinD1复合物催化活性,阻止G1→S期转变,负向调节抑制细胞增殖。PTEN可以通过AKT/PKB信号通路使GSK-3磷酸化而失活。失活的GSK-3就不能磷酸化CyclinD1的Thr-286而引发其更新,从而不能稳定CyclinD1,所以在肿瘤组织中PTEN的表达抑制了CyclinD1的过量堆积,调控了细胞增殖。这一机制可能是目前公认的P16→CyclinD1→pRb途径之外的又一CyclinD1过表达的原因。P16、PTEN同为抑癌基因,且均与CyclinD1蛋白有关,在分析本实验癌组织中P16和PTEN蛋白表达的相互关系中发现,P16与PTEN呈正相关,二者可能在肿瘤的发生过程中存协同作用,由此表明,癌基因及抑癌基因相互协调、相互促进导致P16与PTEN的缺失以及CyclinD1的扩增或过表达从而导致了皮肤基癌的发生发展。检测其表达对认识皮肤基癌发病的分子机制、恶性变、预后和治疗均有一定帮助。但BCC是多步骤、多因素共同参与的复杂过程,具体机制还需进一步深入研究证实。
[1] Kraan MC,Smith MD,Weedon H,et al.Measurement of cytokine and adhesion molecule expression in synovial tissue by digital analysis [J].Ann Rheum Dis,2001,60:296-298.
[2] 吕翔.计算机病理图像定量分析和应注意的问题 [J].中国体视学和图像分析,2002,6(7):123-127.
[3] Reika I,Takashi K,Yoichi A.Association of P16 homozygous deletions with clinicopathologi characteristics and EGFR/KRAS/p53 mutations in lung adenocarcinoma Clin[J].Cancer Res,2008,14:3746.
[4] 武钦学,吴志华,唐慰平.P16、P15及pRb在表皮肿瘤中的表达[J].国际医药卫生导报,2004,10(24):6-8.
[5] Proksch E,Elias PM,Man MQ,et al.Baeeier function regulates epidermal DNA synthesis[J].J Chin Invest,1991,87(5):1668-1673.
[6] 兰斌,许东坡,林永堃,等.CyclinD1、P53蛋白在胃癌组织中的表达 [J].实用癌症杂志,2002,17(1):26-28.
[7] Burd CJ,petre CE,Moghadam H,et al.CyclinD1 binding to the androgen receptor(AR)NH2-terminal domain inhibits cativation function-association and reveals dual roles for AR corepression [J].Mol Endocrinol,2005,19:607.
[8] 孙桂彬,杨景国,李永华,等.PTEN、P16和CyclinD1在胃癌及癌前病变中的表达研究 [J].现代中西医结合杂志,2012,21(15):1614-1616.
[9] 王世军,姚雅芬,张爱华,等.凋亡抑制因子livin和细胞周期蛋白D1在外鼻基底细胞癌的表达及意义[J].中国现代医学杂志,2010,20(6):813-816.
[10]Vazquez F,Matsuoka S,Sellersw WR,et al.Tumor suppressor PTEN acts through dynamic interaction with the plasma membrane[J].Proc Natl Acad Sci USA,2006,103(10):3633-3638.
[11]Dahia PL.PTEN,a unique tumor suppressor genne[J].Endocr Relat Cancer,2007,7(1):115-129.
[12]Tate G,Suzuki T,Mitsuya T.Mutation of PTEN induces cell growth arrest and apoptosis in hunman breast cancer ZR-75-1cells[J].Acta Biochim Biophys Sin(Shanghai),2001,39(10):745.
[13]郭丽丽,刘林蟠.皮肤癌组织中PTEN与Fas蛋白的表达[J].郑州大学学报,2008,43(2):218-219.
[14]武卫,蔡松良.PTEN蛋白和 CyclinD1在膀胱移行细胞癌中的表达及相关性研究 [J].浙江医学,2004,26(2):83-85.
[15]徐波,苏连明,代海平,等.PTEN和 CyclinD1蛋白在结直肠癌组织中的表达及临床意义[J].牡丹江医学院学报,2008,29(4):18-21.
The expression of P16,cyclinD1 and PTEN in basal cell carcinoma of skin and their significance
YAN Dan1,LI Ling2
(1.Department of Dermatology,Chengdu Second People’s Hospital,Chengdu 646000,China;2.Department of Dermatology,Sichuan Academy of Medical Sciences & Sichuan Provincial People’s Hospital,Chengdu 610072,China)
LILing
Objective To investigate the association of expressions of P16,cyclinD1 and PTEN with occurrence and development of skin basal cell carcinoma (BCC).Methods The expressions of P16,cyclinD1 and PTEN in 40 cases with BCC and 15 of healthy skin tissues were examined with immunohistochemical staining.IPP6.0 image analysis equipment was used for half-quantitative analysis and average optical density value was used to express a positive result.Results The density values of P16 and PTEN were lower and cyclinD1 expression was higher than that of normal skin tissues (P< 0.05).In BCC,the expression of cyclinD1 was negatively correlated with P16 and PTEN (r=-0.502 and-0.577,respectively,P< 0.05) while P16 was positively correlated with PTEN (r= 0.758,P< 0.05).Conclusion The low expressions of P16 and PTEN and high expression of cyclinD1 play an important role in occurrence and development of BCC.The correlations between P16,cyclinD1 and PTEN suggest that coordination and promotion each other between oncogene and tumor suppressor genes may be early molecular events of basal cell carcinoma.
P16;CyclinD1;PTEN
李 灵
R 739.5
A
1672-6170(2016)03-0016-05
2015-09-15;
2016-02-02)
