玉米转录因子WRKY76克隆及抗纹枯病表达模式分析
2016-06-23高文成张银超张志明潘光堂林海建
高文成, 李 玥, 张银超, 张志明, 潘光堂, 林海建*
( 1. 四川农业大学 玉米所/农业部西南玉米生物学与遗传育种重点实验室, 成都 611130; 2. 绵阳农业科学研究院, 四川 绵阳 621000 )
玉米转录因子WRKY76克隆及抗纹枯病表达模式分析
高文成1, 李玥2, 张银超1, 张志明1, 潘光堂1, 林海建1*
( 1. 四川农业大学 玉米所/农业部西南玉米生物学与遗传育种重点实验室, 成都 611130; 2. 绵阳农业科学研究院, 四川 绵阳 621000 )
摘要:玉米纹枯病是影响玉米产量和品质的重要病害之一。转录因子WRKY家族部分成员能够调控水杨酸和茉莉酸甲酯信号传递方式来激发防卫反应基因的表达。在NCBI上检索玉米中WRKY家族成员及拟南芥中抗病相关的WRKY家族成员,利用CLUSTAL X和MEGA5.05构建系统进化树,发现转录因子WRKY76可能参与玉米抗纹枯病的调控途径。该研究以玉米抗纹枯病材料R15和感病材料Ye478为对象,在玉米拔节期接种立枯丝核菌AG1-IA,首先分别于接菌前(对照)和接菌后1、2、4、6、12、24 h取叶鞘;然后分别进行水杨酸和茉莉酸甲酯胁迫处理,分别于处理前(对照)和处理后1、2、4、6、12 h取叶鞘,提取RNA,实时荧光定量PCR分析WRKY76转录因子基因在玉米叶鞘组织中不同胁迫条件下的差异表达。结果表明:在立枯丝核菌AG1-IA胁迫下,WRKY76转录因子基因在胁迫后1 h表达量达最大值,抗病材料R15的相对表达量高于感病材料Ye478且差异显著(P≤0.05);经水杨酸(Salicylic Acid, SA)处理,WRKY76在抗感材料中表达趋势相似,在感病材料掖478中,WRKY76被诱导而显著地上调表达,在抗病材料中,相对表达量峰值出现在胁迫后4 h,且相对表达量低于感病材料掖478。经茉莉酸甲酯(Methyl jasmine, MeJA)处理,WRKY76基因在感病材料中呈现下调表达趋势。WRKY76基因在1 h表达量为对照的0.6倍,其他调查时间点基本都在0.1~0.3之间。在抗病材料R15中,WRKY76基因表达呈现上升趋势,变化趋势不明显。这表明WRKY76转录因子基因能够被病原物、SA、MeJA诱导表达,可能参与植物抗纹枯病调控途径。
关键词:纹枯病, 转录调控因子, WRKY基因, 实时荧光定量PCR
玉米是重要的粮食作物和工业原料,其产量的稳定对国民经济的发展和确保我国粮食安全具有重要意义,但生物和非生物逆境胁迫一直是限制玉米高产稳产重要因素。玉米纹枯病是典型的生物逆境,尤其以西南地区最为严重,对该地区玉米的生长、发育、产量和品质均构成严重不利影响(唐海涛等, 2004; 杨俊品等, 2005)。植物经过长期的进化和自然选择,形成了由多条抗性途径在不同时空水平上交叉、重叠而成的复杂的抗性机制和多种表现的抗性形式。在病原菌侵染植物时,激发了病程相关蛋白(pathogenesis-related,PR)基因、组蛋白甲基化基因及染色质重塑基因的表达,这些基因的表达能被植物激素水杨酸(salicylic acid, SA)及茉莉酸(jasmonic acid, JA)调控,激活防卫反应基因的表达从而使植物表现出抗性(Spoel & Dong, 2012)。转录因子WRKY家族部分成员能调控SA及JA信号传递(Li et al, 2004; Mao et al, 2007)。在真核生物中,WRKY转录因子是分布最为广泛、最为保守的一类蛋白,广泛参与植物的激素反应、生长发育、逆境胁迫以及防御反应等生理生化过程(Eulgem et al, 2000; Eulgem & Somssich, 2007),在拟南芥(Qin et al, 2013)、水稻(Baldoni et al, 2013)、烟草(Li et al, 2012)、棉花(Sun et al, 2012)等植物中均有WRKY转录因子基因功能的报道,这类基因能显著提高植物的抗逆性。拟南芥的WRKYIIa亚家族成员包括WRKY28、WRKY62、WRKY71、WRKY76等,对该亚家族所有成员进行过表达可提高水稻对白叶枯病菌(Xanthomonasoryzaepv.oryzae)的抗病性(Peng et al, 2010)。AtWRKY70是植物SA防卫信号传导途径的一个重要决定因子,AtWRKY70过表达能提高SA介导的对白粉病菌(Erysiphecichoracearum)抗性(Li et al, 2004);相反,敲除或抑制WRKY70的表达则会降低植物对SA介导的对白粉病菌抗性(Ren et al, 2008)。这些研究表明,在植物抗病防卫反应过程中,WRKY基因主要以防卫基因转录调节子的角色介导了植物的抗病性。
目前,已有大量WRKY转录因子基因被报道在介导植物生物与非生物胁迫中发挥作用,但在玉米抗纹枯病的研究中还未见报道。本研究以构建系统进化树结果为依据,以WRKY76为候选基因,通过RT-PCR技术克隆WRKY76基因的全长cDNA序列,并运用实时荧光定量PCR分析玉米叶鞘组织在不同胁迫条件下的表达特征,揭示WRKY76基因在病害、激素等多种胁迫下的时空表达特征,为今后阐明玉米抗纹枯病的分子调控机制和利用基因工程手段培育抗病品种奠定理论基础。
1材料与方法
1.1 系统进化树构建
利用CLUSTAL X软件对检索得到的与拟南芥中抗病相关WRKY家族基因蛋白进行多序列联配分析。根据多序列联配结果,采用MEGA5.05软件邻接法(Neighbor-Joining method)的Poisson模型,进行Bootstraping检验,重复100次,选用Uniform rates构建进化树(Tamura et al, 2011)。
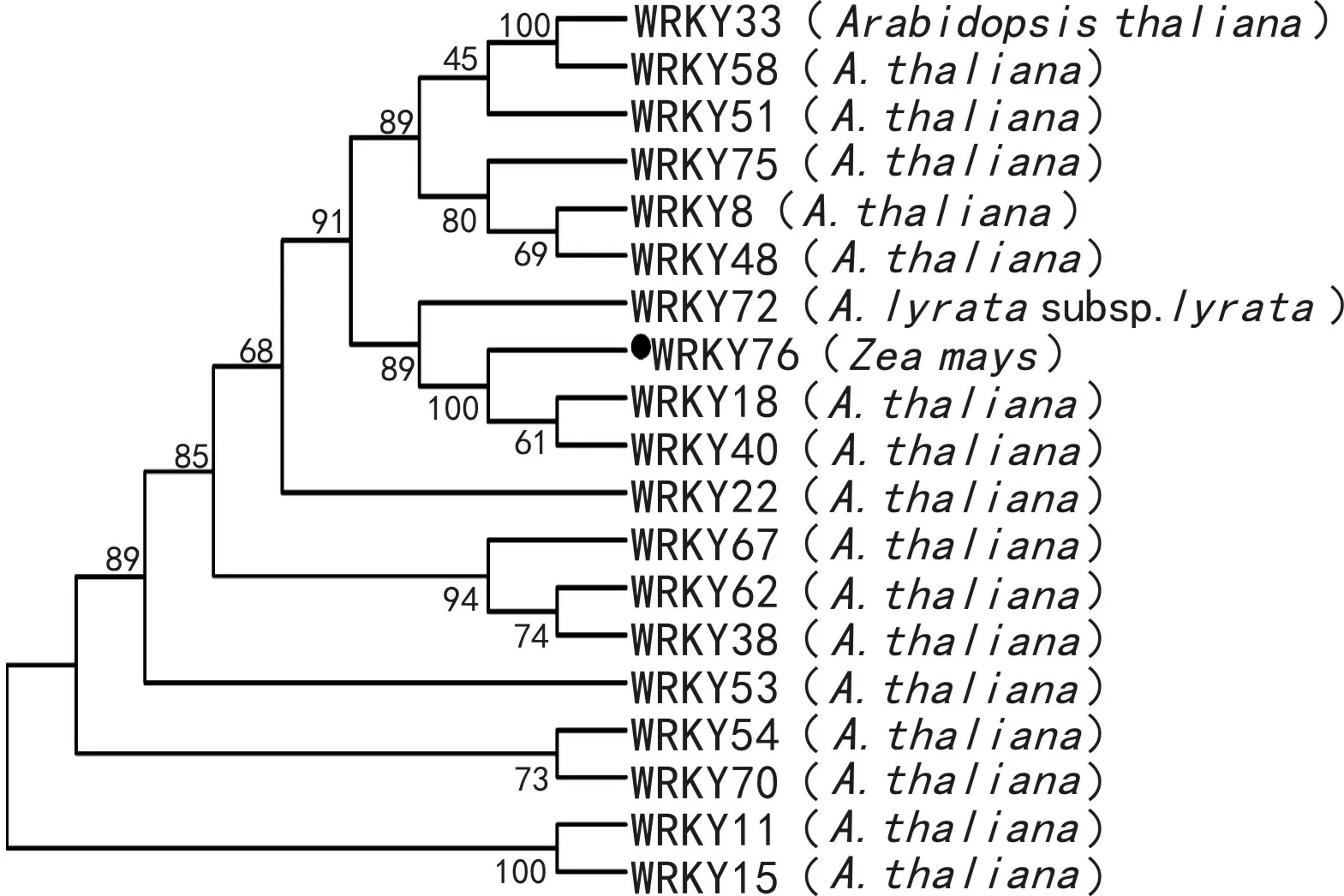
图 1 玉米WRKY76基因与拟南芥抗病相关WRKY基因的系统发生树Fig. 1 Polygentic tree of maize WRKY76 and Arabidopsis pathogen resistance WRKY genes
本研究构建了该基因编码蛋白与拟南芥抗病相关WRKY转录因子的同源进化树,同时进行自展分析,由图1可知,各组及亚组分枝及深部节点都有较高的自展值支持,由此表明该进化树的构建较为准确,各组及亚组的分枝关系得到显著支持。根据系统发育树的拓扑结构,结合遗传距离和自展支持值分析,玉米WRKY76基因与拟南芥抗病相关WRKY基因之间具有较高的同源性,成员多且分支有限,形成相对独立的亚组分枝,没有出现交叉现象,其中ZmWRKY76与抗病相关的AtWRKY18及AtWRKY40(Xu et al, 2006)聚类为一个分支,由此表明WRKY76基因很可能参与植物的抗病反应过程。
1.2 材料及取样
供试材料为课题组前期鉴定筛选的感纹枯病自交系掖478和抗纹枯病自交系R15,均由四川农业大学玉米研究所提供。在玉米拔节期进行胁迫处理:生物胁迫为人工接种高致病性立枯丝核菌AG1-IA,分别于接菌前(对照)和接菌后1、2、4、6、12、24 h取叶鞘;非生物胁迫为水杨酸和茉莉酸甲酯,水杨酸处理浓度为5 mmol·L-1,茉莉酸处理浓度为0.1 mmol·L-1,分别于处理前(对照)和处理后1、2、4、6、12 h取叶鞘,经液氮速冻后保存于-80 ℃备用。
1.3 总RNA提取及cDNA合成
玉米叶鞘总RNA提取按照TRIzol试剂操作流程进行。RNA完整性通过1.0%琼脂糖凝胶电泳检测;用核酸蛋白仪检测RNA浓度和纯度。根据RNA的浓度确定反转录体系中RNA的体积,将总RNA反转录成cDNA按照宝生物公司(TaKaRa)试剂盒说明进行操作,cDNA样品保存于-20 ℃冰箱中,备用。
本研究用于基因克隆的cDNA来自R15接菌后1 h的叶鞘组织RNA的反转录;用于荧光定量分析的材料是R15和掖478生长到拔节期的植株,选择生长一致的植株,进行立枯丝核菌AG1-IA、SA、MeJA三种处理,提取叶鞘组织RNA。提取后的RNA通过琼脂糖凝胶电泳检测,28S和18S条带清晰,无拖尾现象(图2),表明所提RNA完整性较好;通过核酸蛋白仪测定OD260/OD280的比值在1.8~2.1之间,表明RNA的纯度较好。因此,所提RNA可用于后续基因克隆和实时荧光定量分析。
图 2 玉米叶鞘总RNA电泳图Fig. 2 Agarose gel electrophoresis of maize sheath total RNA
1.4 WRKY76基因克隆
根据NCBI数据库公布的玉米WRKY76 mRNA序列,用Primer Premier 5.0设计目标基因的特异引物扩增包含整个CDS的序列(表1)。以反转录的cDNA为模板,进行RT-PCR反应,反应条件如下:模板cDNA 2 μL、上下游引物各0.6 μL、2×KOD Buffer 10 μL、2 mmol·L-1dNTPs 4 μL、KOD FX 0.4 μL,加无菌ddH2O至20 μL。PCR反应程序如下:94 ℃预变性5 min; 以94 ℃变性30 s, 56 ℃退火30 s,72 ℃延伸1.5 min,循环35次;72 ℃再延伸8 min。PCR结束之后,取10 μL进行电泳检测分析结果,回收PCR产物并连接到pMD©19-T载体上,转化E.coliDH5α,菌落PCR验证阳性克隆,送上海英俊生物有限公司测序。
1.5 WRKY76基因表达特征分析
以玉米看家基因GAPDH为内参基因,根据克隆测序的玉米WRKY76序列,用Premier 5.0设计目的基因的qRT-PCR引物(表1)。利用Bio-Rad CFX实时荧光定量PCR仪对玉米叶鞘组织不同胁迫处理时间点的样品进行表达特征分析,反应体系为EvaGreen©Supermix 5 μL、模板1 μL、上下游引物各0.5 μL,加ddH2O至总体积10 μL。反应条件为98 ℃预变性2 min;98 ℃变性2 s,59 ℃(GAPDH)、55.9 ℃(WRKY76)退火和延伸10 s;循环39次;65~95 ℃,作融解曲线。试验共设3个重复,结果分析采用Bio-Rad CFX Manager自带的gene study程序进行。
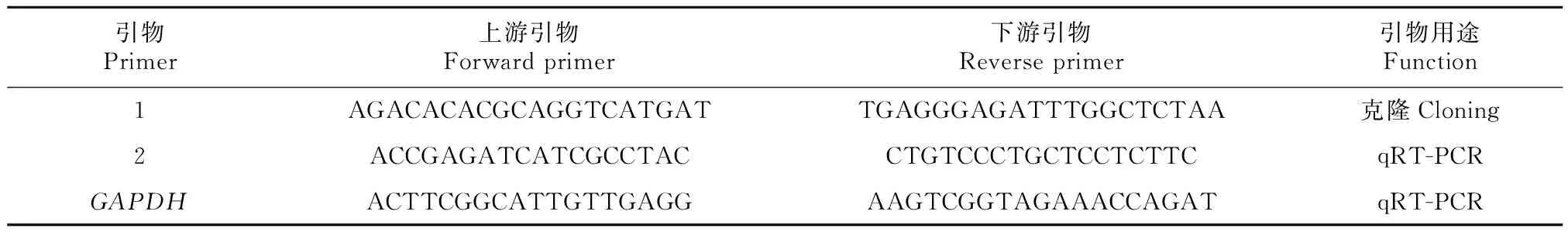
表 1 引物名称及序列
2结果与分析
2.1 WRKY76基因的克隆
根据NCBI数据库公布的玉米WRKY76 mRNA序列,设计目标基因的特异引物扩增包含整个CDS的一段序列,进行PCR扩增,获得一条长度为1 083 bp片段(图3);将其克隆到pMD19-T载体上,菌落PCR筛选阳性克隆,送上海英俊生物有限公司进行基因测序。将测序结果与已知的序列进行BLAST比对,结果与原氨基酸序列同源性达到了100%,这说明克隆得到的序列为目的基因。
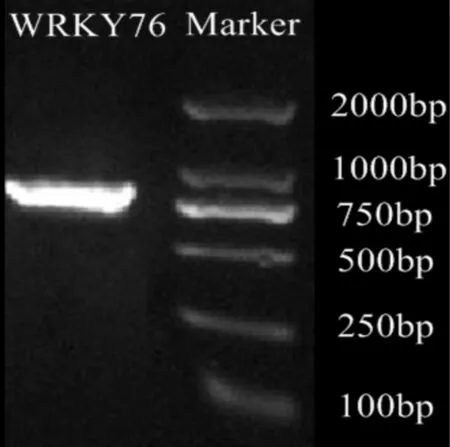
图 3 目的基因(WRKY76)扩增电泳图 左侧为目的基因,右侧为Marker。Fig. 3 Agarose gel electrophoresis of target gene(WRKY76) The target gene is on the left, Marker is on the right.
2.2 WRKY76基因表达特征分析
2.2.1WRKY76在立枯丝核菌AG1-IA胁迫下的差异表达实时定量PCR分析结果表明,立枯丝核菌AG1-IA侵染玉米R15和掖478 1 h后,WRKY76能够强烈迅速上调表达,此时表达量达到最高,其中在感病材料掖478及抗病材料R15中,表达量分别为对照的20倍和32倍;随后2 h的相对表达量较1 h相对表达量降低,感病材料掖478相对表达量为3倍左右,抗病材料R15回到原水平;在之后的4~24 h,在感病材料中,又出现两次峰值,分别出现在4 h和12 h,在胁迫24 h时,相对表达量回到原水平;但在抗病材料R15中,表达呈上升趋势,到达6 h时,变化平缓,相对表达量维持在较高水平(图4)。统计分析结果表明,该基因在抗病材料R15中的相对表达量与感病材料掖478中的差异达到了显著水平(P≤0.05),由此表明WRKY76转录因子基因很可能是玉米纹枯病抗感差异原因之一。
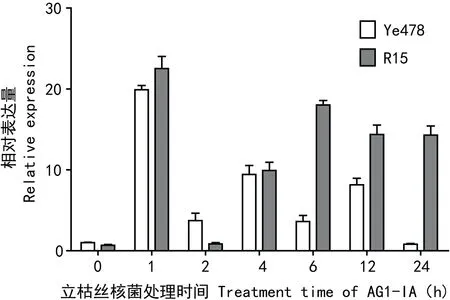
图 4 WRKY76在立枯丝核菌胁迫下的表达模式分析横坐标为处理时间; 纵坐标为WRKY76相对表达量。Fig. 4 Expression profile of WRKY76 under treatment of AG1-IA X axis represents the time of treatment,y axis represents relative expression of WRKY76.
2.2.2WRKY76在SA处理下的差异表达在植物的抗病信号转导途径中,水杨酸(salicylic acid,SA)作为一种内源信号分子通过调控作用激活过敏性坏死反应(hypersensitive response,HR)和系统获得抗性(systemic acquired resistance, SAR)反应。外施SA可以增加植物的抗病性,为了明确WRKY76基因是否受SA的激发,用SA处理R15和掖478后,进行实时荧光定量PCR分析。结果表明在感病材料掖478中,WRKY76被诱导而显著的上调表达,在处理后的1 h的相对表达量为对照的33倍;2 h时相对表达量达到最高的46倍,随后开始下降,12 h时相对表达量与维持在对照的2.5倍水平;在抗病材料中,该基因被诱导表达的趋势与感病材料相似,相对表达量峰值出现在胁迫后4 h,且相对表达量低于感病材料掖478(图5)。在感病材料中SA能快速诱导WRKY76基因的表达。
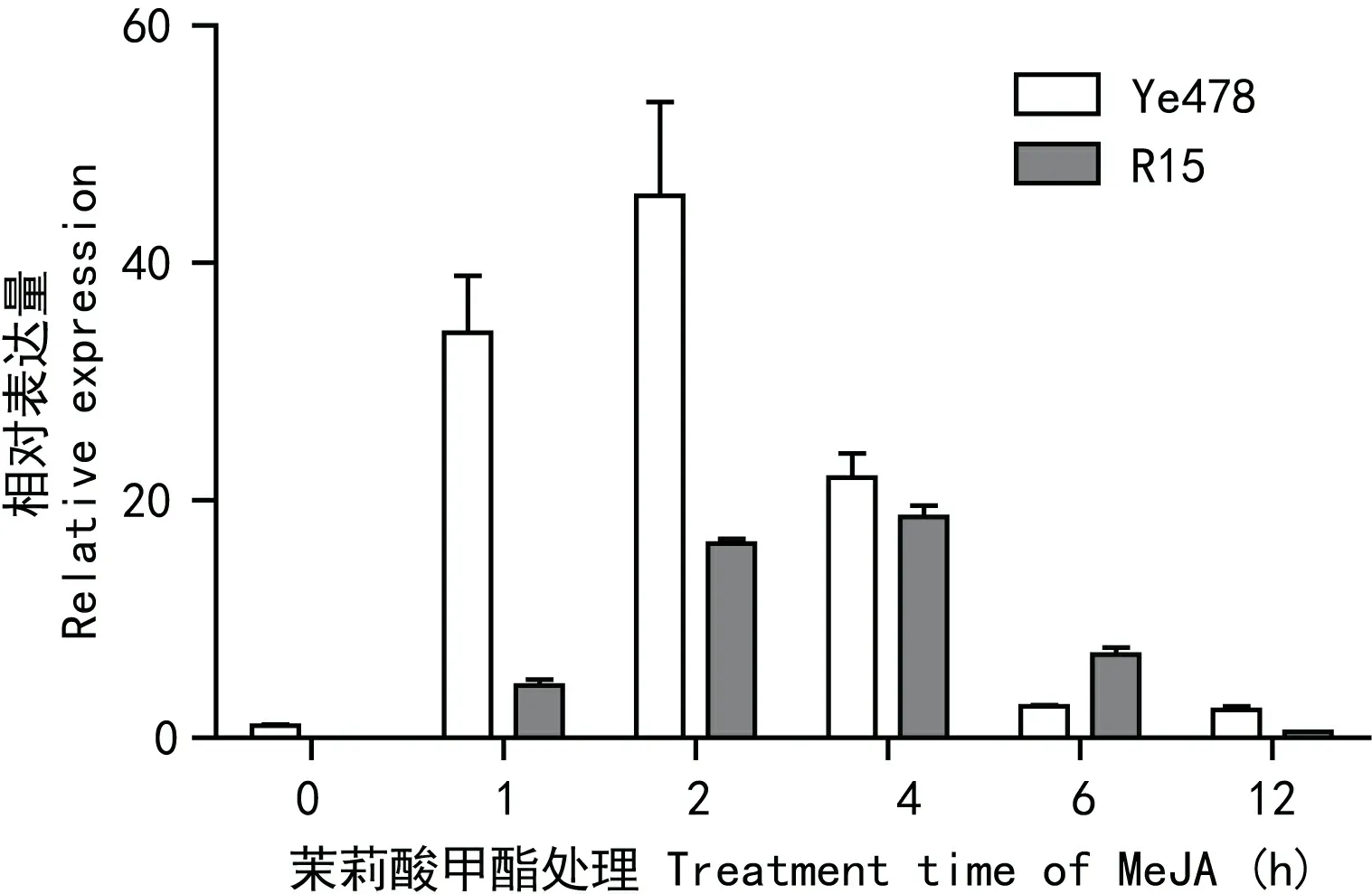
图 5 WRKY76在水杨酸处理下的表达模式分析Fig. 5 Expression profile of WRKY76 under treatment of SA
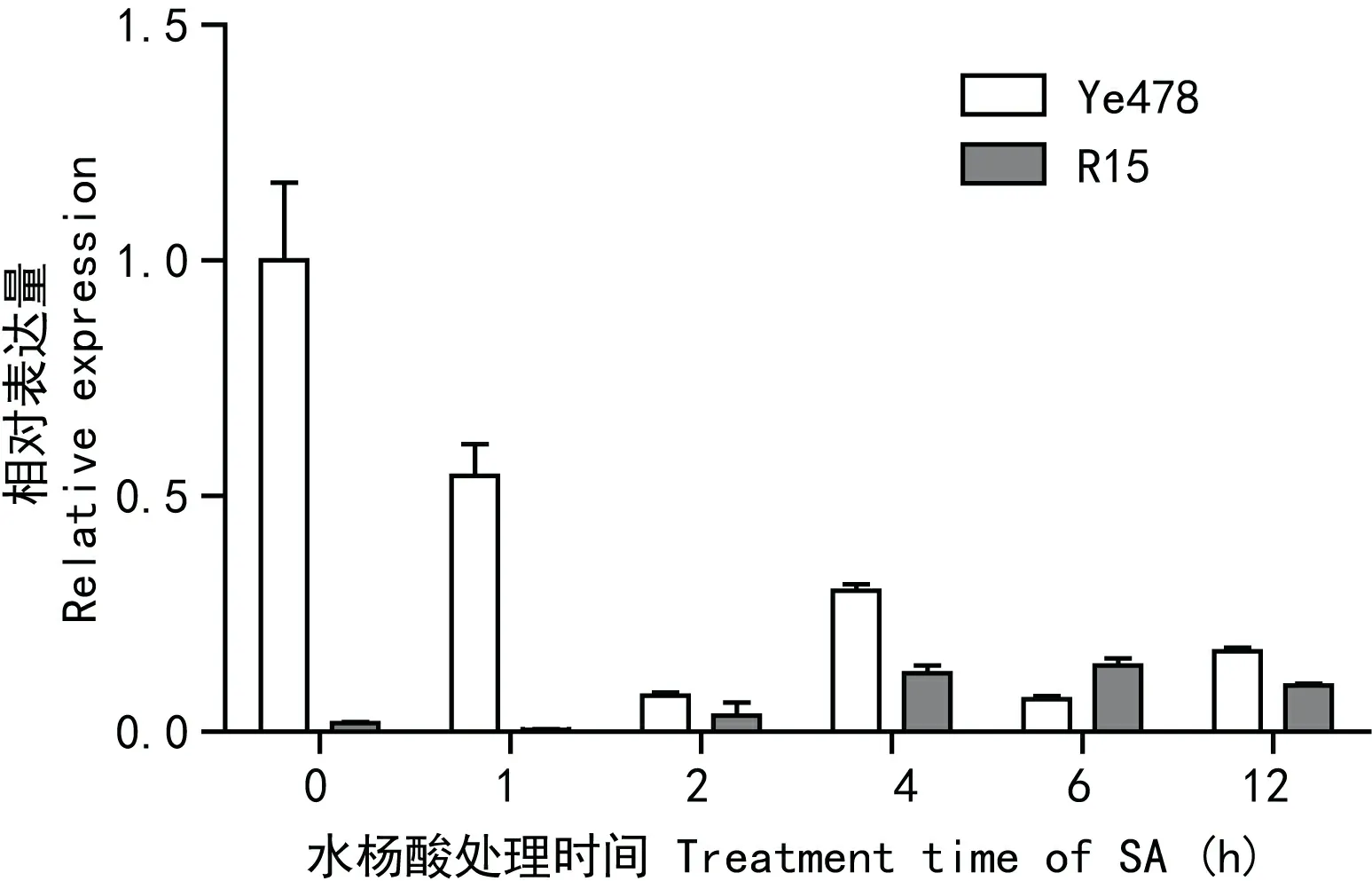
图 6 WRKY76在茉莉酸甲酯处理下的表达模式分析Fig. 6 Expression profile of WRKY76 under treatment of MeJA
2.2.3 MeJA处理下WRKY76基因的差异表达茉莉酸(jasmonic acid,JA)及其功能衍生物如茉莉酸甲酯(methyl jasmonate,MeJA)是高等植物中一种重要的信号分子,在植物应对胁迫应答的信号转导中起到重要的调控作用。一般认为茉莉酸(JA)在调控防御应答相关基因的表达时,主要与真菌类激发子、虫害、干旱、伤害以及渗透等逆境胁迫的应激反应相关。在本研究中,感病材料掖478经茉莉酸甲酯(MeJA)处理后,WRKY76基因的表达都受到了抑制,WRKY76基因在1 h表达量为对照的0.6倍,其他调查时间点基本都在0.1~0.3之间,在处理时间段内,表达呈现下降趋势。而在抗病材料R15中,WRKY76基因表达呈现上升趋势,变化趋势不明显,具体表现为处理4~12 h时间段内相对表达量维持在1.8倍左右(图5)。综合分析表明,WRKY76基因在茉莉酸参与的信号转导途径中是下调表达的。在JA途径中,JA促进MYC表达,MYC增强抗病基因VSP2(vegetative storage protein 2)表达却负调控WRKY76表达,因此WRKY76基因受到抑制的效果更明显。
3讨论与结论
WRKY是一种受诱导表达的转录因子,在高等植物应对生物与非生物胁迫反应的转录调控中有重要功能,且具有快速、瞬时表达的特点(Dong et al, 2003; Pandey & Somssich, 2009)。在病原物胁迫及防卫反应信号分子如水杨酸及茉莉酸处理下均能诱导WRKY的表达(Park et al, 2006)。
WRKY76在两个抗感自交系接种立枯丝核菌后均具有受诱导性及快速瞬时表达的特点,在1 h的相对表达量达到顶峰,抗性材料R15表达量升高的倍数高于感病材料掖478, 这与诱导防卫应答过程中WRKY基因发挥的转录调控功能相似(Dong et al,2003)。在接菌6、12、24 h这三个关键时期的高表达且相对表达量存在显著差异,即抗病材料高于感病材料,这与VpWKRY1和VpWRKY2受白粉菌诱导表达相似(李慧娥, 2010)。

图 7 WRKY76在SA及JA途径中的调控作用 箭头代表正调控作用; T代表抑制作用。Fig. 7 Regulatory effects of WRKY76 in the SA and JA pathways Arrows represent a positive regulation role; T represent inhibitory effect.
水杨酸(SA)信号分子与植物病原相关分子模式(pathogen-associated molecular patterns,PAMP)激发的免疫反应(PAMP-triggered immunity,PTI)和效应子激发的免疫反应(effector-triggered immunity,ETI)(Katagiri & Tsuda, 2010)存在着紧密联系(Ryals et al, 1996; Bostock, 2005)。当受到病原菌侵入时,植物会产生移动免疫信号分子(MeJA、壬二酸、磷酸甘油脱氢酶)和脂质转移蛋白(defective in inducedresistance 1,DIR1;azelaic acidinduced 1,AZI1),通过维管组织运输到整个植物体中,使得植物未被侵染部位产生抗病性,阻止病害进一步蔓延(Spoel & Dong, 2012)。本研究中,玉米经信号分子SA处理后,WRKY76基因都迅速而强烈的上调表达,证实其在转录水平上参与调控植物抗纹枯病防卫应答(Dong et al, 2003),同时这与拟南芥中大多数WRKY基因都受SA的诱导而上调表达结果相符(Eulgem et al, 2000)。表明该基因可能作为SA信号传导的重要成员,同时该基因的表达与SA信号分子的积累有直接联系,它可能通过调控下游的NPR1(non-expressor of pathogenesis-related gene 1),使其从胞内向核内移动,NPR1激活细胞核内WRKY的表达而启动植物的免疫反应(Ülker & Somssich, 2004; Eulgem & Somssich, 2007; Rushton et al, 2010; Spoel & Dong, 2012),参与玉米与AG1-IA的互作,指导植物做出抗病反应。
JA信号转导也是植物抗性反应的重要途径,主要参与伤害引起的信号转导(Katagiri et al, 2010)。用MeJA处理玉米后WRKY76基因的表达明显受到抑制。JA信号转导能负调控依赖SA信号分子的防卫基因的表达(Petersen et al, 2000; Kachroo et al, 2001),AtWRKY70则在激活SA诱导基因表达的同时,抑制JA诱导基因的表达(Li et al, 2004)。WRKY76所具有的SA诱导上调和JA诱导下调特性,推测可能在SA和JA信号转导中具有与AtWRKY70相似的功能,即WRKY76具有负调控茉莉酸JA响应基因VSP2及PDF1.2(plantdefensin1.2)的表达(Hu et al, 2012)。
随着近年来深入和广泛的研究,越来越多的WRKY家族成员被证明参与了植物的病原相关反应。在我们的研究中,MeJA、SA、病原菌均能诱导WRKY76转录因子表达。玉米R15和掖478在接种立枯丝核菌后,目的基因先上调表达并且反应非常迅速,证实WRKY转录因子参与抗纹枯病调控途径。接种1 h后,WRKY76的相对表达量达到最高,而此时AG1-IA的孢子刚刚侵染玉米叶鞘的表皮层,暗示WRKY76可能参与了玉米病原菌侵染早期的防卫反应。
植物在受到外界环境影响后,体内伴随着一系列防御反应信号途径的激活,其中最主要的是水杨酸信号转导途径和茉莉酸信号转导途径。利用实时荧光定量PCR发现WRKY76具有受SA诱导上调表达和JA诱导下调表达特性。在SA途径中,SA信号增强WRKY76表达从而促进SA响应基因的表达使得植物的抗病性增强。在JA途径中,JA信号增强MYC2的表达,而MYC2转录因子却抑制WRKY76的表达。这些与拟南芥WRKY70调控功能相似。
参考文献:
BALDONI E,MATTANA M,LOCATELLI F,et al, 2013. Analysis of transcript and metabolite levels in Italian rice (OryzasativaL.) cultivars subjected to osmotic stress or benzothiadiazole treatment [J]. Plant Physiol Biochem,70:492-503.
BOSTOCK RM,2005. Signal crosstalk and induced resistance:straddling the line between cost and benefit [J]. Ann Rev Phytopathol,43:545-580.
DONG J,CHEN C,CHEN Z, 2003. Expression profiles of theArabidopsisWRKYgene superfamily during plant defense response [J]. Plant Mol Biol,51(1):21-37.
EULGEM T,RUSHTON PJ,ROBATZEK S,et al, 2000. The WRKY superfamily of plant transcription factors [J]. Trends Plant Sci,5(5):199-206.
EULGEM T,SOMSSICH IE, 2007. Networks of WRKY transcription factors in defense signaling [J]. Curr Opin Plant Biol,10(4):366-371.HU Y,DONG Q,YU D, 2012.ArabidopsisWRKY46 coordinates with WRKY70 and WRKY53 in basal resistance against pathogenPseudomonassyringae[J]. Plant Sci,185-186:288-297.
KACHROO P,SHANKLIN J,SHAH J, et al, 2001. A fatty acid desaturase modulates the activation of defense signaling pathways in plants [J]. Proc Nat Acad Sci,98(16):9 448-9 453.
KATAGIRI F,TSUDA K, 2010. Understanding the plant immune system [J]. Mol Plant-micr Inter,23(12):1 531-1 536.
LI HE, 2010. Chinese wild east grape powdery mildew resistant lines of Baihe-35-1 transcription factor gene (WRKY) expression and function analysis [D]. Northwest Agriculture and Forestry University:37-49. [李慧娥, 2010. 中国野生华东葡萄抗白粉病株系白河-35-1转录因子基因(WRKY)表达与功能研究 [D]. 西北农林科技大学:37-49.]LI J,BRADER G,PALVA ET, 2004. The WRKY70 transcription factor:a node of convergence for jasmonate-mediated and salicylate-mediated signals in plant defense [J]. Plant Cell,16(2):319-331.
LI JB,LUAN YS,JIN H, 2012. The tomatoSlWRKYgene plays an important role in the regulation of defense responses in tobacco [J]. Biochem Biophys Res Comm,427(3):671-676.
MAO P,DUAN M,WEI C, et al, 2007. WRKY62 transcription factor acts downstream of cytosolic NPR1 and negatively regulates jasmonate-responsive gene expression [J]. Plant Cell Physiol,48(6): 833-842.PANDEY SP,SOMSSICH IE, 2009. The role of WRKY transcription factors in plant immunity [J]. Plant physiol,150(4): 1 648-1 655.PARK CJ,SHIN YC,LEE BJ, et al, 2006. A hot pepper gene encoding WRKY transcription factor is induced during hypersensitive response to tobacco mosaic virus andXanthomonascampestris[J]. Planta,223(2):168-179.PENG Y,BARTLEY LE,CANLAS P, et al, 2010. OsWRKY IIa transcription factors modulate rice innate immunity [J]. Rice,3(1):36-42.
PETERSEN M,BRODERSEN P,NAESTED H, et al, 2000. Arabidopsis MAP Kinase 4 negatively regulates systemic acquired resistance [J]. Cell,103(7):1 111-1 120.
QIN Z,LÜ H,ZHU X,MENG C, et al, 2013. Ectopic expression of a Wheat WRKY transcription factor gene TaWRKY71-1 results in hyponastic leaves inArabidopsisthaliana[J]. PLoS ONE,8(5):e63033.
REN CM,ZHU Q,GAO BD,KE SY, et al, 2008. Transcription factor WRKY70 displays important but no indispensable roles in jasmonate and salicylic acid signaling [J]. J Integr Plant Biol,50(5):630-637.
RUSHTON PJ,SOMSSICH IE,RINGLER P, et al, 2010. WRKY transcription factors [J]. Trends Plant Sci,15(5):247-258.RYALS JA,NEUENSCHWANDER UH,WILLITS MG, et al, 1996. Systemic acquired resistance [J]. Plant Cell,8(10):1 809-1 819.SPOEL SH,DONG X, 2012. How do plants achieve immunity?Defence without specialized immune cells [J]. Nat Rev Imm,12:89-100.
SUN J,AN H,SHI W,GUO X, 2012. Molecular cloning and characterization of GhWRKY11,a gene implicated in pathogen responses from cotton [J]. S Afr J Bot,81:113-123.
TAMURA K,PETERSON D,PETERSON N, et al, 2011. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods [J]. Mol Biol Evol,28(10):2 731-2 739.
(Continueonpage272)(Continuefrompage279)
TANG HT,RONG YZ,YANG JP, 2004. Researching progress in Maize Sheath Blight [J]. Maize Sci,12(1):93-96. [唐海涛,荣延昭,杨俊品. 2004. 玉米纹枯病研究进展 [J]. 玉米科学,12(1):93-96.]
XU X,CHEN C,FAN B, et al, 2006. Physical and functional interactions between pathogen-induced Arabidopsis WRKY18, WRKY40, and WRKY60 transcription factors [J]. Plant Cell,18(5):1 310-1 326.
YANG JP,TANG HT,YANG JX, et al, 2005. identification and inheritance of resistance to Maize Sheath Blight [J]. J Plant Pathol,35(2):174-178. [杨俊品,唐海涛,杨家秀, 等. 2005. 抗玉米纹枯病材料的鉴定及抗性遗传研究 [J]. 植物病理学报,35(2):174-178.]
ÜLKER B,SOMSSICH IE, 2004. WRKY transcription factors:from DNA binding towards biological function [J]. Curr Opin Plant Biol,7(5):491-498.
Cloning of maizeWRKY76 and its expression patterns involved in resistance to maize banded sheath blight
GAO Wen-Cheng1, LI Yue2, ZHANG Yin-Chao1, ZHANG Zhi-Ming1,PAN Guang-Tang1, LIN Hai-Jian1*
( 1.MaizeResearchInstitute,SichuangAgriculturalUniversity/KeyLaboratoryofBiologyandGeneticImprovementofMaizeinSouthwestRegion,MinistryofAgriculyure, Chengdu 611130, China;2.MianyangAcademyofAgriculturalScience, Mianyang 621000, China )
Abstract:Maize banded leaf and sheath blight (BLSB) which is a very destructive disease, can result in a significant yield loss and also heavily affect the quality of corn in maize production area. The expression of defense response genes could be stimulated by SA (salicylic acid) and MeJA (methyl jasmine) in the signal transduction pathway, and regulated by members of the WRKY transcription factors family. Transcription factors WRKY family members in Maize and WRKY family members which are related to resistance in Arabidopsis were collected from NCBI, and then polygenetic tree was successfully constructed. According to the result of polygenetic which was conducted by using the software CLUSTAL X and the software MEGA5.05, we concluded that the transcription factor WRKY76 was most likely involved in maize sheath blight resistance network. Whether the transcription factor WRKY76 plays a truly important role in sigjnal transduction path is still unknown. The materials used in this study were R15 (Resistant line) and Ye478 (Susceptible line). R15 and Ye478 under different kinds of stress conditions were used to characterize the expression pattern of WRKY76 gene by qRT-PCR, leaf sheath samples were collected at 0, 1, 2, 4, 6, 12 and 24 h post Rhizoctonia solani AG1-IA inoculation, and 0, 1, 2, 4, 6, 12 h after SA (salicylic acid) and MeJA (methyl jasmine) stress treatment. When leaf sheath samples were inoculated with R. solani AG1-IA at jointing stage, the WRKY76 gene expression was able to reach to the highest at 1 h post inoculation, and its expression was 20 and 32 times higher than control in Ye478 (Susceptible line) and R15 (Resistant line), with significant difference (P<0.05). The relative expression decreased at 2 h post inoculation. 3 times for Ye478 (Susceptible line) while it returned to the original level for R15 (Resistant line). The expression pattern in R15 (Resistant line) tended to increase along with treatment time increasing, while it was always higher than the susceptible line Ye478 with significant difference (P<0.05). When the maize leaf sheath was treated with SA (salicylic acid), the expression pattern of WRKY76 between Ye478 (Susceptible line) and R15 (Resistant line) were almost the same level, and its expression in R15 (Resistant line) was higher than that of Ye478 (Susceptible line). For R15 (Resistant line), the relative expression level of WRKY76 was 33 times at 1 h post inoculation compared to the control, 46 times at 2 h post inoculation, and then decreasd to 2.5 time at 12 h post inoculation. However, When the maize leaf sheath was treated with MeJA, Ye478 (Susceptible line) presents the downward trend, R15 (Resistant line) shows a upward pattern according to the results of relative expression level at each treatment time. There was no significant difference between Ye478 (Susceptible line) and R15 (Resistant line). Finally research results of this study indicated that the WRKY76 gene expression could be induced by R. solani AG1-IA, SA (salicylic acid) and MeJA (methyl jasmine), and the WRKY76 might be involved in plant resistance signal transduction regulation pathway to maize banded leaf and sheath blight.
Key words:maize banded leaf and sheath blight, transcription factor, WRKY76, qRT-PCR
DOI:10.11931/guihaia.gxzw201401022
收稿日期:2014-06-29修回日期: 2014-11-19
基金项目:国家自然科学基金(31201221);国家“863”项目(SS2012AA100107)[Supported by the National Natural Science Foundation of China(31201221); National High-tech R & D Program of China(SS2012AA100107)]。
作者简介:高文成(1987-),男,内蒙开鲁县人,硕士研究生,研究方向为玉米逆境分子生物学,(E-mail)gaowencheng2009@163.com。 *通讯作者: 林海建,博士,副研究员,研究方向为玉米分子生物学与遗传育种,(E-mail)linhj521@gmail.com。
中图分类号:Q943.2, Q751
文献标识码:A
文章编号:1000-3142(2016)03-0273-07
高文成,李玥,张银超,等. 玉米转录因子WRKY76克隆及抗纹枯病表达模式分析 [J]. 广西植物, 2016, 36(3):273-279
GAO WC,LI Y,ZHANG YC,et al. Cloning of maizeWRKY76 and its expression patterns involved in resistance to maize banded sheath blight [J]. Guihaia, 2016, 36(3):273-279
