不同铅水平下紫茎泽兰细胞内铅的分布和化学形态的分析
2016-06-23刘小文齐成媚颜冬冬王秋霞郭美霞曹坳程
刘小文, 齐成媚, 李 园, 颜冬冬, 王秋霞, 郭美霞, 曹坳程*
( 1. 湖南科技学院 化学与生物工程学院, 湖南 永州 425199; 2. 植物病虫害生物学国家重点实验室,北京 100193; 3. 中国农业科学院植物保护研究所, 北京 100193 )
不同铅水平下紫茎泽兰细胞内铅的分布和化学形态的分析
刘小文1,2,3, 齐成媚1, 李园2,3, 颜冬冬2,3, 王秋霞2,3, 郭美霞2,3, 曹坳程2,3*
( 1. 湖南科技学院 化学与生物工程学院, 湖南 永州 425199; 2. 植物病虫害生物学国家重点实验室,北京 100193; 3. 中国农业科学院植物保护研究所, 北京 100193 )
摘要:该研究运用差速离心法和化学试剂逐步提取法,分析了重金属铅在紫茎泽兰亚细胞内的分布和主要化学形态。结果表明:随着Pb浓度的升高,紫茎泽兰的叶、根、茎中各亚细胞组分Pb含量逐渐增加;紫茎泽兰中的Pb在叶片分布于可溶性部分和细胞壁中,两者占总量的75.34%~84.63%;茎也主要分布于可溶性部分和细胞壁中,占总量的36.10%~57.14%和20.07%~36.52%;而在根中则富集于细胞壁和可溶性部分,分别占39.2%~49.78%和28.27%~37.62%,其他细胞器中的Pb含量均较少。紫茎泽兰叶中的Pb以盐酸提取态和水提取态为主,两者占总量的58.74%~73.04%;茎中的Pb以醋酸提取态和氯化钠提取态为主;而根中的Pb则以醋酸提取态和盐酸提取态占优势,两者占总量的39.15%~52.91%。
关键词:铅, 紫茎泽兰, 亚细胞分布, 化学形态
重金属污染是最为广泛的土壤污染源之一,并逐步发展成污染生态学的研究热点(刘秀梅和王庆仁, 2001)。植物修复是近年来发展迅速的一门环境污染修复技术,是以植物对某种或某些化学元素的耐性或超累积效应为基础而作用于环境中的污染物,并能良好地利用植物与环境微生物之间的共存效应而成为一种新兴的环境污染修复技术,对治理土壤重金属污染产生了重要作用(Garbisu & Alkorta, 2001; Salt et al, 1995)。植物主要通过避性和耐性两种方式来实现适应环境中的重金属污染,避性是植物以自我调节的方式远离不良的生存环境,从而免受或减轻重金属污染对其危害性,如根系向重金属含量低的部分生长,或是植物通过自身代谢将吸收的重金属转运至外环境中;耐性是植物体内通过一些生理变化,与重金属结合呈现出解毒形态,如与植物细胞壁结合,或与植物细胞内合成的蛋白、多肽、有机酸反应而形成络合物,通过改变重金属原有的活性,使其形成无毒或毒性较弱的形态,再转运到液泡内贮存等。Pb是植物生长的非必需元素,可通过影响植物的光合作用,破坏叶绿素的合成和抗氧化酶系统,浓度过高时能严重影响植物正常生理代谢功能,进而抑制植物生长发育,严重时可使植物死亡(Wu et al, 2003)。
紫茎泽兰(Eupatoriumadenophorum)是原产于中美洲的菊科泽兰属多年生草本植物,现已扩散至亚洲、欧洲、非洲、大洋洲、北美洲等区域且已被诸多国家及权威研究机构公认为世界级恶性入侵杂草(牛燕芬等,2011)。该植物于20世纪40年代前后从中缅边境以自然扩散的方式传入我国云南,经半个多世纪发展后已蔓延至我国贵州、广西、重庆、四川、湖北、西藏等地并以其对环境极强的适应性迅速建立起了种群优势,严重危害了当地的自然环境和生物链平衡(贾海江等,2009)。鉴于紫茎泽兰的危害性大,研究紫茎泽兰的防控措施已迫在眉睫。目前,研究重金属污染土壤的热点是植物修复技术,且已证实紫茎泽兰生长能力强、产量高,具备环境污染修复先锋植物的特征(鲁平等,2005;李雪瑶和应浩,2009)。紫茎泽兰可有效吸收富集土壤中的Pb,且植株的不同部位对Pb的耐受能力呈现出很大差异(李冰等,2008;汪文云等,2008;Zu et al,2005)。笔者在调查中也发现,紫茎泽兰可在重金属Pb污染严重的环境中保持正常生长,且随着土壤Pb含量不同,其生长状况也明显不同,紫茎泽兰体内可能存在某些耐重金属的机制。前期研究表明,紫茎泽兰的生长状态随Pb处理水平表现出低促高抑的效应,且在高浓度Pb胁迫下,紫茎泽兰各组织中Pb的累积量远超过一般植物的累积水平。具备超累积效应的植物对重金属的吸附能力跟植株在细胞和亚细胞水平上区隔重金属的作用强弱有关(Kupper et al,1999)。研究重金属在植物亚细胞分布将有助于揭示植株内重金属的解毒形态和富集区的具体分布(Hall,2002)。因此,本研究以差速离心技术分离紫茎泽兰各组织的亚细胞组分,并运用化学试剂逐步提取法对Pb在紫茎泽兰细胞内的亚细胞分布特征和结合形态富集量进行了研究,拟揭示其对Pb的耐性和解毒机理,以期为研究紫茎泽兰对Pb的生理响应和富集Pb的分子机理奠定基础。
1材料与方法
1.1 植物培养
试验在室内大棚中进行,场地环境为相对湿度(55±8)%、白天温度(25±5)℃、夜间温度(15±5)℃。场地土壤采自四川省西昌学院内实验基地土壤表层,相关参数为pH值6.30(水)/7.71(CaCl2)、总N 853 mg·kg-1、总P 441 mg·kg-1、总K 2 313 mg·kg-1,CEC 11.23 meq、有机质含量25.1 mg·kg-1、重金属Pb含量20 mg·kg-1。Pb胁迫处理水平为0(CK)、200、500、1 000 mg·kg-1,Pb以Pb(CH3COO)2的形式加入。经上述处理后将土壤充分拌匀,稳定2周后移植紫茎泽兰幼苗。选取株高8~10 cm且质量接近的植株,随机分配至每个浓度处理的土壤中,每个处理栽种16盆,每盆1株。移植完成后,用称重法补充水分至田间持水量的60%左右并保持至收获,重金属胁迫处理60 d后,收获紫茎泽兰植株。植株先用自来水冲洗表面杂质后,再用20 mmol·L-1Na2-EDTA交换20 min,去除根系表面吸附的Pb2+,最后用去离子水洗净,并用吸水纸吸干植株表面水分,于-20 ℃环境的冰箱中储存。处理过的样品组分为根、茎和叶片3个组分,依次测定重金属全量、亚细胞分布和亚细胞内化学形态。
1.2 植物亚细胞组分的分离
将紫茎泽兰各组织研磨匀浆后用差速离心法分离不同组织中的各亚细胞组分。参照Weige & Jager(1980)和Gabbrielli et al(1980)的方法,并针对处理方法的局限性加以完善:取样0.200 0 g,加入8 mL提取液[0.25 mol·L-1蔗糖+50 mmol·L-1Tris-HCl缓冲液(pH7.5)+1 mmol·L-1二硫赤鲜糖醇],匀浆处理后,收集匀浆液后在300 r·min-1下冷冻离心30 s,至沉淀完全析出,过滤分离上清液,即为细胞壁组分(F1);收集离心样品的上清液并在2 000 r·min-1下离心15 min,待沉淀稳定后分离上清液,沉淀部分即为细胞核和叶绿体组分(F2);收集细胞核和叶绿体沉淀后上清液在10 000 r·min-1下离心20 min,重复上述分离操作,所谓不溶物为线粒体组分(F3);收集经三次差速离心分离的上清液,为可溶组分(F4),各步骤均在4 ℃下进行。
1.3 紫茎泽兰体内重金属化学形态分析
采用不同试剂分步提取法逐步分离紫茎泽兰植株内内重金属各化学形态,方案如下:取样0.200 0 g,加入8 mL提取剂研磨匀浆后转入10 mL塑料离心管中,在25 ℃恒温振荡22 h后,5 000 r·min-1下离心10 min,倒出上清液,加入8 mL的提取剂,25 ℃下恒温振荡1 h,10 000 r·min-1离心10 min,取上清液混合后充分摇匀,采用下列5种提取剂依次逐步提取:80%乙醇(FE),去离子水(FW),1 mol·L-1NaCl溶液(FNaCl),2% HAc(FHAc),0.6 mol·L-1HCl(FHCl),最后为残留态(FR)。
1.4 Pb含量的测定
以提取剂作为空白对照,所得样品用去离子水洗净后转移至100 mL三角瓶中,将其蒸干后采用浓HNO3∶HF∶HClO4(2∶1∶2)法测定Pb的含量,先消煮至澄清,过滤后用去离子水定容,北京瑞利WFX-120A /石墨炉原子吸收分光光度计测定,所有数据用SAS 8.2软件进行处理。
2结果与分析
2.1 紫茎泽兰各组织中Pb的亚细胞分布
重金属为避免损伤植物核心的细胞、组织和细胞器,从而体现对应的选择性分配,形成了在亚细胞各组分中的分配差异,其主要累积区位于植物的细胞壁和液泡中,但由于植物种类、Pb处理水平等条件的不一致,会导致Pb在两者之间分配比例存在差异。不同浓度的Pb处理下,Pb在紫茎泽兰各组织的亚细胞分布及各组分所占比例如表1所示,在紫茎泽兰的亚细胞组分分离样品中,Pb的回收率为82.17%~97.65%,除对照中叶片外,紫茎泽兰叶片Pb的亚细胞组分的含量均呈现F4>F1>F3>F2的分布格局,即均以含可溶性部分F4分布最高,占28.72%~54.23%,其次是细胞壁F1,占23.51%~44.44%,两者占全量的75.34%~84.63%,少量分布在F2和F3中,与对照相比,Pb在F4组分中明显上升,而在F1组分中呈现逐步降低的趋势;紫茎泽兰茎中Pb主要富集于F4和F1,占36.10%~57.14%和20.07%~36.52%,少量富集于F2和F3中,随Pb浓度增加,Pb在细胞壁和可溶性部分分配比例均呈先增后降的趋势,而细胞核和叶绿体的分配比例则先减少后增加。根系中细胞亚细胞组分Pb含量依次为F1>F4>F3>F2,大部分Pb位于细胞壁和可溶性部分,分别占39.2%~49.78%和28.27%~37.62%。随Pb浓度增加,Pb在细胞壁分配比例逐渐下降,而可溶性部分则逐渐增加。以上结果证实了Pb在紫茎泽兰根茎叶中的主要分布位点集中在可溶性部分和细胞壁,少量分布在紫茎泽兰各组织的细胞核和叶绿体、线粒体等细胞器中,细胞壁对Pb有较强的束缚能力,对其根来说这种束缚作用更为明显,随Pb浓度的增加各组织细胞壁对Pb的束缚能力有所降低,并能降低紫茎泽兰各组织的细胞核、叶绿体和线粒体等细胞器中Pb的分布,有效地保护了紫茎泽兰正常的生理功能。
2.2 紫茎泽兰各组织中Pb的化学形态
一般来说,重金属都以其特定的形态存在于植物的不同组织中,并保持动态平衡,各组织中重金属特征形态的性质和活性,对重金属在植物体内的毒性强弱、转运及累积有明显影响。各种化学结合形态的Pb在紫茎泽兰各组织的含量,所占比例如表2所示。不同浓度Pb处理下,叶中不同形态的Pb占的比例均有所不同,除对照外,均以盐酸提取态FHCl和水提取态Fw为主,两者占总量的58.74%~73.04%,其次为乙醇提取态FE,醋酸提取态FHAc和氯化钠提取态FNaCl最少,随Pb浓度的增加,FHCl有所减低,而FE则明显升高。在茎中, 除对照外,各处理Pb的提取形态依次为FHAc>FNaCl>FW>FHCl>FE,

表 1 Pb胁迫下对紫茎泽兰各组织中Pb亚细胞分布
注: F1. 细胞壁组分; F2. 细胞核和叶绿体组分; F3. 线粒体组分,F4. 可溶组分。表中数据为平均值±标准差(n=3),Pb含量和分配比例中同一行的不同字母表示不同组分有显著差异(P<0.05)。下同。
Note: F1. Cell wall fraction; F2. Nuclear and chloroplast fraction; F3. Mitochondrial fraction; F4. Soluble fraction. Date are shown as Mean±SD. (n=3). Different letters within the same Pb subcellular fraction of the same lead level indicate significant differences between the four cultivars at 0.05 level. The same below.
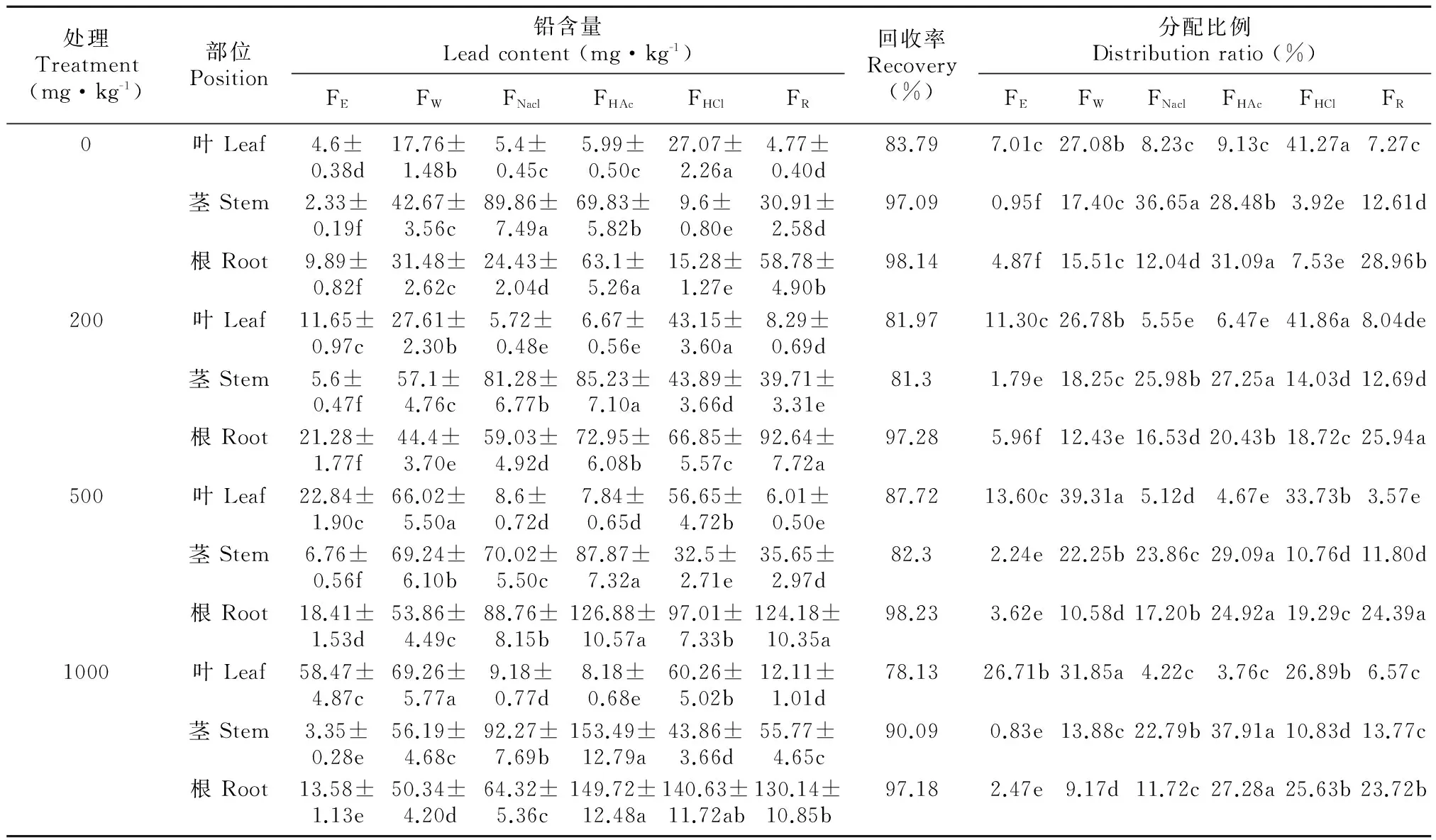
表 2 Pb胁迫下紫茎泽兰中Pb的化学形态
注: FE. 乙醇提取态; FW. 水提取态; FNaCl. 氯化钠提取态; FHAc. 醋酸提取态; FHCl. 盐酸提取态; FR。
Note: FE. ethanol-extractable; Fw. water-extractable; FNacl. Nacl-extractable; FHAc. HAc-extractable; FHCl. HCl-extractable; FR. residual.
FHAc和FNaCl提取态所占比例优势明显,且FHAc随Pb浓度的增加而增加,FNaCl则逐渐减少。Pb在根的主要形态依次为FHAc>FHCl>FNaCl>FW>FE,FHAc和FHCl占总量的39.15%~52.91%,且两者均随Pb的增加而分布比例增大。上述结果说明在紫茎泽兰不同部位Pb存在着不同的化学形态,根茎叶中Pb均与多种配位体结合。
3讨论
植物自身进化出了许多机制来适应被重金属污染土壤的逆境胁迫环境,避免受到重金属的毒害作用,与其它因素在植株对重金属的忍耐与解毒过程中发挥了重要作用(杨卫东等, 2009),主要包括选择性排斥,通过阻止重金属跨膜运输来限制重金属吸收、富集及代谢,通过质子泵作用于重金属将其泵出胞外;重金属鳌合,通过鳌合素、金属硫蛋白、有机酸等赘合重金属,使其转化为低毒形态,并通过液泡将其隔离;细胞壁固定,胞外碳水化合物能将重金属结合并固定于细胞壁上(Zornoza et al, 2002; Ke et al, 2007; Wu et al, 2005; Ramos et al,2002)。
超累积植物自身一般都具备相应的生理解毒机制从而对重金属产生耐性,使植株能适应高浓度重金属污染的区域,并保持正常生长,这是因为重金属在植物体内以赘合物等解毒形态存在,从而失去原有的毒性,形成解毒机制,如与植物细胞壁结合、植物的主动运输作用将重金属转运至液泡、与有机酸或某些蛋白质结合形成络合物等(夏小燕等, 2007),在植物对重金属的耐性与富集特性方面,植物细胞壁的固持作用及液泡区隔化效应发挥了重要作用(Kupper et al, 2000);液泡中含有多种能与重金属离子结合的有机酸、有机碱、蛋白质等,使其在细胞内区隔化;以细胞壁为主体的非原生质体部分以特定的成分及理化性质,构成植物中的“死组织”,其生理代谢活动水平低,这些亲金属离子的配位基团由植物细胞壁中多糖分子(木质素、纤维素、半纤维素、粘胶等)和蛋白质分子中的大量羟基、羧基、氨基、醛基和磷酸基等通过相互作用形成,这些配位集团进入植物体内与重金属离子发生配位作用,有效防止植物体内重金属离子发生跨膜转运,大幅度减少了到达原生质体中重金属离子的富集量,保护了植物细胞功能区正常生理活性;由此可见,细胞壁是植物体内吸收重金属代谢解毒的重要场所(Hayens,1980; Allan & Jorrell, 1989)。当细胞壁吸附重金属离子的量接近饱和时,重金属离子进入细胞内部通过转运进入液泡中储存,液泡中含有多种有机酸、有机碱、蛋白质等,可作用于重金属使其在植物细胞内被区隔化,降低了原生质中重金属富集量,从而避免或减轻重金属对植株的危害。
本研究结果表明紫茎泽兰中的Pb在叶片分布于可溶性部分和细胞壁中,两者占全量的75.34%~84.63%;茎类似与叶片也主要分布于可溶性部分和细胞壁中,占总量的36.10%~57.14%和20.07%~36.52%;而根中则富集于细胞壁和可溶性部分,分别占39.2%~49.78%和28.27%~37.62%,其他细胞器中的Pb含量均较少。He et al(2002)认为超累积植物东南景天Pb的亚细胞分布主要集中在细胞壁上,其次是可溶性部分;周小勇等(2008)研究表明长柔毛委陵菜中47%~77%的Pb分布于细胞壁上,其次分布于可溶性部分;江行玉和赵可夫(2002)证实芦苇细胞中不同位置Pb的含量有明显差异,Pb在细胞内的具体分布为细胞间隙>细胞壁>液泡>细胞质;本研究结果与上述结果类似,紫茎泽兰吸收的Pb首先与细胞壁中众多的化合物形成稳定的络合物或不溶性有机物而固定下来,若细胞壁上可承载的Pb离子接近饱和状态后,多余的Pb会通过细胞膜进入原生质中,与液泡中一些可溶性部分如有机酸、有机碱等物质结合而Pb在液泡被区隔化(周小勇等, 2008),使Pb对其它细胞器的危害大大减弱,使紫茎泽兰对重金属Pb的耐性相对于一般植物明显增强。因此,大量的Pb在紫茎泽兰植株内可溶性部分被区隔化和细胞壁沉淀可能是其耐受高浓度Pb的重要机制,这说明了紫茎泽兰对于Pb污染土壤有良好的生态修复价值。
植物体内重金属的迁移能力、活性、毒性和基质分离的难易与其在植物体内呈现的化学形态密切相关(Qiao & Ho, 1996)。重金属区被植物体内室化的方式一般是通过与植物体内存在的配体结合,这些有机配体主要有3种类型:以柠檬酸、苹果酸、草酸等为代表的含氧羧酸;以金属硫蛋白与鳌合素等为代表的含硫基化合物;以组氨酸等为代表的含氮氨基酸。Wu et al(2003)和杨居荣等和黄翌认为由于在不同提取剂中,重金属的溶解度有很大差异,故Pb、Cd等重金属存在的化学形态可通过不同溶剂对应的提取量来反映。其中,以氯化物、硝酸盐为主的重金属结合态可用乙醇提取;去离子水对以水溶性有机酸盐、重金属的一代磷酸盐M(H2PO4)等方式结合的重金属有较好的提取效果;氯化钠能提取与蛋白质结合态或呈吸着态的重金属和在植物体内以果胶酸盐的形式结合的重金属等;而醋酸常用来提取包括M2HPO4和正磷酸盐M3PO4在内的难溶于H2O的重金属磷酸盐结合态;盐酸一般用来提取草酸盐等。提取剂的极性强弱对应提取的重金属的活性、毒性及迁移能力差异显著,极性越强,提取得到的重金属盐在植物体内的活性、毒性及迁移能力越低,以此来分离得到与植物基质结合程度各异的重金属离子(许嘉琳和宋文昌, 1991)。
长柔毛委陵菜中Pb以盐酸提取态为主,占总量的28%~60%(周小勇等, 2008);药用植物麦冬、北沙参和地黄中的Pb的形态是以盐酸提取态和醋酸提取态形式存在,占药用部分的65%(刘军和李先恩, 2002);小麦和水稻叶中的Pb都以盐酸提取态为主,根中都以醋酸提取态和盐酸提取态为主(许嘉琳和宋文昌, 1991);芦苇体内的Pb也以盐酸提取态和醋酸提取态为主(江行玉和赵可夫, 2002);本研究结果显示紫茎泽兰叶中Pb以盐酸提取态和水提取态为主,两者占总量的58.74%~73.04%,在茎中,以醋酸提取态和氯化钠提取态为主,在根中,醋酸提取态和盐酸提取态占优势,两者占总量的39.15%~52.91%;说明紫茎泽兰叶片中的Pb的存在方式主要以水溶性的有机酸盐、磷酸盐为主;紫茎泽兰茎中的Pb主要以难溶于水的重磷酸盐、果胶酸盐方式被吸附或与蛋白质结合的形态存在;根中Pb的存在方式也主要是以难溶于水的重磷酸盐醋酸、草酸盐的形式等,表明紫茎泽兰体内的Pb存在多种配位体,且螯合的铅都不易被植物吸收,紫茎泽兰体内迁移能力强的乙醇提取态的比例较低,Pb在其体内的移动性较差,这种Pb形态可明显促进紫茎泽兰体内的Pb在细胞壁的固定和液泡的区隔化,使得Pb在紫茎泽兰植株体内转运困难,从而避免了Pb对紫茎泽兰造成损伤。
4结论
本研究证实了紫茎泽兰中的Pb在茎、叶片中的主要分布区域位于可溶性部分和细胞壁中,而在根中则富集于紫茎泽兰细胞壁和其它可溶性部分,其它细胞器中的Pb含量均较少;Pb对其它细胞器的毒性由于这种特殊亚细胞分布大大降低,使得紫茎泽兰对Pb的耐性明显提高。紫茎泽兰体内存在多种Pb配位形式,且螯合的铅大都不易被植物体吸收,紫茎泽兰体内迁移能力强的乙醇提取态的比例较低,Pb在其体内的移动性较差,这种Pb形态十分有利于细胞壁对Pb的固定和液泡对Pb的区隔化,限制了Pb在紫茎泽兰植物体内转运,从而避免了Pb对紫茎泽兰植株造成损伤。紫茎泽兰能有效吸收土壤中的Pb,且能适应高浓度Pb处理的土壤,体现了一定的超富集植物特性。可见紫茎泽兰作为环境污染修复植物,在Pb及其它重金属污染的土地区的防治上有着良好的应用前景。
参考文献:
ALLAN DL, JARRELL WM, 1989. Proton and copper adsorption to maize and soybean root cell walls [J]. Plant Physiol, 89(3): 823-832.
GARBISU C, ALKORTA I, 2001. Phytoextraction:a cost-effective plant-based technology for the removal of metals from the environment [J]. Bioreso Technol, 77(3): 229-236.
Gabbrielli R,Panddfini T,Vergnano O,et a1, 1990. Comparison of two ser-pentine species with different nickel tolerance strategies [J]. Plant Soil,22:271-277.
HALL JL, 2002. Cellular mechanisms for heavy metal detoxification and tolerance [J]. J Exper Bot, 53(366): 1-11.
HAYENS RJ, 1980. Ione xehange ProPerties of roots and ionie interactions within the apoplasm: Their role in ion accumulation by Plants [J]. Bot Rev, 46: 75-99.
HE B, YANG XE, NI WZ, et al, 2002. Sedum alfredii: a new lead-accumulating ecotype [J]. Acta Bot Sin Chin Ed, 44(11): 1 365-1 370.
JIA HJ,LI XK,TANG SC,et al, 2009. Allelopathic effects ofEupatoriumadebophorumon seed germination of three woody plants in karst region [J]. Guihaia,29(5): 631-634. [贾海江,李先琨,唐赛春,等, 2009. 紫茎泽兰对三种岩溶地区木本植物种子萌发的化感作用 [J]. 广西植物,29(5): 631-634.]
JIANG YX,ZHAO KF, 2002. The Distribution of Pb and Pb-stressed relative proteins in Pb-polluted phragmites austral is seedlings [J]. J Plant Physiol Mol Biol,28(3): 169-174. [江行玉,赵可夫, 2002. 铅污染下芦苇体内铅的分布和铅胁迫相关蛋白 [J]. 植物生理与分子生物学学报,28(3): 169-174.]KE W, XIONG Z, XIE M, et al, 2007. Accumulation, subcellular localization and ecophysiological responses to copper stress in twoDaucuscarotaL. populations [J]. Plant & Soil, 292(1): 291-304.
KUPPER H, JIEZHAO F, MCGRATH SP, 1999. Cellular compartmentation of zinc in leaves of the hyperaccumulatorThlaspicaerulescens[J]. Plant Physiol, 119(1): 305-312.
KUPPER H, LOMBI E, ZHAO FJ, et al, 2000. Cellular compartmentation of cadmium and zinc in relation to other elements in the hyperaccumulatorArabidopsishalleri[J]. Planta, 212(1): 75-84.
LI B,ZHANG CH, 2008. Studies on the bryophytes and analysis of ecological restore potential in the Lannigou Gold Deposit, Guizhou Province [J]. J Trop & Subtrop Bot,16(6): 511-515. [李冰,张朝晖, 2008. 贵州烂泥沟金矿区苔藓植物及其生态修复潜力分析 [J]. 热带亚热带植物学报,16(6): 511-515.]
LI XY,YING H, 2009. The harms prevention and comprehensive utilization ofEupatoriumadenophorum[J]. Biomass Chem Engin,43(1): 57-60. [李雪瑶,应浩, 2009. 紫茎泽兰的危害、防除及综合利用 [J]. 生物质化学工程,43(1): 57-60.]
LIU J,LI XN, 2002. Chemical form and distribution of lead in medical plants [J]. Agro-environm Protect,21(2): 143-145. [刘军,李先恩, 2002. 药用植物中铅的形态和分布研究 [J]. 农业环境保护,21(2): 143-145.]LIU XM,WANG QH, 2001. The latest development about phytoremediation of heavy metal contaminated soil [J]. J Gansu Agric Univ,36(1): 8-13. [刘秀梅,王庆仁, 2001. 植物修复重金属污染土壤的研究进展 [J]. 甘肃农业大学学报,36(1): 8-13.]
LU P,SANG WG,MA KP, 2005. Progress and prospects in research of an exotic invasive species,Eupatoriumadenophorum[J]. Acta Phytoecol Sin,29(6): 1 029-1 037. [鲁平,桑卫国,马克平, 2005. 外来入侵种紫茎泽兰研究进展与展望 [J]. 植物生态学报,29(6): 1 029-1 037.]NIU YF,FENG YL,XIE JL,et al, 2011. Effects of disturbance intensity on seed germination, seedling establishment and growth ofAgeratinaadenophora[J]. Guihaia,31(6): 795-800. [牛燕芬,冯玉龙,谢建磊,等, 2011. 干扰强度对群落中紫茎泽兰种子萌发、幼苗定居和生长的影响 [J]. 广西植物,31(6): 795-800. ]
QIAO L, HO G, 1996. The effect of clay amendment on speciation of heavy metals in sewage sludge [J]. Water Sci & Technol, 34(7-8): 413-420.
RAMOS I, ESTEBAN E, LUCENA J, et al, 2002. Cadmium uptake and subcellular distribution in plants ofLactucasp. Cd-Mn interaction [J]. Plant Sci, 162(5): 761-767.
SALT DE, BLAYLOCK M, KUMAR NPBA, et al, 1995. Phytoremediation: a novel strategy for the removal of toxic metals from the environment using plants [J]. Nature, 13(5): 468-474.
WANG WY,ZHANG CH, 2008. Study on the bryophytes from Shuiyindong carlin gold deposit in Guizhou [J]. Gold,29(6): 8-12. [汪文云,张朝晖, 2008. 贵州水银洞卡林型金矿苔藓植物研究 [J]. 黄金,29(6): 8-12.]
Weigel HJ,Jager HJ, 1980. Subcellular distribution and chemical form of cadmium in bean [J]. Plant Physiol, 65:480-482.
WU F, DONG J, QIAN QQ, et al, 2005. Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes [J]. Chemosphere, 60(10): 1 437-1 446.WU FB, ZHANG GP, DOMINY P, 2003. Four barley genotypes respond differently to cadmium:lipid peroxidation and activities of antioxidant capacity [J]. Environ & Exp Bot, 50(1): 67-78.
XIA XY,YANG LQ,ZHAI FQ,et al, 2007. Organic acids alleviating the toxicity of Cd to young wheat plants [J]. J Agro-Environ Sci,26(3): 990-995. [夏小燕,杨丽琴,翟福勤,等, 2007. 有机酸对小麦幼苗镉毒的缓解作用 [J]. 农业环境科学学报,26(3): 990-995.]
XU JL,SONG WC, 1991. Chemieal forms of Pb, Cd and Cu in crops [J]. Chin J Appl Ecol,2(3): 244-248. [许嘉琳,宋文昌, 1991. 农作物体内铅, 镉, 铜的化学形态研究 [J]. 应用生态学报,2(3): 244-248.]YANG JR,HUANG Y, 1994. Mechanism of heavy metal tolerance of plants [J]. Chin J Ecol,13(6): 20-26. [杨居荣,黄翌, 1994. 植物对重金属的耐性机理 [J]. 生态学杂志,13(6): 20-26.]
YANG WD,CHEN YT,QU MH,et al, 2009. Subcellular distribution and chemical forms of cadmium inSalixmatsudana[J]. Acta Bot Boreal-Occident Sin,(7): 1 394-1 399. [杨卫东,陈益泰,屈明华,等, 2009. 镉在旱柳中亚细胞分布及存在的化学形态 [J]. 西北植物学报,(7): 1 394-1 399.]ZHOU XY,CHOU RL,LI QF,et al, 2008. Effects of zinc on distribution and chemical for m of lead inPotentillagriffithiivar.velutina[J]. Acta Sci Circumst,28(10): 2 064-2 071. [周小勇,仇荣亮,李清飞,等, 2008. 锌对长柔毛委陵菜中铅的分布和化学形态的影响 [J]. 环境科学学报,28(10): 2 064-2 071.]
ZORNOZA P, VáZQUEZ S, ESTEBAN E, et al, 2002. Cadmium-stress in nodulated white lupin: strategies to avoid toxicity [J]. Plant Physiol Biochem, 40(12): 1 003-1 009.
ZU YQ, LI Y, CHEN JJ, et al, 2005. Hyperaccumulation of Pb,Zn and Cd in herbaceous grown on lead-zinc mining area in Yunnan, China [J]. Environm Inter, 31(5): 755-762.
Subcellular distribution and chemical forms of lead inEupatoriumadenophorumat different lead levels
LIU Xiao-Wen1,2,3, QI Cheng-Mei1, LI Yuan2,3, YAN Dong-Dong2,3,WANG Qiu-Xia2,3, GUO Mei-Xia2,3, CAO Ao-Cheng2,3*
( 1.CollegeofBiologicalandChemicalEngineering,HunanUniversityofScienceandTechnology, Yongzhou 425199, China;2.StateKeyLaboratoryforBiologyofDiseasesandInsertPests, Beijing 100193, China; 3.InstituteofPlantProtection,ChineseAcademyofAgriculturalSciences, Beijing 100193, China )
Abstract:The differential centrifugation technique and sequential chemical extraction method were used to study the subcellular distribution and chemical forms of lead in the roots, leaves and stems of Eupatorium adenophorum. The results showed that with the increasing of lead levels, the contents of lead in subcellular distribution of leaves, stems and roots significant increased. The lead distributed mainly in the soluble partition and cell wall in leaves, occupied 75.34%-84.63% of the total. Lead distributed in stems were similar to it in leaves. It mainly accumulated in the soluble partition and cell wall, which occupied 36.10%-57.14% and 20.07%-36.52%, respectively. And it distributed mainly in cell wall and soluble partition in roots, which occupied 39.20%-49.78% and 28.27%-37.62%, respectively. There was less lead in other organelles. The chemical forms of lead in leaves of E. adenophorum were mainly in HCl and water, occupied 58.74%-73.04% of the total. In stems, the main chemical forms were HAc and NaCl, and the chemical forms of HAc and HCl were predominant in roots, occupied 39.15%-52.91% of the total.
Key words:lead, Eupatorium adenophorum, subcellular distribution, chemical forms
DOI:10.11931/guihaia.gxzw201404010
收稿日期:2014-07-18修回日期: 2014-12-18
基金项目:国家公益性行业(农业)科技专项(201103027); 湖南省教育优秀青年项目(14B071);中国博士后科学基金第56批面上项目(2014M561110);湖南省自然科学基金(13JJ6080);湖南省重点学科建设项目(2011-76);湖南省高校科技创新团队支持计划项目(2012-318)[Supported by National Public Welfare Fund for Agricultural Research(201103027); Preject for Advanced Youth of Hunan Provincial Education Department(14B071); Postdoctoral Science Foundation of China(2014M561110); Key Discipline Construction Project of Hunan Province(2011-76); Science and Technology Innovation Team Plan of Hunan Provincial Colleges and Universities(2012-318)]。
作者简介:刘小文(1983-),男,湖南耒阳人,博士,副教授,研究方向为生物安全和环境毒理学,(E-mail)lxw1110@126.com。
*通讯作者:曹坳程,博士,研究员,研究方向为生物入侵和土壤消毒,(E-mail)caoac@vip.sina.com。
中图分类号:Q945.79
文献标识码:A
文章编号:1000-3142(2016)03-0335-07
刘小文,齐成媚,李园,等. 不同铅水平下紫茎泽兰细胞内铅的分布和化学形态的分析 [J]. 广西植物, 2016, 36(3):335-341
LIU XW, QI CM, LI Y, et al. Subcellular distribution and chemical forms of lead inEupatoriumadenophorumat different lead levels [J]. Guihaia, 2016,
36(3):335-341
