互花米草生物量变化对盐沼沉积物有机碳组分和来源的影响: 以王港河口潮滩为例
2016-06-23冯振兴高建华汪亚平高建慧白凤龙
冯振兴, 高建华,2*, 陈 莲, 汪亚平, 高建慧, 白凤龙
互花米草生物量变化对盐沼沉积物有机碳组分和来源的影响: 以王港河口潮滩为例
冯振兴1, 高建华1,2*, 陈 莲1, 汪亚平1, 高建慧3, 白凤龙4
(1. 南京大学 地理与海洋科学学院, 江苏 南京 210023; 2. 海洋沉积与环境地质国家海洋局重点实验室, 山东 青岛 266061; 3. 盐城工学院 环境科学与工程学院, 江苏 盐城 224059; 4. 青岛海洋地质研究所 国土资源部海洋油气与环境地质重点实验室, 山东 青岛 266071)
2012~2013年在江苏王港典型互花米草盐沼湿地采集了4根柱状样和48个表层样, 通过对比光滩和互花米草滩沉积物中总有机碳(TOC)、活性有机碳(LC)和顽固性有机碳(RC)含量, 结合互花米草生物量季节变化, 探讨了互花米草生物量对沉积物中有机碳组分的影响。结果表明, 互花米草滩表层沉积物中LC含量及其中互花米草来源比例, 均与互花米草地表枯落物量密切相关, 但存在两个月的“相位差”, 这与枯落物有机碳快速分解时间一致, 说明枯落物通过提高沉积物中LC的含量, 提高了TOC含量并改变了TOC组分。互花米草地下生物量主要分布在0~20 cm深度内, 该深度范围内互花米草滩各形态碳含量较高, LC和RC含量分别达到了光滩的4.03倍和1.70倍; 同时, TOC中LC所占比重在0~20 cm深度内较高, 也表现出先下降后不变的趋势; 另外, 不同深度各形态有机碳含量均与地下生物量之间存在较好的正相关关系, 说明地下生物量是影响沉积物各形态碳含量的重要因素, 且对LC的影响大于RC。
顽固性有机碳; 活性有机碳; 互花米草; 生物量; 季节动态
0 引 言
盐沼植被在整个盐沼湿地生态系统的有机碳循环中发挥着核心作用, 在大多数盐沼湿地, 植物是有机物的最主要来源[4‒5], 其生物量和枯落生物量是影响盐沼湿地生态系统有机碳累积和输出过程的关键因素之一[6‒10]。盐沼湿地有机碳成分复杂, 从生化顽固性方面可以分为顽固性有机碳(recalcitrant carbon, RC)和活性有机碳(labile carbon, LC)两部分[11]。一般而言, RC占TOC比重大, 能长期留存于土壤中, 对有机碳库的长期固存意义重大; LC占TOC比重小, 但具有较高的生物活性, 在短期内可以控制生态系统的生产力, 对植被类型等外界环境因子的变化更为敏感[12‒13]。
然而, 在外来种入侵背景下, 原有盐沼湿地生态系统中优势物种发生变化, 使盐沼湿地生态系统的结构和物质循环过程发生改变[14]。特别是外来种的生产力和原有物种有显著差异的情况下, 生态系统的生产力和输入土壤中的有机碳均显著地受到外来种入侵的影响[15‒16], 使原有盐沼湿地碳库的数量和组成均发生改变[17]。这不但影响了对全球碳质量平衡的估算, 也直接影响了对盐沼湿地在全球碳循环中地位和作用的正确评估[18‒19]。
互花米草(Loisel)于1982年被引种到江苏沿海, 此后凭借极强的适应性和繁殖能力, 在潮间带迅速扩张, 逐渐取代盐蒿()成为单一的优势物种, 形成了大面积的互花米草盐沼湿地[20]。至2007年, 互花米草盐沼在江苏分布面积已达187 km2, 占全国沿海潮间带盐沼总分布面积的54%[21]。已有研究表明, 互花米草引种能够显著增加盐沼有机碳的累积[5,17,22‒24], 同时也还提高了盐沼土壤水溶性有机碳、微生物量碳等活性有机碳组分含量[25‒27]。然而, 在短时间序列内, 对互花米草不同部位生物量(包括地上、地下生物量和枯落物量)在有机碳输出和累积中的作用仍缺乏深入了解。对此, 已有有机碳数量方面的一些研究[28], 然而在有机碳组成方面还有待进一步发现。本次工作拟选择小区域的盐沼湿地作为研究对象, 通过分析互花米草盐沼沉积物中活性和顽固性有机碳变化及其与互花米草生物量的内在联系, 探讨互花米草在盐沼湿地有机碳赋存中的作用机制, 为深入理解互花米草盐沼有机碳循环机制提供科学依据。
1 研究区概况
王港潮滩湿地(33°11.2′N, 120°45.5′E)位于江苏沿海中部地区, 海洋动力以潮汐作用为主, 为典型半日潮, 平均潮差为3.68 m, 波浪作用小, 沉积物供给充足, 发育有典型的淤泥质潮滩, 也是江苏沿海盐沼湿地发育的典型地区之一[29]。研究区位于北亚热带季风气候区, 年平均温度14.4 ℃, 年相对湿度81%, 年平均降水量1087.8 mm。互花米草自引种以来, 几十年间, 凭借极强的竞争性, 逐渐取代盐蒿成为潮滩先锋物种, 形成大片单一物种组成的互花米草盐沼湿地[20]。王港河是当地一条主要的入海河流, 受潮汐作用影响强烈, 两岸分布有典型的自然生物群落演替序列, 自海向陆依次为光滩、互花米草滩和芦苇()滩。采样点位于王港河口门上游5 km处, 此处由于围垦后河堤被人为加高, 芦苇仅在地势较高处生长, 呈现斑点状分布。因此, 很大程度上减小了其他类型植被有机质的干扰, 利于开展本项研究。
2 材料与方法
2.1 布点和采样
研究区设计有4条断面(图1), 2012年8月在此采集了4根柱状样(WG1―WG4), 其中WG1―WG3分别位于断面01―03的互花米草滩, WG4位于断面04的光滩。此外, 每条断面每次分别在光滩和互花米草滩定点采集表层样各1个, 自2012年8月至2013年6月期间, 每2个月1次(共6次), 共采集表层样48 (2×4×6)个。
在采集表层样的同时, 调查研究区互花米草枯落物量季节变化规律, 每次随机选择3个1 m × 1 m的样方, 齐地面割取互花米草植株后, 收集样方内的全部枯落物。2012年8月, 在3个调查枯落物量的样方点, 采集1 m × 1 m样方的地下5层根系(0~20cm、20~40 cm、40~60 cm、60~80 cm和80~100 cm), 放入网筛中冲洗、烘干, 称重后获得地下生物量随深度分布特征。
2013年6月于河口段20 km内均匀设置6个点, 分别采集涨潮、落潮水样, 现场加入浓度为5%的稀HCl至弱酸性, 用GF/F滤膜(预先于450 ℃烧4~6 h)过滤后冷冻保存, 带回实验室分析。
2.2 实验分析和测试
植物样品(包括枯落物和地下部分)在50 ℃下烘干至恒重, 称重法测互花米草生物量。选取少量根、茎和叶样品, 冷冻干燥后, 于球磨仪(RestchRM200)研磨过100目筛, 用DELTAplus Advantage同位素质谱仪分别测定其中碳同位素(13C)含量, 分析精度为0.1‰。水样同上。
沉积物样品采用酸解法[11]分离顽固性库(RP)和活性库(LP):用镊子剔除可见的生物碎屑, 以HCl溶液(1 mol/L)浸泡处理24 h得到沉积物有机质(SOM)。称取500 mg SOM放入试管, 加入20 mL H2SO4溶液(2.5 mol/L), 密封后在105 ℃条件下酸解30 min, 离心、倾析提取酸解产物后, 残渣用20 mL蒸馏水清洗, 清洗液加入酸解产物中得到LPⅠ。剩余残渣60 ℃烘干后, 加入2 mL H2SO4溶液(13 mol/L)于室温下振荡酸解12 h。然后加入蒸馏水稀释H2SO4溶液至1 mol/L, 105 ℃条件下酸解3 h。离心、倾析提取酸解产物后的残渣再用20 mL蒸馏水清洗, 清洗液离心、倾析加入酸解产物中, 得到LPⅡ。LPⅠ加入LPⅡ中, 得到LP。剩余残渣用蒸馏水漂洗2次, 转移到预先称重的坩埚中, 60 ℃烘干, 得到RP样品。SOM和RP样品研磨均至100目以下, 分别测定其中有机碳、氮含量, 得到总有机碳(TOC)、总氮(TN)和顽固性有机碳(RC)、顽固性氮(RN)以及同位素碳(13C)含量。实验中TOC、TN含量采用Leeman CE440元素分析仪测定, 测试精度为0.1%。

图1 研究区位置(a)和采样点分布图(b)
沉积物粒度数据采用英国Malvern公司生产的Mastersizer2000型激光粒度仪测得(测量范围为0.02~2000 μm, 重复测量的相对误差≤3%)。具体操作为: 取2~3 g样品置于烧杯中, 用镊子捡去植物碎屑, 加入5%的六偏磷酸钠溶液((NaPO3)6), 搅拌、浸泡24 h后上机测试。粒度参数计算采用矩值法。
2.3 数据处理
2.3.1 各形态互花米草来源有机碳比例
沉积物中13C值是植被和外源输入相对贡献的综合结果。本研究测得互花米草13C值介于–13.89‰ ~ –13.27‰之间, 是典型的C4植物, 以根、茎、叶中13C平均值–13.55‰作为互花米草植株的13Cs.p代表值。考虑到潮滩特殊的水动力环境, 假设外源有机质均是通过潮水涨落输入的, 分别以水样中颗粒态有机碳13C平均值(–27.97‰)和顽固性有机碳13C平均值(–28.32‰)作为外源13C代表值。依据端元线性混合模型[30](式1), 可计算出沉积物中互花米草来源TOC、RC所占比例:
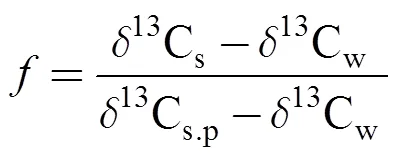
式中,13Cs和13Cw分别代表样品和外源有机质中TOC、RC的13C值,为TOC和RC中互花米草来源有机碳所占比例。根据质量平衡模型(式2), 可计算出LC中互花米草来源有机碳所占比例:
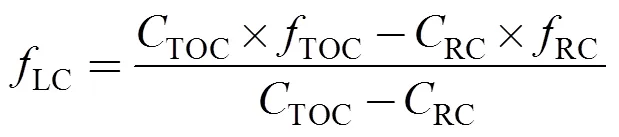
式中,TOC、RC和LC分别表示TOC、RC和LC中互花米草来源有机碳所占比例,TOC和RC分别表示TOC和RC含量。
2.3.2 沉积物活性有机碳13C值
依据Cheng.[31]提出的线性公式(式3), 通过TOC和RC的13C值可计算出活性碳同位素值13CLC:
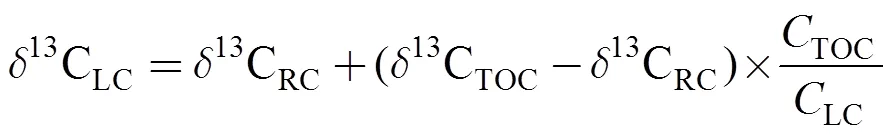
式中,13CTOC、13CRC和13CLC分别表示TOC、RC和LC中13C值,TOC和LC分别表示TOC和LC含量。
3 结 果
3.1 互花米草枯落物量季节动态和地下生物量分布
春季枯立物开始大量凋落, 从2月起地表枯落物量持续增加, 至6月达全年最高, 约209 g/m2。随着互花米草生长进入旺季, 枯落物量逐渐减小, 至12月降至最低。2月份植株已全部枯黄, 但仍然挺立, 枯落物量与12月份基本相当, 约170 g/m2(图2a)。
互花米草具有发达的地下根系, 地下生物量随着深度的增加呈指数衰减(图2b), 其中0~20 cm和20~40 cm深度内的平均生物量分别达到2896 g/m2和1312 g/m2, 各占地下生物量的60%和27%。由此可见, 地下生物量主要分布在表层40 cm深度内, 尤其是0~20 cm。
3.2 表层沉积物各形态有机碳特征
由表1可见, 互花米草滩表层沉积物中TOC含量介于9.69~13.10 mg/g之间, 其中LC和RC含量分别为4.35~5.97 mg/g和5.05~7.13 mg/g, 均显著大于光滩。互花米草滩各形态碳含量同时在8月达到最大, 但TOC和LC含量在2月最小, RC含量在12月最小。光滩各形态碳含量最大值均出现在6月, 最小值均出现在12月, 表现出与互花米草滩不同的季节变化趋势。
互花米草滩表层沉积物中LC在TOC中所占比重(LC/TOC)介于0.45~0.50之间, 平均值为0.46。光滩沉积物中这一数值在各个月份均低于互花米草滩, 年平均值为0.34。
互花米草滩活性库C/N值介于6.09~12.17之间, 季节变化较大, 且显著大于光滩。顽固库C/N值各月份互花米草滩均大于光滩, 但两者之间的差异不如活性库显著。
3.2.2 表层沉积物中各形态有机碳同位素季节动态
受互花米草的影响, 互花米草滩表层沉积物中TOC、LC和RC的13C值较光滩均显著偏重(表2)。
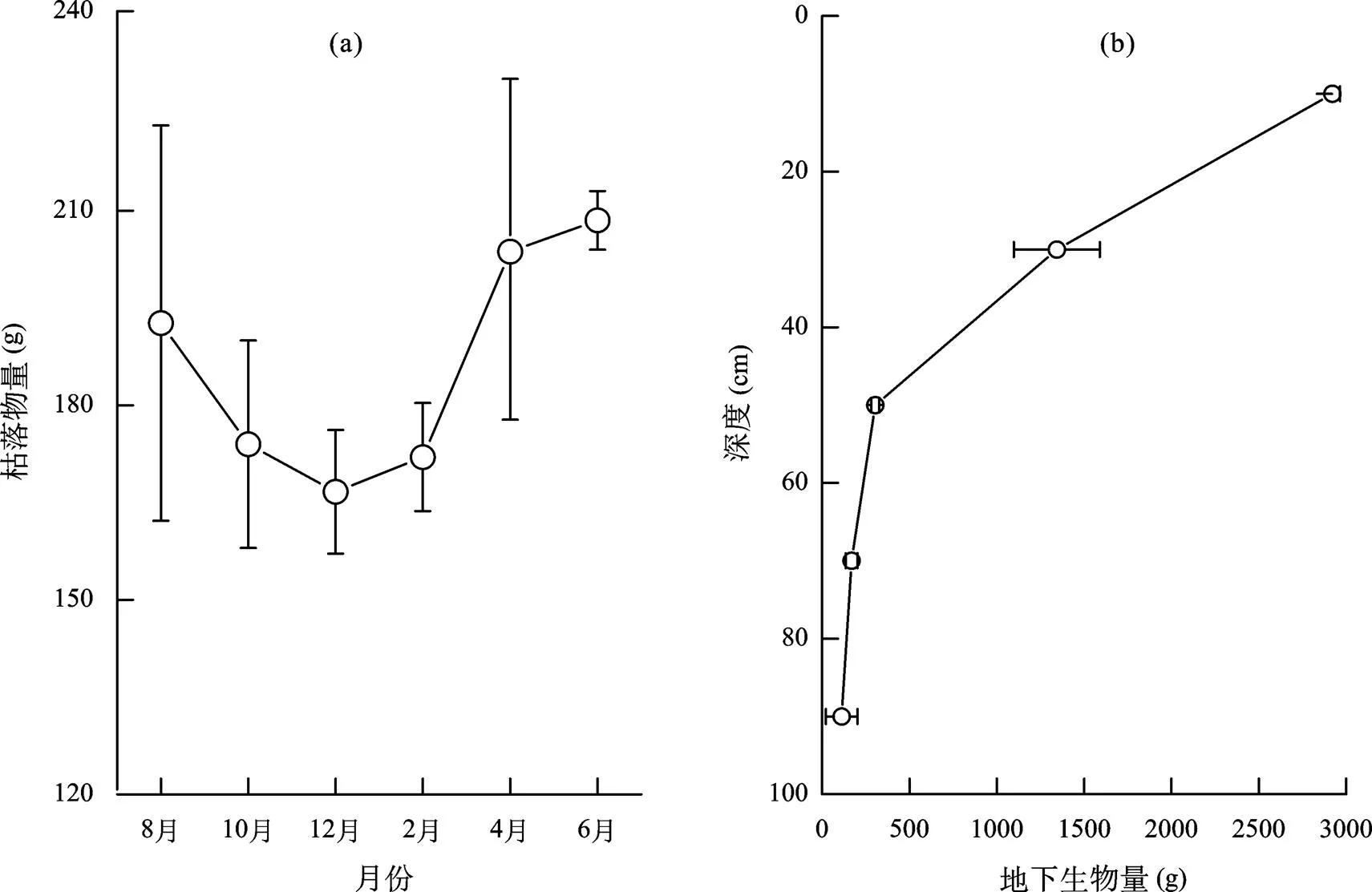
图2 地表枯落物量季节分配(a)及地下生物量分布(b)

表1 光滩/互花米草滩表层沉积物各形态有机碳、氮含量、碳氮比以及活性碳比重季节动态
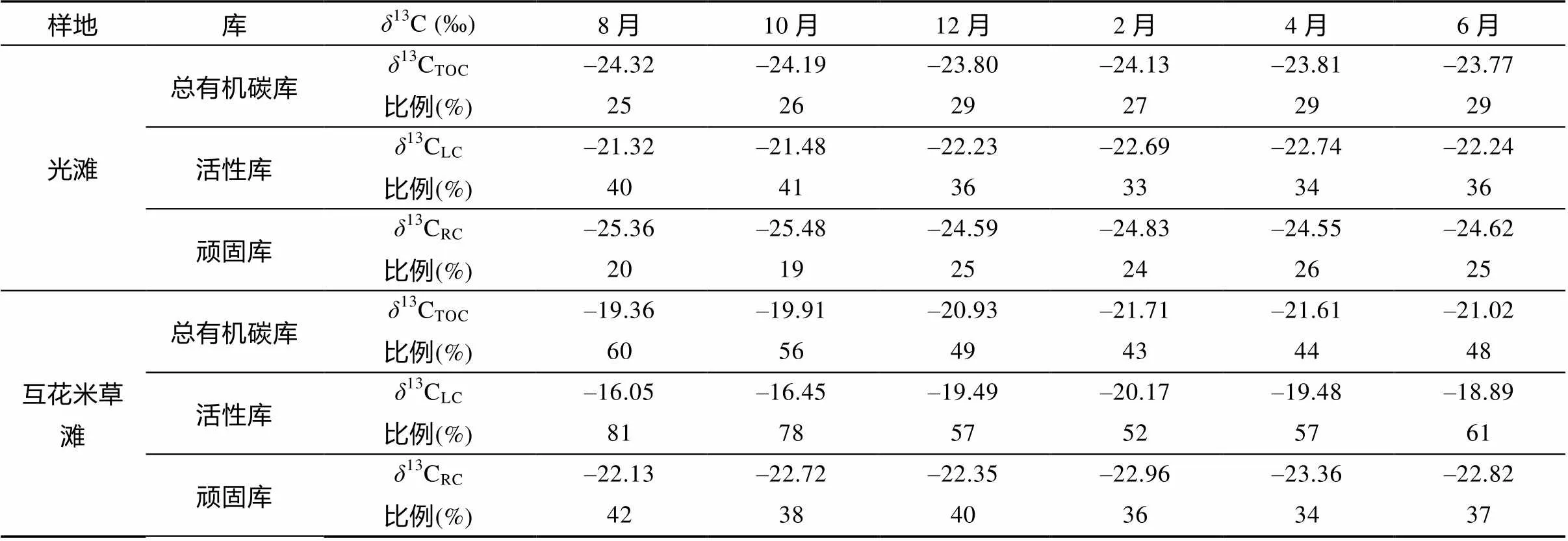
表2 光滩和互花米草滩表层沉积物中各形态有机碳δ13C值及其中互花米草来源比例
另外, 互花米草滩各形态碳的13C值季节变化波动较大, 尤其LC的13C值季节差异显著大于光滩。互花米草滩LC的13C值较TOC和RC明显偏重, TOC的13C值显著重于RC。光滩LC的13C值较TOC和RC也明显偏重, 但TOC和RC之间差异不显著。
端元混合模式计算结果显示(表2), 光滩和互花米草滩沉积物各形态碳中互花米草来源比例大小均表现为:LC>TOC>RC, 但光滩各形态碳这一数值及季节变化幅度均显著小于互花米草滩。互花米草滩TOC、LC和RC中互花米草贡献率同时在8月达到最大, 其中TOC和LC中这一贡献率季节变化一致, 在2月达到最小; 而RC中互花米草贡献率在4月最小, 且表现出与TOC和LC不同的季节变化趋势。
3.3 垂向沉积物中有机碳变化特征
互花米草滩柱样(WG1―WG3)之间各形态碳含量差异不大, 且表现出了极强的相似性, TOC含量范围依次为1.19~16.97、0.90~17.64和0.93~15.56 mg/g, LC含量范围分别为0.06~5.35、0.05~6.07和0.06~6.04 mg/g, RC含量范围依次为1.13~11.62、0.75~11.57和0.86~9.83 mg/g(图3)。三者均在亚表层(2.5~5 cm)达到峰值, 亚表层向下至20 cm深度内下降较快, 20 cm深度以下, 三者含量较低且基本稳定。光滩柱样(WG4)在0~30 cm深度内, TOC和RC含量变化较小, 平均值分别为4.90 mg/g和4.15 mg/g, 自30 cm至底部, TOC和RC含量逐渐降低。另外, LC含量整柱变化不大, 基本维持在0.35 mg/g上下微小波动。
目前日本的年轻一代很多人盛行“断舍离”“简简单单最好”的风潮,身上穿的、家里摆的都尽量要简洁设计、不会产生累赘感的,例如没有任何LOGO的的纯白T恤比较畅销,家电方面如冰箱、电视机、电话、电脑等等都倾向使用薄型产品,这种时候,薄型手表就应运而生了。薄型手表纤薄的外形,设计简洁的表盘,简单的功能等特点都符合目前年轻一代的追求时尚风
互花米草滩0~20 cm深度内TOC的13C值大致随深度呈减小趋势, 20 cm以下基本稳定, RC的13C值也表现出与此一致的变化趋势。光滩TOC和RC中13C值自上而下变化不大, 60 cm以下有细微偏重现象。互花米草滩TOC和RC的13C值在0~40 cm深度内均显著高于光滩, 40 cm以下两者差异不显著。
互花米草滩沉积物组分以粉砂为主, 表层有粗化现象。WG1柱在5~40 cm深度内变化不大, 40 cm以深逐渐变粗。WG2整柱波动较大, 在30 cm和60 cm上下较小范围内有明显细化的波动, 10 cm以下总体呈现变粗趋势。WG3柱15 cm以下大致逐渐变粗。WG4粒径波动主要集中在表层20 cm内, 下部变化不大。相比互花米草滩, 光滩0~20 cm深度内沉积物更细, 20 cm以下两者差异不显著。
4 讨 论
4.1 互花米草枯落物对表层有机碳的影响
有机质来源和沉积物粒径是影响沉积物有机碳含量的两个主要因素[30,32,33]。研究区互花米草滩表层沉积物中的TOC、LC和RC含量与平均粒径之间均无显著线性相关(>0.05), 说明互花米草滩沉积物中各形态有机碳含量更多地受到有机质来源因素的影响。
前期研究表明, 表层沉积物中TOC含量与地上生物量之间并无显著相关关系, 而是更多地受枯落物量及其季节变化的影响[28]。而本研究进一步证实, 互花米草滩沉积物中的有机碳组分变化也同样受枯落物量及其季节变化影响。首先, 互花米草滩表层沉积物中的LC含量与地表枯落物量的季节变化密切相关(图4)。研究区枯落物中有机碳的快速分解大致在两个月内完成[28], 因此LC含量变化要比枯落物量变化延迟两个月。消除两个月的相位差后, 枯落物量与LC含量之间存在显著正相关关系(<0.05), 与RC则无显著相关关系(>0.05)。这说明枯落物量的季节变化直接影响了LC含量的季节变化; 其次, 互花米草枯落物的分解提高了沉积物中LC在TOC中所占比重。互花米草滩表层沉积物中LC/TOC显著大于光滩, 而互花米草来源有机碳中这一数值达到了0.54~0.62, 超过50%的互花米草来源有机碳转化成了LC; 第三, 互花米草滩表层沉积物的LC中互花米草来源比例也与枯落物量的季节变化高度相关, 但季节变化上同样存在两个月的相位差。端元混合模型计算结果表明(表2), 自12月开始, 随着枯落物量的增加, LC中互花米草来源比例从2月起逐渐增加, 至8月达到最大值81%。此后由于枯落物的减少, 互花米草贡献比例也逐渐较小, 于2月达到最小值52%。C/N值的季节变化也表现出了相同的趋势。这进一步证明, 枯落物分解通过提高沉积物中的LC含量, 从而增加了TOC含量并改变了TOC的组分。
Berg.的研究发现, LC含量的增加可导致RC含量相应的增加[11,34], 本文中RC和LC含量季节变化趋势除冬季外基本一致也证实了这一点(表1)。互花米草滩LC含量在2月最小, 而RC含量在12月最小。然而, 12月份互花米草滩沉积物中来源于互花米草的RC无论是数量还是比例均高于2月份; 另外, 光滩沉积物中, 非互花米草来源的RC含量也同样在12月出现最小值。由此可以判断, 外源RC在12月份输入较小是导致这一现象的主要原因。
4.2 互花米草地下生物量对各形态有机碳的影响
互花米草滩沉积物中LC、RC和TOC含量之间呈现出显著的线性正相关关系(<0.01), 说明LC和RC含量的同时增加导致了TOC含量的增加。之前的研究表明, 互花米草大量地下根系不但增加了土壤中的TOC含量, 其生长特征也影响到了TOC的垂向分布形态[28,35,36]。本文研究结果进一步显示, 互花米草地下生物量同样影响了不同组分有机碳含量的垂向分布:首先, 互花米草滩LC和RC含量随深度的增加呈现指数衰减趋势, 这与互花米草地下生物量分布在形态上具有高度相似性; 其次, 不同深度地下生物量与LC和RC含量(相应层位的平均值)之间也存在显著的正相关(<0.01)(图5)。

受互花米草生长的影响, 互花米草滩沉积物中顽固性有机碳13C值显著重于光滩, 且在0~20 cm深度内迅速减小, 与20 cm以下相比也显著偏重, 明显受到互花米草地下根茎的影响。同时, 互花米草滩沉积物TOC中LC组分的相对比重有着与地下生物量相似的分布特征, 显示出互花米草植物体残体对沉积物中有机碳组分的影响。互花米草滩柱样中RC的13C值显著高于TOC, 但RC中互花米草贡献比例却显著低于TOC, 说明互花米草贡献的有机碳更多的输入到了LC中。进一步分析发现, 0~20 cm深度内互花米草滩沉积物中RC含量是光滩的1.70倍, 而LC含量则达到了光滩的4.03倍。因此, 互花米草地下生物量对LC的影响大于RC。本文认为造成这种现象的原因主要有以下两方面: 一方面, 0~20 cm内分布有60%的地下生物量, 根系分泌物是LC的一个主要来源[37‒38], 密集的根系提供了大量的LC; 另一方面, 0~20 cm内C/N值较高, 限制了微生物的活动, 有利于LC的积累[39‒40]。
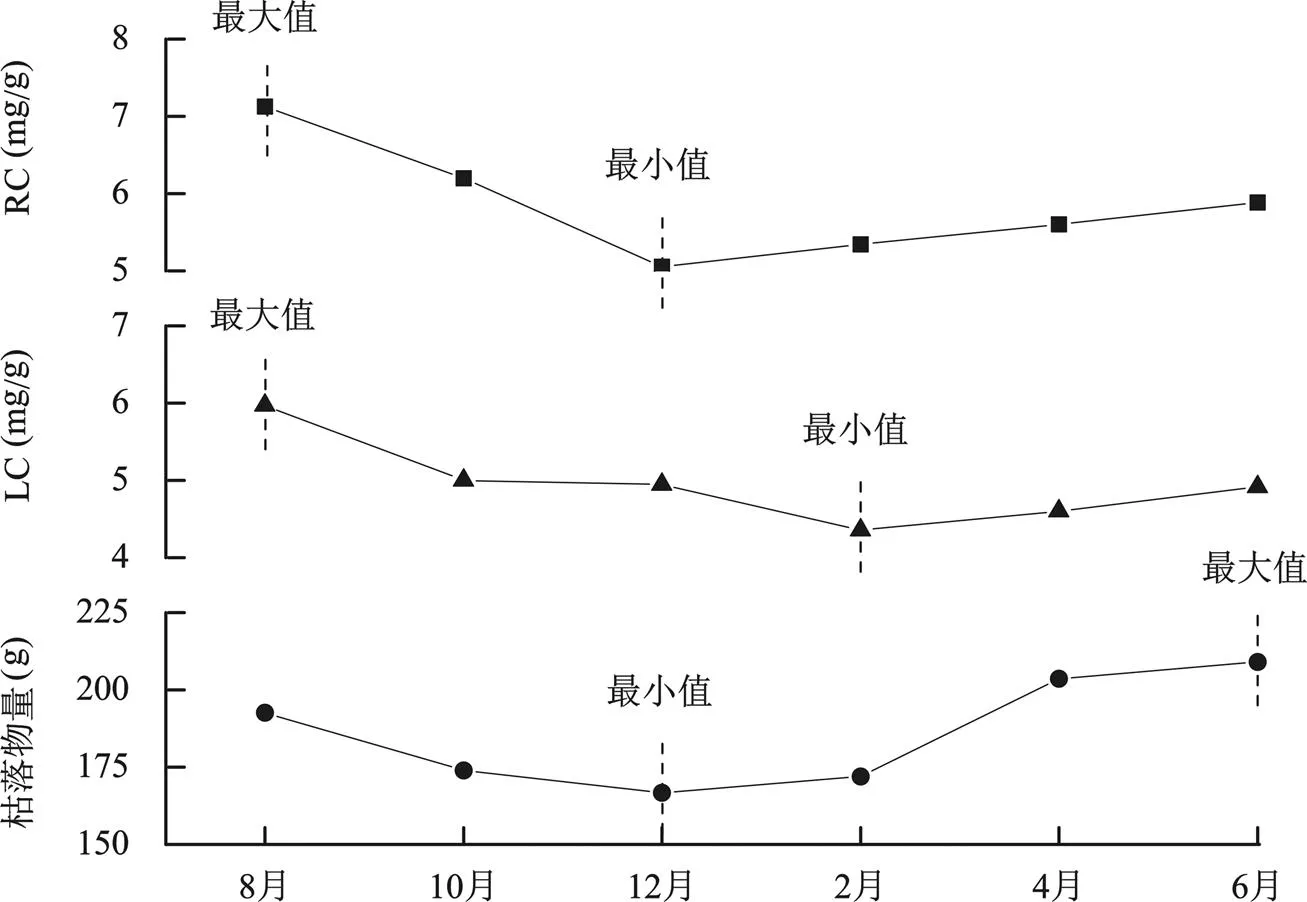
图4 地表枯落物、表层沉积物活性碳以及顽固性碳含量
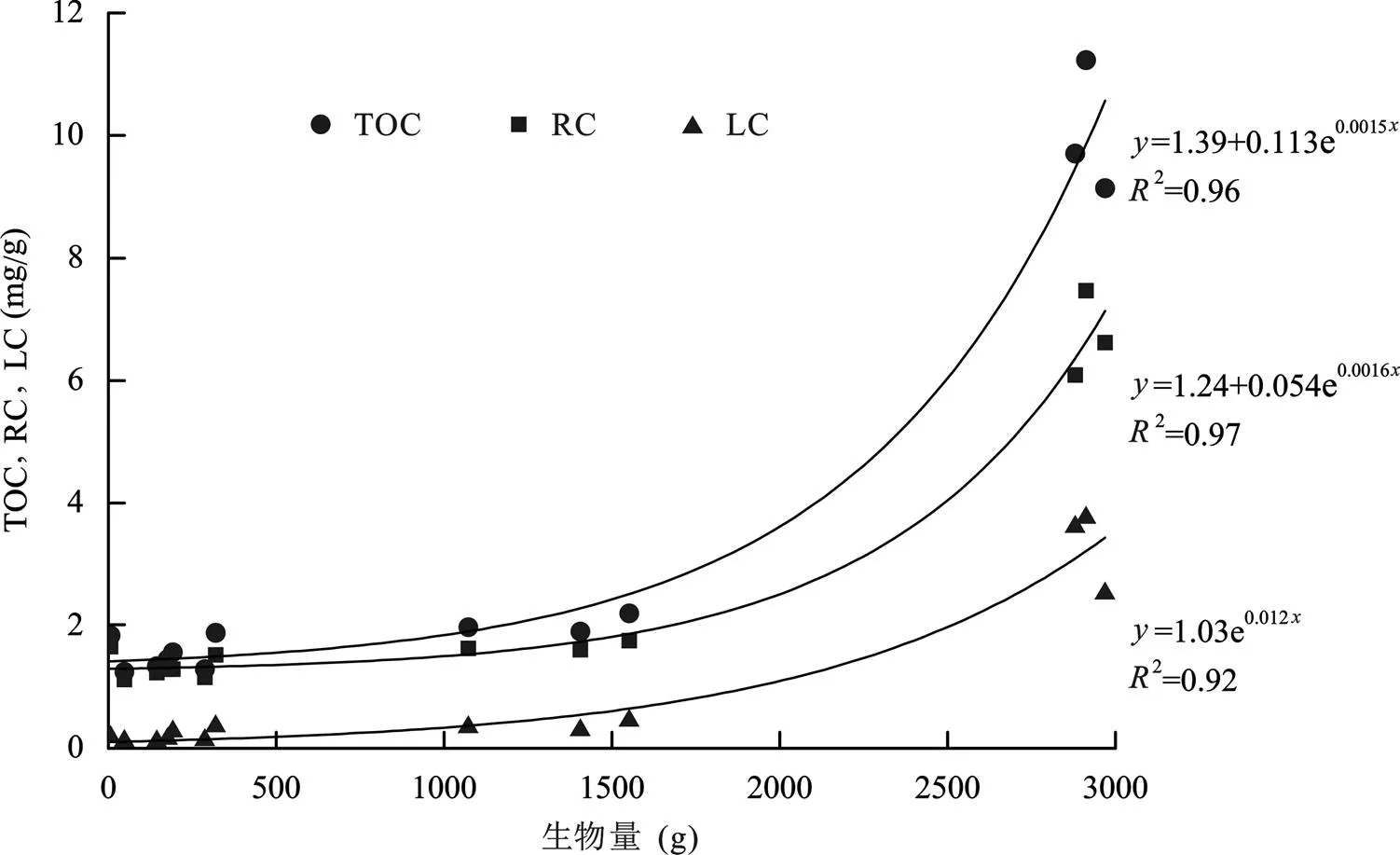
图5 不同深度生物量与各组分有机碳含量的关系
5 结 论
互花米草滩表层沉积物中TOC、LC和RC含量范围分别为9.69~13.10、4.35~5.97和5.05~7.13 mg/g, 各形态碳含量均显著高于光滩, 并且呈现出不同的季节变化趋势。其中, LC含量变化和枯落物量季节变化密切相关。但由于枯落物中有机碳快速分解大致需要两个月的时间, 因此LC含量变化要比枯落物量变化延迟两个月。RC含量及其中互花米草来源比例季节差异不大, 受枯落物分解的影响不如LC显著。互花米草地下生物量具有随着深度的增加呈指数衰减的分布形态, 其中, 超过50%的地下生物量分布在表层20 cm深度内。互花米草滩沉积物中各形态碳含量自表向下逐渐降低, 0~20 cm深度范围内含量较高且下降较快, LC/TOC也呈现出先下降后不变的趋势, 这些变化都与互花米草地下生物量分布较为相似。此外, 垂向各形态碳含量与地下生物量间均存在较好的正相关关系, 说明地下生物量是影响各形态碳含量垂向分布的重要因素。
朱庆光、徐夏楠、徐粲、吴丹丹参与了野外数据采集工作; 陈景东、于睿在图件绘制过程中给予了宝贵意见, 在此一并表示感谢。
[1] Amundson R. The carbon budget in soils[J]. Annu Rev Earth Planet Sci, 2001, 29(1): 535–562.
[2] Choi Yong-hong, Wang Yang. Dynamics of carbon sequestration in a coastal wetland using radiocarbon measurements[J]. Global Biogeochem Cy, 2004, 18(4), doi: 10.1029/2004GB002261.
[3] 曹磊, 宋金明, 李学刚, 袁华茂, 李宁, 段丽琴. 滨海盐沼湿地有机碳的沉积与埋藏研究进展[J]. 应用生态学报, 2013, 24(7): 2040–2048. Cao Lei, Song Jin-ming, Li Xue-gang, Yuan Hua-mao, Li Ning, Duan Li-qin. Deposition and burial of organic carbon in coastal salt marsh: Research progress[J]. Chinese J Appl Ecol, 2013, 24(7): 2040–2048 (in Chinese with English abstract).
[4] Bull I D, van Bergen P F, Bol R, Brown S, Gledhill A R, Gray A J, Harkness D D, Woodbury S E, Evershed R P. Estimating the contribution ofbiomass to salt-marsh sediments using compound specific stable carbon isotope measurements[J]. Org Geochem, 1999, 30(7): 477–483.
[5] Gao Jian-hua, Bai Feng-long, Yang Yang, Gao Shu, Liu Zhi-yong, Li Jun. Influence ofcolonization on the supply and accumulation of organic carbon in tidal salt marshes of northern Jiangsu Province, China[J]. J Coast Res, 2012, 28(2): 486–498.
[6] Schalles J F, Shure D J. Hydrology, community structure, and productivity patterns of a dystrophic Carolina bay wetland[J]. Ecol Monogr, 1989: 365–385.
[7] Negrin V L, Spetter C V, Asteasuain R O, Perillo G M, Marcovecchio J E. Influence of flooding and vegetation on carbon, nitrogen, and phosphorus dynamics in the pore water of asalt marsh[J]. J Environ Sci, 2011, 23(2): 212–221.
[8] Hodson R E, Christian R R, Maccubbin A E. Lignocellulose and lignin in the salt marsh grass: Initial concentrations and short-term, post-depositional changes in detrital matter[J]. Mar Biol, 1984, 81(1): 1–7.
[9] White D S, Howes B L. Nitrogen incorporation into decomposing litter of[J]. Limnol Oceanogr, 1994, 39(1): 133–140.
[10] Simões M P, Calado M L, Madeira M, Gazarini L C. Decomposition and nutrient release in halophytes of a Mediterranean salt marsh[J]. Aquat Bot, 2011, 94(3): 119–126.
[11] Rovira P, Vallejo V R. Labile and recalcitrant pools of carbon and nitrogen in organic matter decomposing at different depths in soil: An acid hydrolysis approach[J]. Geoderma, 2002, 107(1): 109–141.
[12] Belay-Tedla A, Zhou Xu-hui, Su Bo, Wan Shi-qiang, Luo Yi-qi. Labile, recalcitrant, and microbial carbon and nitrogen pools of a tallgrass prairie soil in the US Great Plains subjected to experimental warming and clipping[J]. Soil Biol Biochem, 2009, 41(1): 110–116.
[13] McLauchlan K K, Hobbie S E. Comparison of labile soil organic matter fractionation techniques[J]. Soil Sci Soc Am J, 2004, 68(5): 1616–1625.
[14] Chen Jin-hai, Wang Lei, Li Yan-li, Zhang Wen-quan, Fu Xiao-hua, Le Yi-quan. Effect of Spartina alterniflora invasion and its controlling technologies on soil microbial respiration of a tidal wetland in Chongming Dongtan, China[J]. Ecol Eng, 2012, 41: 52–59.
[15] Ehrenfeld J G, Scott N. Invasive species and the soil: Effects on organisms and ecosystem processes[J]. Ecol Appl, 2001, 11(5): 1259–1260.
[16] Windham L, Ehrenfeld J G. Net impact of a plant invasion on nitrogen-cycling processes within a brackish tidal marsh[J]. Ecol Appl, 2003, 13(4): 883–896.
[17] Zhang Yao-hong, Ding Wei-xin, Luo Jia-fa, Donnison A. Changes in soil organic carbon dynamics in an Eastern Chinese coastal wetland following invasion by a C4plant[J]. Soil Biol Biochem, 2010, 42(10): 1712–1720.
[18] Mcleod E, Chmura G L, Bouillon S, Salm R, Björk M, Duarte C M, Lovelock C E, Schlesinger W H, Silliman B R. A blueprint for blue carbon: Toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2[J]. Front Ecol Environ, 2011, 9(10): 552–560.
[19] Guo Hai-qiang, Noormets A, Zhao Bin, Chen Ji-quan, Sun Ge, Gu Yong-jian, Li Bo, Chen Jia-kuan. Tidal effects on net ecosystem exchange of carbon in an estuarine wetland[J]. Agr Forest Meteorol, 2009, 149(11): 1820–1828.
[20] Zhang R S, Shen Y M, Lu L Y, Yan S G, Wang H Y, Li J L, Zhang Z L. Formation ofsalt marshes on the coast of Jiangsu Province, China[J]. Ecol Eng, 2004, 23(2): 95–105.
[21] 左平, 刘长安, 赵书河, 王春红, 梁玉波. 米草属植物在中国海岸带的分布现状[J]. 海洋学报, 2009, 31(5): 101–111. Zuo Ping, Liu Chang-an, Zhao Shu-he, Wang Chun-hong, Liang Yu-bo. Distribution ofplantations along the China’s coast[J]. Acta Oceanol Sinica, 2009, 31(5): 101–111 (in Chinese with English abstract).
[22] 高建华, 杨桂山, 欧维新. 互花米草引种对苏北潮滩湿地TOC、TN和TP分布的影响[J]. 地理研究, 2007, 26(4): 799–808. Gao Jian-hua, Yang Gui-shan, Ou Wei-xin. The influence after introduction ofon the distribution of TOC, TN and TP in the national Yancheng rare birds nature reserve, Jiangsu Province, China[J]. Geogr Res, 2007, 26(4): 799–808 (in Chinese with English abstract).
[23] Cheng Xiao-li, Luo Yi-qi, Chen Ji-quan, Lin Guang-hui, Chen Jian-kuan, Li Bo. Short-term C4plantinvasions change the soil carbon in C3plant-dominated tidal wetlands on a growing estuarine Island[J]. Soil Biol Biochem, 2006, 38(12): 3380–3386.
[24] Li Bo, Liao Cheng-zhang, Zhang Xiao-dong, Chen Hui-li, Wang Qing, Chen Zhong-yi, Gan Xiao-jing, Wu Ji-hua, Zhao Bin, Ma Zhi-jun, Cheng Xiao-li, Jiang Li-fei, Chen Jia-kuan.invasions in the Yangtze River estuary, China: An overview of current status and ecosystem effects[J]. Ecol Eng, 2009, 35(4): 511–520.
[25] 周虹霞, 刘金娥, 钦佩. 外来种互花米草对盐沼土壤微生物多样性的影响——以江苏滨海为例[J]. 生态学报, 2005, 25(9): 2304–2311. Zhou Hong-xia, Liu Jin-e, Qin Pei. Effects of an alien species () on soil microorganism diversity in salt marshes, Jiangsu coastal inter-tidal ecosystem[J]. Acta Ecol Sinica, 2005, 25(9): 2304–2311 (in Chinese with English abstract).
[26] 张耀鸿, 王艳玲, 李仁英, 朱红霞, 张富存, 黄宾宾, 彭晓丹. 互花米草入侵对潮滩土壤活性有机碳组分的影响[J]. 土壤通报, 2012, 43(1): 102–106. Zhang Yao-hong, Wang Yan-ling, Li Ren-ying, Zhu Hong-xia, Zhang Fu-cun, Huang Bin-bin, Peng Xiao-dan. Effects ofinvasion on active soil organic carbon in the coastal marshes[J]. Chinese J Soil Sci, 2012, 43(1): 102–106 (in Chinese with English abstract).
[27] Yang Wen, Zhao Hui, Chen Xing-long, Yin Sheng-lai, Cheng Xiao-li, An Shu-qing. Consequences of short-term C4plantinvasions for soil organic carbon dynamics in a coastal wetland of Eastern China[J]. Ecol Eng, 2013, 61: 50–57.
[28] 冯振兴, 高建华, 陈莲, 汪亚平, 高建慧, 白凤龙. 互花米草生物量变化对盐沼沉积物有机碳的影响[J]. 生态学报, 2015, 35(7): 2038–2047. Feng Zhen-xing, Gao Jian-hua, Chen Lian, Wang Ya-ping, Gao Jian-hui, Bai Feng-long. The response of organic carbon content to biomass dynamics inmarsh[J]. Acta Ecol Sinica, 2015, 35(7): 2038–2047 (in Chinese with English abstract).
[29] 任美锷. 江苏省海岸带和海涂资源综合调查[M]. 北京: 海洋出版社, 1986: 517p. Ren Mei-e. Comprehensive Investigation of the Coastal Zone and Tidal Land Resources of Jiangsu Province[M]. Beijing: China Ocean Press, 1986: 517p (in Chinese).
[30] Andrews J E, Greenaway A M, Dennis P F. Combined carbon isotope and C/N ratios as indicators of source and fate of organic matter in a poorly flushed, tropical estuary: Hunts Bay, Kingston Harbour, Jamaica[J]. Estuar Coast Shelf Sci, 1998, 46(5): 743–756.
[31] Cheng Xiao-li, Chen Ji-quan, Luo Yi-qi, Henderson Rachel, An Shu-qing, Zhang Quan-fa. Chen Jia-kuan, Li Bo. Assessing the effects of short-terminvasion on labile and recalcitrant C and N pools by means of soil fractionation and stable C and N isotopes[J]. Geoderma, 2008, 145(3): 177–184.
[32] Mayer L M. Surface area control of organic carbon accumulation in continental shelf sediments[J]. Geochim Cosmochim Acta, 1994, 58(4): 1271–1284.
[33] Gao Jian-hua, Wang Ya-ping, Pan Shao-ming, Zhang Rui, Li Jun, Bai Feng-long. Spatial distributions of organic carbon and nitrogen and their isotopic compositions in sediments of the Changjiang Estuary and its adjacent sea area[J]. J Geogr Sci, 2008, 18(1): 46–58.
[34] Berg B, Matzner E. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems[J]. Environ Rev, 1997, 5(1): 1–25.
[35] Hibbard K A, Archer S, Schimel D S, Valentine D W. Biogeochemicalchanges accompanying woody plant encroachmentin a subtropical savanna[J]. Ecology, 2001, 82(7): 1999–2011.
[36] Liao Cheng-zhang, Luo Yi-qi, Jiang Li-fen, Zhou Xu-hui, Wu Xiao-wen, Fang Chang-ming, Chen Jia-kuan, Li Bo. Invasion ofenhanced ecosystem carbon and nitrogen stocks in the Yangtze Estuary, China[J]. Ecosystems, 2007, 10(8): 1351–1361.
[37] Bolan N S, Baskaran S, Thiagarajan S. An evaluation of the methods of measurement of dissolved organic carbon in soils, manures, sludges, and stream water[J]. Comm Soil Sci Plant Anal, 1996, 27(13/14): 2723–2737.
[38] 柳敏, 宇万太, 姜子绍, 马强. 土壤活性有机碳[J]. 生态学杂志, 2006, 25(11): 1412–1417. Liu Min, Yu Wan-tai, Jiang Zi-shao, Ma Qiang. A research review on soil active organic carbon[J]. Chinese J Ecol, 25(11): 1412–1417 (in Chinese with English abstract).
[39] 向成华, 栾军伟, 骆宗诗, 宫渊波. 川西沿海拔梯度典型植被类型土壤活性有机碳分布[J]. 生态学报, 2010, 30(4): 1025–1034. Xiang Cheng-hua, Luan Jun-wei, Luo Zong-shi, Gong Yuan-bo. Labile soil organic carbon distribution on influenced by vegetation types along an elevation gradient in west Sichuan, China[J]. Acta Ecol Sinica, 2010, 30(4): 1025–1034 (in Chinese with English abstract).
[40] Marin-Spiotta E, Silver W L, Swanston C W, Ostertag R. Soil organic matter dynamics during 80 years of reforestation of tropical pastures[J]. Global Change Biol, 2009, 15(6): 1584–1597.
Impact ofbiomass variation on content and sources of organic carbon fractions in salt marshes: A case study of tidal salt marsh of Wanggang Estuary, Jiangsu Province
FENG Zhen-xing1, GAO Jian-hua1,2*, CHEN Lian1, WANG Ya-ping1, GAO Jian-hui3and BAI Feng-long4
1. School of Geographic and Oceanographic Sciences, Nanjing University, Nanjing 210023, China; 2. Key Laboratory of Marine Sedimentology and Environmental Geology, State Oceanic Administration, Qingdao 266061, China; 3. School of Environmental Science and Engineering, Yancheng Institute of Technology, Yancheng 224059, China; 4. The Key Laboratory of Marine Hydrocarbon Resources and Environmental Geology, Ministry of Land and Resources, Qingdao Institute of Marine Geology, Qingdao 266071; China
In order to investigate the impact ofinvasion on soil organic carbon dynamics in north Jiangsu coastal wetlands, four sediment cores were collected at the intertidal flats near the estuary of the Wanggang River in 2012. Surface sediments as well as the biomass ofwere gathered bimonthly from October 2012 to June 2013. We analyed the labile and recalcitrant C and N in both coral and surface sediments using soil fraction and stable organic carbon isotopes. Our results show that seasonal variation of labile organic carbon (LC) content is closely related to surface litter mass, but a 2-month phase shift exists between them. Meanwhile, the phase-shift phenomenon was also recorded for the proportion of LC orginated fromand surface litter mass. However, the content of RC (recalcitrant organic carbon) was found to be not as significantly correlated to the surface litter mass as that of LC, indicating that litter is a dominant source of LC in surface sediments and the fractions of TOC were changed by incresed LC inputs fromlitter. Furthermore, underground biomass displayed an exponential decay curve corresponding to sediment depth, as 60% of the biomass was observed in the top 20 cm layer.On one hand,invasion can largely increase the contents of both LC and RC when compared with the bare flat, especially within the 0‒20 cm depth sediment layer. The average LC and RC contents in sediments of the top 20 cm depth layer insalt marsh, were 170% and 403% that of the sediments in bare flat, respectively, in terms of the quantity 3.27 and 6.75 mg/g, On the other hand, the LC and RC contents ofmarsh sediments at depths < 20 cm, together with the proportion of LC fraction in TOC, were significantly higher than those in deeper sediment layers (>20 cm), and show a decreasing trend from surface to the depth of 20 cm. The fractions of organic carbon in coral sediments performed a remarkably positive correlatation toground biomass, implying that underground biomass greatly influenced the organic carbon fractions in sediments along the profiles.
recalcitrant carbon; labile carbon;; biomass; dynamics
P597
A
0379-1726(2016)01-0087-11
2014-12-08;
2015-07-09;
2015-09-28
国家重大科学研究计划(2013CB956503); 海洋沉积物与环境地质国家海洋局重点实验室开放基金(MASEG201205); 国土资源部海洋油气资源和环境地质重点实验室基金(MRE201408)
冯振兴(1990–), 男, 硕士研究生, 海洋地质专业。E-mail: zhenxing.feng@163.com
GAO Jian-hua, E-mail: jhgao@nju.edu.cn; Tel: +86-25-89681356
