超分子法制备包埋有机小分子的磷酸钙纳米粒
2016-06-23姚日生
汪 雷, 姚日生, 陶 伟
(合肥工业大学 医学工程学院,安徽 合肥 230009)
超分子法制备包埋有机小分子的磷酸钙纳米粒
汪雷,姚日生,陶伟
(合肥工业大学 医学工程学院,安徽 合肥230009)
摘要:将有机功能小分子包埋于磷酸钙纳米粒里在纳米药物制备等技术中具有重要的意义,但大多数有机小分子在水中溶解度较差、结合磷酸钙的能力不强,从而增加了将其包埋在磷酸钙纳米粒里的难度。文章通过加入羧甲基-β-环糊精,使得与之结合的模型分子的溶解度与磷酸钙结合能力增强,从而解决了上述问题。结果表明亲水性的罗丹明B和疏水性的偶氮苯等模型分子能有效地包埋在磷酸钙纳米粒中。
关键词:磷酸钙纳米粒;羧甲基-β-环糊精;罗丹明B;偶氮苯
近年来,以磷酸钙纳米粒作为药物载体的研究受到人们的广泛关注。其首要原因是磷酸钙具有良好的生物相容性,是人体硬组织如骨骼及牙齿的主要无机成分;其次,磷酸钙具有pH值依赖的溶解性,它在血浆(pH=7.4)中几乎难以溶解,而当pH值下降到6以下,磷酸钙溶解为人体内广泛存在且必需的磷酸根和钙离子;磷酸钙纳米粒因其纳米尺寸而具有富集于肿瘤组织内的能力。所以,纳米磷酸钙被认为是近乎理想的药物载体[1-4]。
大多数小分子药物很难溶解于水中,且这些小分子也往往不具备绑缚磷酸钙的官能团。因此,制备包埋小分子的磷酸钙纳米粒是一项具有挑战性的工作。近年来,包埋小分子的纳米磷酸钙的制备方法主要分为以下两大类:① 基于双反相乳液的制备方法[5-7],这种方法要求被包埋的小分子药物具有一定的水溶性或需要有机溶剂作为辅助,同时目标小分子也需要具有能够绑缚磷酸钙的羧基或硫酸根等官能基团的存在;② 基于高分子组装体[8-12]、脂质体[13]、介孔二氧化硅[14-15]等辅助纳米颗粒的包埋方法,其核心在于先将目标药物负载于这些纳米颗粒,然后将磷酸钙沉积于这些纳米的表面以达到包埋的目的。
β-环糊精是一种可以通过超分子相互作用复合小分子的环状多糖,这一超分子性质使其广泛地应用于药物分子制剂的研究中[16-17]。同时,β-环糊精的环状边缘具有大量的羟基,可以方便地进行修饰[18-19]。目前将β-环糊精与磷酸钙的特点相结合的研究并不多,本文提出一种基于β-环糊精超分子性质制备包埋有机小分子的磷酸钙纳米粒制备方法,将羧基修饰的β-环糊精与目标小分子形成超分子复合体,这时,β-环糊精不仅增加了目标分子的溶解性,同时β-环糊精环状边缘修饰的羧基具有绑缚磷酸钙晶粒的性质,当磷酸钙通过水相沉淀法制备生成时可完成对目标分子的包埋。实验选用罗丹明B和偶氮苯分别作为水溶及疏水小分子药物模型对该方法进行验证。结果表明,通过羧基化β-环糊精的辅助,可以将缺少磷酸钙亲合能力的水溶性药物及疏水性药物进行有效地包埋。
1实验部分
1.1羧甲基-β-环糊精的制备
取9.1 gβ-环糊精与7.5 g NaOH在30 mL蒸馏水中混合,加热至60 ℃,逐滴加入70 mL浓度为1 mol/L的一氯乙酸水溶液,滴加时间控制在30 min左右。保持60 ℃搅拌4 h后,将混合物冷却至室温(25 ℃),并用浓盐酸调节pH值至10。混合液在室温下反应12 h后使用浓盐酸中和至中性。将混合液倾入过量的乙醇,得到浑浊悬浮液,过滤得到白色沉淀物。将白色固体重新溶解在水中,再于乙醇中沉淀2次,收集沉淀物,最后将沉淀在40 ℃下真空干燥得到产物。
1.2磷酸钙纳米粒的制备
将20 mg羟甲基β-环糊精和8 mg罗丹明B加入2 mol/L的20 mL氯化钙水溶液中混合直至溶液澄清,在30 min内逐滴加入磷酸氢二钠0.04 mol水溶液。滴加完毕后,用1 mol/L的NaOH水溶液调节混合物pH值至10,并搅拌1 h。加入30 mg柠檬酸钠。将混合物继续搅拌1 h后,在水中透析(截留分子量为3 500 Da)24 h。然后将混合液以10 000 r/min离心15 min,得到沉淀产物。将沉淀于乙醇中搅拌均匀,再以10 000 r/min离心15 min,洗出残留在表面上的罗丹明B。搅匀、离心的步骤重复至少3次,直至上清液无色透明,收集最终产物,并于40 ℃条件下真空干燥。
在罗丹明B水溶液中直接制备磷酸钙纳米粒,制备过程与包埋罗丹明B的磷酸钙纳米粒一致,但没有加入羟甲基β-环糊精。
在磷酸钙生成后加入罗丹明B和羧甲基-β-环糊精的混合液是为了验证羧甲基-β-环糊精是否能将罗丹明B固定在磷酸钙的表面。向12 mL磷酸氢二钠(0.04 mol)水溶液中滴加2 mol/L氯化钙的水溶液20 mL。将混合液用1 mol/L的NaOH水溶液调节pH值至10,并搅拌1 h。然后将预先混合在20 mL水中1 h的20 mg羟甲基-β-环糊精和8 mg罗丹明B溶液加入。混合液搅拌1 h后加入30 mg柠檬酸钠。继续搅拌1 h,将所得产物以上述实验程序进行纯化获取。
在羧甲基-β-环糊精和偶氮苯的混合液中制备磷酸钙纳米粒,实验步骤与羧甲基-β-环糊精辅助下制备包埋罗丹明B磷酸钙纳米粒一致,将8 mg罗丹明B换为6 mg偶氮苯。
在磷酸钙生成后加入偶氮苯与羧甲基-β-环糊精混合液是为了验证羟甲基-β-环糊精是否能将偶氮苯固定在磷酸钙的表面上。实验步骤与在磷酸钙生成后加入罗丹明B与羧甲基-β-环糊精的混合液一致,将8 mg罗丹明B换为6 mg偶氮苯。
1.3药物分子的负载率和负载量
负载率和负载量的计算公式分别为:
(1)
12 mg包埋罗丹明B的磷酸钙微粒加入10 mL pH值为1的HCl溶液。混合液通过超声处理至少30 min,直至粉末完全溶解,冷冻干燥除去水。加入10 mL的磷酸盐缓冲液(pH=5.4),然后通过紫外分光光度法在555.7 nm波长进行测定。对紫外吸收强度的标准曲线进行计算得出罗丹明B的质量浓度数值。
40 mg包埋有客体分子的磷酸钙微粒加入到20 mL的磷酸盐缓冲液中(pH=5.4或7.4),然后将混合液转移到透析袋(截留分子量为3 500 Da)。将透析袋浸入200 mL相应的磷酸盐缓冲液后在恒温摇动器(37 ℃,150 r/min)中进行释放。以预定的时间间隔提取透析袋外2.0 mL缓冲溶液,并以等体积的新鲜缓冲溶液作为替换来保持漏槽状态。释放客体分子的量通过分析UV吸光度或高效液相色谱(high performance liquid chromatography,HPLC)得到。
1.4细胞培养
人乳腺癌细胞MDA-MB-231(ATCC)由上海复蒙基因生物技术有限公司提供,在DMEM培养基与10%的胎牛血清中置于37 ℃,5% CO2的饱和湿度培养箱中培养。
MDA-MB-231细胞接种于6孔板中,每孔1×105个细胞在0.5 mL DMEM培养基中置于37 ℃,5% CO2的饱和湿度培养箱培养24 h。将培养基替换为含有包埋罗丹明B的磷酸钙微粒的DMEM培养基,罗丹明B的剂量为20 mmol。将细胞在37 ℃条件下培养2 h,然后将细胞进行冲洗,用胰蛋白酶处理,并使用BD FACSCalibur流式细胞仪进行流式细胞分析。
MDA-MB-231细胞与包埋有罗丹明B的磷酸微粒在DMEM培养基中培养2 h,罗丹明B的剂量为20 mmol,然后用磷酸盐缓冲液洗涤2次,并用4%甲醛在室温下固定15 min。细胞骨架F-肌动蛋白和细胞核分别用Alexa Fluor 488和DAPI进行对比染色。盖玻片被安装在显微镜载玻片上并滴加1滴抗荧光淬灭封片液以减少荧光漂白。通过LSM 710共焦激光扫描显微镜观察细胞摄取纳米微粒。
磷酸钙包埋多西紫杉醇的细胞毒性,用MTT法试验测定。通常情况下,MDA-MB-231细胞在96孔板中培养,密度为每孔1×104个细胞,加入系列稀释的磷酸钙纳米微粒。培养48 h后,将样品用MTT法处理4 h,形成的甲瓒结晶溶解于二甲基亚砜中,并使用Bio-Rad model 680酶标仪在波长为570 nm处测定吸光度。
2结果与讨论
2.1羧甲基-β-环糊精的表征
本文在碱性条件下通过β-环糊精和氯乙酸的取代反应制备了羧甲基-β-环糊精,其核磁共振氢谱(1HNMR)如图1所示,其中,位移在5.32和5.10 处为β-环糊精上H1的质子信号峰[20],位移为4.5~3.3的信号峰来自β-环糊精H2~H6及羧甲基上的亚甲基氢(—CH2—COOH)。通过对核磁氢谱各峰的积分面积进行分析[21]可得β-环糊精1-羧甲基的取代度。
将1个β-环糊精内H1标定为7,则β-环糊精上H2~H6的质子数之和对应为42个,由取代度公式可知羧甲基的取代度约为6。

图1 羧甲基-β-环糊精的1HNMR谱
为了验证羧甲基-β-环糊精可以辅助磷酸钙对罗丹明B进行包埋,需证明罗丹明B与羧甲基-β-环糊精在制备磷酸钙的条件下形成了超分子复合体。对此,本文采用二维核磁相关谱对其进行了研究分析[22],结果如图2所示。由图2可看出,β-环糊精与罗丹明B混合物于CaCl2重水溶液中,罗丹明B和羧甲基-β-环糊精特征峰的交叉区出现了明显的相关峰,圆环中的(3.9,1.2)与(3.7,1.2)为罗丹明B上乙基与羧甲基-β-环糊精H3与H5相关峰,矩形框内(3.7,6.8)与(3.7,6.9)为罗丹明B二乙基氨基苯基苯环氢与羧甲基-β-环糊精H5的相关峰。因此可以断定,当羧甲基-β-环糊精与罗丹明B混合时,羧甲基-β-环糊精以包覆罗丹明B二乙胺基苯基的方式形成超分子。
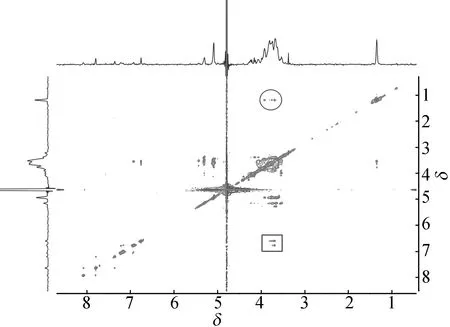
图2 二维核磁相关谱
2.2纳米磷酸钙微粒包埋性质表征
本文选择罗丹明B和偶氮苯分别作为亲水和憎水药物模型进行研究。在罗丹明B水溶液中直接反应获得的磷酸钙沉淀经洗涤后为白色固体,这说明罗丹明B既没有被包埋入磷酸钙颗粒中,也不能牢固地吸附于磷酸钙颗粒的表面。在罗丹明B与羧甲基-β-环糊精混合液中进行磷酸钙的沉淀反应,洗涤产物可得红色的固体颗粒。这说明羧甲基-β-环糊精的加入使得罗丹明B成功负载于磷酸钙颗粒中。一般地,纳米粒负载药物分子的方式有内部包埋和表面吸附2种,本文通过改变加料顺序确定磷酸钙对罗丹明B的负载方式[22],即先形成磷酸钙颗粒,再加入罗丹明B和羧甲基-β-环糊精混合溶液。这种方法获得的磷酸钙经过洗涤后产物为白色,说明罗丹明B并不能通过羧甲基-β-环糊精的辅助牢固地吸附于磷酸钙颗粒的表面。综合以上实验结果可以得出,通过与羧甲基-β-环糊精形成超分子化合物,罗丹明B被有效地包埋于磷酸钙颗粒中。进一步的实验结果表明,在pH值为5.4或7.4的PBS缓冲溶液中,羧甲基-β-环糊精的加入对罗丹明B的紫外可见光吸收几乎没有影响,如图3所示。
图3中,羧甲基-β-环糊精与罗丹明B的摩尔比分别为0、0.5、1.0,与偶氮苯的摩尔比分别为2、4、6、10此,本研究将负载罗丹明B的磷酸钙在酸性条件下溶解后冻干除水,pH值为 5.4的PBS缓冲液定容后经紫外可见分光光度计确定罗丹明B的含量,带入(1)式可得负载量和负载率分别为0.82%、32.72%。
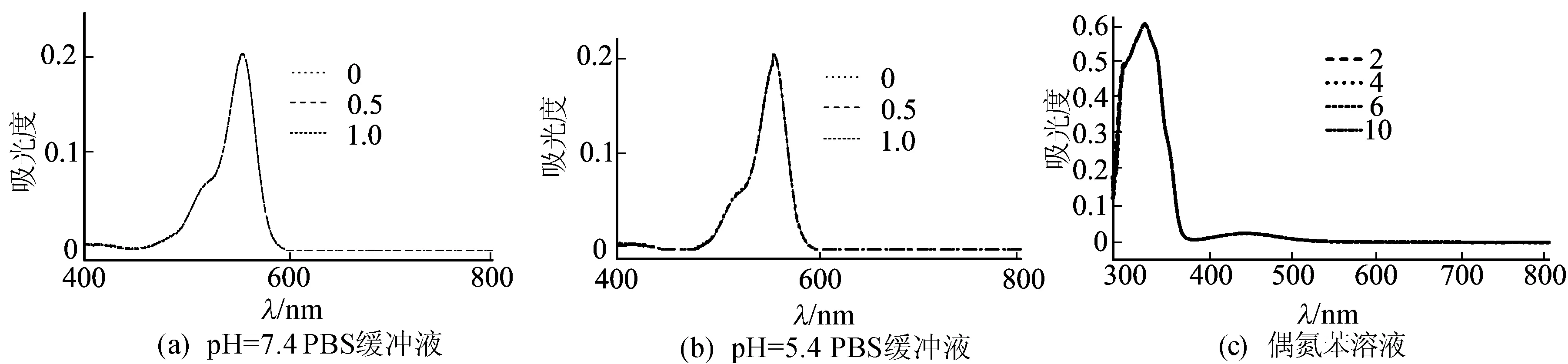
图3 不同分子浓度对紫外-可见光吸收的影响
偶氮苯在水中不能溶解,因此无法直接进行水相反应包埋于磷酸钙中。当向水中加入羧甲基-β-环糊精后,偶氮苯溶解于水中形成溶液,这说明了羧甲基-β-环糊精与偶氮苯形成了稳定的主客体超分子,并溶于水中。在这种超分子溶液中进行磷酸钙的沉淀反应,产物为黄色的磷酸钙。相应地,本文采用先形成磷酸钙再加入偶氮苯和羧甲基-β-环糊精的超分子水溶液的方法却只能获得白色粉末。因此可以推断,黄色产物中偶氮苯是以包埋的方式进入了磷酸钙颗粒。进一步实验显示,在H2O与DMSO体积比为1∶1的混合溶液中,偶氮苯的紫外-可见吸收不会受到羧甲基-β-环糊精的影响,如图3c所示。因此,将定量的包埋偶氮苯的磷酸钙颗粒在酸性条件下溶解后冻干,加入的H2O/DMSO混合溶液定容后经紫外吸收法测量得到偶氮苯的负载量和负载率分别为1.27%和36.25%。
为了验证包埋模型分子的磷酸钙颗粒达到纳米的尺度,本文通过光散射对产物进行了表征,其结果如图4所示,透射电镜照片如图5所示。由图4可知,包埋罗丹明B和包埋偶氮苯的磷酸钙颗粒直径均为100 nm左右。由图5可知,颗粒为球状,且颗粒大小与光散射结果一致。实验证明了在羧基化β-环糊精的辅助下制备出了包埋有机小分子的磷酸钙纳米粒。
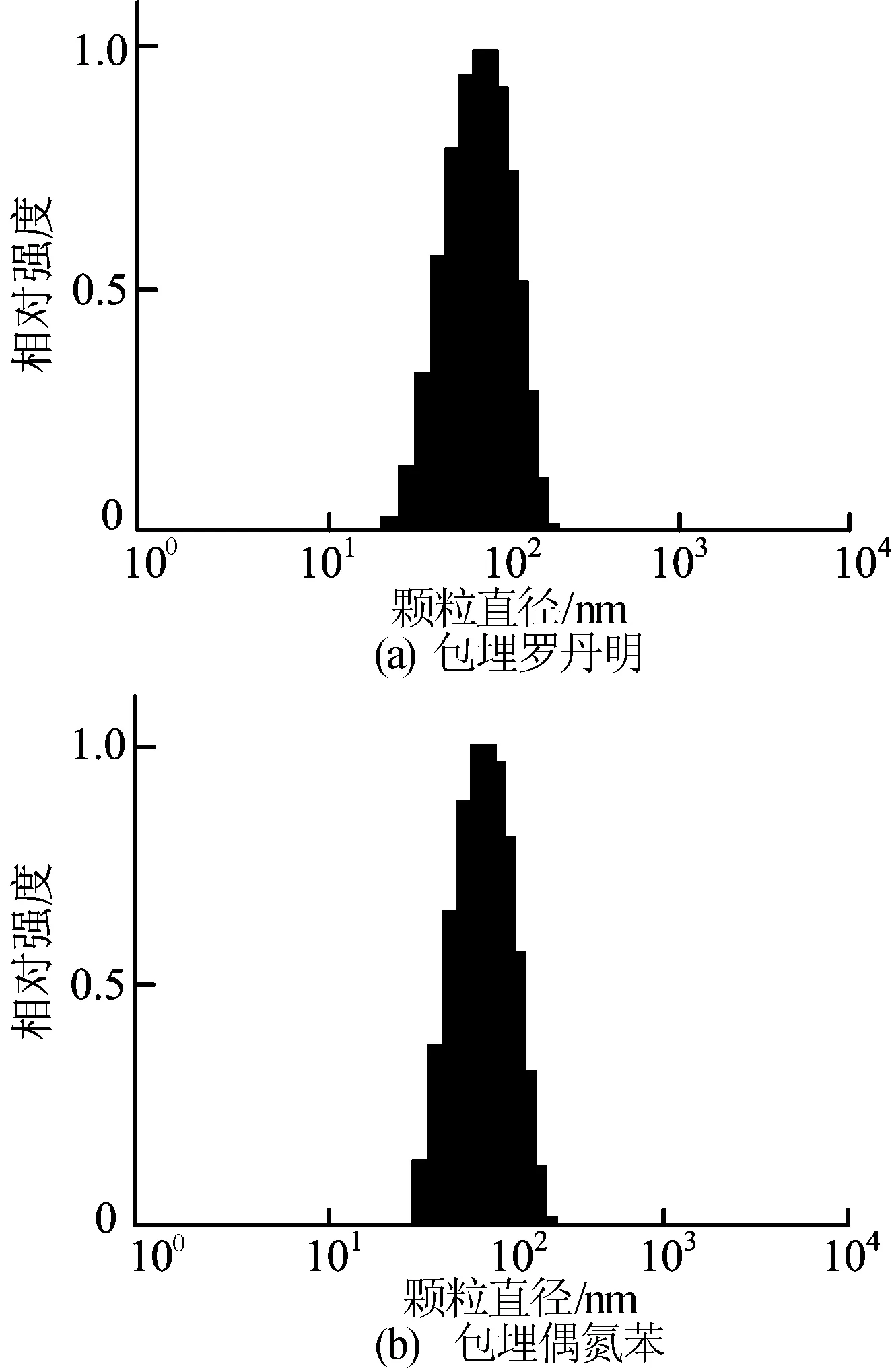
图4 包埋罗丹明B与偶氮苯的纳米磷酸钙的光散射强度分布

图5 包埋罗丹明B与偶氮苯的纳米磷酸钙透射电镜照片
2.3纳米磷酸钙微粒释放性能表征
纳米磷酸钙具有pH值响应的性质,可用于药物的控制释放。本文分别以体内血浆(pH=7.4)和内涵体(pH=5.4)为参考,研究纳米磷酸钙对其负载小分子的释放性能,如图6所示,在pH=7.4时,被负载的小分子几乎不释放。相反地,当体系的pH值降低为5.4时,被负载的小分子逐渐被释放出。由此可以推断,在碱性条件下,处于难溶状态的磷酸钙骨架能够完全抑制被负载有机小分子的释放,而当在酸性条件下,随着磷酸钙的逐渐溶解,被负载的小分子被释放出。这表明纳米磷酸钙包埋的药物分子在输运过程中能有效地与外界隔离,减少被血浆内蛋白清除及损害正常组织细胞的概率。而当纳米粒经EPR效应富集于肿瘤组织而被癌细胞摄取后,酸性条件将促使被包埋药物的释放。
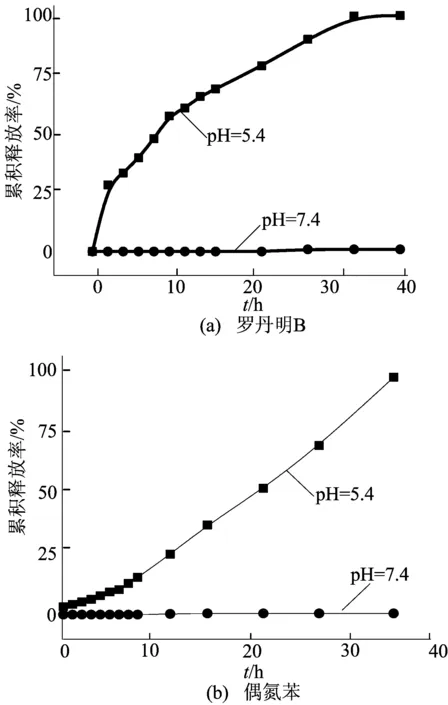
图6 不同pH值条件下磷酸钙纳米粒中的释放曲线
被包埋于磷酸钙纳米粒的药物分子需在细胞摄取后形成的内涵体或溶酶体的酸性条件下释放。为此,本文以包埋罗丹明B的磷酸钙纳米粒进行了细胞摄取实验,流式细胞仪测量结果如图7a所示,在含有纳米粒的培养基中培养的细胞,其荧光强度显示为右边的峰,其明显高于左边的对照组,由于罗丹明在pH=7.4的条件下完全不释放,因此,荧光强度的增加说明纳米粒被细胞摄取。
由于磷酸钙及其降解产物均为人体所必需的物质,而环糊精衍生物被广泛地应用于药物输运,因此,本研究中的磷酸钙具有良好的生物相容性。为了验证这一性质,实验制备了负载羧基化β-环糊精的纳米磷酸钙,并通过MTT法研究了其生物相容性,如图7b所示,在加入磷酸钙纳米粒的培养液中培养的细胞几乎没有凋亡。综合上述纳米磷酸钙的释放、摄取性质可知,本文制备的纳米磷酸钙具备作为药物载体的良好性质。

图7 细胞摄取的荧光强度分析和细胞活性测量
3结束语
本研究采用羧基化环糊精与有机小分子形成主客体超分子的方法,解决了有机小分子难溶于水或缺少对磷酸钙吸附能力的困难,制备了包埋有机小分子的纳米磷酸钙。这种纳米磷酸钙具有根据pH值选择性释放的能力。通过细胞实验可知,这种方法制备的纳米磷酸钙具有应用于药物载体的潜在价值。
[参考文献]
[1]Epple M,Ganesan K,Heumann R,et al.Application of calcium phosphate nanoparticles in biomedicine[J].Journal of Materials Chemistry,2009,1(1):18-23.
[2]Tabakovic A,Kester M,Adair J H.Calcium phosphate-based composite nanoparticles in bioimaging and therapeutic delivery applications[J].Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology,2012,4(1):96-112.

[4]Zhang M,Kataoka K.Nano-structured composites based on calcium phosphate for cellular delivery of therapeutic and diagnostic agents[J].Nano Today,2009,4(6):508-517.
[6]Mark K.Calcium phosphate nanocomposite particles for in vitro imaging and encapsulated chemotherapeutic drug delivery to cancer cells[J].Nano Letters,2008,8(12):4116-4121.
[7]Muddana H S,Sengupta S,Mallouk T E,et al.Substrate catalysis enhances single-enzyme diffusion[J].Journal of the American Chemical Society,2010,132 (7):2110-2111.
[8]Perkin K K,Turner J L,Wooley K L,et al.Fabrication of hybrid nanocapsules by calcium phosphate mineralization of shell cross-linked polymer micelles and nanocages[J].Nano Lett,2005,5(7):1457-1461.
[9]Sugawara A,Yamane S,Akiyoshi K.Nanogel-templated mineralization: polymer-calcium phosphate hybrid nanomaterials[J].Macromolecular Rapid Communications,2006,27(6):441-446.
[10]Chen Z,Li Z,Lin Y,et al.Biomineralization inspired surface engineering of nanocarriers for pH-responsive,targeted drug delivery[J].Biomaterials,2013,34(4):1364-1371.
[11]Min K H,Lee H J,Kim K,et al.The tumor accumulation and therapeutic efficacy of doxorubicin carried in calcium phosphate-reinforced polymer nanoparticles[J].Biomaterials,2012,33(23):5788-5797.
[12]Han H S,Lee J,Kim H R,et al.Robust PE gylated hyaluronic acid nanoparticles as the carrier of doxorubicin: mineralization and its effect on tumor targetability in vivo[J].Journal of Controlled Release: Official Journal of the Controlled Release Society,2013,168(2):105-114.
[13]Schmidt H T,Ostafin A E.Liposome directed growth of calcium phosphate nanoshells[J].Adv Mater,2002,14(7):532-535.
[14]Rim H P,Min K H,Lee H J,et al.pH-tunable calcium phosphate covered mesoporous silica nanocontainers for intracellular controlled release of guest drugs [J].Angewandte Chemie International Edition,2011,50(38):8853-8857.
[15]瞿启云.β-环糊精/TiO2纳米颗粒复合物的制备及其对PCBs的吸附研究[J].合肥工业大学学报:自然科学版,2013,36(6):748-754.
[16]Uekama K,Hirayama F,Irie T.Cyclodextrin drug carrier systems.[J].Chem Rev,1998,98(5):2045-2076.
[17]Brewster M E,Loftsson T.Cyclodextrins as pharmaceutical solubilizers[J].Advanced Drug Delivery Reviews,2007,59(7):645-666.
[18]Wang X,Gao W,Xu W,et al.Fluorescent Ag nanoclusters templated by carboxymethyl-β-cyclodextrin (CM-β-CD) and their in vitro antimicrobial activity[J].Mater Sci Eng C Mater Biol Appl,2013,33:656-662.
[19]Liu X,Lee H,Reinhardt R A,et al.Novel biomineral-binding cyclodextrins for controlled drug delivery in the oral cavity.[J].Journal of Controlled Release: Official Journal of the Controlled Release Society,2007,122(1):54-62.
[20]Zhi J,Tian X,Zhao W,et al.Self-assembled film based on carboxymethyl-beta-cyclodextrin and diazoresin and its binding properties for methylene blue[J].J Colloid Interface Sci,2008,319(1):270-276.
[21]Liu Y,Chen Y,Liu S X,et al.Unique fluorescence behavior of rhodamine B upon inclusion complexation with novel bis(beta-cyclodextrin-6-yl) 2,2'-bipyridine-4,4'-dicarboxylate[J].Org Lett,2001,3(11):1657-1660.
[22]Ueno Y,Futagawa H,Takagi Y,et al.Drug-incorporating calcium carbonate nanoparticles for a new delivery system[J].Journal of Controlled Release,2005,103(1):93-98.
(责任编辑闫杏丽)
Preparation of small organic molecules encapsulated calcium phosphate nanoparticles by supramolecule method
WANG Lei, YAO Ri-sheng, TAO Wei
(School of Medical Engineering, Hefei University of Technology, Hefei 230009, China)
Abstract:The studies of small organic functional molecules encapsulated calcium phosphate nanoparticles(CPNPs) have great significance in preparation of nano-drug loaded carrier. However, most of small organic molecules may be lack of solubility in water or binding affinity to calcium phosphate, which make it difficult to encapsulate them in CPNPs. To solve the problem, carboxymethyl-β-cyclodextrin(CM-β-CD) was used to afford the solubility and bind affinity when it complexed with the model molecules. The results indicated that the model molecules such as hydrophilic rhodamine B(RB) or hydrophobic azobenzene were encapsulated in CPNPs efficiently.
Key words:calcium phosphate nanoparticles(CPNPs); carboxymethyl-β-cyclodextrin(CM-β-CD); rhodamine B(RB); azobenzene
收稿日期:2015-04-09;修回日期:2015-05-05
基金项目:国家自然科学青年基金资助项目(2013GJQN0465)
作者简介:汪雷(1990-),男,安徽合肥人,合肥工业大学硕士生; 姚日生(1962-),男,安徽合肥人,博士,合肥工业大学教授,博士生导师.
doi:10.3969/j.issn.1003-5060.2016.05.006
中图分类号:O636.9
文献标识码:A
文章编号:1003-5060(2016)05-0602-06
