须糖多孢菌Saccharopolyspora pogona的核糖体工程改造对丁烯基多杀菌素合成的影响
2016-06-23罗林根杨燕魏慧穰杰唐琼胡胜标孙运军余子全丁学知夏立秋湖南师范大学生命科学学院微生物分子生物学国家重点实验室培育基地湖南长沙410081
罗林根,杨燕,魏慧,穰杰,唐琼,胡胜标,孙运军,余子全,丁学知,夏立秋湖南师范大学 生命科学学院 微生物分子生物学国家重点实验室培育基地,湖南 长沙 410081
须糖多孢菌Saccharopolyspora pogona的核糖体工程改造对丁烯基多杀菌素合成的影响
罗林根,杨燕,魏慧,穰杰,唐琼,胡胜标,孙运军,余子全,丁学知,夏立秋
湖南师范大学 生命科学学院 微生物分子生物学国家重点实验室培育基地,湖南长沙410081
罗林根, 杨燕, 魏慧, 等. 须糖多孢菌Saccharopolyspora pogona的核糖体工程改造对丁烯基多杀菌素合成的影响. 生物工程学报, 2016, 32(2): 259–263.
Luo LG, Yang Y, Wei H, et al. Effect of ribosome engineering on butenyl-spinosyns synthesis of Saccharopolyspora pogona. Chin J Biotech, 2016, 32(2): 259–263.
摘 要:核糖体工程是以微生物的各类抗生素抗性突变为筛选标记,高效获得次生代谢产物合成能力提高的突变株的一种育种新方法。通过核糖体工程技术,使用链霉素对须糖多孢菌Saccharopolyspora pogona进行抗性选育,以获得高产丁烯基多杀菌素突变菌株。对原始菌株和所获得的突变菌株代谢产物的研究发现,相对于原始菌株,其中突变株S13的丁烯基多杀菌素产量提高幅度最大,相比原始菌株提高了1.79倍。经质谱测定表明,其代谢物中比原始菌株多了一种丁烯基多杀菌素组分Spinosyn α1。对抗性突变株S13的DNA序列进行分析,发现在编码核糖体S12蛋白的rpsL基因保守区域中出现点突变,第314位和第320位的胞嘧啶(C)分别突变为腺嘌呤(A)和胸腺嘧啶(T),对应的氨基酸残基分别由脯氨酸突变为谷氨酰胺,丙氨酸突变为缬氨酸。研究显示,突变株S13遗传稳定性良好。
关键词:核糖体工程,放线菌,丁烯基多杀菌素,链霉素,次级代谢
Received: April 12, 2015; Accepted: June 8, 2015
Supported by: Key Program for International S&T Cooperation Projects of China (No. 0102011DFA32610), National Basic Research Program of China (973 Program) (No. 2011CB111680), National High Technology Research and Development Program of China (863 Program) (No. NC2010GA0091), Collaborative Innovation Center Project of Hunan Province (No. 20134486).
国家国际合作重点项目 (No. 0102011DFA32610),国家重点基础研究发展计划 (973计划) (No. 2011CB111680),国家高技术研究发展计划 (863计划) (No. NC2010GA0091),湖南省协同创新中心项目 (No. 20134486) 资助。
丁烯基多杀菌素是由须糖多孢菌Saccharopolyspora pogona产生的一类与多杀菌素结构类似的大环内酯类抗生素。到目前为止,丁烯基多杀菌素组分共检测到31种,这类化合物具有很好的杀线虫、昆虫活性[1-2]。且丁烯基多杀菌素比多杀菌素具有更为广泛的杀虫谱,包括鳞翅目 (Lepidoptera)、缨翅目 (Thysanoptera)、膜翅目 (Hymenoptera)、双翅目 (Diptera) 等多种害虫,尤其对鳞翅目、缨翅目害虫具有极强的选择性杀虫活性,对多杀菌素难于控制的世界性检疫性害虫苹果蠹蛾和重要农业害虫烟青虫具有良好的生物防治作用[3-4]。它们的杀虫作用机制是通过与烟碱乙酰胆碱受体 (nAChRs)、γ-氨基丁酸受体 (GABARs) 结合使昆虫神经细胞去极化,引起中央神经系统超活化,从而导致昆虫非功能性肌肉收缩、震颤,最后衰竭、瘫痪。对靶标昆虫表现出快速触杀和摄食毒性的双重作用,具有低毒、低残留、对害虫的天敌安全、自然分解快等优点,兼具生物农药的安全性与化学农药的高效性,是当前国际上极具发展前景的环境友好型生物农药[5]。但是丁烯基多杀菌素的发酵产量较低,如何提高其发酵产量是亟待解决的一大难题。目前,核糖体工程技术已广泛应用于菌种改良、提高无细胞翻译系统的蛋白合成效率、提高菌株化学胁迫耐受程度和改善菌种抗逆境能力等方面[6]。本研究通过核糖体工程技术对须糖多孢菌进行选育,获得了丁烯基多杀菌素产量提高的突变菌株。所采用的链霉素在其他菌株中的抗性筛选效果较好,正突变和增产率高,在核糖体工程育种中应用最多,对应的突变位点明确。
1 材料与方法
1.1材料
1.1.1菌株、质粒与引物
Saccharopolyspora pogona NRRL 30141由本实验室从美国农业研究菌种保藏中心购买。E. coli DH5α来源本室保藏。pMD18-T-rpsL为测序质粒由本研究构建。引物rpsL-F (5′-ATTCGGCACACAGAA AC-3′)、rpsL-R (5′-AGAGGAGAACCGTAGAC-3′)由上海生工生物有限公司合成。¢
1.1.2培养基与培养条件
大肠杆菌培养采用LB液体或固体培养基,培养温度为37 ℃;S. pogona种子活化采用SP-2培养基,转接、突变株筛选采用TSB培养基,发酵采用SP-3培养基,在固体平板上的群体形态特征比较采用TSB培养基、GYM培养基、MS培养基以及SFM培养基,培养温度为30 ℃。
1.2方法
1.2.1链霉素最低抑制浓度 (MIC) 的测定与抗性突变菌株的筛选
收集原始菌株孢子,将孢子悬浮液涂布于含不同浓度链霉素的TSB平板上,后续按文献[7]进行。
1.2.2发酵产物的样品制备及超高效液相色谱、质谱分析
将活化好的种子液以10% (V/V) 的接种量接种于发酵培养基中,30 ℃、280 r/min发酵11 d后,向发酵液中加入等体积的丙酮,静置浸提过夜,离心取上清,0.22 μm微孔滤膜过滤。Agilent 1290 Infinity UHPLC测定发酵液中各组分的含量,检测条件如下,色谱柱:Zorbax SB (C18),5 μm,4.6 mm×150 mm,柱温35 ℃;流动相A:10 mmol/L乙酸铵,流动相B:甲醇/乙腈(1∶1),梯度洗脱,流速1 mL/min;二极管阵列检测波长250 nm。发酵产物及菌体蛋白利用Thermo LTQ XL液质联用仪进行鉴定,丁烯基多杀菌素组分检测鉴定条件如下,色谱柱:BioBasic (C18),5 μm,1.0 mm× 150 mm;流动相A:0.1%甲酸,流动相B:甲醇 (含0.1%甲酸),流速300 μL/min,梯度洗脱 (表1)。

表1 液质联用色谱梯度洗脱程序Table 1 LC/MS chromatography gradient elution program
1.2.3菌体生长曲线的测定
活化的种子液转接TSB培养基,30 ℃、160 r/min继续培养,分别于12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h定期取样,测定菌体光密度值OD600,作生长曲线。
1.2.4突变菌株与原始菌株生长形态特征比较
分别对培养48 h的种子液进行取样,利用显微镜观察菌体形态,同时各取50 μL种子液分别涂布于MS、SFM、TSB和GYM固体培养基上,观察不同平板上菌落生长情况。
1.2.5稳定期菌体全蛋白的提取及分析
按照文献[8]进行。
2 结果与分析
2.1链霉素的MIC测定及其抗性突变菌株的筛选
经测定,链霉素对原始菌株30141的MIC为15 μg/mL。利用4×、10×MIC倍数的高浓度链霉素对原始菌株30141进行抗性筛选,共分离到具有链霉素抗性且稳定遗传突变菌株28株。
2.2原始菌株30141及其突变菌株发酵产物的UHPLC、MS分析
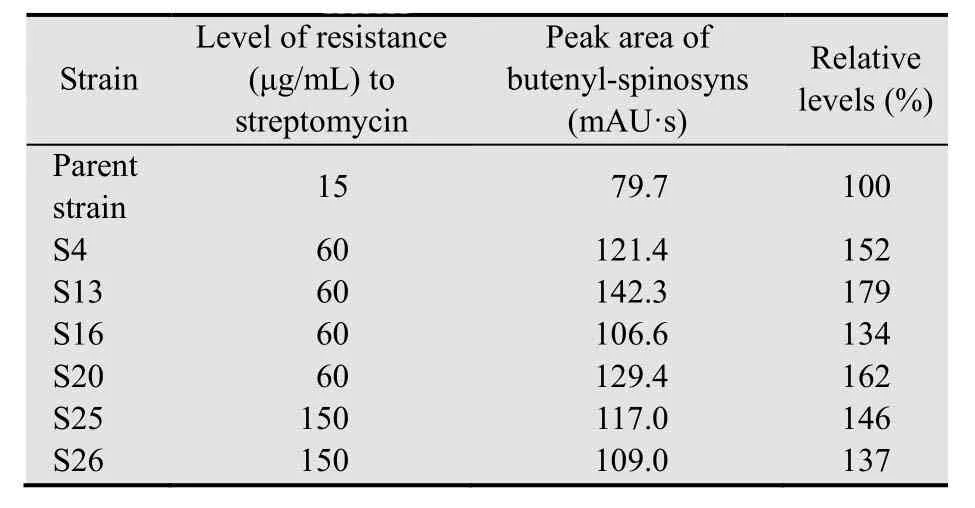
表2 六株丁烯基多杀菌素产量提高的突变株Table 2 The high butenyl-spinosyns producing S. pogona strains of streptomycin-resistant mutants

图1 原始菌株30141 (A) 和突变株S13 (B) 发酵产物的UHPLC图Fig. 1 UHPLC chromatogram of fermentation broths of original strain (A) and mutant S13 (B).
原始菌株和突变菌株的UHPLC图谱对比分析发现,6株突变菌株丁烯基多杀菌素产量相对提高(表2),3株突变株丁烯基多杀菌素产量相对降低,其中突变株S13产量最高 (图1),相比原始菌株提高1.79倍,对其色谱指纹图谱进行扫描发现在2.679 min处,比原始菌株多了一个最大吸收波长为250 nm的色谱峰,而且从色谱图中可以看出,突变株S13的色谱峰增多,可能激活了新代谢产物的合成。
通过质谱检测确定了5.3、6.5 min处的色谱峰分别为丁烯基多杀菌素组分Spinosyn βc和Spinosyn αc/Spinosyn 6-methy 1β,它们的分子量分别为650、634[M+H]+(m/z),二级质谱中含有分子量为189的鼠李糖配基离子碎片,与文献中数据吻合[1]。在突变株S13 UHPLC图中新增的2.679 min处的峰,峰分子量为758[M+H]+(m/z) (图2),根据一级质谱及色谱二极管阵列检测对比,确定其为丁烯基多杀菌素组分Spinosyn α1。
2.3突变位点的鉴定
根据现有的相关研究报道,抗生素抗性突变的产生往往伴随着编码核糖体蛋白基因的碱基突变,链霉素等抗生素的抗性突变由编码核糖体S12蛋白的rpsL基因发生点突变引起[9]。分别以原始菌株和突变株S13的基因组为模板成功扩增出糖多孢菌属核糖体30S小亚基中S12蛋白的编码序列,其开放阅读框由375个碱基组成。对突变株S13的DNA序列分析发现,突变株rpsL基因第314位的C突变为A,第320位的C突变为T;对应的氨基酸残基分别由脯氨酸突变为谷氨酰胺,由丙氨酸突变为缬氨酸。核糖体结构的改变,会影响微生物次级代谢产物的调控途径,进而激发微生物的生物合成潜能,提高其次级代谢产物的产量甚至从中获得新的生物活性物质,获得代谢产物合成能力提高的突变菌株。
2.4原始菌株30141与突变株S13差异表达蛋白分析
通过SDS-PAGE对比分析了原始菌株与突变株S13稳定期蛋白表达水平,选取了突变株中表达明显上调的蛋白条带,切胶并进行胶内酶解质谱鉴定 (图3),其中Crp/Fnr家族转录调控因子与环腺苷酸相互作用影响细胞的形态与生长发育,并作为正转录调控因子促进多杀菌素类化合物的合成,3-磷酸甘油醛脱氢酶能为丁烯基多杀菌素的合成提供更充足的前体物,翻译起始因子IF-3可能提高了稳定期蛋白质的翻译活性从而促进丁烯基多杀菌素合成[10-11]。
2.5原始菌株30141与突变株S13表型特征比较

图2 丁烯基多杀菌素组分质谱鉴定Fig. 2 MS identification of butenyl-spinosyns. (A) Original strain fermentation. (B) Mutant S13 strain fermentation.
原始菌株30141与突变株S13生长曲线如图4所示,原始菌株在培养48 h左右生长趋于平稳,随后进入二次生长周期,至60 h左右达到稳定。从生长曲线中可以看出,在生长期初始阶段,原始菌株与突变株S13生长速率无明显差异,当进入稳定期后,突变株S13比原始菌生长速率明显减缓,这与天蓝色链霉菌核糖体突变后的现象类似[12],且突变株中的二次生长现象消失。显微镜观察菌株的菌体形态,结果 (图5) 显示原始菌株菌丝细长且分枝较少,而突变株S13菌丝粗壮而分枝多。
与原始菌株相比,突变株S13在SFM、TSB和GYM平板上气生菌丝显著增厚,而在产孢子培养基MS上,突变株S13产孢速率与孢子丰满度明显提高 (图6)。放线菌次级代谢的开始通常都伴随着菌体形态的分化,并且研究发现孢子的形成与次级代谢物产量密切相关,由此可以看出,核糖体工程选育不仅能改变突变株的次级代谢能力,同时其生长形态也会发生一定的改变。
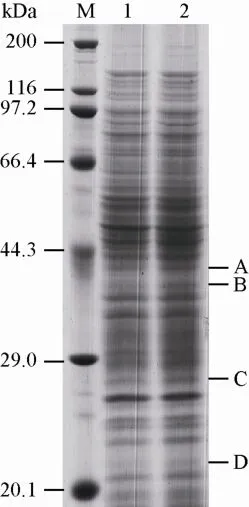
图3 原始菌株30141和突变株S13全蛋白SDS-PAGE检测Fig. 3 Total cellular proteins analysis of original strain and mutant S13 by SDS-PAGE. M: protein marker; 1: original strain; 2: mutant S13. A: protein RecA; B: glyceraldehyde-3-phosphate dehydrogenase; C: Crp/Fnr family transcriptional regulator; D: translation initiation factor IF-3.

图4 原始菌株30141与突变株S13的生长曲线Fig. 4 Growth curve of original strain and mutant S13.
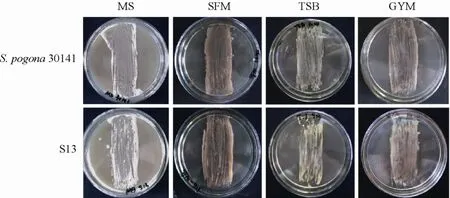
图6 原始菌株30141和突变株S13在固体培养基上群体形态特征比较Fig. 6 Original strain and mutant S13 colony morphologies.
3 结论
本研究以S. pogona NRRL 30141菌株为出发材料,通过核糖体工程技术,得到了丁烯基多杀菌素产量提高的链霉素抗性突变株S13,并测定了它的突变位点 (P105Q、A107V),与能普遍提高链霉菌属中次级代谢产物产量的核糖体蛋白S12的K88E 及P91S等突变类型不同,也与红色糖多孢菌Saccharopolyspora erythraea NRRL 2338各链霉素抗性突变位点不同,但与邬洋等[13]使用与链霉素同为氨基糖苷类的巴龙霉素筛选获得突变位点一致,同类抗生素在不同微生物筛选中的突变位点是否具有特异性有待进一步研究。并且在4倍MIC的条件下筛选效率更高,获得的突变株S13菌丝体粗壮、分支增多,生长后期生长速率减缓更明显,从而更有利于丁烯基多杀菌素的积累,S13中不仅促进了丁烯基多杀菌素组分的合成,还激活了新的丁烯基多杀菌素组分,这可能与稳定期差异的蛋白表达有关,影响了丁烯基多杀菌素次级代谢调控。后期也希望通过多重抗生素的叠加筛选,获得丁烯基多杀菌素产量更高的突变菌株,从而为丁烯基多杀菌素高产菌株的选育开辟有效途径,也为今后核糖体工程技术在其他种属微生物中的应用奠定研究基础。
REFERENCES
[1] Lewer P, Hahn DR, Karr LL, et al. Discovery of the butenyl-spinosyn insecticides: novel macrolides from the new bacterial strain Saccharopolyspora pogona. Bioorgan Med Chem, 2009, 17(12): 4185–4196.
[2] Lewer P, Hahn DR, Karr LL, et al. Pesticidal macrolides: US, 6455504. 2002-9-24.
[3] Hahn DR, Balcer JL, Lewer P, et al. Pesticidal spinosyn derivates: US, 20040097377. 2004-5-20.
[4] Shou JL, Qiu JP. A new type of biological pesticide——butenylspinosyns. Agrochemicals, 2011, 50(4): 239–243 (in Chinese).
寿佳丽, 裘娟萍. 新型生物农药——丁烯基多杀菌素. 农药, 2011, 50(4): 239–243.
[5] Orr N, Shaffner AJ, Richey K, et al. Novel mode of action of spinosad: receptor binding studies demonstrating lack of interaction with known insecticidal target sites. Pestic Biochem Phys, 2009, 95(1): 1–5.
[6] Ochi K, Okamoto S, Tozawa Y, et al. Ribosome engineering and secondary metabolite production. Adv Appl Microbiol, 2004, 56: 155–184.
[7] Tanaka Y, Kasahara K, Hirose Y, et al. Activation and products of the cryptic secondary metabolite biosynthetic gene clusters by rifampin resistance (rpoB) mutations in actinomycetes. J Bacteriol, 2013, 195(13): 2959–2970.
[8] Luo Y, Ding X, Xia L, et al. Comparative proteomic analysis of Saccharopolyspora spinosa SP06081 and PR2 strains reveals the differentially expressed proteins correlated with the increase of spinosad yield. Proteome Sci, 2011, 9(40): 1–12.
[9] Okamoto-Hosoya Y, Hosaka T, Ochi K. An aberrant protein synthesis activity is linked with antibiotic overproduction in rpsL mutants of Streptomyces coelicolor A3 (2). Microbiology, 2003, 149(11): 3299–3309.
[10] Xu M, Wu Y, Yang Y, et al. Impact on strain growth and spinosad biosynthesis by overexpression of cyclic AMP receptor protein gene in Saccharopolyspora spinosa. Sci Agric Sin, 2014, 47(18): 3577–3587 (in Chinese).
徐妙, 邬洋, 杨燕, 等. 环腺苷酸受体蛋白基因的过表达对刺糖多孢菌生长和多杀菌素合成的影响. 中国农业科学, 2014, 47(18): 3577–3587.
[11] Yang Q, Ding X, Liu X, et al. Differential proteomic profiling reveals regulatory proteins and novel links between primary metabolism and spinosad production in Saccharopolyspora spinosa. Microb Cell Fact, 2014, 13(1): 1–16.
[12] Wang G, Inaoka T, Okamoto S, et al. A novel insertion mutation in Streptomyces coelicolor ribosomal S12 protein results in paromomycin resistance and antibiotic overproduction. Antimicrob Agents Chemother, 2009, 53(3): 1019–1026.
[13] Wu Y, Xu M, Luo LG, et al. Screening of butenyl-spinosyn high-yield strains by paromomycin resistance. Chin J Biol Control, 2015, 31(1): 106–114 (in Chinese).
邬洋, 徐妙, 罗林根, 等. 丁烯基多杀菌素高产菌株的巴龙霉素抗性筛选. 中国生物防治学报, 2015, 31(1): 106–114.
(本文责编郝丽芳)
Effect of ribosome engineering on butenyl-spinosyns synthesis of Saccharopolyspora pogona
Lin’gen Luo, Yan Yang, Hui Wei, Jie Rang, Qiong Tang, Shengbiao Hu, Yunjun Sun, Ziquan Yu, Xuezhi Ding, and Liqiu Xia
College of Life Science, Hunan Normal University, State Key Laboratory Breeding Base of Microbial Molecular Biology, Changsha 410081, Hunan, China
Abstract:Through introducing mutations into ribosomes by obtaining spontaneous drug resistance of microorganisms, ribosome engineering technology is an effective approach to develop mutant strains that overproduce secondary metabolites. In this study, ribosome engineering was used to improve the yield of butenyl-spinosyns produced by Saccharopolyspora pogona by screening streptomycin resistant mutants. The yields of butenyl-spinosyns were then analyzed and compared with the parent strain. Among the mutants, S13 displayed the greatest increase in the yield of butenyl-spinosyns, which was 1.79 fold higher thanthat in the parent strain. Further analysis of the metabolite profile of S13 by mass spectrometry lead to the discovery of Spinosyn α1, which was absent from the parent strain. DNA sequencing showed that there existed two point mutations in the conserved regions of rpsL gene which encodes ribosomal protein S12 in S13. The mutations occurred a C to A and a C to T transversion mutations occurred at nucleotide pair 314 and 320 respectively, which resulted in the mutations of Proline (105) to Glutamine and Alanine (107) to Valine. It also demonstrated that S13 exhibited genetic stability even after five passages.
Keywords:ribosome engineering, actinomycetes, butenyl-spinosyns, streptomycin, secondary metabolism
Corresponding author:Liqiu Xia. Tel: +86-731-88872298; E-mail: xialq@hunnu.edu.cn
