人参皂苷20(R)-25-OH-Rg3的分离纯化及结构鉴定
2016-06-22杨佳美,刘春莹,金凤燮,鱼红闪
杨 佳 美, 刘 春 莹, 金 凤 燮, 鱼 红 闪
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
人参皂苷20(R)-25-OH-Rg3的分离纯化及结构鉴定
杨 佳 美,刘 春 莹,金 凤 燮,鱼 红 闪
( 大连工业大学 生物工程学院, 辽宁 大连116034 )
摘要:采用硅胶柱层析法和结晶法,从人参皂苷酶转化产物中分离得到了一种未知人参皂苷,并对其结构进行分析。10 g人参皂苷酶转化产物,分离纯化得到该人参皂苷单体0.25 g。经HPLC检测,其纯度达99.7%。核磁共振检测结果表明,该人参皂苷单体为12β,20(R),25-trihydroxydammar-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranoside,命名为20(R)-25-OH-Rg3。
关键词:人参皂苷;分离纯化;结构鉴定
0引言
人参皂苷是人参中的主要有效成分,在人参主根中的质量分数为4%左右[1-2]。现已明确的人参皂苷单体有60多种[3]。人参皂苷由疏水的非糖基皂苷元(Aglycon)和亲水的糖(Sugarmoieties)两部分组成[4]。人参皂苷属于三萜类皂苷,可分为3类:原人参二醇类皂苷(PPD),原人参三醇类皂苷(PPT)和齐果烷类人参皂苷[5]。人参皂苷具有广泛的生物学活性[6-7]。
本实验室前期利用酶转化法制备了二醇类人参皂苷产物,对该产物进行HPLC检测,与实验室现有标准品(Rg3、F2、Rg5、Rh2、C-K等)对照,发现其中有一种未知人参皂苷,采用硅胶柱层析法及结晶法对该未知皂苷进行分离纯化,得到目的皂苷单体,并利用核磁共振技术对单体结构进行鉴定。
1材料与方法
1.1材料
人参皂苷酶转化产物,实验室自制;人参皂苷标准品Rb1、Rc、Rd、F2、Rg3、Rg5、C-K、Rh2,本实验室提供;薄层层析板SilicaGel60-F254,德国Merck公司;硅胶,青岛海洋化工厂;甲醇、氯仿,均为分析纯。
JascoN2000系列高效液相色谱仪,日本分光公司;Alltech2000ES型蒸发光散射检测器,美国Alltech公司;瑞士BrukeAVANCE600核磁共振波谱仪。
1.2方法
1.2.1薄层层析
将人参皂苷溶于甲醇中,点样于薄层层析板,展开剂为体积比7∶3∶0.5的氯仿-甲醇-水混合物,显色剂为10%硫酸溶液。通过对照样品斑点与标准品斑点来确定样品中所含皂苷成分。
1.2.2硅胶柱层析
取10g人参皂苷产物,用少量甲醇溶解(不能溶解的样品用氯仿溶解),称取25g的80~100目硅胶,加入样品溶液中,并均匀搅拌待其完全蒸干[8]。称取200g的300~400目硅胶作为分离胶,再装入样品胶,在最上层放置脱脂棉。用一定量的纯氯仿通柱,然后按氯仿-甲醇体积比9.5∶0.5、9∶1、8.8∶1.2、8.5∶1.5依次进行洗脱。每200mL收集一瓶,并用TLC法检测。
1.2.3高效液相色谱
采用HPLC-蒸发光散射检测器检测人参皂苷[9],将样品的保留时间与人参皂苷标准品的保留时间进行比对,以确定人参皂苷的种类。中汇达C18色谱柱(4.6mm×250mm,5μm);进样量,10μL;柱温,35 ℃;流动相流量,1.0mL/min;载气,氮气;气体体积流量,3.2L/min;载气压力,0.1MPa;ELSD的漂移管温度,110 ℃。
流动相:乙腈(A)-水(B);0~20min,20%A;20~31min,20%~32%A;31~40min,32%~43%A;40~70min,43%~100%A。
1.2.4核磁共振法
利用瑞士BrukeAVANCE600超导核磁共振波普仪对单体皂苷进行一维核磁共振检测。1H观测频率为400MHz,13C观测频率为150MHz,溶剂是Pyridine-D5(氘代吡啶)。包括1HNMR、13CNMR、1H-1HCOSY、DEPT45、DEPT90、DEPT135、HSQC、HMBC等图谱的测定。
2结果与讨论
2.1人参皂苷产物成分的确定
取少量人参皂苷产物溶解于甲醇溶液中,经HPLC检测,结果如图1所示。

图1 人参皂苷产物的HPLC检测图谱
与实验室标准品对照,可知该产物中主要含有(S,R)-Rg3、Rg5及一种未知皂苷,未知皂苷中有2个吸收峰,暂命名为化合物1和化合物2。
2.2硅胶柱层析法分离未知皂苷
按照“1.2.2”的方法对该未知人参皂苷进行硅胶柱分离。收集洗脱液,TLC检测结果如图2所示。
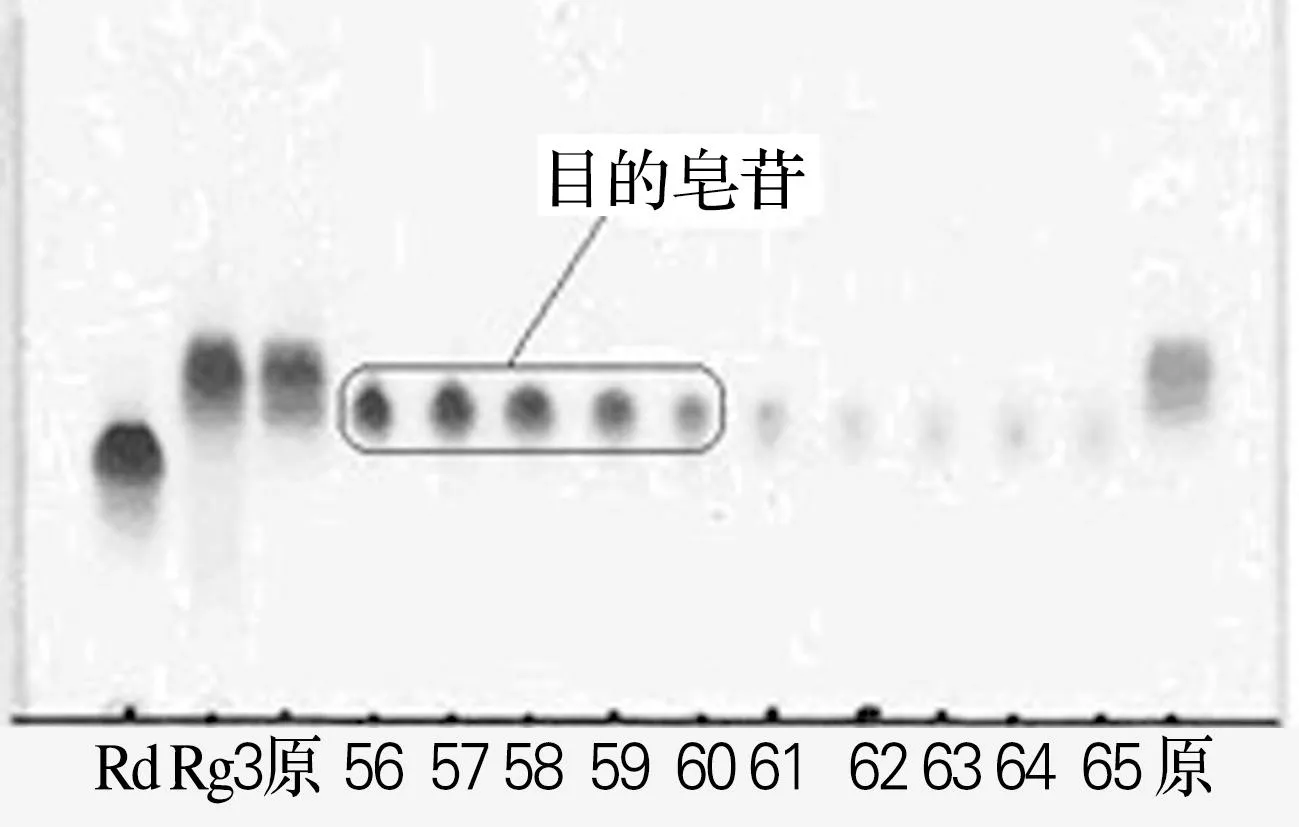
图2 样品的TLC图谱
利用硅胶柱层析法分离目的皂苷,根据TLC检测结果,分别收集较纯的各组分,收集的情况如表1所示。


表1 洗脱分离收集表
经过硅胶柱层析法的分离,得到3种较纯的人参皂苷,分别是目的皂苷、Rg3和Rg5。其中目的皂苷为1.42g,得率是14.2%。采用TLC法对表1中的各组分进行测定,结果如图3所示。
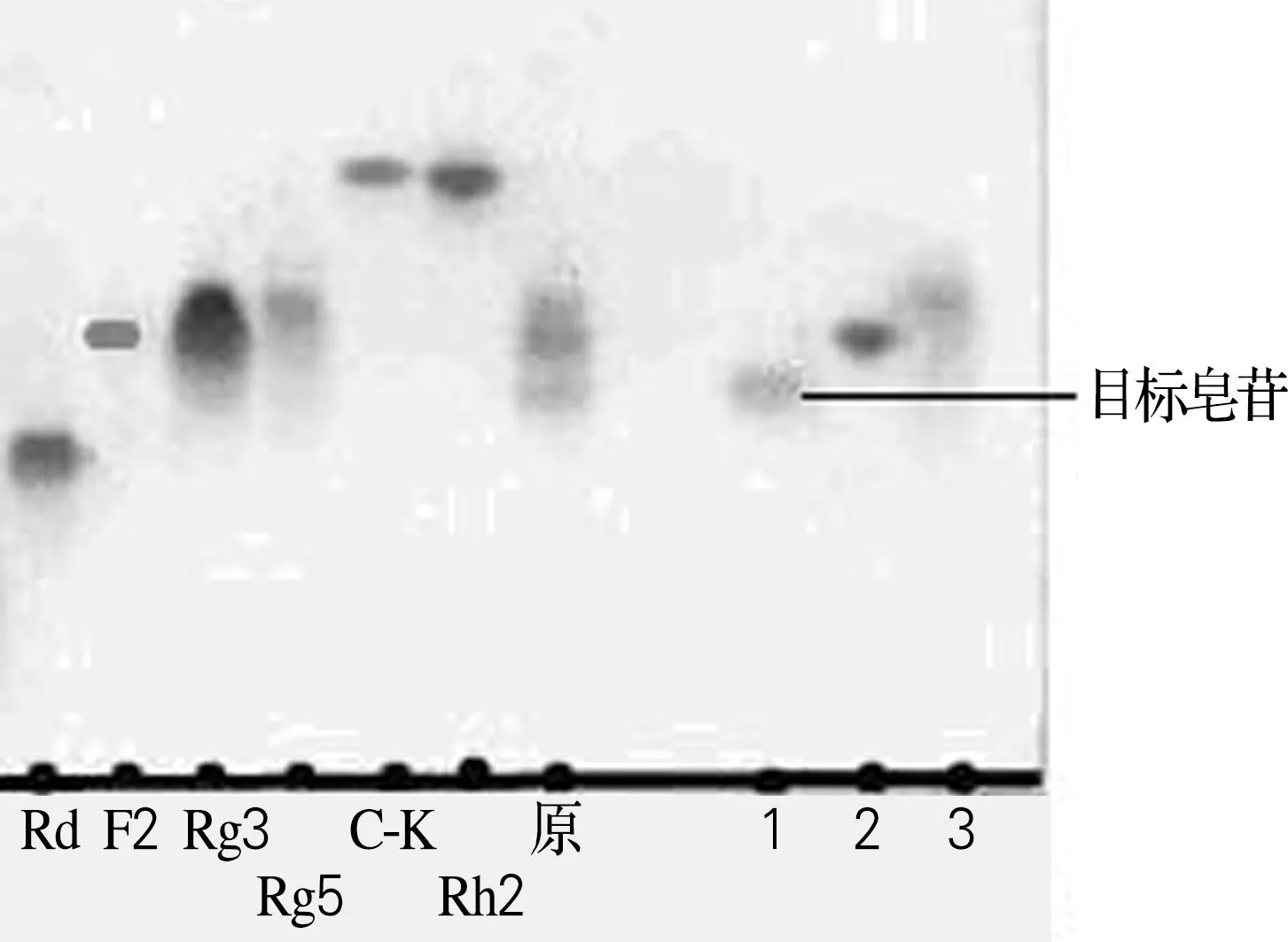
原,人参皂苷混合物;1~3分别为收集的未知皂苷、Rg3和Rg5
图3硅胶柱洗脱单点组分TLC图
Fig.3TLCofpurefractionsfromsilicagel
由图3可以看出,3种组分在TLC板中均为单点。采用HPLC法检测目的皂苷的纯度,结果如图4所示。由图4可知,虽然目的皂苷在TLC上呈现单点,但是在HPLC图谱中显示出2个吸收峰,说明硅胶柱层析法不能将这两种化合物分离,需要对化合物1和化合物2进行进一步的精制。
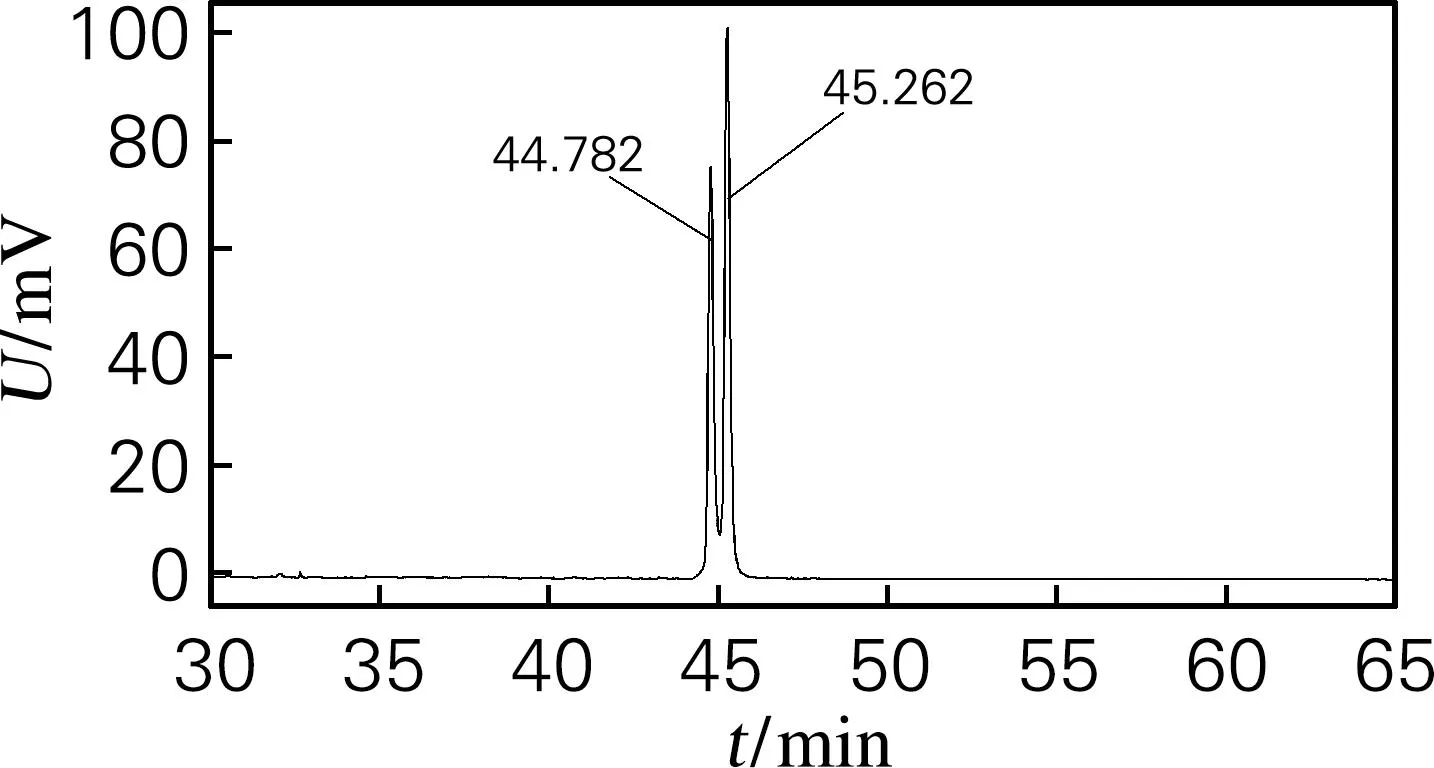
图4 目的皂苷的HPLC图谱
2.3结晶法纯化化合物2
将硅胶柱分离得到的化合物1和化合物2混合物,溶解于20mL70%的甲醇溶液中,自然冷却结晶,放置2~3d后,得到白色不定型沉淀物,过滤后收集沉淀。HPLC检测结果如图5所示,该晶体的保留时间是45.290min,与图4中2个峰的保留时间作对比可以看出,析出的结晶为化合物2,质量为0.25g,得率是17.6%,纯度达99.7%。
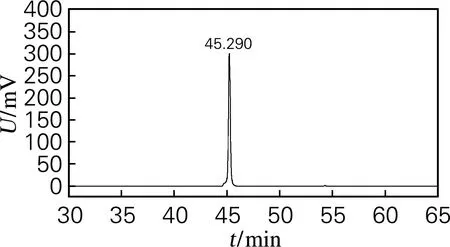
图5 化合物2的HPLC图谱
2.4核磁法测定化合物2的结构
对化合物2进行1HNMR,13CNMR,1H-1HCOSY,DEPT45,DEPT90,DEPT135,HSQC,HMBC等检测。得到1HNMR(吡啶-d5,400MHz) 数据:0.718(3H,s,H-19),0.831(3H,s,H-30),0.904(3H,s,H-18),1.001(3H,s,H-29),1.187(3H,s,H-28),1.305(9H,s,H-21,26,27),5.25(1H,d,J=7.8Hz,H-1′),4.82(1H,d,J=7.8Hz,H-1″);其13CNMR数据如表2所示。
结合1HNMR和13CNMR数据,发现化合物2的碳谱数据与文献[10]中12β,20(R),25-trihydroxydammar-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranoside的数据非常相似,应该是同种物质,结构式如图6所示。其分子式为C42H74O14,相对分子质量为803.03。该物质的简称为25-OH-Rg3[11](也称作Rg3-Hy[12]),由于本次分离出的结构为R型25-OH-Rg3,所以命名为20(R)-25-OH-Rg3。


表2 化合物2的13C-NMR化学位移

图6 20(R)-25-OH-Rg3的结构式
人参皂苷20(R)-25-OH-Rg3具有很高的药用价值,它能增加大脑中的Na+通量进而增强记忆能力[17],而且能抑制肿瘤细胞的生长[18]。
化合物1的纯化未达到核磁要求,未对其进行核磁检测。根据HPLC及此次核磁检测结果分析,推测化合物1和化合物2可能是手性化合物,化合物1可能是S型的25-OH-Rg3,其系统名称是12β,20(S),25-trihydroxydammar-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranoside,结构式如图7所示。
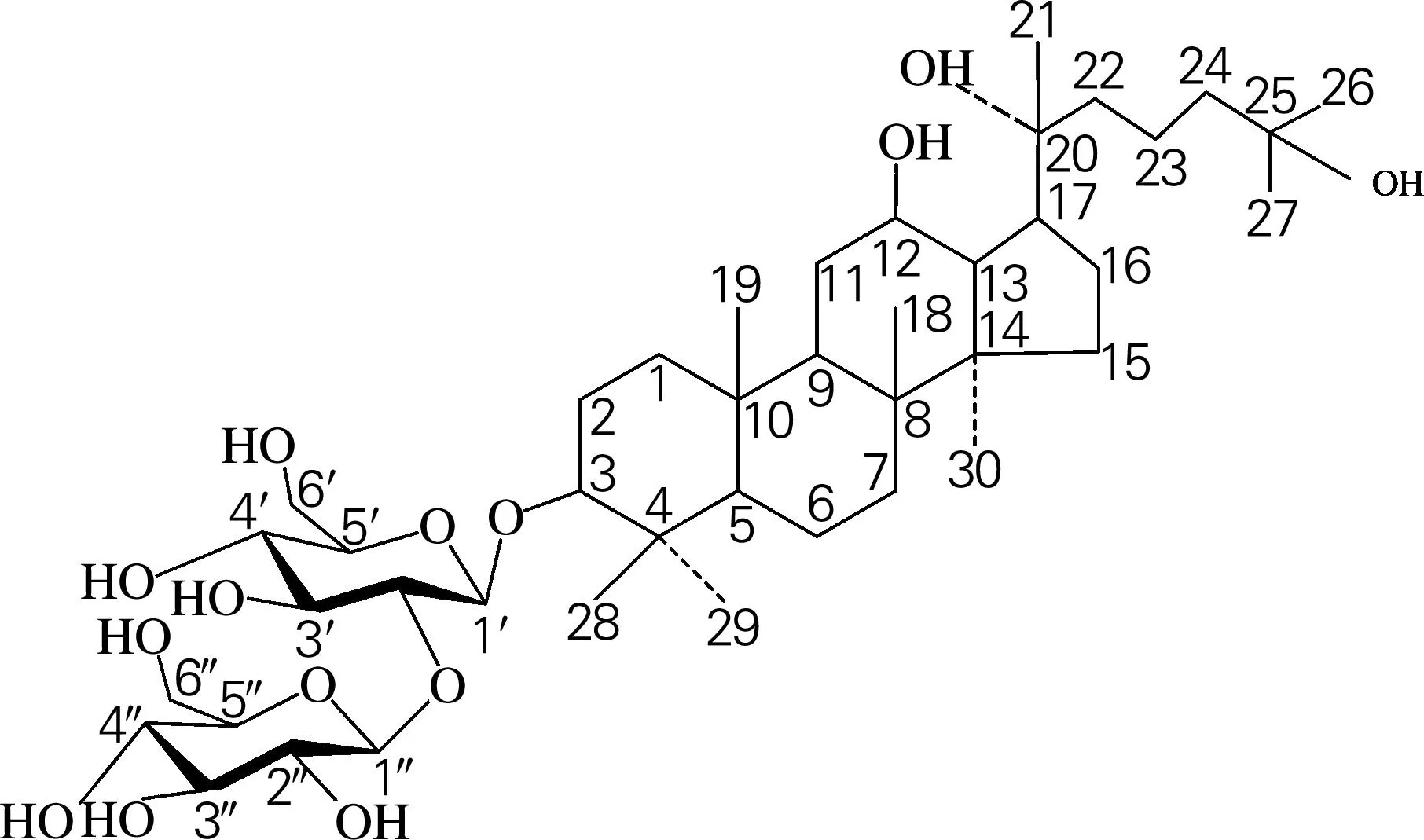
图7 20(S)-25-OH-Rg3的结构式
3结论
该酶转化产物中主要含有(S,R)-Rg3、Rg5及人参皂苷(S,R)-25-OH-Rg3。10g人参皂苷产物进行硅胶柱层析法的分离,得到目的皂苷1.42g,得率为14.2%。结晶法制得20(R)-25-OH-Rg3单体0.25g,得率为17.6%,HPLC检测其纯度达99.7%。经核磁共振分析可知,人参皂苷20(R)-25-OH-Rg3的系统命名为12β,20(R),25-trihydroxydammar-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranoside,其分子式为C42H74O14,相对分子质量为803.03。另外,推测化合物1可能是S型的25-OH-Rg3,其系统名称是12β,20(S),25-trihydroxydammar-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranoside。
目前,国内外文献中关于20(R)-25-OH-Rg3的报道很少,鉴定出(S,R)-25-OH-Rg3的结构,不仅丰富了人参皂苷的种类,还为其更多的生物活性研究提供理论依据。
参考文献:
[1] 郑长龙,鱼红闪,金凤燮.人参稀有皂苷C-K的分离与纯化[J].大连工业大学学报,2003,22(3):167-169.
[2] 杨金祥,章建芳,郑波,等.人参皂苷Rh2抗肿瘤作用研究进展[J].药学进展,2007,10(3):236-237.
[3] 孟祥颖,任跃英,李向高,等.西洋参中皂苷成分的研究综述[J].特产研究,2001(3):43-46.
[4] 唐斌,程绪菊,刘江,等.人参皂苷药理作用研究进展[J].西南军医,2005,7(3):45-47.
[5]YUHS,ZHANGCZ,LUMC,etal.Purificationandcharacterizationofnewspecialginsenosidasehydrolyzingmulti-glycisidesofprotopanaxadiolginsenosides,ginsenosidasetypeⅠ[J].ChemicalandPharmaceuticalBulletin, 2007, 55(2): 231-235.
[6] 王笳,袁崇均,陈帅,等.从西洋参中提取分离纯化人参皂苷Rb1和人参皂苷Re的研究[J].天然产物研究与开发,2008,20(2):357-359.
[7] 窦德强,靳玲,陈杰英.人参的化学成分及药理活性的研究进展与展望[J].沈阳药科大学学报,1999,16(2):15-16.
[8] 李鹏飞,何丹,鱼红闪,等.人参皂苷Rf的分离提纯[J].大连工业大学学报,2011,30(3):180-182.
[9] 蔡艳,郭文盛.HPLC-ELSD测定西洋参中人参皂苷含量[J].陕西中医学院学报,2009,32(1):64-65.
[10]CHENGT,YANGM,SONGY,etal.MicrobialtransformationofginsenosideRb1byAcremoniumstrictum[J].AppliedMicrobiologyandBiotechnology, 2008, 77(6): 1345-1350.
[11]LEEJH,CHOISH,LEEBH,etal.Modificationsofaliphaticsidechainof20(S)-ginsenosideRg3causeanenhancementorlossofbrainNa+channelcurrentinhibitions[J].BiologicalandPharmaceuticalBulletin, 2008, 31(3): 480-486.
[12]WANGJR,LEEFY,ZHANGR,etal.Transformationofginsenosidesfromnotoginsengbyartificialgastricjuicecanincreasecytotoxicitytowardcancercells[J].JournalofAgriculturalandFoodChemistry, 2014, 62(12): 2558-2573.
Purificationandidentificationof20(R)-25-hydroxy-ginsenosideRg3
YANGJiamei,LIUChunying,JINFengxie,YUHongshan
(SchoolofBiologicalEngineering,DalianPolytechnicUniversity,Dalian116034,China)
Abstract:A rare ginsenoside was purified from the biotransformation products of natural ginsenosides. 0.25 g rare ginsenoside was obtained from 10 g samples after silica gel chromatograph and crystalliza- tion, and its purity was 99.7% detected by HPLC. NMR result showed that the rare ginsenoside was 12β, 20(R), 25-trihydroxydammar-3-O-β-D-glucopyranosyl-(1→2)-β-D-glucopyranoside, named 20(R)-25-hydroxy-ginsenoside Rg3.
Key words:ginsenoside; purification; identification
收稿日期:2014-12-30.
基金项目:“重大新药创制”科技重大专项(2012ZX09503001-003).
作者简介:杨佳美(1989-),女,硕士研究生;通信作者:鱼红闪(1968-),男,教授.
中图分类号:TS201.2;Q946.83
文献标志码:A
文章编号:1674-1404(2016)03-0171-03
