*1铁矿石中全铁含量测定方法比较
2016-06-20宋秀丽
宋秀丽
(太原师范学院 化学系,山西 太原 030031)
*1铁矿石中全铁含量测定方法比较
宋秀丽
(太原师范学院 化学系,山西 太原 030031)
〔摘要〕铁矿石中全铁含量可采用多种方法进行测定,不同的方法存在各自不同的系统误差.对不同方法的原理、操作条件、氧化剂、还原剂等比较并对实验方法和结果进行了显著性检验.实验结果表明,SnCl2-TiCl3-Na2WO3-K2Cr2O7法准确度高、精密度好、结果稳定,也不会给环境带来负面影响,具有很多其他方法所不可比拟的优越性,可以用来测定铁矿石中全铁的含量,为铁矿石中全铁含量测定方法的选择提供了一定的实验依据和理论指导.
〔关键词〕有汞法;无汞法;铁矿石;比较
铁是地球上分布最广的金属元素之一,在地壳中的平均含量约为5.1%,在元素丰度表中位于氧、硅和铝之后,居第四位.铁矿石是钢铁工业最基本和最主要的原料,可用于冶炼熟铁、生铁、合金钢、铁合金、碳素钢及特种钢等.截止目前,自然界已知的铁矿石有300多种,但在当前技术条件下,具有工业利用价值的主要有磁铁矿(Fe3O4,含铁72.4%)、赤铁矿(Fe2O3,含铁70.0%)、菱铁矿(FeCO3,含铁48.2%)、褐铁矿(Fe2O3·nH2O,含铁48%~62.9%)、黄铁矿(FeS,含铁63.5%)等[1].我国拥有丰富的铁矿石资源,现已探明储量近600亿吨,位居世界第五位,仅次于巴西、澳大利亚、乌克兰和俄罗斯[2].尤其是近年来,随着钢铁工业的迅速发展,我国对铁矿石的需求量也日益增长,仅2003~2010年间,国内铁矿石产量已从2.6亿吨增加到10.7亿吨,年均增长率超过20%[3].在钢铁行业中,对铁矿石的成分,尤其是总铁和硫的含量进行准确分析和测定非常重要,是保证钢铁质量的先决条件[4].
铁矿石中全铁含量的测定,传统的分析方法主要是氯化汞的重铬酸钾法.该方法以其适用性强、准确度高等优点,一直被作为一种标准的经典方法广泛应用于合金、矿石、金属盐类及硅酸盐等材料中全铁含量的测定.但是该方法在测定过程中引入了大量的汞,会造成严重的环境污染.而且该化学方法在分析铁矿石中的全铁时,过程纷繁复杂、工艺流程较长,以致往往无法及时提供分析结果,很难满足高速发展的现代化生产对快速分析的要求.基于上述多方面原因,本研究将该传统分析方法与其他适用的新的分析方法[5-9]进行比较,对所得结果进行分析和处理,判断各方法的准确度和精密度,以期得到一种适用性更强、可行性更高的分析方法,为铁矿石测定方法的选择提供一定的理论指导和实验依据.
1实验部分
1.1仪器与试剂
HH-4数显恒温水浴锅(国华电器有限公司);电子天平;酸式滴定管等常用玻璃仪器.
二苯胺磺酸钠指示剂(2 g/L);甲基橙指示剂(1 g/L);浓盐酸(分析纯);浓氨水(分析纯);锌粉(分析纯);重铬酸钾(分析纯);氯化亚锡(分析纯);浓硫酸(分析纯);浓磷酸(分析纯);钨酸钠(分析纯);三氯化钛(分析纯);硫酸亚铁铵(分析纯);氯化汞(分析纯);铁矿样(实验室模拟自制);去离子水等.
1.2溶液的配制
K2Cr2O7标准溶液:差减法称取K2Cr2O71.25 g(精确至0.000 1 g)于烧杯中,水溶,定量转移至250 mL容量瓶中,定容至刻度,计算K2Cr2O7的浓度.
SnCl2溶液(100 g/L):称取10 g SnCl2·2H2O固体溶于60 mL浓盐酸中,加水稀释至100 mL,摇匀,贮于试剂瓶中保存,备用.
SnCl2溶液(50 g/L): 称取5 g SnCl2·2H2O固体溶于60 mL浓盐酸中,加水稀释至100 mL,摇匀,贮于试剂瓶中保存,备用.
硫-磷混酸:将150 mL浓硫酸缓慢加入盛有700 mL蒸馏水的烧杯中,冷却后再加入150 mL浓磷酸,混匀,备用.
Na2WO3溶液(200 g/L):称取20 g钨酸钠固体溶于适量水中,加5 mL浓磷酸,用水稀释至100 mL,混匀,贮于试剂瓶中保存,备用.
TiCl3溶液(15 g/L):移取10 mL 150 g/L TiCl3试剂与20 mL HCl (1:1)及70 mL水混匀后贮于棕色瓶中保存,备用.
(NH4)2Fe (SO4)2·6H2O溶液(0.05 mol/L):称取1.9 g(精确至0.000 1 g)硫酸亚铁铵固体置于烧杯中水溶,定量转移至100 mL容量瓶中,定容至刻度,摇匀并保存,备用.
HgCl2溶液(50 g/L):称取5.0 g氯化汞固体置于烧杯中,用蒸馏水溶解,加水稀释至100 mL,摇匀,贮于试剂瓶中保存,备用.
1.3实验方法
1.3.1SnCl2-HgCl2-K2Cr2O7法[10,11]
实验原理:试样用浓盐酸在加热条件下分解,在热浓盐酸中用氯化亚锡还原预Fe(Ⅲ)为Fe(Ⅱ),并使氯化亚锡过量,然后迅速加入适量氯化汞溶液以除去过量的氯化亚锡,会立即有大量白色丝状Hg2Cl2沉淀产生.静置一段时间后,在硫-磷混酸介质中,选择二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液进行滴定,即可测得试样中全铁的含量.即:
实验步骤:称取已干燥试样0.15~0.20 g(精确至0.000 1 g),置于400 mL烧杯中,加入30 mL浓盐酸,低温加热(应控制在105℃以下)分解,待溶液体积浓缩至10~15 mL时取下,加温水至溶液量约为40 mL,再低温加热浓缩至约30 mL.趁热用少量水冲洗杯壁,立即边搅拌边滴加浓度为100 g/L的氯化亚锡溶液至黄色消失,并过量1~2滴,随即用流水冷却至室温,加入5 mL氯化汞饱和溶液,混匀,静置3 min,加150~200 mL水及30 mL硫-磷混酸、滴加5滴二苯胺磺酸钠指示剂,立即用重铬酸钾标准溶液滴定至溶液呈稳定紫色,且保持半分钟不褪色即为终点.同时进行空白试验,平行测定四次,取其算术平均值.
1.3.2SnCl2-TiCl3-Na2WO3-K2Cr2O7法[12-14]

Fe3++Ti3++H2O=Fe2++TiO2++2H+
实验步骤:称取已干燥的试样0.15~0.20 g(精确至0.000 1 g)于500 mL锥形瓶中,加入40 mL浓盐酸,于恒温水浴锅上低温加热至溶解,加热至近沸后滴加浓度为100 g/L的氯化亚锡溶液至无色(反复多次),继续加热至试样全部溶解并浓缩至体积为20~25 mL,滴加少量高锰酸钾溶液至浅黄色,冷却后用水稀释至80~100 mL,加10~15滴钨酸钠溶液,再滴加三氯化钛溶液至溶液出现稳定的浅蓝色,用重铬酸钾标准溶液滴至蓝色恰好褪去,不记消耗重铬酸钾标准溶液的体积.之后,加15 mL硫-磷混酸,滴加6~8滴二苯胺磺酸钠溶液,立即用重铬酸钾标准溶液滴定至溶液呈稳定的紫色,且保持半分钟不褪色即为终点.同时进行空白试验,平行测定四次,取其算术平均值.
1.3.3甲基橙-SnCl2-K2Cr2O7法[15,16]
实验原理:试样经浓盐酸溶解后,用二氯化锡将Fe(Ⅲ)预还原为Fe(Ⅱ),选择甲基橙做指示剂,通过甲基橙在酸性条件下由橙红→红→淡红→无色的颜色变化来指示还原终点, 同时, 稍微过量的氯化亚锡把甲基橙还原成氢化甲基橙而使溶液褪色,从而指示还原终点.氯化亚锡还能继续使氢化甲基橙还原,最终产物为N,N-二甲基对苯二胺和对氨基苯磺酸钠,使稍微过量的氯化亚锡被消除.然后在硫-磷混酸介质中,选择二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定,此时全部Fe2+被氧化为Fe3+,根据滴定时消耗的重铬酸钾标准溶液体积,即可求得试样中铁含量.即:
(CH3)2NC6H4N=NC6H4SO3Na
实验步骤:准确称取1.0~1.5 g铁试样(精确至0.000 1 g),置于250 mL烧杯中,用少量水润湿,用玻璃棒调成糊状,加入20 mL浓盐酸,盖上表面皿,在通风柜中低温加热分解试样.试样分解完全后,用少量水冲洗烧杯内壁和表面皿凸面部分,冷却后转移至250 mL容量瓶中,稀释至刻度并摇匀.用移液管移取试样溶液25.00 mL于锥形瓶中,加8 mL浓盐酸,加热至近沸,滴入6滴甲基橙指示剂,趁热边摇动锥形瓶边逐滴加入浓度为100 g/L的SnCl2溶液还原,溶液由橙变红.然后慢慢滴加浓度为50 g/L的SnCl2溶液至溶液变为淡粉色,再用力摇动至淡粉色褪去.随即用流水冷却,加入50 mL蒸馏水,20 mL硫-磷混酸以及4滴二苯胺磺酸钠指示剂,立即用重铬酸钾标准溶液滴定至溶液呈稳定的紫红色,且保持0.5 min不褪色即为终点.同时进行空白试验,平行测定四次,取其算术平均值.
1.3.4Zn-K2Cr2O7法[17]
实验原理:试样用浓盐酸在加热条件下分解后,加入适量氨水与体系中的盐酸中和,避免在后面的步骤中耗费过多的锌粉,这时溶液中有NH4Cl生成.将溶液加热煮沸,加入锌粉将Fe(Ⅲ)预还原为Fe(Ⅱ),溶液中存在的NH4Cl可加速Fe(Ⅲ)的转化.过量的锌粉用盐酸除去,此时溶液呈无色透明状.然后在硫-磷混酸介质中,选择二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定至溶液呈现稳定的紫色,且保持0.5 min不褪色即达终点.即:
2Fe3++Zn=2Fe2++Zn2+
Zn+2HCl=ZnCl2+H2↑
实验步骤:准确称取0.15~0.20 g(精确至0.000 1 g)铁矿石试样,置于250 mL锥形瓶中, 滴加少量水润湿并摇动使其散开,以免溶样时粘底,然后加10 mL浓盐酸,盖上表面皿,在通风橱中于低温加热至近沸(或在水浴上加热),试样分解完全至澄清.取已经分解完全的试样,稍冷加入20 mL水,并用洗瓶吹洗表面皿凸面部分和锥形瓶内壁,加入1∶1的氨水10~15 mL (视盐酸挥发量而定),这时溶液的pH约为1~1.5,加入0.40 g锌粉,继续加热反应至完全,这时溶液应为无色透明,锥形瓶内应有少量未反应完全的锌粉,整个反应过程约需3~5 min,然后加入适量1∶1的盐酸溶液,使过量的锌粉反应完全.迅速用流水冷却至室温,加水稀释至总体积为120 mL,置于冷水浴中待滴定.待溶液冷却至室温后,从冷水浴中取出,加入硫-磷混酸15 mL,滴加4滴二苯胺磺酸钠指示剂,立即用重铬酸钾标准溶液滴定至溶液由绿色恰变为紫色,并保持0.5 min不褪色即为终点.同时进行空白试验,平行测定四次,取其算术平均值.
1.4空白值的测定
进行空白试验时,于250 mL锥形瓶中加入6.00 mL 0.05 mol/L硫酸亚铁铵溶液、相应量的硫-磷混酸和二苯胺磺酸钠指示剂,用重铬酸钾标准溶液滴定至溶液由绿色恰变为紫色,并保持0.5 min不褪色即为终点,记录消耗重铬酸钾标准溶液的体积(VA).同时,于另一置有空白溶液的250 mL锥形瓶中加入6.00 mL 0.05 mol/L硫酸亚铁铵溶液,摇匀后再以重铬酸钾标准溶液滴定至溶液由绿色恰变为紫色,并保持0.5 min不褪色即为终点,记录滴定所用重铬酸钾标准溶液的体积VB,则V0=(VA-VB)即为空白值.
2结果与讨论
2.1试样的要求
试样由三氧化二铁、四氧化三铁及铁粉(均为分析纯)按一定比例混合组成(故本试样中不存在杂质,不需考虑干扰离子对实验的影响),在烘箱中于105 ℃烘干1 h 后放在干燥器中冷却至室温,并置于广口瓶中保存,备用.
2.2注意事项
1)酸度的选择:选择重铬酸钾作为Fe(Ⅱ)滴定剂的主要原因和优点之一,就是它允许一定量的盐酸存在.据文献[18]介绍,溶液中盐酸浓度可为1~2 mol/L,甚至3.5 mol/L,也不会影响测定结果的准确度.还原时,盐酸浓度在1~1.5 mol/L,对测定结果亦无明显影响.
2)温度与浓缩体积的选择:为了使Fe(Ⅲ)能较为迅速地还原完全,常将溶液浓缩到小体积,趁热滴加SnCl2溶液至黄色褪去.趁热加入SnCl2溶液,是因为Sn2+还原Fe3+的反应在室温下进行得很慢,提高温度到近沸,可加快反应速度;浓缩至小体积,既提高了酸度,防止SnCl2水解,又提高了反应物浓度,有利于Fe(Ⅲ)的还原和还原完全时颜色变化的观察.
3)放置时间的控制:加HgCl2除去过量的SnCl2必须在冷溶液中进行,其氧化作用较慢,在加入HgCl2溶液后需放置2~3 min后才能滴定.因为在热溶液中,HgCl2可氧化Fe(Ⅱ),使测定结果偏低;加入HgCl2溶液后不放置或放置时间太短,反应不完全,Sn2+未除尽,使测定结果偏高;若放置时间过长,已被还原的Fe(Ⅱ)可被空气中的氧气氧化,导致测定结果偏低.
4)滴定前加入硫-磷混酸的作用[15]:在滴定过程中生成的铁(Ⅲ)可能会氧化后期加入体系的指示剂,导致终点提前.加入磷酸,一是保证K2Cr2O7氧化能力所需的酸度,二是H3PO4与Fe3+形成无色配离子[Fe(HPO4)2]-,既可消除FeCl4-黄色对终点颜色变化的影响,同时又可降低Fe3+/Fe2+电对的电位,使滴定突跃下限降低,滴定突跃范围变宽,指示剂颜色变化明显,从而减小系统误差.但是,需要注意的是,在H3PO4介质中,Fe2+的稳定性较差,易被氧化,因此,加入硫-磷混酸后,必须尽快进行滴定.
5)指示剂用量:二苯胺磺酸钠与K2Cr2O7的反应速度很慢,但微量Fe2+具有催化作用,可使之与K2Cr2O7的反应迅速进行,变色敏锐.因此,同时做空白试验时,要加入一定量的硫酸亚铁铵溶液.由于指示剂被氧化时也消耗K2Cr2O7,所以应严格控制指示剂用量.
6)氯化亚锡的反应条件:用氯化亚锡预还原必须在较强的酸度条件下进行;还原温度不能低于60 ℃,否则还原反应进行缓慢;温度太高FeCl3要挥发.同时,溶液的体积不能太大,否则难以观察还原终点.另外,氯化亚锡易水解,生成碱式盐沉淀,配制时需先加入适量盐酸抑制水解,即:
SnCl2+H2O=Sn(OH)Cl(白)↓+H++Cl-
7)空气对二价铁的氧化作用虽然缓慢,但当有盐酸存在时,特别是在加热条件下反应速度会明显加快,加入硫酸后则可减缓空气对亚铁的氧化作用[19].
2.3空白值的测定
由于水质、试剂纯度或指示剂等的影响,可能致使全铁含量的测定结果不准确,故应添加空白试验,同试样一起溶解并滴定,记录下滴定时所消耗的重铬酸钾标准溶液的体积.计算试样最终消耗的滴定液的体积,需用实际消耗的体积减去空白试验消耗的体积来计算.
2.4结果的计算
可以通过下列公式计算分析结果:
式中:
V-滴定试样时所消耗的重铬酸钾标准溶液的体积(mL);
V0-滴定空白试样时所消耗的重铬酸钾标准溶液的体积(mL);
T-重铬酸钾标准溶液对铁的滴定度(g/mL);
m-试样质量(g).
2.5样品测定结果
按拟定实验方案测定铁矿石试样中全铁含量,并对不同实验方法的结果进行比较,结果如表1所示.
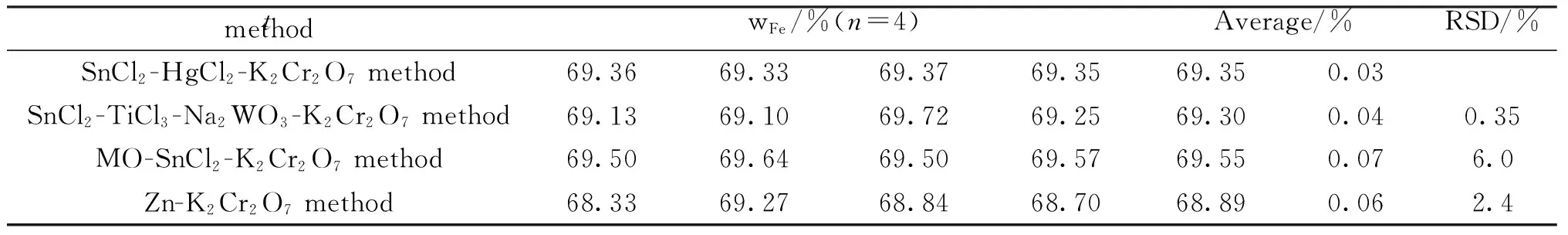
表1 样品测定结果
3结论
实验结果表明,铁矿石试样在盐酸介质中低温加热的情况下溶解,用预还原剂氯化亚锡预还原全部铁至低价铁后,过量的预还原剂用氧化剂完全氧化,然后加水稀释,并加入适量的硫-磷混酸溶液,低价铁基本不被还原.
SnCl2-HgCl2-K2Cr2O7法虽然在测定全铁含量时保持了快速、稳定、准确度高等优点,但氧化剂氯化汞对环境和人体有较大危害,与我们一贯推崇的“绿色化学”理念相矛盾,应尽可能避免使用.
SnCl2-TiCl3-Na2WO3-K2Cr2O7法准确度高、精密度好、结果稳定,过量的预还原剂氯化亚锡用高锰酸钾除去,而不是用SnCl2-HgCl2-K2Cr2O7法中的氯化汞除去,对环境基本没有影响;高锰酸钾氧化氯化亚锡至浅黄色,会有微量低价铁同时被氧化,这时可以钨酸钠为指示剂,用三氯化钛还原,可以减小测定误差.
甲基橙-SnCl2-K2Cr2O7法用甲基橙代替SnCl2-HgCl2-K2Cr2O7法中的氯化汞来消除过量的氯化亚锡,消除了SnCl2-HgCl2-K2Cr2O7法的缺陷.但该法仍存在一些不足:一方面,甲基橙的用量不易控制,很容易过量,过量会使滴定终点颜色变色不敏锐,为此应控制在溶液变为红色后,逐滴加入浓度为50 g/L的SnCl2溶液,并在溶液颜色变为粉色后用力摇动,使反应完全,直至淡粉色褪去,可减小误差;另一方面,在实验过程中,溶液酸度也很难控制,由于先加甲基橙后加SnCl2溶液,酸度一旦过高,SnCl2将先还原甲基橙为无色,后还原Fe3+,这将无法指示铁的还原而导致实验失败.因此该方法在指示剂用量、溶液酸度及操作条件等方面均存在不足,仍需进一步改进.
Zn-K2Cr2O7法的准确度与精密度都不是很好,虽然该方法操作简单,且过量锌粉可用盐酸除去,但在实验过程中加入锌粉的量不易控制,锌粉少会导致Fe(Ⅲ)不能完全转为Fe(Ⅱ),但锌粉加多,在温度较高的条件下容易使单质铁析出,而若温度太低,反应会减慢.同时,若少量剩余的锌粉不除去,在滴定过程中氧化生成的Fe(Ⅲ)又会被锌还原,导致测定结果偏大.
综上所述,SnCl2-TiCl3-Na2WO3-K2Cr2O7法准确度高、精密度好、结果稳定,而且不会给环境带来负面影响,具有很多其他方法所不可比拟的优越性,可以用来测定铁矿石中全铁的含量,为铁矿石中全铁含量测定方法的选择提供了一定的实验依据和理论指导.
参考文献:
[1]曹锡章,王杏乔,宋天佑.无机化学[M]第三版.北京:高等教育出版社,1994:1011
[2]闫卫东.正确认识我国的矿产资源形势[J].中国矿业,2008,17(1):1-5
[3]何洋,王化军,孙体昌,等.赤铁矿石隧道窑直接还原助还原剂的作用及机理[J].北京科技大学学报,2012,34(6):625-631
[4]单华珍,卓尚军,盛成,等.粉末压片法波长色散X射线荧光光谱分析铁矿石样品的矿物效应校正初探[J].光谱学与光谱分析,2008,28(7):1661-1664
[5]周凤英.二氯化锡-重铬酸钾容量法快速测定硫铁矿中全铁量[J].矿业快报,2006,26(5):37-38
[6]何巧玲,贾广信,马永录,等.高氯酸代替氯化高汞重铬酸钾容量法测定铁矿石中全铁[J].矿业快报,2007,27(8):53-54
[7]马茜,马秀卿.抗坏血酸法测定铁矿石中全铁的研究[J].分析化学,1995,23(5):609
[8]张厚廷.铝片还原-铈量法测定铁矿中的全铁[J].岩矿测试,1989,8(1):68-69
[9]王瑞斌.盐酸羟胺-重铬酸钾无汞滴定法测定铁矿石中铁[J].治金分析,2005,25(6):89-90
[10]冶金工业部标准研究院.GB/T6730.4-1986.铁矿石化学分析方法氯化亚锡-氯化汞-重铬酸钾容量法测定全铁量[S].北京:中国标准出版社,1987,480-483
[11]陈建亚.铁矿石中全铁含量的测定-EDTA滴定法[J].福建分析测试,2004,13(1):1916-1917
[12]任莹.铁矿石全铁含量的测定-三氯化钛还原法[J].黑龙江冶金,2011,31(2):20-21
[13]张海松,李林庆.无汞盐重铬酸钾容量法测定铁的分析方法[J].化学工程与装备,2009,38(8):159-161
[14]华中师范大学,东北师范大学,陕西师范大学,等.分析化学实验[M].第三版.北京:高等教育出版社,2001,81-82
[15]武汉大学.分析化学实验[M].第四版.北京:高等教育出版社,2001,200-202
[16]刘步明,王瑞斌.氯化亚锡-甲基橙法测铁实验的讨论[J].榆林高等专科学校学报,1996,6(1):41-42
[17]李晖,朱刚,谭炯,等.无汞盐法测定铁矿石中铁含量研究[J].西南民族学院学报(自然科学版),2000,26(1):44-46
[18]林雪飞.全铁的无汞盐重铬酸钾测定法[J].曲靖师专学报,1998,17(5-6):71-74
[19]杨武,高锦章,康敬万.光度分析中的高灵敏度反应及方法[M].北京:科学出版社,2000,270-276
Comparison of Testing Methods for Total Iron Content in Iron Ore
SONG Xiuli
(Department of Chemistry, Taiyuan Normal University, Taiyuan 030031, China)
〔Abstract〕Total iron content in iron ore can be tested using many kinds of methods, and every method has different system error. Different methods have been compared in principle, operating conditions, oxidant and reductant. At the same time, significance of every methods and results has been tested. The results show that the SnCl2-TiCl3-Na2WO3-K2Cr2O7 method has high accuracy, good precision, stable results and absence of environment pollution. So it can be used to determine the total iron content in iron ore owing to many superiorities. And this study will provide some experimental basis and theoretical guidance for determination total iron content in iron ore.
〔Key words〕mercury method; mercury-free method; iron ore; comparison
*收稿日期:2015-12-10
作者简介:宋秀丽(1973-),女,山西长治人,太原理工大学博士研究生,太原师范学院化学系副教授,主要从事分析化学教学及实验研究.
〔文章编号〕1672-2027(2016)01-0076-06〔中图分类号〕O657.7
〔文献标识码〕A
