壳聚糖中蛋白质含量测定方法的研究
2016-06-20作者韩婷史国华李素哲刘俊英河北省医疗器械与药品包装材料检验研究院石家庄市05006石家庄亿生堂医用品有限公司石家庄市05000
【作者】韩婷,史国华,李素哲,刘俊英 河北省医疗器械与药品包装材料检验研究院,石家庄市,05006 石家庄亿生堂医用品有限公司,石家庄市,05000
壳聚糖中蛋白质含量测定方法的研究
【作者】韩婷1,史国华1,李素哲2,刘俊英2
1 河北省医疗器械与药品包装材料检验研究院,石家庄市,050061
2 石家庄亿生堂医用品有限公司,石家庄市,050200
【摘要】目的 解决壳聚糖中蛋白质含量测定时出现的沉淀问题。方法 对考马斯亮蓝法测定壳聚糖中蛋白质含量进行方法改进。结果 用盐酸浓度为5%的考马斯亮蓝溶液作为染色剂,染色15 min,在最大吸收波长598 nm处进行测定;吸光度-蛋白质浓度标准曲线为:y=0.003x+0.017 9,r2=0.991,蛋白质浓度范围为5 µg/mL~40 µg/mL时线性相关性良好;最低检出限1 µg/mL,加标回收率97.8%~103.7%。结论 该文确定的壳聚糖中蛋白质含量的检测方法准确性高、试验结果稳定、可靠,重现性强,可广泛用于产品检验。
【关 键 词】蛋白质含量;壳聚糖;考马斯亮蓝法;盐酸
壳聚糖又称脱乙酰甲壳素,是一种天然碱性多糖[1-2],具有抗菌、止血、止痛作用[3],在生物医学领域应用广泛。目前,考马斯亮蓝法被应用于蛋白质含量的检测,但实际检测壳聚糖中蛋白质含量时发现,染色20 s即出现沉淀,影响测定结果。为此,我们进行了大量的试验,并对该方法进行了改良。
1 仪器和试剂
原料 壳聚糖(石家庄亿生堂医用品有限公司)。
仪器 UV-2600型紫外可见分光光度计(岛津企业管理(中国)有限公司);SK-1型快速混匀器(江苏中大仪器厂);AL204电子天平(梅特勒-托利多仪器(上海)有限公司)。
试剂 蛋白质标准品(Sigma 公司);考马斯亮蓝G-250(Sigma公司);95%乙醇(天津市科密欧化学试剂有限公司,AR);盐酸(天津市永大化学试剂有限公司,AR);实验用水为纯化水。
2 实验方法
2.1配制试剂
(1) 考马斯亮蓝溶液 称取100 mg考马斯亮蓝G-250,溶解于50 mL的95%乙醇中,加盐酸50 mL,并用水稀释至1000 mL,置棕色瓶中,室温贮存。
(2) 蛋白质标准品溶液 称取约25 mg牛血清白蛋白(预先置于含五氧化二磷的真空干燥器中真空干燥至恒重),置50 mL容量瓶中,加水溶解并稀释至刻度,摇匀。4oC下贮存,作为原液。临用时,取5 mL原液,加纯化水稀释成50 µg/mL,作为标准液。
(3) 供试品溶液 取壳聚糖1.0 g,精密称定,置100 mL容量瓶中,用1%乙酸溶液溶解并稀释至刻度,混匀,作为供试液。
2.2最大吸收波长
精密移取2 mL蛋白质标准品溶液于25 mL比色管中,加入10 mL考马斯亮溶液,用快速混匀器使试管中溶液充分混合,室温放置15 min,于400~700 nm波长范围内进行扫描,取2 mL壳聚糖溶液同法操作,结果见图1。
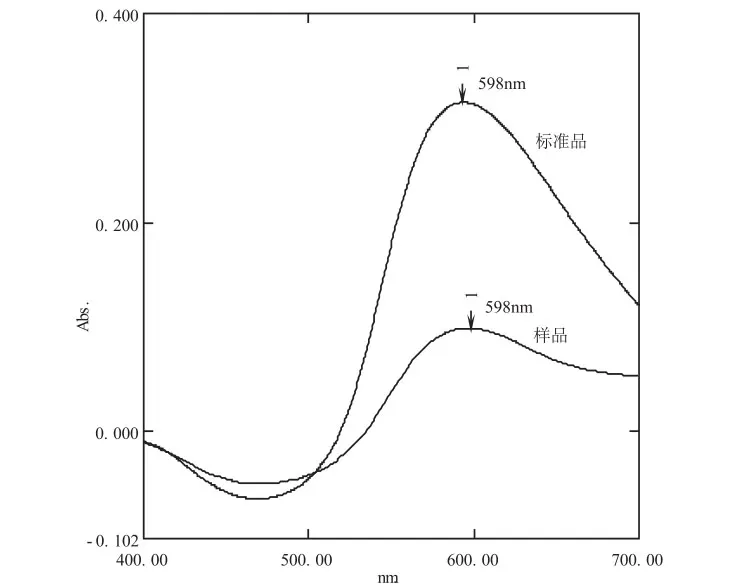
图1 蛋白质考马斯亮蓝扫描图谱Fig.1 Scanning spectrum of protein with Coomassie brilliant blue
标准品和样品的最大吸收波长均在598 nm处,确定该波长为检测波长。
2.3盐酸浓度的选择
取2 mL蛋白质标准品溶液7份,加考马斯亮蓝溶液10 mL(其中盐酸浓度分别为3%、4%、4.5%、5 %、6%、7 %、9 % (V/V)),快速混匀器使其混合均匀,室温放置15 min,于598 nm波长处测定吸光度,见表1。

表1 盐酸浓度选择Tab.1 Selection of hydrochloric acid concentration
由表1可见,体系反应相同的时间,盐酸浓度越高,598 nm处的吸光度值越小,灵敏度越差。但实际检测时,盐酸浓度小于4.5%,反应体系有沉淀产生,影响结果准确性。因此,为了保证检测结果的可靠性,从灵敏度和准确性两方面考虑,选择盐酸浓度为5%。
2.4染色时间的选择
取2 mL蛋白质标准品溶液,加10 mL盐酸浓度5 %的考马斯亮蓝溶液,快速混合器使其混合均匀,室温放置,每隔一定时间对于同一样品取样测定,持续1 h,结果见表2。
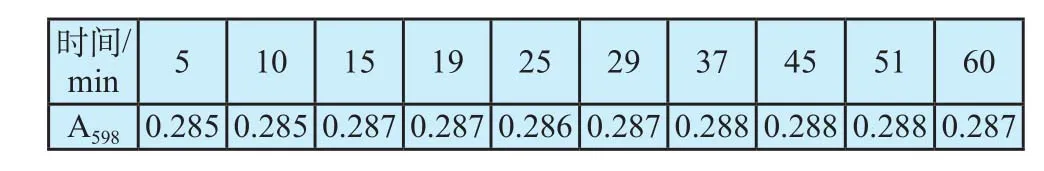
表2 反应时间Tab.2 Reaction time
从表2可以看出,反应体系于室温放置15 min后吸光度值已基本稳定,且1 h内的吸光度值基本不变,稳定性较好,因此确定染色时间确定为15 min。
2.5标准曲线
取6个试管,编号为0~5,向其中依次加入0、 0. 2 mL、0.4 mL、0.8 mL、1.2 mL、1.6 mL的蛋白质标准液(50 µg/mL),然后用纯化水补齐至2 mL,配制成浓度依次为0、5 µg/mL、10 µg/mL、20 µg/mL、30 µg/mL、40 µg/mL的蛋白质标准溶液,然后再依次向其中加入10 mL的考马斯亮蓝G-250溶液,用快速混匀器使试管中溶液充分混匀,室温放置15 min后,用0号管作空白,于598 nm波长处测定吸光度值,绘制吸光度值-蛋白质浓度标准曲线,见图2。
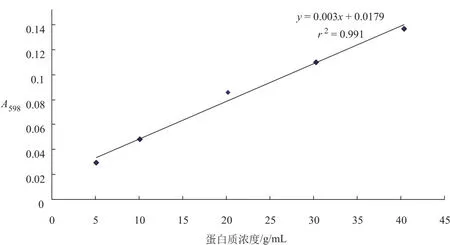
图2 蛋白质溶液标准曲线Fig. 2 Standard curve of protein solution
标准曲线回归方程为y=0.003x+0.017 9,r2=0.991,线性相关性良好,线性范围为5~40 µg/mL,最低检出限1 µg/mL。
2.6重复性试验
为了验证实验结果是否可靠,对同一蛋白质标准溶液用盐酸浓度5%的考马斯亮蓝溶液染色15 min,于598 nm重复测定6次,结果见表3。

表3 重复性试验Tab.3 Repeatability test
同一样品重复测定6次的相对标准偏差RSD=1.4%,说明该方法重复性好。
2.7加标回收率
称取4份质量均为1.0 g的壳聚糖,分别置于4个100 mL容量瓶中,加入适量1%乙酸溶液溶解,然后用移液枪依次取2 mL、4 mL、6 mL浓度为500 µg/mL的蛋白质标准品溶液原液,分别置于三份壳聚糖溶液中,最后用1%乙酸溶液定容至100 mL;分别量取2 mL上述溶液于4个25 mL比色管中,依次加入10 mL盐酸浓度为5%的考马斯亮蓝溶液,快速混匀器使其混合均匀,室温放置15 min,于598 nm波长处测定吸光度,每个样品平行测定2次,计算蛋白质加入量及加标回收率,结果见表4。
回收率为97.8%~103.7%,平均回收率为101.1%,RSD=2.4%

表4 加标回收率Tab.4 Recovery rate
3 结果与讨论
3.1结果
取供试品溶液2 mL,加盐酸浓度为5%的考马斯亮蓝溶液10 mL,混合均匀,室温放置15 min,于598 nm波长处检测吸光光度值,计算壳聚糖中,重复进行3次实验,结果见表5。

表5 供试品试验结果Tab.5 Test results of the sample
3.2结论
改进后壳聚糖中蛋白质含量的检测方法为:取2 mL样品溶液中加入10 mL盐酸浓度为5%的考马斯亮蓝溶液,混合均匀后,室温放置15 min,598 nm波长处检测吸光度值,根据吸光度值-蛋白质浓度标准曲线计算壳聚糖中蛋白质含量。
3.3讨论
壳聚糖中杂质蛋白的检测,中国医药行业标准YY/T 0606.7—2008《组织工程医疗产品》[4]中壳聚糖部分规定用考马斯亮蓝法。在工作实践中发现该方法准确性欠佳,重复性差,混匀后20 s即出现沉淀,分析原因可能为:磷酸浓度太大,壳聚糖析出,产生了沉淀;也有可能是考马斯亮蓝分子上有磺酸基,壳聚糖在磺酸基和磷酸存在的情况下生成了不溶于水的壳聚糖磷酸酯,给检测壳聚糖中蛋白质含量带来困难。本文对原方法进行了改良,用盐酸替代磷酸,因壳聚糖盐酸盐具有良好的水溶性,且选用的盐酸浓度合适,因此显著改善了检测过程中产生沉淀的问题,经方法学验证表明,检测结果准确度高,重现性好,检测结果稳定、可靠。
参考文献
[1] 刘小华, 张宏宇, 李舒梅, 等. 低蛋白含量壳聚糖制备研究[J]. 广东化工, 2010, 37(5): 100-112.
[2] 杨久林, 谢红国, 于炜婷, 等. 组织工程用壳聚糖研究进展[J]. 功能材料, 2013, 11(44): 1521-1525.
[3] Zivanovic S, Li J, Davidson M, et a1. Physical, mechanical and antibacterial properties of chitosan/PEO blend films[J]. Biomacromolecules, 2007, (8): 1505-1510.
[4] 国家食品药品监督管理局. YY/T 0606.7—2008 组织工程医疗产品[S].
Study of the Determination Method of Protein Content in Chitosan
【Writers】HAN Ting, SHI Guohua, LI Suzhe, LIU Junying
1 Hebei Testing Institute for Medical Instrument and Pharmaceutical Packing Profi le, Shijiazhuang, 050061
2 Shijiazhuang yishengtang Medical Supplies co. Ltd., Shijiazhuang, 050200
【Abstract】Objective Using the Coomassie brilliant blue method to solve the problem of the precipitation when detecting the protein content in chitosan. Methods Improving the Coomassie brilliant blue method. Results Use the Coomassie brilliant blue solution with hydrochloric acid concentration of 5% as stain, stain 15 min , the maximum absorption wavelength is 598 nm. the standard curve of absorbance-protein concentration is y=0.003x+0.017 9. r2=0.991, the linear correlation is good within the protein concentration scope of 5 µg/mL~40 µg/mL, the lowest detection limit is 1 µg/mL, and its recovery is 97.8%~103.7%. Conclusions In this paper, the method of determining the content of protein in chitosan is high accurate, stable, reliable and reproducible, and can be widely used in product testing.
【Key words】protein content, chitosan, Coomassie brilliant blue method, hydrochloric acid
【中图分类号】R318.08
【文献标志码】A
doi:10.3969/j.issn.1671-7104.2016.02.014
文章编号:1671-7104(2016)02-0122-03
收稿日期:2015-10-29
作者简介:韩婷,E-mail: 905168841@qq.com
