MPO-AAV患者临床特点及其肺部受累预后危险因素分析
2016-06-20孔秀芳纪宗斐陈慧勇马莉莉张卓君姜林娣
孔秀芳 纪宗斐 闫 焱 陈慧勇 马莉莉 张卓君 姜林娣
(复旦大学附属中山医院风湿免疫科 上海 20032)
MPO-AAV患者临床特点及其肺部受累预后危险因素分析
孔秀芳纪宗斐闫焱陈慧勇马莉莉张卓君姜林娣△
(复旦大学附属中山医院风湿免疫科上海20032)
【摘要】目的分析髓过氧化物酶阳性的抗中性粒细胞胞浆抗体相关性血管炎 (myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis,MPO-AAV)患者临床特点并探讨肺部受累患者呼吸衰竭、肺部感染和死亡的危险因素。方法收集复旦大学附属中山医院2005年2月至2013年12月初诊入院的MPO-AAV患者基线时临床资料,截至2014年8月或死亡,应用Logistic多因素回归分析肺部受累患者不同预后的独立危险因素。结果共纳入98例确诊的MPO-AAV患者,早期系统型13例,全身型50例,重型28例,难治型7例。呼吸系统以咳嗽咳痰、胸闷气促为主要表现;胸部X线和高分辨CT(high resolution computed tomography,HRCT)示以渗出 (36例)、肺间质改变 (35例)常见;肺活检示8例肺组织病理学见肺泡间隔破坏、慢性炎性细胞浸润。糖皮质激素治疗92例,免疫抑制剂治疗79例,两种球蛋白治疗19例,免疫吸附5例。治疗后改善者71例,复发者17例。发生急性呼吸衰竭者16例,死亡9例,肺部感染者35例;分别以急性呼吸衰竭、死亡和肺部感染为终点,Logistic回归分析肺部受累患者临床资料发现:肺部感染、肺间质病变、Scr>500 μmol/L以及ALB<30 g/L是急性呼吸衰竭的危险因素;发病年龄≥65岁、急性呼吸衰竭是患者死亡的危险因素;急性呼吸衰竭是患者肺部感染的危险因素。结论MPO-AAV患者多有肺部受累,同时伴有全身及血液、肾脏等其他系统受累的异常表现。肺部感染是MPO-AAV肺部受累患者发生急性呼吸衰竭的主要诱发因素,且二者相互促进增加患者死亡风险;发病年龄>65岁是呼吸衰竭患者死亡的危险因素。
【关键词】髓过氧化物酶阳性的抗中性粒细胞胞浆抗体相关性血管炎;呼吸衰竭;肺部感染;死亡;危险因素
髓过氧化物酶阳性的抗中性粒细胞胞浆抗体相关性血管炎 (myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis,MPO-AAV)是抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关性血管炎 (ANCA-associated vasculitis,AAV)的一种类型,其代表性疾病是显微镜下多血管炎 (microscopic polyangiitis,MPA),以患者血清中出现抗髓过氧化物酶 (myeloperoxidase,MPO)抗体为主要标志,是一种主要累及小血管的系统性坏死性血管炎,可侵犯肾脏、皮肤和肺等脏器的小动脉、微动脉、毛细血管和小静脉。常表现为坏死性肾小球肾炎和肺毛细血管炎,在欧洲南部以及亚洲国家多见[1]。
目前关于AAV的临床研究均是包括MPO-AAV和蛋白酶3(proteinase 3,PR3)阳性的抗中性粒细胞胞质抗体相关性血管炎(PR3-AAV)的总体研究,尚无单独针对MPO-AAV的系统报道,且相比于PR3-AAV, MPO-AAV相关研究较少。MPO-AAV的诊断主要依赖具有致病性的抗MPO抗体,其受累器官最常见的是肾脏和肺。肾脏可表现为急进型肾小球肾炎,组织学上为寡免疫复合物沉积的坏死性新月形肾小球肾炎[2]。既往对MPA的研究多集中在肾脏器官,但临床实践发现,MPA患者肺部受累也较常见,且其发生呼吸衰竭和死亡的风险明显增加,导致患者预后不佳。曾有报道指出,MPA患者肺部受累时以肺间质改变为主,可表现为弥漫性肺泡出血和肺纤维化,胸部高分辨CT(high resolution computed tomography,HRCT)表现为寻常型间质性肺炎或非特异性间质性肺纤维化,同时可伴有肺气肿、蜂窝肺以及磨玻璃影[3-4]。根据欧洲血管炎研究组建议,AAV的治疗分为诱导缓解期和维持治疗期,长期维持缓解是治疗AAV患者的关键[5]。
在日本,73.7%的MPA患者有肺部受累,其中11.3% 的患者表现为肺泡出血[6],预后较差。目前在国内肺部受累仅局限于少数案例分析的报道,尚无系统性临床特点的研究,也无相关肺部受累时预后危险因素分析。刘育佳等[7]曾对AAV患者临床特点及相关肺部表现进行分析,结果表明AAV的发病率逐渐升高,其临床表现多变,病变部位广泛,肾脏和肺脏是 AAV 最易受累的器官,对于长期发热及多器官受损的患者应尽早进行 ANCA 检查及诊断,及时治疗,改善预后。 王勇等[8]通过对AAV相关肺部影像学表现分析表明,肺部影像学表现与肾脏病理相关,且肺出血合并I型急进型肾小球肾炎者进展迅速,病情凶险,重视影像学分析有助于AAV的诊断。张娟等[9]对AAV相关的肺部感染进行危险因素分析,发现老年、MPA、低蛋白血症和合并肺间质病变的AAV患者发生肺部感染的风险高,临床中应给予重视。
X线和HRCT是诊断AAV肺部受累的重要手段,但由于AAV患者肺部受累时无特异性表现,常被误诊为感染性肺炎、狼疮性肺炎以及肺结核等,导致患者治疗延误[10-11]。因此,关注患者的临床特点、治疗效果及肺部受累相关预后是AAV临床诊断和治疗中重要的环节。本研究在系统收集患者临床资料的基础上,分析总结了患者的临床特点、治疗方案、效果及其肺部受累时不同结局的危险因素,以期为患者的临床诊断和治疗提供理论依据。
资 料 和 方 法
临床资料
病例选择本研究纳入复旦大学附属中山医院2005年2月至2013年12月期间初诊入院的MPO-AAV患者98例,初诊入住肾内科55例、呼吸内科9例、风湿免疫科32例及其他科2例;其中男性47例,女性51例,平均发病年龄为(60.67±13.66)岁,平均病程为(0.76±1.8)年(0.08~10年)。所有纳入患者均满足2012年CHCC (Chapel Hill)分类标准以及美国风湿病学会的分类标准[12],或由风湿免疫专科医师诊断,除外结缔组织病、感染、肿瘤、药物等继发的血管炎患者。
截至患者死亡或2014年8月31日,回顾性收集98例患者的临床症状、体征、实验室检查、病理学及影像学检查资料,其中1人自动出院、1人失访未纳入本研究。所有入组患者均在入院后完成胸部HRCT。
临床分型参照欧洲血管炎研究组分型标准[13]对AAV患者的进行临床分型,包括局限型、早期系统型、全身型及重型。
定义
肺部受累在AAV诊断明确的基础上,排除感染病原体引起的肺炎,X线或肺部CT提示肺部病变(如间质性肺炎、肺泡出血、肺气肿以及肺结节等),伴或不伴肺部临床症状如咳嗽、咳痰、咯血等。
肺部感染诊断依据: (1)发热、咳嗽、咳黄痰、咳黏稠拉丝痰、呼吸困难,伴或不伴胸痛; (2)痰病原微生物学检查有明确病原菌>2; (3)HRCT提示肺部炎症。肺部HRCT为必备条件。采用西门子双源64层螺旋CT行肺部HRCT检查,嘱患者仰卧位,常规扫描层厚为10 mm、螺距为8 mm,HRCT选层厚1~2 mm,120~140 kV,100~230 mAs,Matrix 1 024×1 024,嘱患者深吸气后屏气扫描。观察肺窗宽1 000~1 400 HU,中心(-700)~(-800) HU,纵隔窗宽为300~400 HU,中心34~50 HU。肺部扫描共分为3个部分:肺尖、主动脉弓下至肺门以及膈上部分。
呼吸衰竭由血管炎肺部受累引起的呼吸功能障碍,引起动脉血氧分压 (PaO2)降低,伴或不伴有动脉血二氧化碳分压 (PaCO2)增高而出现一系列病理生理紊乱的临床综合征。
死亡因疾病本身或疾病并发症引起的死亡。
实验室检查就诊患者入院后常规进行血、尿、血沉 (erythrocyte sedimentation rate,ESR)、C-反应蛋白 (C-reactive protein,CRP)、肝肾功能及ANCA等相关免疫学指标的检查。ANCA检测采用欧蒙MPO以及PR3的抗体IgG检测试剂盒分别检测血清中的MPO及PR3抗体。
组织病理学检查8例患者行支气管镜下肺组织活检并进行组织病理学检查;55例患者行肾脏穿刺并进行光镜和电镜的病理学检查;2例患者行皮肤病理学检查。

结果
临床表现患者临床资料见表1。其中肺部受累75例 (76.53%),肾脏受累80例 (81.63%),肺肾同时受累58例 (59.18%);全身症状中发热者59例 (60.20%);呼吸系统表现中,患者初次就诊时有咳嗽咳痰症状者69例 (70.41%),有胸闷气促者38例 (38.78%),伴咯血者18例 (18.37%),有胸痛者8例 (8.16%)。对所纳入患者按照欧洲血管炎研究组分型标准[13]进行分型,其中早期轻型13例、全身型50例、重型28例、难治型7例。
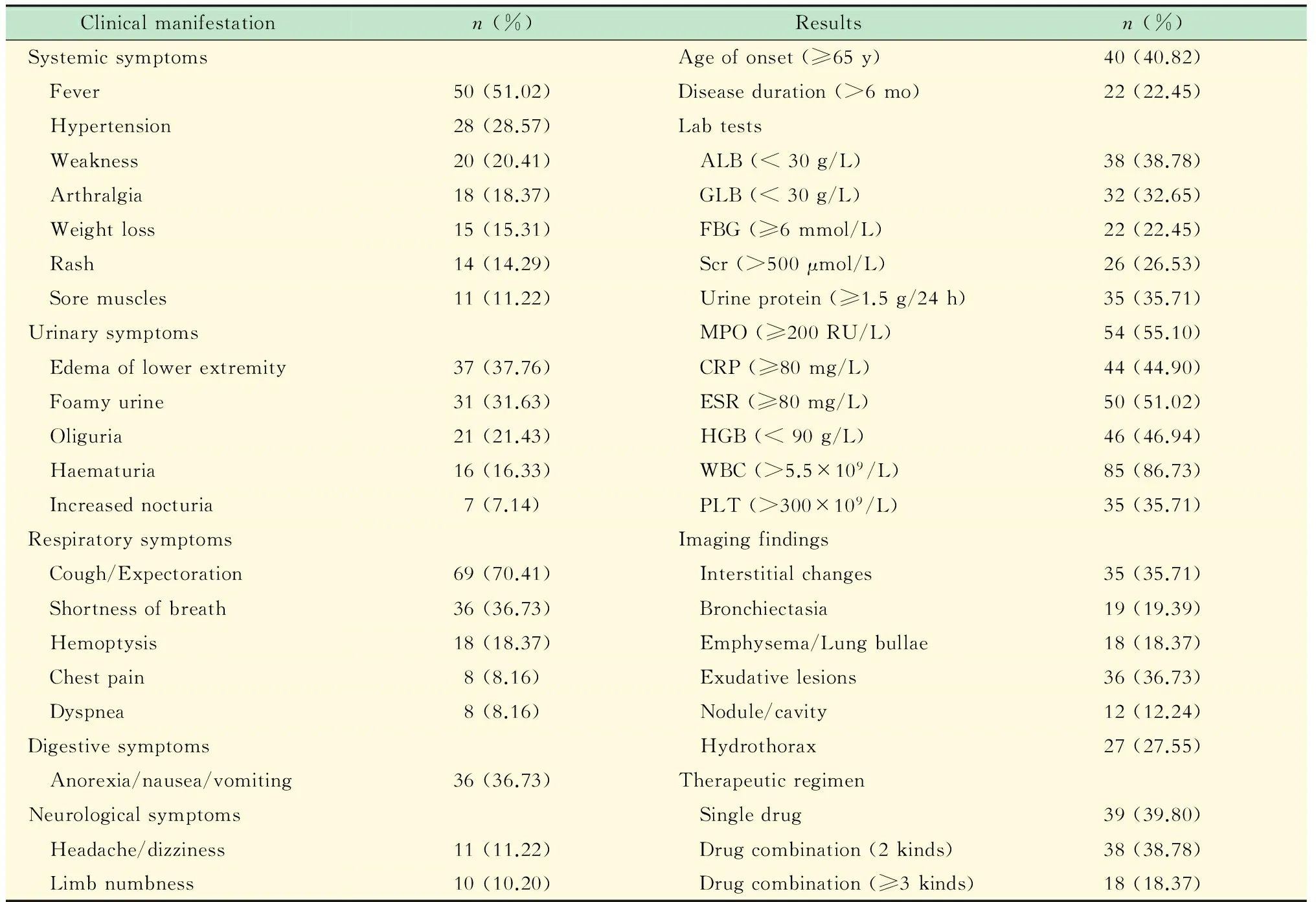
表1 患者主要临床特点
ALB:Albumin;GLB:Globulin;Scr:Serum creatinine;FBG:Fasting blood glucose;HGB:Haemoglobin;WBC:White blood cell;PLT:Platelet.
实验室检查血尿常规、ESR、CRP、肝肾功能以及相关免疫学主要指标结果见表1,可发现部分患者血红蛋白下降、白细胞和血小板升高、白蛋白下降、肌酐升高,MPO抗体滴度均大于20 RU/mL。
胸部HRCT炎症渗出者36例;肺间质炎症或间质纤维化改变者35例,多为弥漫性;胸腔积液27例,多为两侧少量胸腔积液;支气管扩张19例;肺气肿/肺大疱18例;结节/空洞12例。此外,病程较长者可伴有胸膜增厚、钙化。
病理肾活检55例,其中新月体肾炎49例;肺组织活检8例,6例可见纤维组织增生伴慢性炎性细胞浸润,以浆细胞、淋巴细胞为主,2例可见肺泡塌陷,肺泡纤维素渗出,1例肺泡腔出血;皮肤活检2例,1例见真皮层胶原纤维增生、淋巴细胞及浆细胞浸润,1例见皮下小血管内皮细胞增生。
治疗糖皮质激素 (glucocorticoids,GCs)治疗92例 (93.88%),其中初始冲击治疗者39例 (39.80%,相当于泼尼松剂量500 mg及以上);免疫抑制剂治疗79例 (80.61%),包括环磷酰胺 (cyclophosphamide,CTX)、霉酚酸酯 (mycophenolate mofetil,MMF)、环孢素A (cyclosporin A)、硫唑嘌呤 (azathioprim,AZA)以及甲氨蝶呤 (methotrexate,MTX);同步应用丙种球蛋白治疗19例 (19.39%);免疫吸附5例 (5.1%)。在维持治疗过程中,用药方案可分为单药、2种药物联合、3种及以上联合用药,单药治疗者39例 (39.80%),GCs治疗37例 (37.76%),AZA治疗2例 (2.04%));二联方案治疗38例(38.78%),均以GCs为基础联合免疫抑制剂的应用,后者包括MMF (20例)、CTX (15例)、AZA (5例)和MTX (2例);三联及以上治疗者18例 (18.37%)。随访时间平均为(2.67±1.97)年。
转归与死亡治疗有效者且敏感者54例(55.1%),难治或复发者44例(44.9%)。治疗有效者均应用GCs治疗,其中冲击治疗者20例,单用者6例,联合免疫抑制剂治疗者48例,其中联合1种免疫抑制剂者35例(CTX 20例、MMF 11例、AZA 3例、MTX 1例),联合2种免疫抑制剂者10例[CTX加用另外1种免疫抑制剂(AZA 7例、MMF 2例、MTX 1例)],联合3种及以上免疫抑制剂者3例。在复发或难治性患者中,GCs治疗者38例,免疫抑制剂应用者30例。 在治疗有效组与无效组中GCs的初始用量差异有统计学意义[(434.41±217.30) mgvs. (325.46±249.45) mg,P=0.03],维持计量无明显差异[(7.8±3.6) mgvs.(8.8±4.0) mg,P=0.34],两组之间激素冲击治疗用量差异无统计学意义[(616.25±12.23) mgvs. (617.11±11.94) mg,P=0.46];联合的免疫抑制剂用药方案:CTX (32例) 累计用药剂量平均为(3.68±2.97) g;15例MMF治疗者中11例由初始计量0.5 g(每日2次)减至0.25 g (每日1次),其余2例7.5 g (每日2次),2例2.5 g (每日3次);12例AZA治疗者均为50 mg (每日1次);5例MTX治疗者2例每周10 mg、2例每周15 mg、1例每周7.5 mg。治疗有效组与无效组之间免疫抑制剂用药方案及用药剂量无明显差异。
在肺部受累患者中,发生急性呼衰者16例 (16.33%)、肺部感染者35例 (35.71%)、死亡者9例 (9.18%)。死亡患者中,5例肺部感染后呼吸衰竭,1例呼吸循环衰竭,1例肾脏衰竭,1例消化道出血,1例心肺肾多器官功能衰竭,呼吸衰竭者均为Ⅰ型呼吸衰竭。死亡患者平均发病年龄为71.56岁,明显高于非死亡患者发病年龄 (59.57岁,P<0.05)。
不同结局影响因素分析以急性呼衰、死亡和肺部感染为终点,将75例肺部受累MPO-AAV病例的临床特点纳入Logistic回归进行多因素分析,包括性别、年龄、病程、实验室检查、肺部感染、呼吸衰竭以及肺间质病变。急性呼吸衰竭、肺部感染和死亡3种不同结局的危险因素见表2。
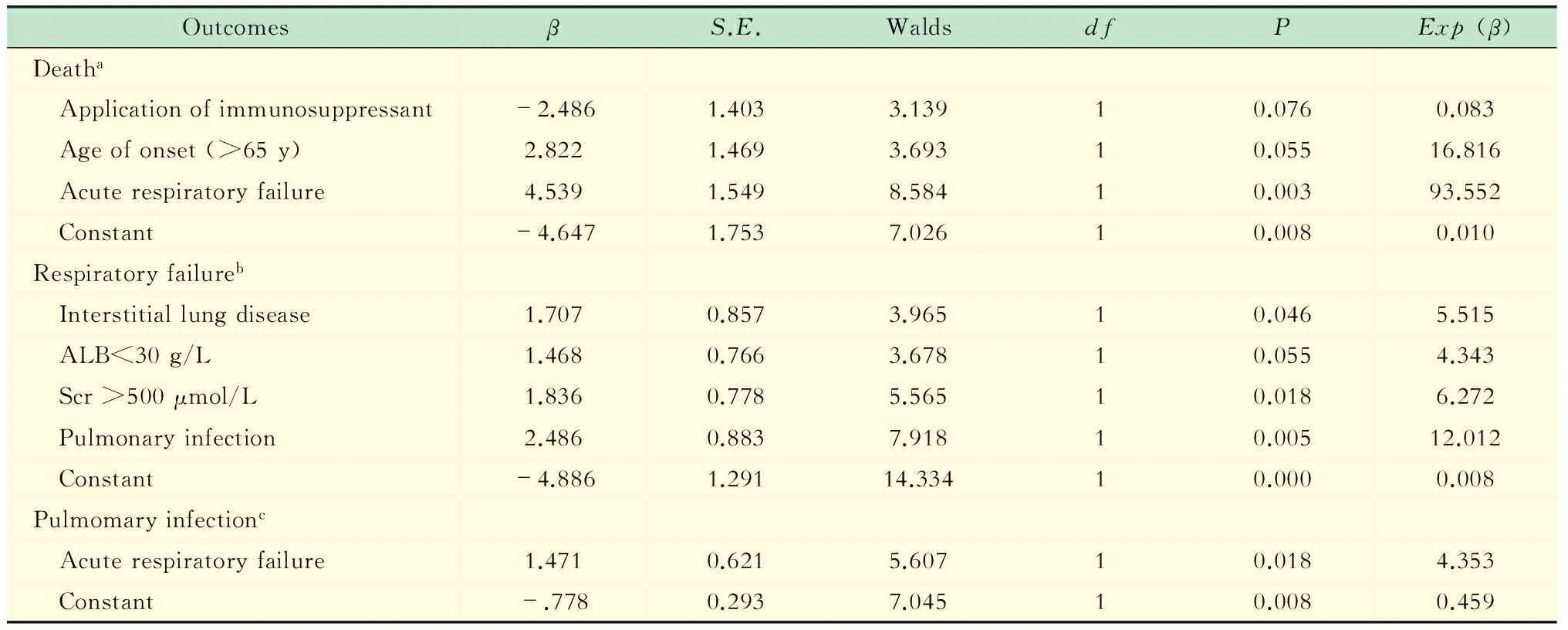
表2 MPO-AAV中肺部受累患者不同结局的Logistic多因素分析
aY1 = -4.674-2.486× (application of immumosuppressant) +2.822×(age of onset >65 years)+4.539× (acute respiratory failure);bY2 = -4.886+1.707×(interstitial lung disease) +1.468× (ALB<30 g/L) +1.836× (Scr>500 μmol/L) +2.486× (pulmonary infection);cY3 = -0.778+1.471×(acute respiratory failure).
讨论
AAV是一种发病率较低的纤维素样坏死性小血管炎,可累及全身各个系统,以肾脏和肺部受累为主,其次是消化和神经系统。本研究98例MPO-AAV患者中,肺部受累占76.53%,肾脏受累占81.63%,肾脏受累比例高于肺脏受累。单中心研究发现:MPO-AAV患者肺部受累时,呼吸系统症状主要表现为咳嗽咳痰、胸闷气促和咯血,少数患者出现呼吸困难;肾脏受累时下肢浮肿、尿异常;全身系统的表现则主要为发热、高血压和乏力;此外,消化系统和神经系统也常常受累。这些临床表现与既往临床特点分析类似,也证实了AAV是一种多系统损害、临床表现多样、无特异性的血管炎性疾病。
根据实验室检查结果可知,MPO-AAV患者常有血液系统的异常,主要表现为血红蛋白降低、白细胞以及血小板增多。血红蛋白降低可能与患者肾脏受累有关,促红细胞生成素合成减少可导致红细胞生成下降,而白细胞及血小板增多可能与疾病的应激状态有关。发病过程中,与ANCA结合的白细胞过度激活、凋亡异常与疾病进展密切相关。此外,当血管受到损伤时,内皮细胞可分泌血小板活化因子,促进血小板活化,使循环系统处于高凝状态。Chen等[14]报道426例系统性血管炎患者中89%有贫血,其中大部分为中度贫血,43.6%的患者有白细胞增多,28.7%有血小板增多。Basnet等[15]报道MPO-AAV患者可合并嗜血细胞性淋巴组织细胞增生症,当患者出现全血细胞减少、肝脾肿大而骨髓增殖正常时应警惕该疾病的发生。
X线及HRCT是AAV肺部受累时重要的影像学检查手段。从本研究中可看出,MPO-AAV患者肺部受累时多表现为炎性渗出、弥漫性间质病变,合并支气管扩张、胸腔积液、肺气肿/肺大疱以及结节、空洞者也较多,整体表现复杂多样,病程较长、病灶靠近胸膜下时可有胸膜增厚以及钙化。对患者进行随访观察发现,AAV患者肺部受累时最初可只表现为片状炎性浸润,此时若患者得到及时治疗则可逆转炎性渗出,避免后期慢性间质纤维化改变。当患者肺部受累为隐匿性进展时,由于肺泡间隔慢性受损,最终可导致慢性间质纤维化改变。此外,由于AAV多发于中老年男性,肺泡弹性较差,当局部肺泡破坏严重时,病灶旁肺组织常有代偿性通气过度现象,导致肺大泡的发生。而肺泡受损严重部位则导致肺泡塌陷,在致纤维化因子的作用下最终发生肺实变。因此,对有肺部症状的AAV患者应及时评估肺功能并进行药物治疗。
根据既往AAV相关肺部受累的病例特点分析,AAV患者肺部受累多发于中老年男性,同时合并全身以及其他系统的症状,如发热、乏力、关节痛、皮肤及肾脏受累等[16]。因此,当患者以肺部多处受累为首要表现、伴随其他系统症状且抗生素治疗无效时应及时行ANCA检测,以便确诊后早期治疗。肺活检进行病理检查有助于AAV肺部受累诊断。根据病理检查可知,肺部局部病变以慢性炎性浸润、肺泡破坏及纤维素渗出为主要表现,其中慢性炎性细胞以淋巴细胞和浆细胞为主。
在AAV治疗中,GCs是基础治疗药物,当患者起病较重时,可选用甲泼尼龙冲击联合免疫抑制剂减轻急性炎性反应;CTX是免疫抑制剂中最常用的药物,AZA、MTX、CyA以及MMF可作为CTX不耐受者的备选药物;羟氯喹是常用的辅助用药,具有抗炎和免疫调节功能,不良作用较少。MPO-AAV患者治疗分为诱导缓解期和维持治疗期。AAV诱导缓解的标准方案为CTX (15 mg/kg每2周1次,3个疗程后继以每3周1次)联合GCs (醋酸泼尼松1 mg/kg每天;重型可用甲泼尼龙1 g每天,连续3天)。维持治疗时间为18个月,常用药物为AZA,MTX可作为替代药物[17-18]。有研究提示MMF在诱导缓解治疗中作用不亚于CTX[19],但确切的效果仍需验证;单独应用CD20单抗 (利妥昔单抗)诱导缓解且无维持治疗,可与CTX诱导缓解联合AZA维持治疗18个月达到相同的治疗效果[20]。因此,B细胞失调在AAV发病及疾病进展中具有重要作用。针对B淋巴细胞的其他治疗药物也在临床试验中。治疗方案的改进有助于减少患者GCs和免疫抑制剂的用量及其引起的不良反应。由本研究统计结果可知,纳入AAV患者的治疗尚规范,用药剂量和方案在治疗有效和无效组无明显差异,因此其与患者的结局无明显相关性。
多因素分析显示肺部感染、肺间质病变、ALB<30 g/L以及Scr >500 μmol/L是患者发生呼吸衰竭的危险因素。其中,肺部感染占主导地位,提示AAV患者在日常生活中应避免感染,以减少呼吸衰竭的发生率。既往对AAV的研究也提示患者第一年死亡的主要原因为感染。ALB代表身体基础状态,当白蛋白下降时机体基础代谢紊乱,可促进呼吸衰竭的发生。Scr水平反映了肾脏基本功能,当肾脏受累严重时,机体代谢废物增加、酸碱失衡以及电解质代谢紊乱,可增加肺循环负荷,促进呼吸功能衰竭。年龄>65岁、急性呼吸衰竭是MPO-AAV肺部受累患者死亡的独立危险因素,呼吸衰竭者发生死亡的风险是同年龄段AAV患者未发生呼吸衰竭者的93.52倍,而患者发生呼吸衰竭时免疫抑制剂的应用可延缓病情进展、降低患者死亡率。Hogan等[21]报道,MPA患者以肺部弥漫性肺泡出血为首发表现时,患者死亡风险增加8.65倍。而在以肺部感染为结局变量的多因素分析中,呼吸衰竭是重要的影响因素。既往研究提示年龄 (>60岁)、MPA、低蛋白血症、合并肺间质病变患者更容易合并肺部感染[9],而肺部感染和年龄又是AAV患者死亡的独立危险因素[22-23]。由此可知,年龄、低蛋白血症以及肺间质病变在MPO-AAV肺部受累患者发生肺部感染和呼吸衰竭中具有重要作用;呼吸衰竭和肺部感染是互为促进的不良预后因素;肺部感染是MPO-AAV肺部受累患者病情恶化的重要诱因;年龄和呼吸衰竭极大增加了MPO-AAV肺部受累患者死亡的风险。
综上所述,患者转归或不良结局与治疗方案以及治疗药物剂量无明显相关性。而肺部感染、肺间质病变、肾脏受累等并发症以及机体基础条件则与患者不良预后有密切的联系。对于初始病情较重的患者,GCs冲击治疗仍为常用选择。在维持缓解期,小剂量GCs与免疫抑制剂长期使用可避免患者疾病复发。目前AAV的治疗难题主要在于患者不能坚持长期用药,以及如何合理应用GCs和CTX或未来替代药物,在诱导或维持缓解疾病的同时减少药物不良作用。
MPO-AAV患者多有肺部受累,同时伴有全身及血液、肾脏等其他系统受累的异常表现。MPO-AAV患者肺部受累时影像学以弥漫性肺间质病变为主,可伴随渗出、支气管扩张、肺大泡及肺实变等非特异性改变。以GCs为基础联合免疫抑制剂是目前治疗AAV的主要方案,早期及时治疗可改善肺部预后。肺部感染是诱发呼吸衰竭的主要因素,年龄>65岁的MPO-AAV患者发生呼吸衰竭时死亡风险增加,而免疫抑制剂的应用则可改善患者病情,是呼吸衰竭患者发生死亡的保护因素。
参考文献
[1]KATSUYAMA T, SADA KE, MAKINO H. Current concept and epidemiology of systemic vasculitides[J].AllergolInt, 2014, 63(4):505-513.
[2]KALLENBERG CG. The diagnosis and classification of microscopic polyangiitis[J].JAutoimmun. 2014(48-49):90-93.
[3]HERVIER B, PAGNOUX C, AGARD C, et al. Pulmonary fibrosis associated with ANCA-positive vasculitides. Retrospective study of 12 cases and review of the literature[J].AnnRheumDis,2009, 68(3):404-407.
[4]SAKAE H, AIKA S,KEITA S. Pulmonary involvement in ANCA-associated vasculitis from the view of the pulmonologist[J].ClinExpNephrol, 2013, 17(5):667-671.
[5]LALLY L, SPIERA R. Current landscape of antineutrophil cytoplasmic antibody-associated vasculitis:classification,diagnosis, and treatment[J].RheumDisClinNorthAm, 2015,41(1):1-19.
[6]SUGIYAMA K, SADA KE, KUROSAWA M,etal. Current status of the treatment of microscopic polyangiitis and granulomatosis with polyangiitis in Japan[J].ClinExpNephrol, 2013, 17(1):51-58.
[7]李晓辕, 刘佳育,徐伟. ANCA相关性血管炎肺部表现[J]. 中国老年学杂志,2011,31(20):3941-3943.
[8]王勇, 蒋瑾,钟智,等. 抗中性粒细胞胞质抗体相关性血管炎肺部影像学的表现与诊断意义[J]. 实用医院临床杂志,2014, 11(3):214-216.
[9]张娟, 杨程德. 抗中性粒细胞胞质抗体相关性血管炎肺部感染的危险因素分析[J]. 中华风湿病学杂志, 2014, 18(5):321-324.
[10]曹然, 汪东方. ANCA相关性小血管炎性肺炎的影像学表现及预后[J]. 中国医学影像技术,2004,20(S1):30-31.
[11]郭明好, 刘向东,刘云,等. ANCA相关性小血管炎的肺部表现特点及误诊分析[J]. 中国航天医药杂志, 2003,5(3):40-42.
[12]JENNETTE JC. Overview of the 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides[J].ClinExpNephrol, 2013, 17(5):603-606.
[13]MUKHTYAR C, GUILLEVIN L, CID MC,etal. EULAR recommendations for the management of primary small and medium vessel vasculitis[J].AnnRheumDis, 2009, 68(3): 310-317.
[14]CHEN M, YU F, ZHANG Y,etal. Clinical [corrected] and pathological characteristics of Chinese patients with antineutrophil cytoplasmic autoantibody associated systemic vasculitides:a study of 426 patients from a single centre[J].PostgradMedJ,2005, 81(961):723-727.
[15]BASNET A, CHOLANKERIL MR. Hemophagocytic lymphohistiocytosis in a patient with Goodpasture's syndrome: a rare clinical association[J].AmJCaseRep, 2014, 15:431-436.
[16]徐虹, 李伟峰, 杜海坚, 等. 以肺部表现首发的抗中性粒细胞胞浆抗体相关性小血管炎临床分析[J]. 临床肺科杂志, 2009, 14(1):29-30.
[17]JAYNE D, RASMUSSEN N, ANDRASSY K,etal. A randomized trial of maintenance therapy for vasculitis associated with antineutrophil cytoplasmic autoantibodies[J].NEnglJMed, 2003,349(1):36-44.
[18]HOFFMAN GS. L52. Vasculitis treatment: is it time to change the standard of care for ANCA-associated vasculitis? [J].PresseMed, 2013, 42(4 Pt 2):643-650.
[19]JONES R, HARPER L, BALLARIN J,etal. A randomized trial of mycophenolate mofetil versus cyclophosphamide for remission induction of ANCA-associated vasculitis[J].PresseMed,2013, 42(4 pt 2):678-679.
[20]SPECKS U, MERKEL PA, SEO P,etal. Efficacy of remission-induction regimens for ANCA-associated vasculitis[J].NEnglJMed, 2013, 369(5):414-427.
[21]HOGAN SL, NACHMAN PH, WILKMAN AS,etal. Prognostic markers in patients with anti-neutrophil cytoplasmic autoantibody associated microscopic polyangiitis and glomerulonephritis[J].JAmSocNephrol, 1996, 7(1):23-32.
[22]于峰, 陈曼,赵明辉,等.原发性ANCA相关小血管炎患者死因分析[J].北京医学,2007, 29(4):196-199.
[23]CHEN M, YU F, ZHANG Y, et a1. Antineutrophilie cytoplasmic autoantibody-associated vasculitic in older patients[J].Medicine(Bahimore), 2008, 87(4):203-209.
Analysis of clinical characteristics in MPO-AVV patients and prognostic risk factors for Patients with lung involvement
KONG Xiu-fang, JI Zong-fei, YAN Yan, CHEN Hui-yong, MA Li-li, ZHANG Zhuo-jun, JIANG Lin-di△
(DepartmentofRheumatology,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
【Abstract】ObjectiveTo analyze the clinical characteristics of myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis (MPO-AAV) patients and explore risk factors for respiratory failure,lung infection and death respectively in patients with lung involvement.MethodsPatients admitted in Zhongshan hospital,Fudan University from Feb.,2005 to Dec.,2013 were enrolled in this study and followed up to 31st,Aug of 2014 or death.Clinical materials were collected in their first time and during their follow-up period.A multiple Logistic regression analysis was used to analyze risk factors for different outcomes.ResultsNinety-eight patients were recruited in this study,who was classified as early systemic (n=27),generalized (n=50),severe (n=28) and refractory disease (n=7).In patients with lung involvement,initial manifestations were cough and chest distress with inflammatory exudation (n=36) and interstitial changes (n=35) as mainly features in high resolution computed tomography (HRCT).Destroyed alveolar septum and chronic inflammatory cells infiltration can be seen in local lung tissues by lung biopsy in 8 patients.Patients were treated with glucocorticoids (n=92),immunosuppressive agents (n=79),IVIG (n=19) and immunoadsorption therapy (n=5).Seventy-one patients were improved,while 17 patients relapsed after treatment.Respiratory failure occurred in 16 patients,lung infection 35 occured in patients, and 9 patients were death during follow-up period.The multiple Logistic regression showed that risk factors for acute respiratory failure included pulmonary infection,interstitial lung disease,Scr>500 μmol/L and ALB<30 g/L.Age at onset ≥65 years and acute respiratory failure were risk factors for death in patients with lung involvement,while acute respiratory failure was a potential risk factor for pulmonary infection.ConclusionsPatients with MPO-AAV always have lung involved with other systems involvement such as urinary system and hematologic system.Pulmonary infection was a primary induction factor for acute respiratory failure in MPO-AAV patients with lung involvement.Respiratory failure may increase mortality risk in patients more than 65 years old.
【Key words】myeloperoxidase anti-neutrophil cytoplasmic antibody-associated vasculitis;respiratory failure;pulmonary infection;death;risk factors
【中图分类号】R593.2; R563.9
【文献标识码】A
doi:10.3969/j.issn.1672-8467.2016.01.006
(收稿日期:2015-05-15;编辑:王蔚)
△Corresponding authorE-mail:zsh-rheum@hotmail.com
