血管内近程放疗联合支架植入及经动脉化疗栓塞治疗肝细胞肝癌合并门脉主干癌栓
2016-06-20张子寒罗剑钧颜志平刘清欣刘凌晓王建华
张子寒 罗剑钧△ 颜志平 刘清欣 张 雯 刘凌晓 王建华
(1复旦大学附属中山医院介入科 上海 200032; 2上海市影像医学研究所 上海 200032)
血管内近程放疗联合支架植入及经动脉化疗栓塞治疗肝细胞肝癌合并门脉主干癌栓
张子寒1,2罗剑钧1,2△颜志平1,2刘清欣1,2张雯1,2刘凌晓1,2王建华1,2
(1复旦大学附属中山医院介入科上海200032;2上海市影像医学研究所上海200032)
【摘要】目的评价血管内近程放疗 (endovascular brachytherapy,EVBT)联合支架植入及经动脉化疗栓塞 (transarterial chemoembolization,TACE)治疗肝细胞肝癌 (hepatocelluar carcinoma,HCC)合并门脉主干癌栓 (main portal vein tumor thrombus,MPVTT)的安全性及疗效。方法对2009年1月至2014年12月在复旦大学附属中山医院接受支架植入及TACE治疗的289例HCC合并MPVTT患者的病例资料进行回顾性分析,其中194例 (研究组)同期在门脉主干内植入碘-125粒子条,余95例未接受EVBT的患者作为对照组。对两组患者的生存期、无疾病进展生存期、支架通畅期及治疗相关不良事件的发生率进行比较。结果所有碘-125粒子条及支架均准确植入门脉主干梗阻段,无严重治疗相关不良事件发生。平均随访(10.1±5.2)个月,研究组及对照组的中位生存期分别为(9.3±1.1)及(4.9±0.5)个月 (P<0.001),中位无疾病进展生存期分别为(6.0±0.3)及(3.0±0.1)个月 (P<0.001),中位支架通畅期分别为(11.0±1.1)及(4.8±0.3)个月 (P<0.001)。结论血管内EVBT联合支架植入及TACE治疗HCC合并MPVTT安全、有效。
【关键词】肝细胞肝癌;门脉主干癌栓;碘-125粒子条;支架植入;近程放疗
肝细胞肝癌(hepatocellular carcinoma,HCC)发病率高[1],约40%的中、晚期HCC患者合并门脉癌栓[2]。一旦门脉主干受癌栓累及,将增加肿瘤肝内播散、使继发于肝硬化基础上的门脉高压进一步恶化、阻碍入肝门脉血流,导致肝功能储备受损,患者的预后极差,其自然病程仅为2.7~4.0个月[3]。由于术后复发率高,门脉癌栓是肝移植术的相对禁忌证[4];70%~80%的HCC患者在就诊时已无外科根治性肝切除的适应证[5];研究发现[6]:口服Sorafenib可使得血管受侵犯的HCC患者生存获益,但目前高昂的治疗费用限制了该药物在临床上的广泛使用;外放疗可有效抑制门脉癌栓的进展[7],但受阻的入肝门脉血流无法及时得到恢复;支架植入后可迅速恢复受阻的门脉血流[8],Meta分析[9]提示:即使对于门脉主干梗阻的HCC患者,采用经动脉化疗栓塞(transarterial chemoembolization,TACE)治疗,仍可使其生存获益,然而门脉主干癌栓(main portal vein tumor thrombus,MPVTT) 往往缺乏明显的供血动脉,单纯行TACE对MPVTT的抑制作用不足。近年来,实验[10]及临床研究[11]验证了血管内植入-125粒子条的安全性。为探讨门脉主干内同时植入碘-125粒子条及支架联合TACE治疗HCC合并MPVTT的安全性及疗效,进行本项研究。
资 料 和 方 法
病例资料经复旦大学附属中山医院伦理委员会批准,对2009年1月至2014年12月入我院行介入治疗的HCC合并MPVTT患者的病例资料进行回顾性分析。对这些患者实施支架植入联合TACE治疗的适应证为: (1) 成年患者,年龄18~70岁; (2) 经病理学确诊或符合我国卫生部颁布的原发性肝癌诊疗规范2011版 (简称2011版规范)临床诊断标准的原发性HCC患者; (3) 根据2011版规范,患者不适合接受外科手术、肝移植或局部消融治疗; (4) 腹部增强计算机断层扫描 (computer tomography,CT)或磁共振 (magnetic resonance,MR)检查证实门脉主干内癌栓形成,且至少肝内一叶的门脉2级分支通畅; (5) 患者肝功能为Child A 或 B级; (6) 美国东部肿瘤协作组 (eastern cooperative oncology group,ECOG) 状态评分<2。排除标准: (1) 既往因门脉恶性梗阻接受过外放疗或支架植入; (2) 肝内门脉完全闭塞,或癌栓累及肠系膜上静脉或脾静脉; (3) 肝功能Child C级; (4) ECOG状态评分>2; (5) 合并TACE禁忌证 (如总胆红素>51 μg/L、AST/ALT>5倍正常上限、白蛋白<28 g/L、HCC范围超过肝脏体积的70%、高流量肝内动静脉分流、白细胞计数< 2.0×109/L、血小板计数< 50×109/L、凝血酶原时间较正常值延长6 s以上、肌酐>115 μmol/L)。治疗前,对所有符合入组标准的患者本人及家属详细解释血管内植入碘-125粒子条近程放疗的获益及可能出现的不良事件,所有接受治疗的患者签署知情同意书。
2009年1月至2014年12月共289例HCC合并MPVTT的患者在我院接受门脉支架植入及TACE治疗,其中194例同时在门脉主干内植入碘-125粒子条的患者作为研究组,95例不愿接受血管内近程放疗的患者作为对照组。所有患者的术前资料见表1,治疗前两组患者的基线特征差异无统计学意义。
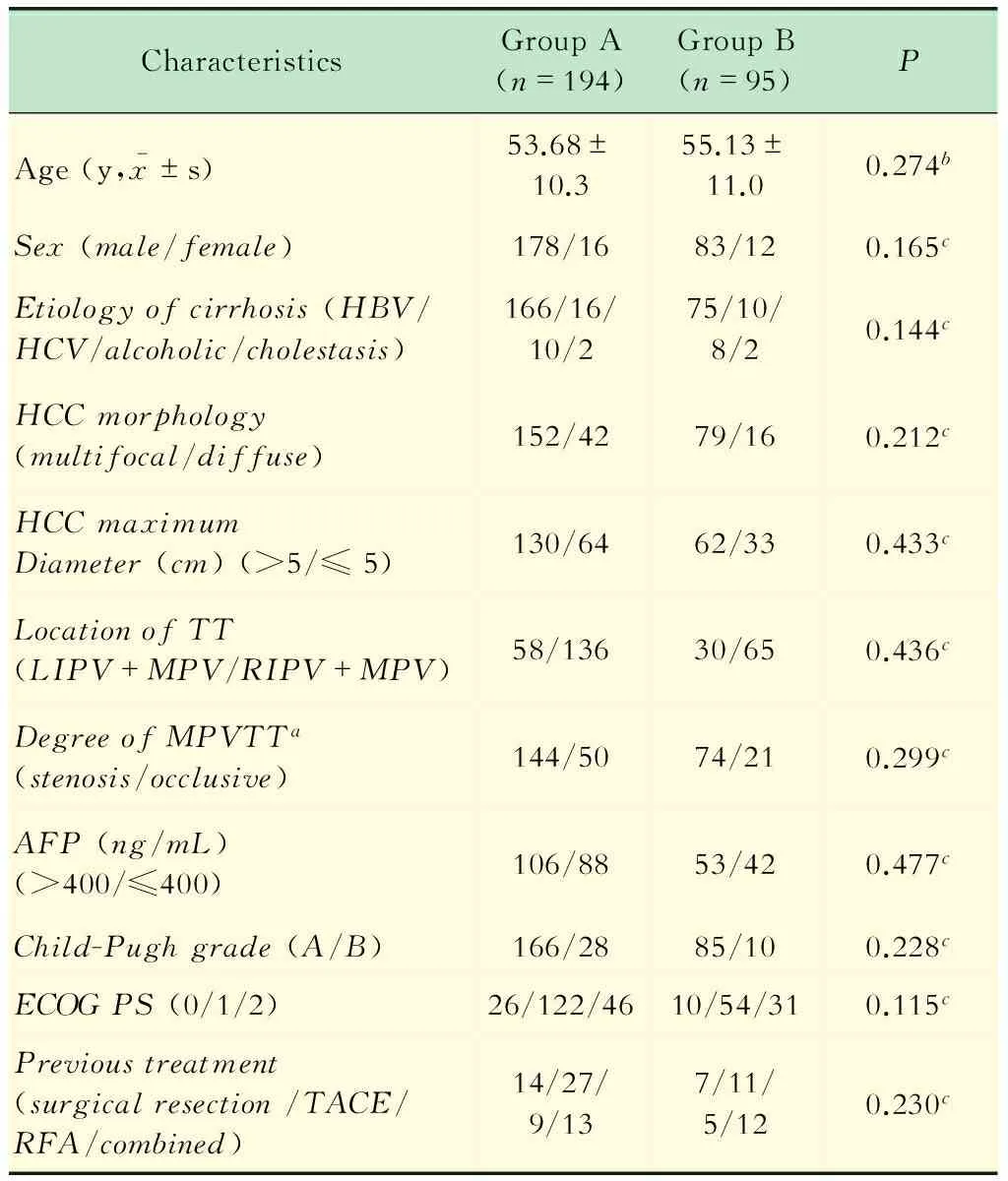
表1 两组患者术前一般资料的比较
AFP:Alpha-fetoprotein;ECOG PS:Eastern cooperative oncology group performance status;HBV:Hepatitis B virus;HCC:Hepatocellular carcinoma;HCV:Hepatitis C virus;LIPV:Left intrahepatic portal vein;MPV:Main portal vein;RIPV:Right intrahepatic portal vein;RFA:Radiofrequency ablation;TACE:Transarterial chemoembolization;TT:Tumor thrombus.aMPV was arbitrarily defined as occlusive when more than 90% of its lumen was involved by tumor thrombus;bIndependentttest was used;cChi square test was used.Group A:Stent with125I seed strand; Group B:Stent only.
治疗前检查及评估所有患者治疗前行肝、肾功能、血常规及凝血功能及上腹部增强CT或MR检查评价肝内病灶大小、形态、门脉主干梗阻情况。
碘-125粒子及支架本研究使用的6711型碘-125粒子 (上海欣科医药有限公司)为圆柱型近程放射籽源,其活性部分是长度为3.25 mm、表面吸附碘-125核素的银丝,包裹于直径为0.8 mm、长度为 (4.5±0.5) mm钛金属壳内。单枚粒子的放射性活度为25.9 MBq,半衰期为59.4天,主要发射27.4 KeV的X线及35.3 KeV的γ射线,组织半值层为17 mm,初始剂量为7 cGy/h。本研究使用直径为12~14 mm、长度为60~100 mm的镍钛合金自膨胀式支架 (美国Bard公司)。
研究组患者的治疗超声导引下,使用22G Chiba针 (美国Cook公司)穿刺通畅的肝内门脉2级分支,成功后,将0.018英寸导丝 (美国Cook公司)送入门脉系统,沿导丝送入6F NEFF套件 (美国Cook公司)。经NEFF套件外套管送入0.035英寸导丝 (日本Terumo公司)及4F VER导管 (美国Cordis公司),设法通过门脉主干梗阻段进入肠系膜上静脉或脾静脉,交换入5F标记猪尾巴导管 (美国Cook公司),行门脉造影,测门脉梗阻段长度、直径及门脉主干压力,如胃冠状静脉、胃短静脉显影,则超选择进入靶血管后,使用相应直径的弹簧圈 (美国Cook公司)将其闭塞。按公式N=门脉梗阻段长度 (mm)/4.5+2,计算出需植入的碘-125粒子数目 (N),将这些粒子排列成直线,连续封装于4F 无菌医用导管内,制备成碘-125粒子条。静脉注入肝素 (50 U/kg,上海信宜制药公司)后,沿导丝交换入7F、23 cm鞘,将2根0.035英寸、260 cm的Amplatz导丝 (美国Cook公司)经7F鞘送入肠系膜上静脉内,在体外将4F VER导管送入6F NEFF套件的外套管内备用,撤去7F鞘,沿2根导丝,分别送入相应直径的支架释放系统及VER导管——NEFF套件外套管进入肠系膜上静脉内,撤去VER导管及其通过的导丝,经NEFF外套管注入对比剂,进行支架释放前定位,释放支架,经NEFF外套管送入碘-125粒子条,后撤NEFF外套管释放粒子条。再次行门脉造影、测压,使用3/30 mm弹簧圈 (美国Cook公司)闭塞经皮穿肝穿刺道 (图1 A、B)。
局麻后,穿刺右侧股动脉,为尽可能明确所有的肿瘤供血动脉,使用5F RH导管 (美国Cook公司)分别行腹腔动脉、肠系膜上动脉、胃左动脉、双侧膈动脉造影。明确肿瘤供血动脉后,使用2.7F微导管 (美国Boston Scientific公司),超选择进入靶血管。将10~50 mg/m2表柔比星 (美国Pfizer公司)与5~20 mL超液化碘油 (法国Laboratoire Guerbet公司)充分混合成乳剂,根据患者肝功能及肿瘤血供情况决定化疗药物及碘油用量。X线透视下,经微导管,缓慢注入化疗药及碘油乳剂 (1 mL/min),直至靶血管血流瘀滞,再用明胶海绵颗粒 (上海信宜制药公司)加强栓塞 (图1 C、D)。
A:5-F calibrated pigtail catheter was placed in the main portal vein and showed the tumor thrombus in proximal MPV;B:A self-expandable stent and125I strand were placed precisely in obstruvted MPV.And125I strand was fixed steadily between the stent and MPV;C:Hepatiec artery angiography showed that tumor stain in the posterior segment of right hepatic lobe;D:After embolization of the feeding artery for the tumor.
图1粒子条与支架植入过程
Fig 1125I seed strand and stent placement
对照组患者的治疗采用与治疗组患者相同的方法,在对照组所有患者的门脉主干梗阻段植入普通自膨式支架,然后实施TACE。
治疗后处理及评价给予所有患者24 h心电监护、保肝、止酸、止吐、对症、支持治疗,并给予每天2次、连续3天,皮下注射低分子肝素4 100 U (上海信宜制药公司)抗凝。治疗后1天,对研究组患者行单光子激发断层扫描 (single photon emission computer tomography,SPECT)检查,明确植入的碘-125粒子产生的辐射分布范围。治疗后3天,所有患者给予口服华法令 (2.5 mg/d,上海信宜制药公司)抗凝6个月 (INR 维持在1.8~2.0)。
随访所有患者治疗后每30~45天门诊或电话随访至患者死亡或至2014年12月31日。随访时复查肝、肾功能、血常规、凝血功能,并行腹部增强CT检查,观察HCC治疗后改变。支架通畅情况使用美国肝脏病协会推荐的改良实体瘤治疗应答标准 (modified response evaluation criteria in solid tumor,mRECIST)[12]:完全缓解 (complete response,CR)、部分缓解 (partial response,PR)、疾病稳定 (stable disease,SD)及疾病进展 (progressive disease,PD)对HCC治疗后改变进行评价。如肝内病灶仍有强化或出现新发病灶,且患者耐受,再次行TACE治疗,治疗时行间接门脉造影评价支架通畅情况。
安全性及有效性评价分别对两组患者的生存期、无疾病进展生存期、支架通畅期及治疗相关不良事件进行评价。生存期定义为:自患者接受治疗至患者死亡或至随访期内末次随访的时间间隔。研究发现:门脉主干内癌栓形成后,可增加肿瘤肝内播散的机会、恶化继发于肝硬化基础上的门脉高压、阻碍入肝门脉血流,导致肝功能储备受损。本研究将出现上述事件定义为疾病进展,并将其作为两种治疗方法比较的指标。无疾病进展生存期定义为:自患者接受治疗至患者死亡或至发生肿瘤肝内播散、门脉高压性上消化道出血、肝功能失代偿中任何一项的时间间隔。支架通畅期定义为:自植入支架致支架闭塞 (上腹部增强CT门脉期,支架内无对比剂或间接门脉造影时,支架内无血流)的时间间隔。因本研究使用的6711型碘-125粒子的半衰期为59.4天,约87.5%的辐射能量将在植入后180天内释放,故采用美国国立癌症研究所的通用毒性标准 (0~4级)对治疗后180天的实验室检查结果进行分析,评价植入碘-125粒子条对研究组患者肝、肾功能、造血及凝血功能的影响。
结果
植入支架及碘-125粒子条植入支架前,研究组与对照组患者门脉主干梗阻段平均长度分别为 (58.2±1.9)mm(48.2~71.0mm)及 (59.7±2.0)mm(49.1~71.3mm) (t=0.586,P=0.558),门脉主干压力分别为 (40.5±5.3)cm水柱 (24~65cm水柱)及 (41.8±5.4)cm水柱 (27~45cm水柱) (配对t检验,P=0.465)。所有支架均准确植入门脉梗阻段,植入支架后,研究组和对照组患者门脉主干压力分别降至 (34.0±4.9)cm水柱 (17~32cm水柱)及 (15.5±5.0)cm水柱 (12~29cm水柱)。研究组患者门脉主干内平均植入(16.8±4.5)枚(6~31枚)碘-125粒子,根据美国医用物理协会的公式[13]及碘-125粒子辐射场强分布软件的计算结果,给予门脉癌栓的平均辐射剂量为 (160.3±32.7)Gy(67.3~190.70Gy)。
SPECT/CT扫描术后1天,研究组患者接受SPECT/CT扫描检查,所有植入的碘-125粒子条均准确覆盖门脉主干梗阻段,无移位;产生的辐射分布均匀,呈圆柱形完全覆盖门脉癌栓 (图2)。
A:SPECT-CT showed that the stent and125I seed strand were placed in the obstructed MPV correctly.B and C:125I seed strand presented a cylindrical shape with a diameter of 17 mm covering the target lesion completely.
图2植入碘-125粒子条后SPECT-CT检查结果
Fig 2SPECT-CT image after placement of125I strand
TACE及HCC治疗后改变随访期内,研究组及对照组患者平均接受(3.9±2.0)次(1~9次)及(4.2±2.2)次 (1~9次) TACE治疗(t=1.527,P=0.128);两组患者平均使用表柔比星剂量分别(31.73±10.4) mg (10~50 mg)及(30.5±11.6) mg (10~60 mg) (t=0.890,P=0.374),平均碘油用量为(8.7±4.8) mL (3~20 mL)及(9.5±4.4) mL (5~20 mL) (t=1.397,P=0.163)。末次随访时两组患者肝内病灶的客观缓解率 (CR+PR)分别为37.8% 及31.4% (χ2=1.409,P=0.242)。
Group A:Stent with125I seed strand;Group B:Stent only.
图3患者生存分析
Fig 3Analysis on survival time of patients
相关不良事件两组患者接受治疗后均无严重的治疗相关不良事件 (如腹腔内出血、急性肝功能衰竭等)发生,大多数患者发生短期的栓塞后综合征,包括:发热、呕吐、上腹部疼痛等,经对症治疗后好转。研究组患者治疗后180天的实验室检查结果与治疗前无显著差异,无3级或以上毒性反应发生。
生存期平均随访(10.1±5.2)个月 (1.3~62.2个月),研究组与对照组分别有163例(84.0%)及90例(94.7%)患者死亡 (P=0.010)。研究组及对照组的平均及中位生存期分别为(14.7±1.2)个月 (95% CI:12.7~17.2个月)、(9.3±1.1)个月 (95% CI:7.2~11.4个月)及(6.2±0.5)个月 (95% CI:5.2~7.3个月)、 (4.9±0.5)个月 (95% CI:4.0~5.8个月);治疗后6及12个月,研究组及对照组的累计生存率分别为 69.4 %,42.5 %及29.5 %,10.0 % (χ2=47.998,P<0.001,图3)。 单因素分析提示:肝功能分级、是否植入碘-125粒子条、支架通畅性、梗阻相关症状是否重现、是否进展与本组患者的预后密切相关。多因素分析结果显示:植入放射性支架、支架通畅性及肝功能分级是提示本组患者预后良好的独立因素 (表 2)。
无疾病进展生存期随访期内,研究组与对照组中分别有153例(78.9%)和79例(84.0%)患者出现肝内肿瘤播散(P=0.389),12例(6.2%)及15例(16.0%)患者出现门脉高压性上消化道出血(χ2=0.742,P=0.008)、57例(29.4%)及45例(47.9%)患者出现肝肝功能失代偿 (χ2=9.034,P=0.003)。两组患者平均及中位无疾病进展生存期分别为(8.3±0.6)个月(95% CI:7.2~9.4个月)、(6.0±0.4)个月(95% CI:5.3~6.7个月)及(4.8±1.4)个月(95% CI:2.0~7.5个月)、(3.0±0.1)个月 (95% CI:2.7~3.3个月),治疗后6及12个月,两组累计无疾病进展生存率分别为46.8%,25.1% (研究组)及17.2%,0% (对照组) (χ2=34.434,P< 0.001,图4)。

表2 单因素及多因素分析
AFP:Alpha-fetoprotein;CI:Confidence interval;CR:Complete response;EOCG PS:Eastern cooperative oncology group performance status;HCC:Hepatocellular carcinoma;HR:Hazard ratio;MPV:Main portal vein;MPVTT:Main portal vein tumor thrombus;PD:Progressive disease;PR:Partial response;SD:Stable disease;TT:Tumor thrombus.aMPV was arbitrarily defined as occlusive when more than 90% of its lumen was involved by tumor thrombus.
随访期内,研究组与对照组中分别有118例(60.8%)及75例(78.9%)患者的门脉支架闭塞 (χ2=9.441,P=0.002),两组患者平均及中位支架通畅期分别为(19.8±1.9)个月 (95% CI:16.1~23.5个月)、(11.0±1.1)个月(95% CI:8.8~13.1个月)及(7.2±0.7)个月 (95% CI:5.8~8.6个月)、(4.8±0.3)个月 (95% CI:4.2~5.4个月) (χ2=43.719,P<0.001)。治疗后6及12个月,两组累计无梗阻症状生存率分别为72.1%、46.6% (研究组)及30.8%、14.7% (对照组) (χ2=17.622,P<0.001,图 5)。
Group A:Stent with125I seed strand;Group B:Stent only.
图4两组患者无病生存分析
Fig 4Analysis on free of disease progression
time of the two groups
Group A:Stent with125I seed strand;Group B:Stent only.
图5两组支架通畅期分析
Fig 5Analysis on stent patency time of the two groups
讨论
尽管全身性及局部治疗取得了很大的进步,但HCC合并门脉癌栓患者的预后仍较差,尤其对于合并MPVTT的患者,目前仍无最佳的治疗方案[3]。近期的一些研究结果提示:与TACE比较,根治性外科切除术未能明显延长肝癌合并MPVTT患者的生存期[14]。单独使用TACE[15]或Sorafenib治疗[16]HCC合并MPVTT,患者的中位生存期分别为4.1及3.1个月;TACE联合Sorafenib治疗HCC合并MPVTT患者的中位生存期为3.0~5.8月[17-18]。这些结果提示:及时恢复门脉主干的入肝血流,有效抑制癌栓进展,应能进一步提高HCC合并MPVTT患者的生存获益。门脉内植入支架联合TACE治疗HCC合并门脉主干癌栓已在临床上广泛开展,但由于门脉癌栓缺乏明显供血动脉,单纯使用TACE对其抑制作用不足,随着癌栓的进展,植入的支架将很快发生闭塞。
植入碘-125粒子治疗肝内门脉分支癌栓[19]取得了良好的效果。碘-125粒子组织穿透距离仅为17 mm,使得高剂量的辐射聚集于靶病灶内,对周围正常组织的损伤小;研究发现:持续性、低剂量的辐射可诱导肿瘤细胞凋亡、降低其转移能力[19];植入的碘-125粒子产生的辐射不受患者呼吸运动影响。实验[11]及临床研究验证了血管内植入碘-125粒子条的可行性及安全性,植入碘-125粒子条可避免放射性粒子植入后发生移位,同时可确保对靶病灶进行均匀、持续的辐射治疗,因而采用TACE治疗肝内病灶、植入支架恢复受阻的入肝门脉血流、利用植入碘-125粒子条产生的持续辐射抑制癌栓进展的联合治疗方法,将进一步提升HCC合MPVTT患者的获益。
同期植入支架及实施近程放射治疗MPVTT的优点是: (1) 穿刺通畅的肝内门脉2级分支植入支架及碘-125粒子条,避免了直接穿刺MPVTT植入碘-125粒子时可能出现的严重不良事件; (2) 根据门脉梗阻段长度决定所植入的碘-125粒子数目、支架释放后的径向支撑力可将碘-125粒子条固定于支架与门脉壁之间,确保对MPVTT实施完全适形的腔内近程放射治疗; (3)结合碘-125粒子产生的辐射所具备的抗内膜增生作用[19],将进一步延长门脉主干支架的通畅期。
本研究中所有碘-125粒子条及支架均准确植入于门脉主干梗阻段,治疗后1天的SPECT/CT扫描证实所植入的碘-125粒子条未发生移位。研究[20]发现:大血管可耐受的最大安全辐射剂量为800 Gy,显然,本研究给予门脉癌栓的平均剂量(142.1±39.9)Gy是安全的。虽然这一剂量要高于文献报道的外放疗治疗门脉癌栓的平均剂量 (36~45 Gy),但由于碘-125粒子产生的辐射呈低剂量率、组织穿透距离短的特征,因而研究组患者治疗后180天的实验室检查结果与治疗前无显著差异,亦无3级或以上的毒性反应发生。
虽然两组患者治疗前基线特征、肝内病灶接受TACE治疗后的改变差异无统计学意义,但由于在研究组患者门脉主干内同期植入的碘-125粒子条所具备的抗肿瘤及抑制内膜增生作用,使得研究组门脉支架的通畅性优于对照组,并降低了疾病进展的发生率,研究组患者的生存期得到明显的延长。与既往文献报道的结果比较,本研究中接受血管内EVBT治疗患者的生存获益明显优于使用TACE[15]、Sorafenib[16]或TACE联合Sorafenib[17-18]治疗HCC合并MPVTT患者,这与同期植入支架及碘-125粒子条可及时恢复入肝门脉血流、有效抑制癌栓进展密切相关。
综上所述,门脉内同期植入支架及碘-125粒子条近程放疗联合经动脉化疗栓塞治疗HCC合并MPVTT安全、可行。与单纯使用支架植入联合TACE比较,该新颖的治疗方法显著延长门脉支架的通畅期、降低了疾病进展的发生率、进一步提高了HCC合并MPVTT患者的生存获益。
参考文献
[1]YANG JD,ROBERTS LR.Hepatocellular carcinoma:a global view[J].NatRevGastroenterolHepatol,2010,7 (8):448-458.
[2]HYUN YW,JEONG H.New perspectives on the management of hepatocellular carcinoma with portal vein thrombosis[J].ClinMolHepatol,2015,21 (2):115-121.
[3]KATAGIRI S,YAMAMOTO M.Multidisciplinary treatments for hepatocellular carcinoma with major portal vein tumor thrombus[J].SurgToday,2014,44 (2):219-226.
[4]BRUIX J,SHERMAN M.AASLD practice guideline:management of hepatocellular carcinoma:an update[J].Hepatology,2011,53 (3):1020-1022.
[5]CHEN X,LIU HP,LI M,etal.Advances in non-surgical management of primary liver cancer[J].WorldJGastroenterol,2014,20 (44):16630-16638.
[6]LLOVET JM,RICCI S,MAZZAFERRO V,etal.Sorafenib in advanced hepatocellular carcinoma[J].NEnglJMed,2008,359 (4):378-390.
[7]LEE DS,SEONG J.Radiotherapeutic options for hepatocellular carcinoma with portal vein tumor thrombosis[J].LiverCancer,2014,3 (1):18-30.
[8]YAMAKADO K,TANAKA N,NAKATSUKA A,etal.Clinical efficacy of portal vein stent placement in patients with hepatocellular carcinoma invading the main portal vein[J].JHepatol,1999,30 (4):660-668.
[9]XUE TC,XIE XY,ZHANG L,etal.Transarterial chemoembolization for hepatocellular carcinoma with portal vein tumor thrombus:a meta-analysis[J].BMCGastroenterol,2013,8 (13):60-68.
[10]ZHANG W,YAN Z,LUO J,etal.Iodine-125 seeds strand for treatment of tumor thrombus in inferior vena cava:an experimental study in a rabbit model[J].CardiovascInterventRadiol,2013,36 (5):1371-1382.
[11]LUO J,YAN Z,LIU Q,etal.Endovascular placement of iodine-125 seed strand and stent combined with chemoembolization for treatment of hepatocellular carcinoma with tumor thrombus in main portal vein[J].JVascIntervRadiol,2011,22 (4):479-489.
[12]TAKADA J,HIDAKA H,NAKAZAWA T,etal.Modified response evaluation criteria in solid tumors is superior to response evaluation criteria in solid tumors for assessment of responses to sorafenib in patients with advanced hepatocellular carcinoma[J].BMCResNotes,2015 (8):609.
[13]PODDER TK,BEAULIEU L,CALDWELL B,etal.AAPM and GEC-ESTRO guidelines for image-guided robotic brachytherapy:Report of task group 192[J].MedPhys,2014,41(10):101501.
[14]KOJIMA H,HATANO E,TAURA K,etal.Hepatic Resection for hepatocellular carcinoma with tumor thrombus in the major portal vein[J].DigSurg,2015,32 (6):413-420.
[15]JEONG SW,JANG JY,SHIM KY,etal.Practical effect of sorafenib monotherapy on advanced hepatocellular carcinoma and portal vein tumor thrombosis[J].GutLiver,2013,7 (6):696-703.
[16]PAN T,LI XS,XIE QK,etal.Safty and efficacy of transarterial chemoembolization plus sorafenib for hepatocellular carcinoma with portal venous tumour thrombus[J].ClinRadiol,2014,69:e553-e561.
[17]LIU L,ZHANG C,ZHAO Y,etal.Transarterial chemoembolization for the treatment of advanced hepatocellular carcinoma with portal vein tumor thrombosis:prognostic factors in a single-center study of 188 patients[J].BiomedResInt,2014,2014:194278.
[18]HU H,DUAN Z,LONG X,etal.Sorafenib combined with transarterial chemoembolization versus transarterial chemoembolization alone for advanced-stage hepatocellular carcinoma:a propensity score matching study[J].PLoSOne,2014,9 (5):e96620.
[19]LIU Y,LIU RB,WANG P,etal.Percutaneous implantation of125iodine seeds for treatment of portal vein tumor thrombosis in hepatocellular carcinoma[J].MedOncol,2015,32(8):1-5.
[20]SINDELAR WF,KINSELLA TJ.Normal tissue tolerance to intraoperative radiotherapy[J].SurgOncolClinNAm,2003,12 (4):925-942.
Endovascular brachytherapy combined with stent placement andtransarterial chemoembolization for treatment of hepatocellular carcinoma with main portal vein tumor thrombus
ZHANG Zi-han1,2, LUO Jian-jun1,2△, YAN Zhi-ping1,2, LIU Qing-xin1,2, ZHANG Wen1,2, LIU Ling-xiao1,2, WANG Jian-hua1,2
(1DepartmentofInterventionalRadiology,ZhongshanHospital,FudanUniversity,Shanghai200032,China;2ShanghaiInstituteofMedicalImaging,Shanghai200032,China)
【Abstract】ObjectiveTo evaluate the safety and efficacy of endovascular implantation of iondine-125 (125I) seeds strand and stent combined with transarterial chemoembolization (TACE) to treat hepatocellular carcinoma (HCC) with main portal vein (MPV) tumor thrombus (MPVTT).Methods
Data on treatment with intra-portal vein stent placement and TACE in 289 consecutive HCC patients with MPVTT,from Jan., 2009 to Dec., 2014 in Zhongshan Hospital of Fudan University were analyzed retrospectively.Synchronal implantation of125I seeds strand in MPV was performed in 194 patients (study group).The remaining 95 patients who refused endovascular brachytherapy served as control (control group).The overall survival,free of disease progression survival,stent patency period and procedure-related adverse events were compared between the two groups.ResultsAll125I seeds strand and stent were implanted in obstructed MPV correctly without serious procedure-related adverse events.During a mean of (10.1±5.2) months’ follow-up,the median survival was (9.3±1.1) months in study group,while it was (4.9±0.5) months in control group,respectively (P<0.001).Median free of disease progression survival in study and control group was (6.0±0.3) months and (3.0±0.1) months (P<0.001).Median stent patency period was (11.0±1.1) months in study group and (4.8±0.3) months in control group,respectively (P<0.001).ConclusionsThese findings suggested that endovascular implantation of125I seeds strand and stent combined with TACE was potentially a safe and effective treatment option for patients with HCC and MPVTT.
【Key words】hepatocellular carcinoma;main portal vein tumor thrombus;iodine-125 seeds strand;stent placement;brachytherapy*This work was supported by the Project of Advanced and Appropriate Technique Generalization from Shanghai Municipal Commission of Health and Family Planning (2013SY060),the Youth Project of National Natural Foundation of China (81201170) and the Project of Scientific Research from Shanghai Municipal Commission of Health and Family Planning (20124188).
【中图分类号】R 735.7
【文献标识码】A
doi:10.3969/j.issn.1672-8467.2016.01.001
(收稿日期:2015-08-26;编辑:王蔚)
上海市卫计委先进适宜技术推广项目(2013SY060); 国家自然科学基金青年项目(81201170);上海市卫计委科研项目(20124188)
△Corresponding authorE-mail:luo.jianjun@zs-hospital.sh.cn
