PELP1和Ki67在子宫内膜癌中的表达及临床意义
2016-06-19王倩李从铸朱彦
王倩 李从铸 朱彦
子宫内膜癌为女性生殖道常见的恶性肿瘤之一,占女性生殖道恶性肿瘤的20%~30%。发达国家中发病率居女性生殖道恶性肿瘤首位,死亡率居第二位。多见于老年妇女,高发年龄为50~60岁,年轻患者有增多趋势。因此寻找新的评价肿瘤恶性程度及判断预后的指标尤为重要,可以指导个体化治疗。PELP1是一个新的雌激素受体 (estrogen recepter,ER)共激活因子,能调节ER的基因组和非基因组途径的作用,它可以通过激活Src/MAPK通路而促进细胞的增殖[1],激活PI3K/Akt通路而抑制细胞的凋亡[2]。另外,PELP1通过非基因组功能参与细胞的分化、生存和凋亡。在乳腺癌、卵巢癌等多种激素相关的肿瘤中,PELP1的研究较多[3-6],这些研究发现其除了与肿瘤的发生、发展和转移等相关外,还在肿瘤的激素治疗耐药性中有意义。但PELP1在子宫内膜癌中的相关研究较少[7]。
资料和方法
一、标本来源
选取汕头大学医学院附属肿瘤医院1999年7月至2009年4月开腹手术并经术后病理确诊为子宫内膜癌患者76例,其中有1例为透明细胞癌,其余均为子宫内膜样腺癌。其中取腹水送检73例。72例行ER、孕激素受体 (progestrone recepter,PR)检测 (结果来自术后病理资料)。49例行腹膜后淋巴结清扫。患者年龄36~71岁,平均年龄53岁。所有患者术前均无放化疗及激素治疗史。病理诊断均经HE染色及病理科专家复核。
二、主要试剂
兔抗人PELP1单克隆抗体 (IHC-00013)购自美国Bethyl Laboratories公司。鼠抗人Ki67单克隆抗体 (M-0350)购自上海长岛生物技术有限公司。二步法免疫组化检测试剂盒 (PV-9000)购自北京中杉金桥生物技术有限公司。
三、方法
所有标本均经过常规福尔马林固定和石蜡包埋,4μm连续切片,常规脱蜡、水化,进行常规HE染色和免疫组织化学染色。免疫组织化学操作按照二步法试剂盒说明书进行。抗原修复采用微波修复的方法,抗原修复液选用柠檬酸盐溶液 (PH6.0,0.01M)。一抗孵育条件选择4°C过夜 (时间14~16 h)。一抗稀释度PELP1为1:150、Ki67为1:50。以PBS代替一抗染色作为空白对照。
四、结果判定标准
采用临床和病理资料双盲条件下、由两名病理学专家进行读片。PELP1和Ki67蛋白阳性表达均为细胞核内可见棕黄色颗粒。PELP1评分标准为:每张染色切片中阳性肿瘤细胞数占所有肿瘤细胞数的百分比计数,分为两组:<50%为弱阳性,>50%为强阳性。
Ki67评分标准为:每张染色切片随机选取5个高倍镜视野 (×400)进行细胞计数,计算肿瘤细胞中的阳性细胞占所有肿瘤细胞的百分比,分为两组:<25%为弱阳性,>25%为强阳性。
五、统计学方法
PELP1和Ki67蛋白在子宫内膜癌中的表达与各临床病理因素的分析采用χ2检验、Fisher确切概率法。PELP1和Ki67的相关性研究采用Spearman等级相关检验。所有统计分析均采用SPSS17.0统计学软件进行数据分析。检验水准α=0.05(双侧)。
结 果
一、PELP1和Ki67蛋白在子宫内膜癌中的表达
PELP1和Ki67在子宫内膜癌中均呈阳性表达,但强弱程度不同,定位于癌细胞核。
二、PELP1蛋白表达与各子宫内膜癌临床病理因素之间的关系
PELP1蛋白的表达在不同分化程度的子宫内膜癌组织中表达强度之间的差异具有统计学意义(P<0.05),G1组强度<G2、G3组 (P<0.01),但G2、G3组之间无差异。在不同手术-病理分期的子宫内膜癌中,PELP1蛋白的表达强度具有差异性,早期组 (Ⅰ期)强度低于中、晚期组 (Ⅱ、Ⅲ、Ⅳ期)(P<0.01)。不同肌层浸润深度的子宫内膜癌患者中,PELP1蛋白的表达强度不同 (P<0.01)。有淋巴结转移者,PELP1蛋白的表达强度比无淋巴结转移者强 (P<0.05)。另外,PELP1蛋白的表达强度还与双侧附件是否受累、腹水是否找到癌细胞有关。但与宫颈管是否受累、ER、PR的表达之间均无关,见表1。
Ki67蛋白的表达强度在不同分化程度之间具有差异 (P<0.01)。早期者 (Ⅰ期)Ki67强度低于中、晚期者 (Ⅱ、Ⅲ、Ⅳ期) (P<0.05)。有淋巴结转移者,Ki67的表达强度比无淋巴结转移者强,其差异具有统计学意义 (P<0.05),见表1。
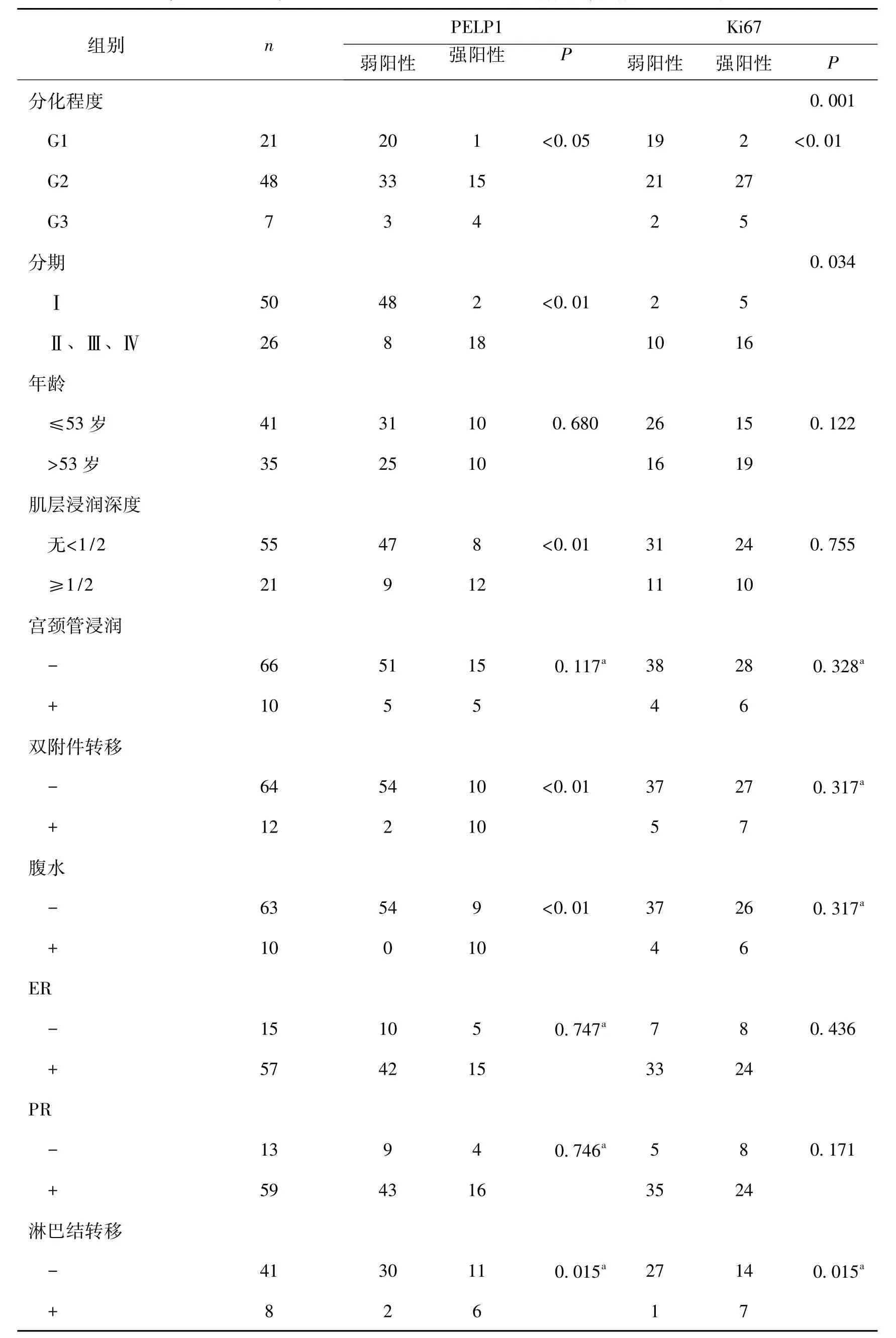
表1 PELP1和Ki67蛋白的表达与子宫内膜癌各临床参数之间的关系

表2 子宫内膜癌中PELP1蛋白和Ki67蛋白之间的关系 (总例数n=76)
三、PELP1蛋白和Ki67表达之间的相关性
在子宫内膜癌中,PELP1蛋白与Ki67蛋白的表达呈正相关 (P<0.05),相关系数r=0.244。见表2。
讨 论
一、PELP1和Ki67与子宫内膜癌
由于人类寿命延长和肥胖人群增多,近20年间子宫内膜癌发病率居高不下,而且死亡率呈明显上升趋势。但至今尚无判断子宫内膜癌疗效和预后的可靠指标。PELP1蛋白作为一种新的ER共激活因子,其在肿瘤形成过程中起到原癌基因的作用,在多种激素相关性肿瘤中表达异常[4],在子宫内膜癌中,PELP1亦出现异常定位和表达[8],该研究证实,PELP1可能在子宫内膜癌发生和进展中起重要作用[9]。
Ki67是一种细胞核相关抗原,是目前临床上广泛应用的检测细胞增殖的标志。Ki67的检测对于判断肿瘤的恶性程度、进展及其生物学行为具有重要的意义。有研究报道,子宫内膜随卵巢激素的变化而发生周期性的变化,在一个生理周期中,Ki67在增生期子宫内膜中有表达,而在分泌期内膜中表达则明显减少[10]。
Ki67在除了G0期和G1期之外的所有细胞周期中都有表达,定位在细胞核,与细胞的合成代谢有关,其表达的高低反映了细胞增殖的程度。
二、PELP1的表达与子宫内膜癌临床病理特征之间的关系
本研究发现,PELP1蛋白定位于肿瘤细胞核中,与有关文献报道中不一致[8]。而关于PELP1蛋白的表达与子宫内膜癌各临床病理特征之间的关系尚未见报道。本研究应用免疫组织化学法检测PELP1蛋白在子宫内膜癌中的表达,结果显示,其表达强度在高分化子宫内膜癌中明显低于中低分化组,差异具有显著统计学意义 (P<0.01),早期患者PELP1的表达强度低于晚期患者,其差异具有显著统计学意义 (P<0.01),另外在深肌层浸润的患者中,PELP1的表达量高于浅肌层者 (P<0.01),上述结果说明,PELP1的表达与子宫内膜癌的发生和进展密切相关,肿瘤的进展越快、恶性程度越高,PELP1的表达量越高,提示PELP1可能成为判断子宫内膜癌患者病情进展的指标。
本研究亦显示,对于宫颈管受累、双附件转移及腹水阳性的患者,PELP1的表达明显高于阴性患者,有淋巴结转移者高于无淋巴结转移者,而临床病理分期及淋巴结转移是影响子宫内膜癌预后的主要因素,由此可见,PELP1的表达与子宫内膜癌患者的预后密切相关,其表达量越高,预后越差,提示PELP1可能成为判断子宫内膜癌患者预后的指标。
PELP1作为一种ER共激活因子,调节ER的基因组和非基因组途径[11-12],其在正常子宫内膜的周期性变化中起重要作用,也与子宫内膜癌的发病机制有关。但本研究发现PELP1的表达强度与在ER、PR的不同表达之间无差异,该结果可能与选取的样本量过少有关。
三、Ki67的表达与子宫内膜癌临床病理特征之间的关系
本研究显示,随着子宫内膜癌分化程度的降低、手术-病理分期的进展,Ki67的表达强度增加。有淋巴结转移者,Ki67的表达强度高于无淋巴结转移者,表明Ki67可能成为评价子宫内膜癌增殖、分化及判断预后的指标。本研究结果与多项研究结果一致[13-15]。
四、PELP1和Ki67蛋白的表达在子宫内膜癌中的相互关系
本研究结果显示,PELP1和Ki67蛋白在子宫内膜癌中的的表达呈正相关,可能在子宫内膜癌的发生和进展中起协同作用,但其共同作用的机制尚不明确,由于本实验选取的病例数较少,结果可能有所偏倚,尚有待进一步大样本的研究证实。
联合检测PELP1和Ki67两种蛋白在子宫内膜癌中的表达,可能成为判断子宫内膜癌的生物学行为及预后的指标,且可能对个体化治疗提供依据。另外二者具有协调作用,如能同时对其进行基因水平的干预,可能对肿瘤的生物学行为具有更强的抑制作用,从而显著提高子宫内膜癌的临床治疗效果。
[1]Brann DW,Zhang QG,Wang RM,et al.PELP1-a novel estrogen receptor-interacting protein [J]. Mol Cell Endocrinol,2008,290(1-2):2-7.
[2]Vadlamudi RK, Balasenthil S, Sahin AA, et al.Novel estrogen receptorcoactivatorPELP1/MNAR gene and ERbeta expression in salivary duct adenocarcinoma:potential therapeutic targets [J].Hum Pathol,2005,36(6):670-675.
[3]VadlamudiRK, KumarR.Functionaland biological properties of the nuclear receptor coregulator PELP1/MNAR[J].Nuclear receptor signaling,2007,5:e004.
[4]Nair S, VadlamudiRK.EmergingsignificanceofER-coregulator PELP1/MNAR in cancer [J].Histol Histopathol,2007,22(1):91-96.
[5]Kumar R,Zhang H,Holm C,et al.Extranuclear coactivator signaling confers insensitivity to tamoxifen [J].Clin Cancer Res,2009,15(12):4123-4130.
[6]石福英,王文霞.PELP1对人卵巢癌OVCAR3细胞株侵袭能力及MMP-2、MMP-9表达的影响[J].山东医药,2015,(27):32-33.
[7]万璟,李小毛.RNAi沉默PELPI/MNAR基因对子宫内膜癌细胞增殖和细胞周期的作用[J].中山大学学报(医学科学版),2013,34(6):811-818.
[8]VadlamudiRK, BalasenthilS, Broaddus RR, etal.Deregulation of Estrogen Receptor Coactivator Proline-,Glutamic Acid-,and Leucine-Rich Protein-1/Modulator of NongenomicActivity ofEstrogen Receptorin Human Endometrial Tumors [J].J Clin Endocrinol Metab,2004,89(12):6130-6138.
[9]王清娟,王言奎.子宫内膜样腺癌组织PELP1/MNAR表达及其与雌激素受体相关性[J].齐鲁医学杂志,2012,27(5):383-385.
[10]Mertens HJ, Heineman MJ,Evers JL.The expression of apoptosis-related proteins Bcl-2 and Ki67 in endometrium of ovulatory menstrual cycles [J].Gynecol Obstet Invest,2002,53(4):224-230.
[11]Cheskis BJ,Greger J, Cooch N, et al.MNAR plays an important role in ERa activation of Src/MAPK and PI3K/Akt signaling pathways [J].Steroids,2008,73(9- 10):901-905.
[12]Hall JM,McDonnell DP.Coregulators in nuclear estrogen receptor action:from concept to therapeutic targeting [J].Mol Interv,2005,5(6):343-357.
[13]马晓欣,李晓晗,李娜,等.细胞核增殖相关抗原Ki67在子宫内膜病变中的表达[J].中国肿瘤临床,2005,32(19):1104-1106.
[14]周惠玲,何莹莹,范良生,等.子宫内膜癌组织中基因及分子标志物表达及其与预后的相关性研究[J].中国实用妇科与产科杂志,2015,(10):947-950.
[15]曹桦,吴宁,陈樑,等.ER、PR、Ki-67在子宫内膜癌中的表达及其临床意义[J].实用癌症杂志,2015,30(7):964-966.
