miR-124在胃癌中的表达及临床意义
2016-06-17谢黎明张志伟唐海林邬力祥
刘 锋,谢黎明,张志伟,唐海林,邬力祥
1.中南大学公共卫生学院,湖南 长沙,430100;2.南华大学肿瘤研究所,湖南 衡阳,421001
miR-124在胃癌中的表达及临床意义
刘 锋1, 2,谢黎明2,张志伟2,唐海林2,邬力祥1
1.中南大学公共卫生学院,湖南 长沙,430100;2.南华大学肿瘤研究所,湖南 衡阳,421001
[摘要]背景与目的:miR-124在多种肿瘤中发挥抑癌基因样功能,如肺癌、前列腺癌、膀胱癌和乳腺癌,但是其在胃癌中的表达及临床意义尚不清楚。该研究旨在研究miR-124在正常胃黏膜上皮细胞与不同胃癌细胞及胃癌组织及正常胃黏膜组织中的表达,分析其表达与胃癌患者性别、年龄、组织学分级、T分期、TNM分期、淋巴结转移及预后之间的相关性。方法:采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain-reaction,RTFQ-PCR)检测miR-124在人胃黏膜上皮细胞及胃癌细胞中的表达,采用原位杂交法检测miR-124在胃癌及癌旁正常组织中的表达。结果:RTFQ-PCR结果显示,miR-124在胃癌MKN-74、MKN-28、MKN-45、MGC-803、SGC-7901及AGS细胞中的表达均低于GES-1细胞;原位杂交实验结果显示,miR-124在正常胃黏膜中呈强阳性表达,在胃腺癌组织中表达下降、局灶阳性或缺失;统计分析显示,miR-124与胃腺癌患者组织学分级、TNM分期及淋巴结转移密切相关,与患者的年龄、性别及肿瘤大小无关;Kaplan-Meier生存曲线统计分析显示,miR-124低表达患者的总生存时间和无病生存时间显明低于miR-124高表达患者;多因素分析结果提示,miR-124表达下调是影响患者生存的独立预后因素。结论:miR-124在胃癌细胞及组织中表达下调,并且与患者的组织学分级、TNM分期、淋巴结转移及预后密切相关。
[关键词]胃癌;miR-124;临床意义;原位杂交
Expression of miR-124 in gastric cancer and its clinical significance
现有大量研究证实,表观遗传学调控参与了肿瘤发生、发展的多个过程。非编码RNA是近年来的研究热点,miRNA是一类内源性的具有调控功能的非编码RNA,其大小为17~25个核苷酸,在mRNAs的3’UTR区,miRNA与互补的序列结合导致抑制翻译过程或者直接降解mRNA,从而在转录后调控基因的表达。miRNA参与肿瘤发生、发展多个过程:细胞增殖、凋亡、周期阻滞、侵袭转移、血管形成、上皮间质样变及干细胞特性维持等[1-2]。miR-124在多种肿瘤中发挥抑瘤基因的功能,如膀胱癌、肺癌、乳腺癌和前列腺癌[3-6]。但是其在胃癌中的表达及功能尚不清楚。本次研究拟通过采用原位杂交技术和实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测miR-124在不同胃癌细胞及胃癌组织中的表达,明确miR-124在胃癌中的表达情况,并统计分析miR-124与胃癌患者性别、年龄、分化程度、组织学分级、肿瘤大小、TNM分期、淋巴结转移及预后之间的相关性。
1 材料和方法
1.1细胞系和组织样本
1.1.1细胞系
人胃上皮细胞GES-1、人胃腺癌MKN-74、MKN-28、MKN-45、MGC-803、SGC-7901及AGS细胞购自美国模式培养物研究所(American Type Culture Collection,ATCC),均用含10%胎牛血清、1%青霉素链霉素的DMEM培养,置于37℃、CO2体积分数为5%的恒温培养箱中。
1.1.2临床资料
收集2008年3月—2010年9月在南华大学附属第一医院就诊的126例原发性胃腺癌患者的肿瘤组织及癌旁正常组织。其中,大于等于60岁的患者53例,小于60岁的患者73例;男性患者70例,女性患者56例;高、中分化患者32例,低分化或未分化患者94例;肿瘤分期1~2期的患者71例,3~4期患者55例;TNM分期I~Ⅱ期患者51例,Ⅲ~Ⅳ期患者75例;有淋巴结转移者88例,无淋巴结转移者38例。上述组织标本的使用经南华大学伦理委员会同意。
1.2主要材料
miR-124原位杂交探针序列购自美国Exiqon公司,逆转录试剂盒 (#A3500)购自美国Promega公司,miRNAs PCR定量试剂盒购自美国复能基因公司,TRIzolTMReagent购自美国Invitrogen公司,SABC-POD、生物素化抗地高辛、胃蛋白酶、封闭液和预杂交液均购自武汉博士德生物工程有限公司,DEPC水购自广州美津生物技术有限公司。
1.3RTFQ-PCR检测
20 μL体系逆转录:U6反转录引物或miR-124反转录引物(1 mmol/L)1.2 μL,5×反转录缓冲液为4 μ L,总R N A为1 μg,dNTP (10 mmol/L)0.75 μL,RNasin (40μmol/μL)0.25 μL,DTT(1 mmol/L)2 μL,M-MLV反转录酶(200 μmol/μL)0.5 μL,无酶水补足至20 μL。将PCR管置于PCR仪内,反应条件为16℃ 30 min,42℃ 30 min,85℃ 10 min,4℃ 10 min,立即进行PCR扩增或-20℃保存;20 μL体系PCR扩增:miR-124或U6反转录化合物2.0 μL,2×SYBR Mix 10 μL,miR-124或U6特异性引物(5 μmol/L)0.4 μL,Taq DNA聚合酶5 μmol/μL)0.2 μL,无酶水7.4 μL。将PCR管放入PCR仪内进行扩增,反应条件为:95.0℃,3 min变性;95.0℃,12 s;62.0℃,35 s,共40个循环;熔解曲线检测从62.0℃开始至95.0℃停止;计算各组CT值,用ΔCT评价miRNA的表达。
1.4原位杂交
将收集的组织标本进行取材、常规脱水、浸蜡、包埋、切片,切片厚度4 μm;石蜡切片放入65℃恒温烤箱中烤片至石蜡成水样,然后常规脱蜡至水,取出切片,擦干;在组织上滴适量3% H2O2灭活内源性酶;在切片上滴加3%胃蛋白酶37℃消化15 min,以暴露mRNA核酸片段;1%多聚甲醛/0.1 mol/L PBS(pH为7.2~7.6),室温下固定组织10 min,擦干切片;加预杂交液20 μL,42℃恒温温育3 h,擦干切片;加10 μL杂交液(miRNA探针∶杂交液=1∶250),载玻片上用盖玻片覆盖,在杂交仪中55℃杂交过夜;依次于37℃ 2×SSC液、0.5×SSC液、0.2×SSC液中洗涤15 min;滴加封闭液,37℃恒温温育30 min;滴加生物素化鼠抗地高辛,室温下温育2 h;PBST液漂洗4次,每次5 min;在切片上加DAB显色液,显微镜下控制观察,待阳性切片出现棕黄色立即将切片放入水中终止显色,充分水洗;苏木精复染,最后中性树胶封片,显微镜下观察。
1.5原位杂交结果分析
根据组织阳性染色程度计分:阴性为1分;+为2分;++为3分;+++为4分;根据组织中的阳性细胞数计分:0%~25%为1分;26%~50%为2分;51%~75%为3分;76%~100%为4分。两种计分方法得到的分数相乘,小于8为低表达,大于等于8为高表达。
1.6统计学处理
采用SPSS 17.0统计学软件分析,计量资料两组或两组以上采用Student t-test或One-way ANOVA分析;正常胃组织及胃癌组织中miRNA的表达与临床参数关系的比较采用χ2检验和Fisher’s exact test分析;Kaplan-Meier生存曲线采用Log-rank检验,分析miRNA与胃癌患者的临床预后。P<0.05为差异有统计学意义。
2 结 果
2.1miR-124在胃癌细胞中的表达水平检测
运用RTFQ-PCR技术检测了人胃上皮细胞GES-1、人胃腺癌MKN-74、MKN-28、MKN-45、MGC-803、SGC-7901及AGS细胞中miR-124的表达。本研究结果表明,miR-124 在MKN-74中的表达为人胃上皮细胞GES-1的(0.834±0.076)倍,在NKN-28中的表达为GES-1的(0.428±0.041)倍,在MKN-45中的表达为GES-1的(0.037±0.002)倍,在MGC-803细胞中的表达为GES-1细胞中的(0.379±0.031)倍,在SGC-7901细胞中的表达为GES-1中的(0.046±0.003)倍,在A G S细胞中的表达为G E S - 1中的(0.062±0.005)倍。每组细胞株中实验重复3次,最后取出平均值。miR-124在人胃腺癌细胞中的表达均低于人胃上皮细胞GES-1,差异有统计学意义(P<0.05);在人胃腺癌细胞中,miR-124表达最高的为MKN-74细胞,最低的为MKN-45细胞(图1)。

图 1 RTFQ-PCR检测miR-124在人胃上皮细胞GES-1、人胃腺癌MKN-74、MKN-28、MKN-45、MGC-803、SGC-7901 及AGS细胞中的表达Fig. 1 The expressions of miR-124 in human gastric mucosal epithelium cells GES-1 and gastric cancer cells MKN-74, MKN-28, MKN-45, MGC-803, SGC-7901 and AGS tested by RTFQPCR
2.2miR-124在胃癌组织中的表达与临床病理参数的关系
采用原位杂交技术检测了126例胃腺癌组织及癌旁正常组织中miR-124的表达。结果表明,miR-124在正常胃黏膜中呈强阳性表达,在高分化胃腺癌组织中表达下降,在中分化及低分化胃腺癌组织中的表达显著降低、局灶阳性或缺失(图2)。
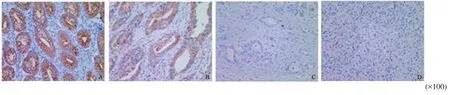
图 2 原位杂交检测miR-124在胃腺癌组织及正常胃黏膜中的表达Fig. 2 Expression of miR-124 in gastric cancer tissues and matched para-cancerous tissues detected by in situ hybridization
miR-124在73例小于60岁患者中有43例表达下降,在53例大于等于60岁患者中有31例表达下降,差异无统计学意义(P=1.000),说明miR-124表达与胃腺癌患者年龄无关;miR-124 在70例男性患者中有45例表达下降,在56例女性患者中有29例表达下降,差异无统计学意义(P=0.203),说明miR-124表达与胃腺癌患者性别无关;miR-124在32例高中分化胃腺癌组织中有24例表达下降,在94例低分化或未分化胃腺癌组织中有50例表达降低,差异有统计学意义(P=0.038),说明miR-124表达与胃腺癌组织学分级有关;miR-124在肿瘤大小1~2级71例患者中有38例表达下降,在肿瘤大小3~4级55例患者中有36例表达下降,差异无统计学意义(P=0.204),说明miR-124的表达与肿瘤大小无关;miR-124在TNM分期I~Ⅱ期51例患者中有23例低表达,在TNM分期Ⅲ~Ⅳ期75例患者中有51例低表达,差异有统计学意义(P=0.016),说明miR-124表达与胃腺癌患者TNM分期相关;在88例有淋巴结转移患者中,miR-124表达下降的59例,在38例无淋巴结转移患者中,miR-124表达下降的15例,差异有统计学意义(P=0.006),说明miR-124表达与胃腺癌患者淋巴结转移相关(表1)。此结果说明,miR-124的表达与胃腺癌患者组织学分级、TNM分期及淋巴结转移密切相关。
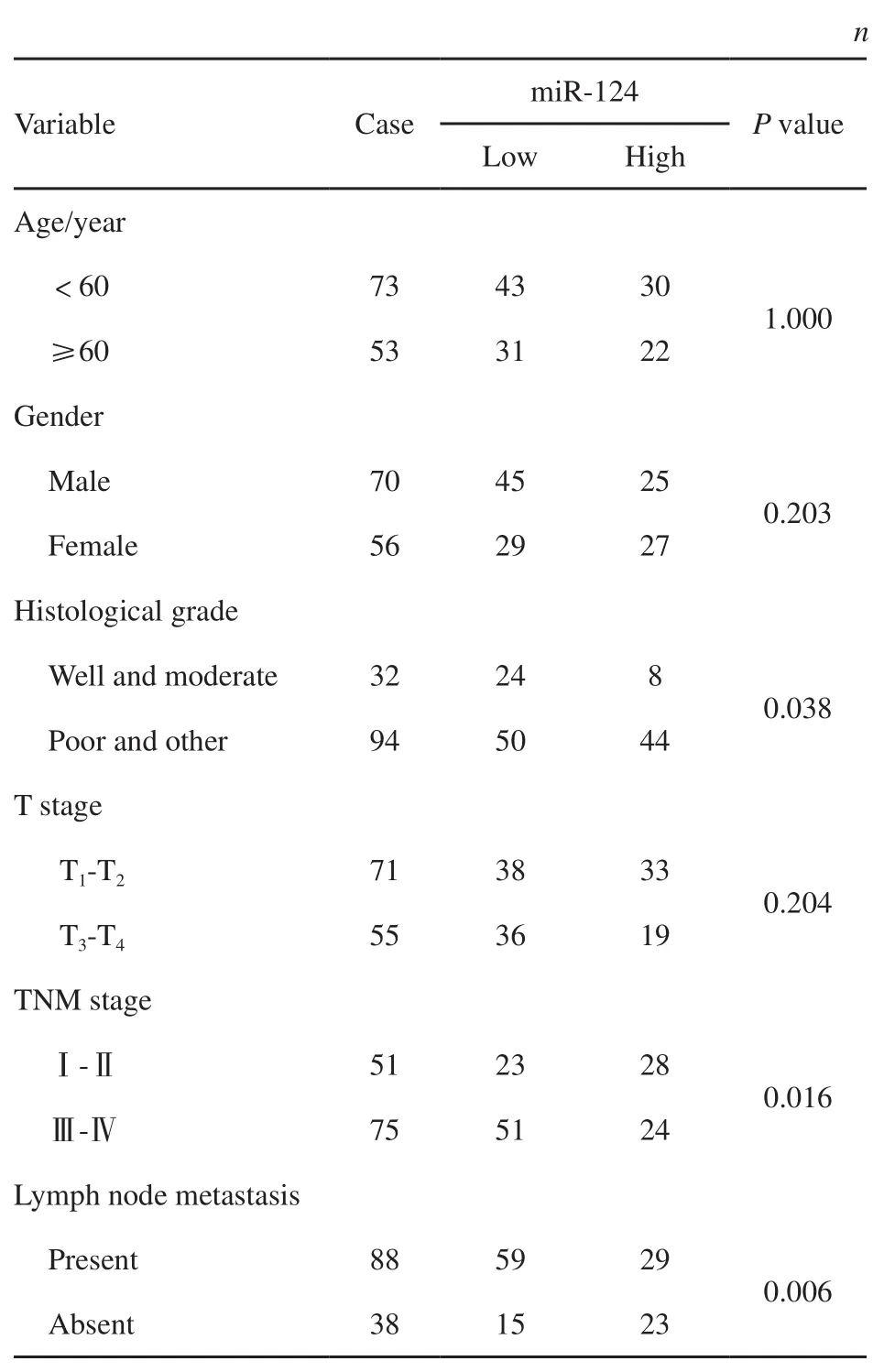
表 1 胃癌患者中miR-124的表达与临床病理参数的关系Tab. 1 Correlations of miR-124 expression with pathological parameters of gastric cancer
2.3miR-124表达与胃癌患者预后的关系
本研究将所收集的胃癌病例分成miR-124高表达与低表达两组,统计分析了miR-124表达与胃癌患者预后的关系。结果表明(图3),miR-124低表达组患者的总生存时间为4~56个月,平均生存时间为(22.1±11.9)个月;miR-124高表达组患者总生存时间为6~58个月,平均生存时间为(28.0±11.6)个月。Kaplan-Meier生存曲线统计分析显示,miR-124低表达组患者总生存率低于miR-124高表达组,差异有统计学意义(P=0.002)。miR-124低表达组患者的无病生存时间为3~56个月,平均无病生存时间为(12.8±16.8)个月;miR-124高表达组患者无病生存时间为6~58个月,平均无病生存时间为(23.2±14.1)个月(图4)。Kaplan-Meier生存曲线统计分析显示,miR-124低表达组患者无病生存率(disease-free survival,DFS)低于miR-124高表达组,差异有统计学意义(P=0.008)。说明miR-124表达越低,胃腺癌患者预后越差,miR-124的表达与胃腺癌患者预后呈正比。多因素分析结果提示,miR-124表达下调(RR=2.57;95%CI:1.39~4.68;P=0.001)是影响患者生存的独立预后因素。

图 3 miR-124表达与胃癌患者总生存率的关系Fig. 3 Survival curve of miR-124 expression and its overall survival in gastric cancer
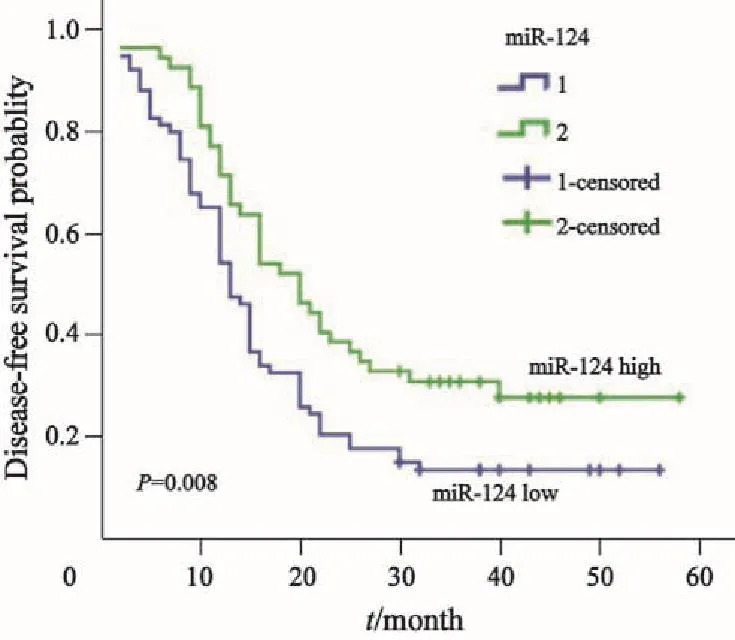
图 4 miR-124表达与胃癌患者无病生存率的关系Fig. 4 Survival curve of miR-124 expression and its disease-free survival in gastric cancer
3 讨 论
胃癌是危害人类健康的主要问题之一,每年有将近1 000 000的新发病例,是导致人类死亡的主要因素之一[7]。有研究显示,70%的胃癌发生在亚洲,与其他的实体瘤相比,胃癌的5年存活率在过去的10年间有了显著增加,提高了15%~27%,但这仅限于早期胃癌患者,中晚期患者的5年生存率仍低于5%,中位总生存时间小于1年[8]。
最近,很多研究者都在寻找miRNA的潜在用途。研究发现,miRNA在癌症表型差异化方面似乎优于mRNA。一项最近的报告显示,胃癌预后信号主要包括4个危险性miRNA(miR-10b、miR-21、miR-233和miR-338,危害比大于1)和3个保护性miRNA(miR-30a-5p、miR-126 和let-7a,危害比小于1),并且都与临床结局相关[9]。另一项研究表明,miR-21和miR-181b的低表达与用S-1和去氧氟尿苷治疗后的胃癌患者的存活之间有一定的联系[10]。miR-125a-3p的低表达和肿瘤的大小、侵袭能力、转移以及临床分期有关,并且可作为一个独立的胃癌预后标志物[11]。miR-200b与miR-200c在胃癌细胞与组织中低表达,并且其表达状态与胃癌患者的临床分期、淋巴结转移及预后相关[12]。
有研究显示,在非小细胞肺癌中,miR-124通过抑制STAT3的表达抑制细胞增殖[4]。miR-124也可通过抑制ROCK1的表达抑制胃癌细胞的迁移能力[13],其在乳腺癌中也可通过抑制Ets-1的表达抑制细胞增殖和迁移[5]。miR-124通过抑制amotL1的表达抑制宫颈癌细胞血管生成拟态及细胞运动能力[14]。与很多miRNA一样,miR-124还参与肿瘤EMT的调控。在前列腺癌细胞中,miR-124通过靶向Slug抑制TGF-α诱导的EMT[6]。miR-124通过增加肿瘤细胞对化疗药物的敏感性抑制肿瘤。miR-124通过靶向磷酸二酯酶增加弥漫性大B细胞淋巴瘤对糖皮质激素的敏感性[15]。同时,miR-124可通过抑制R-Ras和N-Ras的表达抑制胶质瘤细胞生长、增殖,并增加其化疗敏感性[16]。上述研究表明,miR-124具有抑制肿瘤增殖、迁移、调控EMT转化及增加化疗敏感性的作用。
研究表明,多个miRNA在胃癌细胞及组织中表达发生改变。miR-124作为抑瘤因子在多种肿瘤中发挥抑瘤作用。本研究首先检测了miR-124在人胃上皮细胞GES-1、人胃腺癌MKN-74、MKN-28、MKN-45、MGC-803、SGC-7901 及AGS细胞中的表达。结果表明,miR-124在人胃腺癌细胞中的表达均低于人胃上皮细胞GES-1,差异有统计学意义。随后,本研究进一步检测了miR-124在126例胃癌组织及癌旁正常组织中的表达,以确定miR-124在胃癌组织中的表达是否与胃癌细胞中一致。结果表明,miR-124在正常胃黏膜中呈强阳性表达,在高分化胃腺癌组织中表达下降,在中分化及低分化胃腺癌组织中的表达显著降低、局灶阳性或缺失。相关性分析显示,miR-124在胃癌组织中的表达与患者的组织学分级、TNM分期以及淋巴结转移相关。本研究还统计分析了miR-124表达与胃癌患者预后的关系。Kaplan-Meier生存曲线统计分析显示,miR-124低表达组患者无病生存率低于miR-124高表达组,差异有统计学意义。多因素分析结果提示,miR-124表达下调是影响患者生存的独立预后因素。
综上所述,miR-124在胃腺癌组织与细胞中均表达降低,这与miR-124在其他肿瘤中的表达一致。miR-124在胃癌组织中的表达状态与胃癌患者的组织学分级、TNM分期、淋巴结转移及预后明显相关,并且miR-124表达下调是影响患者生存的独立预后因素。这些结果均提示了miR-124可能参与胃癌的发生、发展过程,为miR-124成为胃癌临床预后生物学标志物以及可能的治疗靶点提供了实验证据。
[参 考 文 献]
[1] HE L, HANNON G J. MicroRNAs: small RNAs with a big role in gene regulation [J]. Nat Rev Genet, 2004, 5(7): 522-531.
[2] BUSHATI N, COHEN S M. microRNA functions [J]. Annu Rev Cell Dev Biol, 2007, 23(2): 175-205.
[3] ZHANG T, WANG J, ZHAI X, et al. MiR-124 retards bladder cancer growth by directly targeting CDK4 [J]. Acta Biochim Biophys Sin (Shanghai), 2014, 46(12): 1072-1079.
[4] LI X, YU Z, LI Y, et al. The tumor suppressor miR-124 inhibits cell proliferation by targeting STAT3 and functions as a prognostic marker for postoperative NSCLC patients [J]. Int J Oncol, 2015, 46(2): 798-808.
[5] LI W, ZANG W, LIU P, et al. MicroRNA-124 inhibits cellular proliferation and invasion by targeting Ets-1 in breast cancer [J]. Tumour Biol, 2014, 35(11): 10897-10904.
[6] QIN W, PAN Y, ZHENG X, et al. MicroRNA-124 regulates TGF-alpha-induced epithelial-mesenchymal transition in human prostate cancer cells [J]. Int J Oncol, 2014, 45(3):1225-1231.
[7] LEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[8] POWER D G, KELSEN D P, SHAH M A. Advanced gastric cancer--slow but steady progress [J]. Cancer Treat Rev,2010, 36(5): 384-392.
[9] LAN J, HUA S, HE X, et al. DNA methyltransferases and methyl-binding proteins of mammals [J]. Acta Biochim Biophys Sin (Shanghai), 2010, 42(4): 243-252.
[10] JIANG J, ZHENG X, XU X, et al. Prognostic significance of miR-181b and miR-21 in gastric cancer patients treated with S-1/Oxaliplatin or Doxifluridine/Oxaliplatin [J]. PLoS One,2011, 6(8): e23271.
[11] HASHIGUCHI Y, NISHIDA N, MIMORI K, et al. Downregulation of miR-125a-3p in human gastric cancer and its clinicopathological significance [J]. Int J Oncol, 2012,40(5): 1477-1482.
[12] TANG H, DENG M, TANG Y, et al. miR-200b and miR-200c as prognostic factors and mediators of gastric cancer cell progression [J]. Clin Cancer Res, 2013, 19(20): 5602-5612.
[13] HU C B, LI Q L, HU J F, et al. MiR-124 inhibits growth and invasion of gastric cancer by targeting ROCK1 [J]. Asian Pac J Cancer Prev, 2014, 15(16): 6543-6546.
[14] WAN H Y, LI Q Q, ZHANG Y, et al. MiR-124 represses vasculogenic mimicry and cell motility by targeting amotL1 in cervical cancer cells [J]. Cancer Lett, 2014, 355(1): 148-158.
[15] KIM J, JEONG D, NAM J, et al. MicroRNA-124 regulates glucocorticoid sensitivity by targeting phosphodiesterase 4B in diffuse large B cell lymphoma [J]. Gene, 2015, 558(1):173-180.
[16] SHI Z, CHEN Q, LI C, et al. MiR-124 governs glioma growth and angiogenesis and enhances chemosensitivity by targeting R-Ras and N-Ras [J]. Neuro Oncol, 2014, 16(10): 1341-1353.
LIU Feng, XIE Liming, ZHANG Zhiwei, TANG Hailin, WU Lixiang (1.School of Public Health, Central South University, Changsha 430100, Huan Province, China; 2. Tumor Institute, Nanhua Univercity, Hengyang 421001, Huan Province, China)
Correspondence to: WU Lixiang E-mail: 12095569@qq.com
[Abstract]Background and purpose: miR-124 is considered to be a tumor suppressor in multiple tumors, including lung cancer, prostate cancer, bladder cancer, and breast cancer. However, its function is unclear in gastric cancer. This study aimed to explore the expression of miR-124 in human gastric mucosal epithelium cells and different gastric cancer cells, as well as gastric cancer tissues and matched para-cancerous tissues. The correlations of miR-124 expression with gender, age, histological grade, T stage, TNM stage, lymph node metastasis and prognosis of gastric cancer patients were analyzed. Methods: A real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR)was employed for detecting the expression of miR-124 in human gastric mucosal epithelium cells and gastric cancer cells. The expression of miR-124 in gastric cancer tissues and matched para-cancerous tissues was detected by in situ hybridization. Results: The RTFQ-PCR results indicated that the expression of miR-124 was down-regulated in MKN-74, MKN-28, MKN-45, MGC-803, SGC-7901 and AGS cells compared to GES-1 cells. In situ hybridization showed that miR-124 was strongly expressed in normal gastric mucosa. However, low expression, focal positive expression or lack of miR-124 expression were observed in gastric cancer tissues. Statistical analysis showed that miR-124 was closely correlated to histological stage, TNM stage and node metastasis of gastric cancer patients, but not the age, gender and tumor size. The OS and DFS of the patients with low expression of miR-124 were shorter than that of the patients with high expression of miR-124. Multivariate analysis suggested that miR-124 down-regulation was an independent prog-nostic factor for survival in patients with gastric cancer. Conclusion: miR-124 is down-regulated in gastric cancer cells and tissues. The expression of miR-124 is correlated to histological stage, TNM stage, node metastasis and prognosis.
[Key words]Gastric cancer; miR-124; Clinical significance; In situ hybridization
DOI:10.3969/j.issn.1007-3969.2016.03.003
中图分类号:R735.2
文献标志码:A
文章编号:1007-3639(2016)03-0215-06
基金项目:国家自然科学基金(31100935);湖南省医药卫生科研基金(B2013-041)。
通信作者:邬力祥 E-mail:12095569@qq.com
收稿日期:(2015-04-17 修回日期:2015-08-25)
