靶向HIF-1α基因的CRISPR/Cas9基因敲除质粒的构建与鉴定>*
2016-06-17何玉婷孙冉冉陈晓龙阚全程余祖江
何玉婷,李 娟,孙冉冉,陈晓龙,申 珅,阚全程,余祖江#
1)郑州大学第一附属医院感染科 郑州 450052 2)郑州大学第一附属医院药学部 郑州 450052
靶向HIF-1α基因的CRISPR/Cas9基因敲除质粒的构建与鉴定>*
何玉婷1),李娟1),孙冉冉1),陈晓龙1),申珅1),阚全程2),余祖江1)#
1)郑州大学第一附属医院感染科 郑州 4500522)郑州大学第一附属医院药学部 郑州 450052
关键词HIF-1α;CRISPR/Cas9;肝细胞癌;载体构建;基因敲除
摘要目的:构建靶向低氧诱导因子(HIF)-1α基因的CRISPR/Cas9基因敲除质粒,并体外鉴定其敲除效果。方法:设计靶向HIF-1α基因的gRNA序列,将其插入到CRISPR/Cas9质粒骨架载体pCAG-T7中,转化后挑取克隆,进行测序验证。将构建好的重组质粒体外转染人肝癌细胞HepG2和SK-Hep-1,利用嘌呤霉素进行筛选并扩大培养获得HIF-1α基因敲除混合克隆细胞,应用Western blot技术检测未转染细胞和混合克隆细胞中HIF-1α蛋白的表达情况。结果:经测序验证,成功构建了靶向HIF-1α的重组质粒pCAG-T7-HIF-1α-gRNA,经Western blot验证,转染该重组质粒后人肝癌细胞株HepG2和SK-Hep-1经CoCl2诱导HIF-1α蛋白表达明显减弱。结论:成功构建了靶向HIF-1α基因的CRISPR/Cas9基因敲除质粒载体。
肝细胞癌(hepatocellular carcinoma,HCC)是指肝细胞或肝内胆管细胞发生的恶性肿瘤,恶性程度高、进展迅速、预后差,是我国常见的恶性肿瘤之一,且发病率有逐年增高趋势[1]。因此,寻找新型的、有效的辅助治疗手段对提高HCC的总体生存率显得尤为重要[2]。低氧诱导因子(hypoxia induced factor,HIF)-1在缺氧条件下能激活多种缺氧反应性基因的表达, 是目前发现的惟一在特异性低氧状态下发挥活性的转录因子[3]。研究[4-5]表明,在前列腺癌、胰腺癌、脑瘤以及肝癌等多种肿瘤中均存在HIF-1α过表达,而在相应正常组织中无表达,提示HIF-1α的表达与肿瘤明显相关,HIF-1α通过调控下游基因的表达,参与并影响肿瘤细胞的重要生物学行为。相关研究[6]证实,HIF-1α表达水平与肝癌的发生发展具有密切关系,所以靶向HIF-1α的基因治疗策略可能成为HCC治疗的新的手段。
近年来兴起的CRISPR/Cas9技术具有强大的基因改造能力并且操作便捷,能够在体内外实现精确的基因编辑,其在基因编辑领域的应用日渐广泛[7]。因此,作者构建了靶向HIF-1α基因的CRISPR/Cas9质粒载体,并利用其敲除人肝癌细胞中的HIF-1α基因,为进一步探索和证实HIF-1α与肝癌发生发展及预后之间的关系打下了基础。
1材料与方法
1.1主要试剂大肠杆菌DH5α感受态购自北京康为世纪生物科技有限公司,CRISPR/Cas9质粒骨架pCAG-T7购自北京唯尚立德公司,质粒提取试剂盒购自美国Omega Bio-Tek公司,转染试剂Easyfect购自无锡药科美生物科技有限公司。HIF-1α抗体购自美国Novus公司,氯化钴及其余化学试剂购自上海生工生物工程有限公司。
1.2靶向HIF-1α基因的gRNA的设计和合成根据CRISPR/Cas9靶点设计原则,首先应用在线工具(http://crispr.mit.edu)设计出符合实验要求的gRNA,对其进行筛选及脱靶效应评估,挑选出特性强的gRNA。gRNA设计的主要原则[8]:3’端要有NGG碱基序列的20个连续的碱基序列,且不包括PAM序列;必须在外显子区域且选择靠前的外显子,以提高移码突变的概率;然后利用生物信息学软件进行全基因组比对,避免选择脱靶风险大的靶点序列,需考虑到gRNA效率以及染色体和核小体三维结构可能造成的空间位阻效应所致的Cas9无法结合的情况。同时选择出以下3个序列作为靶点序列(图1和表1)并进行体外筛选,以增加成功率和敲除效率。引物由上海生工生物工程有限公司合成。将3对gRNA引物稀释待用。
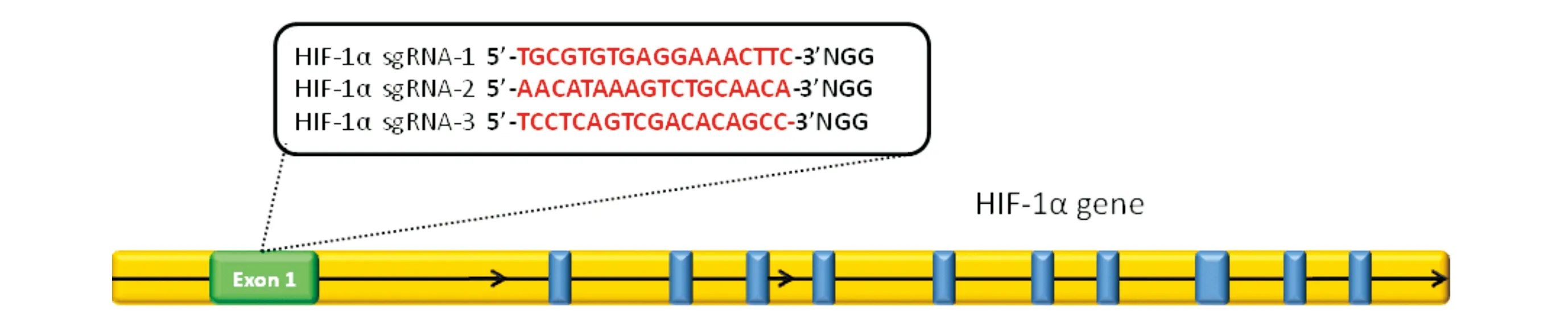
图1 靶向HIF-1α基因靶点位置示意图

引物名称引物序列(5-3)HIF-1α-gRNA-1-FAAACACCGTGCGTGTGAGGAAACTTCHIF-1α-gRNA-1-RCTCTAAAACGAAGTTTCCTCACACGCAHIF-1α-gRNA-2-FAAACACCGAACATAAAGTCTGCAACAHIF-1α-gRNA-2-RCTCTAAAACTGTTGCAGACTTTATGTTHIF-1α-gRNA-3-FAAACACCGTCCTCAGTCGACACAGCCHIF-1α-gRNA-3-RCTCTAAAACGGCTGTGTCGACTGAGGA
1.3pCAG-T7-HIF-1α-gRNA载体的构建及鉴定
质粒构建过程示意图见图2。PCR反应体系:10 μmol/L HIF-1α-gRNA-F、gRNA-R各1 μL,solutionⅠ5 μL,用ddH2O 稀释至10 μL。95 ℃反应3 min,95 ℃缓慢自然冷却至25 ℃,16 ℃反应5 min。然后将退火产物连接到载体中:pCAG-T7 1 μL,PCR反应产物2 μL,用ddH2O 稀释至10 μL,充分混合后,室温(25 ℃)静置 5 min。取连接产物5 μL加入到刚解冻的50 μL DH5α感受态细胞中,轻弹混匀,冰浴30 min后,42 ℃热激90 s,冰上静置2 min,直接涂于氨苄抗性的平板。第2天,挑选出生长状况良好的单菌落于20 mL含有氨苄抗性的LB培养液中,37 ℃ 200 r/min摇床培养过夜。取5 mL菌液送上海英潍捷基生物技术有限公司测序。
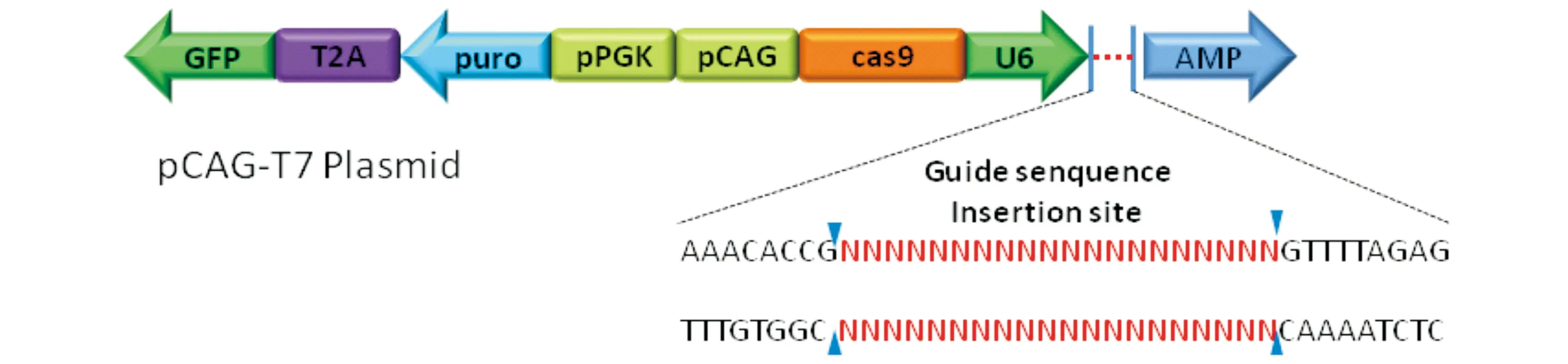
图2 pCAG-T7-HIF-1α-gRNA重组载体结构示意图
1.4pCAG-T7-HIF-1α-gRNA对肝癌细胞的转染
按照试剂盒说明书提取阳性质粒,将3个构建好的重组质粒用TE buffer稀释至等浓度后等体积混合,测定浓度后待用。将处于生长状态良好的人肝癌细胞HepG2和SK-Hep-1(购自上海中科院细胞库)分别消化后接种至12孔板,融合达60%~80%时进行pCAG-T7-HIF-1α-gRNA转染。3个重组质粒各取2 μg,分别在聚苯乙烯管中与100 μL Opti-MEM®培养基混合成预混液,室温静置5 min后在预混液中加入2 μL Easyfect,轻轻吹打,摇晃混匀,室温孵育20 min。将配制好的DNA-脂质体复合物加入12孔板中,来回轻柔摇晃培养板,放入培养箱继续培养。转染24 h后,在荧光显微镜下观察细胞GFP蛋白表达情况,评估转染效率并拍照。转染36~48 h后加入含嘌呤霉素(HepG2和SK-Hep-1最优筛选浓度分别为2.0和1.5 mg/L)的无抗生素培养基,48 h后更换为最优筛选浓度一半的嘌呤霉素的新鲜无抗培养基维持10~15 d,筛选出基因敲除的混合克隆细胞株。
1.5细胞中HIF-1α蛋白的Western blot法检测用HIF-1α表达诱导剂CoCl2(200 μmol/L)诱导培养未转染的HepG2、SK-Hep-1以及混合克隆细胞24 h,提取蛋白,应用Western blot方法检测HIF-1α蛋白的表达,以相应条带灰度值表示表达水平。
2结果
2.1pCAG-T7-HIF-1α-gRNA的鉴定挑取的菌液经上海英潍捷基公司测序,所得序列与gRNA序列一致,测序比对结果见图3。
2.2pCAG-T7-HIF-1α-gRNA对HepG2、SK-Hep-1细胞的转染效果见图4。
2.3基因敲除效果Western blot结果见图5、表1。可以看出,未转染细胞经CoCl2处理后可见明显的HIF-1α表达,而基因敲除的混合克隆细胞HIF-1α表达明显减弱。

图3 pCAG-T7-HIF-1α-gRNA测序结果
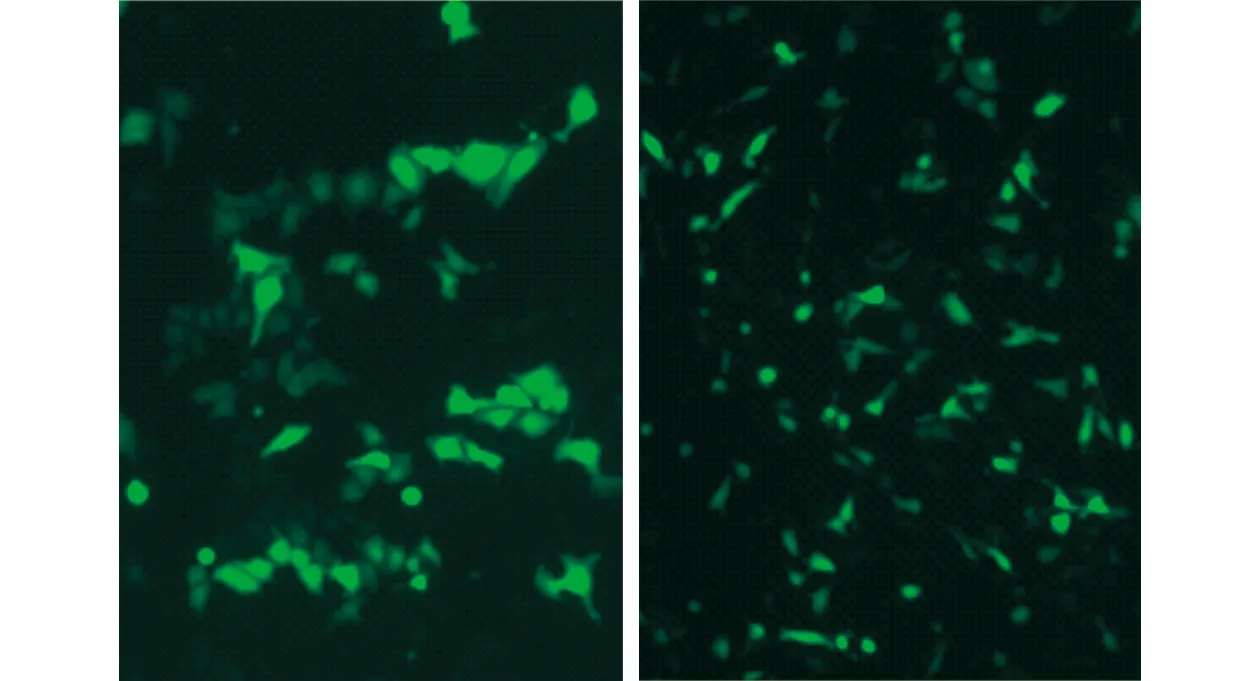
左:HepG2;右:SK-Hep-1。图4 pCAG-T7-HIF-1α-gRNA转染效果图

A:HepG2;B:SK-Hep-1;1:未转染未诱导;2:未转染+诱导;3转染+诱导。图5 Western blot结果

表1 转染和未转染细胞中HIF-1α蛋白表达水平的比较
*:与HepG2或SK-Hep-1比较,P<0.05;与HepG2+CoCl2或SK-Hep-1+CoCl2比较,P<0.05。
3讨论
HIF-1是PAS(PER-ARNT-SIM)家族的成员之一,是一个以折叠-环-折叠为基础结构的转录因子家族,另外还包括结构相似的HIF-2和HIF-3。HIF-1为异源二聚体结构,由对氧含量敏感的HIF-1α亚基和结构性表达的HIF-1β亚基组成,通过与DNA结合发挥转录调节作用。HIF-1α亚基为特异性活性调节亚基,对氧的依赖性较强, 起到主要的缺氧调节作用。在常氧条件下,HIF-1α蛋白合成后会很快被降解,不发挥作用[9]。然而,在缺氧的情况下,HIF-1α的脯氨酰羟化被阻断,未被降解的HIF-1α进入细胞核, 与HIF-1β形成稳定的异质二聚体, 活化的HIF-1 在其靶基因的转录起始部位形成一个转录起始复合物, 从而启动对靶基因的转录,继而进一步发挥促进肿瘤细胞生长、侵袭、转移和化疗耐药的作用[10]。HIF-1α是介导生理性和病理性低氧反应的关键转录因子, 在缺氧环境中表达相对显著,活化的HIF-1作用于人类基因组的1%~2%基因,主要调节血管形成、细胞存活/死亡、代谢、pH、黏附、细胞外基质重塑、迁徙和转移等基因产物的表达,其表达与肿瘤的生长、浸润、转移和预后等密切相关, 并对肿瘤的治疗具有重要意义[11]。目前研究[6]表明, HIF-1在由肝脏炎性疾病向肝脏恶性肿瘤的演进过程中发挥着重要的作用,故推测 HIF-1有可能为肝癌的治疗提供新的靶点。为了进一步深入探索和研究HIF-1α在肝癌发生发展中的调控机制,该研究利用CRISPR/Cas9技术,在体外敲除人肝癌细胞HepG2和SK-Hep-1中的HIF-1α基因,并体外鉴定敲除效果。
CRISPR系统是由成簇间隔的短回文重复序列(clustered regularly interspaced short palindromic repeat sequences)和Cas基因(CRISPR-associated genes)组成的系统[12]。CRISPR系统的原理是基于gRNA 序列能够靶向识别与其互补的DNA 序列,并介导Cas9蛋白特异性地识别及切割该靶位点。同传统的siRNA和shRNA基因沉默技术相比,CRISPR/Cas9技术能够在基因水平实现对靶基因的敲除,更加稳定和彻底。与现有的其他基因编辑工具如锌指核酸酶(ZFNs)和TALE核酸酶(TALENs)相比较,CRISPR/Cas9系统的载体构建更为简单和便捷,只需设计并改造载体上的目的基因的sgRNA序列即可,并且具备更强的扩展性[13]。
实验中,作者首先将设计好的能够靶向HIF-1α基因的gRNA序列连入gRNA-Cas9体系载体中,构建靶向HIF-1α基因的CRISPR/Cas9表达载体。该重组质粒编码的Cas9蛋白带有的核定位信号(nuclear localization signal,NLS)使其能够与gRNA片段结合并组装成gRNA-Cas9 复合体,在目标基因PAM元件的上游实现DNA双链的断裂,随后细胞利用自身的易错倾向的非同源末端连接(non-homologous end joining, NHEJ)修复,同源修复的过程中会在断裂位点产生插入或缺失,继而发生移码突变,导致靶基因编码的蛋白发生改变,从而达到基因敲除的效果。将构建成功的靶向HIF-1α的CRISPR/Cas9质粒转染至肝癌细胞HepG2和SK-Hep-1中,利用抗性基因筛选获得HIF-1α基因敲除的混合克隆细胞,再进一步用Western blot法检测HIF-1α蛋白的表达情况。结果显示未转染细胞经CoCl2诱导后HIF-1α表达明显升高,而混合克隆细胞HIF-1α未见明显表达,提示HIF-1α基因敲除成功。
该研究成功构建了靶向HIF-1α的CRISPR/Cas9质粒载体,为下一步体内外水平敲除HIF-1α基因,进一步研究其在肝癌发生发展过程中的作用打下了前期基础。
参考文献
[1]CHEN JG,ZHANG SW.Liver cancer epidemic in China: past, present and future[J].Semin Cancer Biol,2011,21(1):59
[2]BRUIX J,SHERMAN M.Management of hepatocellular carcinoma:an update[J].Hepatology,2011,53(3):1020
[3]RANKIN EB,GIACCIA AJ.The role of hypoxia-inducible factors in tumorigenesis[J].Cell Death Differ,2008,15(4):678
[4]POUYSSÉGUR JD,MAZURE NM.Hypoxia signalling in cancer and approaches to enforce tumour regression[J].Nature,2006,441(7092):437
[5]ZHONG H,DE MARZO AM,LAUGHNER E,et al.Overexpression of hypoxia-inducible factor 1 alpha in common human cancers and their metastases[J].Cancer Res,1999,59(22):5830
[6]DAI CX,GAO Q,QIU SJ,et al.Hypoxia-inducible factor-1 alpha, in association with inflammation, angiogenesis and MYC, is a critical prognostic factor in patients with HCC after surgery[J].BMC Cancer,2009,9(1):1
[7]SANDER JD,JOUNG JK.CRISPR-Cas systems for editing, regulating and targeting genomes[J].Nat Biotechnol,2014,32(4):347
[8]孙冉冉,陈晓龙,李娟,等.靶向PD-L1基因的CRISPR/Cas9基因敲除质粒的构建[J].郑州大学学报(医学版),2016,51(1):22
[9]WANG GL,SEMENZA GL.Purification and characterization of hypoxia-inducible factor 1[J].J Biol Chem,1995,270(3):1230
[10]SEMENZA GL.Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics[J].Oncogene,2010,29(5):625
[11]TALKS KL,TURLEY H,GATTER KC,et al.The expression and distribution of the hypoxia-inducible factors HIF-1α and HIF-2α in normal human tissues, cancers, and tumor-associated macrophages[J].Am J Pathol,2000,157(2):411
[12]CONG L,RAN FA,COX D,et al.Multiplex genome engineering using CRISPR/Cas systems[J].Science,2013,339(6121):819
[13]MA YZ,HUANG X.Genome modification by CRISPR/Cas9[J].FEBS J,2014,281(23):5186
Construction and indentification of CRISPR/Cas9 plasmid targeting HIF-1α gene
HEYuting1),LIJuan1),SUNRanran1),CHENXiaolong1),SHENShen1),KANQuancheng2),YUZujiang1)
1)DepartmentofInfectionDiseases,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052 2)DepartmentofPharmacology,theFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052
Key wordsHIF-1α;CRISPR/Cas9;hepatocellular carcinoma;vector construction;gene knock-out
AbstractAim: To construct CRISPR/Cas9 knock-out plasmid targeting HIF-1α gene, and identify its knock-out effect in vitro.Methods: The gRNA sequences targeting HIF-1α gene were designed,then were inserted into CRISPR/Cas9 plasmid skeleton vector pCAG-T7,which was transformed into competent DH5α.The single clone was picked up and validated via sequencing. Then the constructed recombinant vector pCAG-T7-HIF-1α-gRNA was transfected into HepG2 and SK-Hep-1, and the HIF-1α gene knock-out mixed colony cell were selected using puromycin. Subsequently, the expression level of HIF-1α in the HIF-1α gene knock-out mixed colony cell lines was detected by Western blot. Results: Through the sequencing validation, the plasmids targeting HIF-1α gene was successfully constructed. The expression levels of HIF-1α in HepG2 and SK-Hep-1 transfected with the recombinant vector were significantly reduced.Conclusion: CRISPR/Cas9 plasmid targeting HIF-1α gene has been successfully constructed.
doi:10.13705/j.issn.1671-6825.2016.03.002
#通信作者,男,1971年5月生,教授,博士生导师,研究方向:重症肝炎和肝癌的综合治疗,E-mail:johnyuem@zzu.edu.cn
中图分类号Q781
*河南省科技厅创新人才基金项目124100510010;郑州大学第一附属医院青年基金项目(2013年)
