海兰 G-F20 治疗症状性膝关节骨关节炎有效性与安全性的前瞻性单臂多中心临床研究
2016-06-17宣梁杨惠林薛庆云严世贵勘武生王宸朱振安
宣梁 杨惠林 薛庆云 严世贵 勘武生 王宸 朱振安
海兰 G-F20 治疗症状性膝关节骨关节炎有效性与安全性的前瞻性单臂多中心临床研究
宣梁 杨惠林 薛庆云 严世贵 勘武生 王宸 朱振安
【摘要】目的 本研究采用前瞻性干涉性开放单臂多中心试验设计评价海兰 G-F20(欣维可®)注射治疗症状性膝关节骨关节炎的有效性和安全性。方法 入选患膝关节骨关节炎的合格受试者 237 例,接受连续3 次隔周关节腔内注射 2ml 海兰 G-F20。在给药后第8周、第12 周、第26 周,对受试者进行膝关节检查并对 Western Ontario and McMaster Universities(WOMAC),患者对目标膝关节的整体评价(patient global assessment,PTGA)、研究者对患者疾病的整体评价(clinical observer global assessment,COGA)问卷调查进行评估。结果 注射海兰 G-F20 后,232 例受试者在第8周、12 周、第26 周时目标膝关节行走痛评分均值较基线期都显著降低。其中给药后第26 周时,主要观察指标目标膝关节行走痛(WOMAC A1)评分均值较基线期显著降低 33.0±17.71(�±s),(P<0.0001)。与基线期比较,降低幅度达 59%。此外,第26 周时受试者目标膝关节的疼痛程度(WOMAC A)、僵硬程度(WOMAC B)和关节功能(WOMAC C)评分均值较基线期显著降低121.5±77.2、36.6±39.8、358.4±270.5(P<0.0001)。受试者 PTGA 和 COGA 在第8周、第12 周和第26 周时的分布相对于其在基线期时的分布变化差异有统计意义,说明受试者自评或研究者评价受试者的总体状况随试验进行不断改善。共 66 例(27.8%)受试者发生不良事件(AE),其中9例(3.8%)受试者发生了与治疗相关的 AE。整个试验期间,无治疗相关的严重不良事件(SAE),无死亡病例。结论 使用海兰 G-F20,患者关节疼痛、关节僵硬、关节功能都得到了有统计学意义的改善,其中关节行走痛的改善程度具有临床意义。在整个研究过程中,海兰 G-F20 治疗的临床副作用少,严重程度低,患者耐受性好。
【关键词】骨关节炎;透明质酸;黏弹性补充疗法;膝关节;海兰 G-F20
骨关节炎(ostoarthritis,OA)是一种最常见的关节疾病,也是致残的常见原因之一[1]。其发病风险随年龄增长而增加,以中老年患者居多,且女性高于男性[2]。关节滑液黏性和弹性的丧失在骨关节炎的病理生理发病中起了决定性作用[3-4]。关节滑液黏弹性降低改变了传递到软骨上的机械力,增加了关节软骨对机械性损害或磨损的易感性。透明质酸是一种具有保持滑液和缓冲功能的糖胺聚糖,在骨关节炎患者中透明质酸的分子量减少、浓度降低导致关节滑液黏弹性的降低[5-6]。
黏弹性补充疗法常用于骨关节炎的临床治疗。欣维可®是一种高分子量透明质酸衍生物聚合物注射剂,其主要有效成分为海兰 G-F20。海兰 G-F20用于骨关节炎临床治疗的有效性和安全性已在得到证实[7-9],但在中国人群中评估海兰 G-F20 有效性和安全性的临床研究较少。本研究旨在评价海兰 G-F20 在有症状性膝关节骨关节炎(knee osteo arthritis,KOA)的中国患者中的有效性和安全性。
资料与方法
一、研究设计
本研究是 2012年3月9日至2013年9月4日,在中国浙江、江苏、湖北、上海及北京地区等 10 家研究中心共同实施的一项前瞻性、干涉性、单臂、多中心临床试验。本试验为单组未作分组设计,故试验中不涉及随机和盲态方法。ClinicalTrials.gov 注册号为 NCT01586338。研究方案和知情同意书均已获得上海交通大学医学院附属第九人民医院伦理委员会批准。本研究根据受试者相关症状和体征,采用 WOMAC[10]评分量表评估其关节炎的严重程度及其治疗疗效,分为疼痛、僵硬、关节功能三大方面来评估膝关节的结构和功能。患者对目标膝关节的整体评价(patient global assessment,PTGA)和研究者对患者疾病的整体评价(clinical observer global assessment,COGA)亦被采用于评估海兰G-F20 治疗症状性 KOA的有效性。临床试验启动时对研究者和相关医护人员就关节注射技术、受试者评分标准、不良事件判定标准进行了统一培训。
二、入选标准与排除标准
1.入选标准:(1)年龄≥30 岁的男女患者;(2)临床诊断为症状性 KOA,且能够正常活动者;(3)能提供3 个月内拍摄且可作为 KOA 诊断证据的 X 线片者[Kellgren-Lawrence 分级属于轻度到中度关节间隙狭窄和(或)凸向胫股关节间隙的骨赘 ];(4)目标膝关节行走痛基线 VAS 评分在中度到重度者(评分 40~80 分);(5)双侧膝关节病变的受试者必须选择疼痛评分较高的膝关节作为试验目标膝关节。非目标膝关节 X 线片的病变程度不要求符合入选标准,但其它入组标准与排除标准均适用。双侧膝关节病变的受试者非目标膝关节也可采用海兰 G-F20治疗,但只进行安全性评价不作有效性评价。
2.排除标准:(1)注射区域有皮肤疾病或出现皮肤感染者;(2)任何关节的感染病史或目标膝关节出现亚急性感染且有临床意义者;(3)伴发可能影响关节炎症的疾病/情况者(例如:风湿性关节炎、代谢性骨病、银屑病、痛风等);(4)有临床意义的下肢静脉或淋巴回流障碍者;(5)有临床意义的膝关节外翻或内翻畸形、韧带松弛或不稳定性半月板和其它影响评估目标膝关节疗效的肌肉骨骼疾病者;(6)目标膝关节 6 个月内外科手术史或计划进行任何下肢关节手术的患者;(7)患有任何关节腔内注射禁忌证,如抗凝治疗或临床上可能存在凝血功能障碍的患者;(8)试验前 6 个月内用过任何透明质酸或其诱导物治疗的患者;(9)试验前3 个月内激素关节内注射治疗者;(10)对禽类蛋白和(或)含透明质酸类注射物质过敏者;(11)妊娠或哺乳期女性患者。
三、给药方案
所有合格受试者须接受连续3 次的膝关节腔内2ml 海兰 G-F20 注射,每次间隔为1周。分别在第0 天(访视 2),第1周(访视3)和第2周(访视 4)进行注射。受试者在注射后第8周(访视 5)、第12 周(访视 6)和第26 周(访视 7)参加随访由指定的固定医师进行疗效评估。在接受试验药注射前和注射后的随访期,受试者仍可接受常规治疗。常规治疗中可以使用包括止痛消炎的治疗,如阿司匹林、非甾体抗炎药(NSAID)、关节炎止痛药(COXIBS)、镇痛药、麻醉药、中医、针灸等。但受试者在整个试验阶段禁用糖皮质激素、肝素或抗维生素 K、及影响试验结果判断的外科手术等。
四、有效性评价方法
WOMAC 被广泛应用于膝关节和髋关节处于疾病状态下的疼痛程度、僵硬状况和关节功能的评估,其中行走痛是评估关节炎临床症状改善的常用指标。本研究采用 WOMAC VAS3.1版对关节状态进行评分。WOMAC 采用 VAS 格式评分,基于 100 mm的总长度,测量尺子左侧到受试者标记的刻度点的长度(精确度至毫米)为评价分数。每一项问题的评价分数为:0~100 分。疼痛程度(WOMAC A)由5项问题组成,评价分数范围为 0~500。僵硬程度(WOMAC B)由 2项问题组成,评价分数范围为 0~200。关节功能(WOMAC C)由 17 项问题组成,评价分数范围为 0~1700。
有效性主要观察指标为用药后第26 周目标膝关节行走痛(WOMAC A1)评分较基线期的改变程度。次要观察指标包括:(1)第8周和第12 周行走痛(WOMAC A1)较基线期的改变程度;(2)第8、12 和 26 周的 WOMAC A、WOMAC B 和 WOMAC C 较基线期的改变程度;(3)第8、12 和 26 周,PTGA 和 COGA 评分较基线期的改变程度。PTGA 和 COGA采用 Likert 评级(5个等级:0=很好,1=好,2=一般,3=差,4=很差)。
五、安全性评估方法
通过试验期间出现的所有不良事件(AE)的发生率、严重程度、与受试药物的相关性,对海兰G-F20的安全性进行评价。如果受试者双侧膝关节均接受了海兰 G-F20 治疗,则双侧膝关节均进行安全性评价。
六、统计学分析
假设配对 t 检验的显著性水平为双侧 0.05,降幅的标准差为 25.0,则样本量为 117 时有 99%的效能检验出行走痛评分与基线相比改变 10.0。考虑到中国食品和药品监督管理局(CFDA)至少入组200 例受试者的要求,并预计可能出现 10%的脱落率,最终估算的样本量为 223 例。
P<0.05 为差异有统计学意义。主要疗效指标提供样本例数、均数、标准差等统计量,采用配对t 检验(或配对样本的符号秩检验)。次要疗效指标的数据将采用描述性统计量进行总结,连续变量采用样本例数、均数、标准差;分类变量采用发生例数和百分比。应用配对 t 检验(或配对样本的符号秩检验)分析连续变量;应用 McNemar-Bowkers 检验分析有序变量。本研究的有效性分析采用全分析集(FAS),无法提供治疗后疗效资料的受试者不纳入全分析集,疗效数据缺失时应用末次数据结转方法(LOCF)进行填补。安全性分析选用安全性分析集(SS)。至少应用1次海兰 G-F20 关节内注射治疗的受试者都将纳入安全性分析集。
研究结果
一、受试者分布和基线特征
本研究有 237 例受试者参与(图1),其中3 例因违背知情同意书签署原则,2例因缺乏治疗后有效性资料,被剔除出全分析集(FAS),最终本研究纳入共 232 例(97.9%)受试者全分析集。其中,229 例(96.6%)受试者完成全部研究过程,3 例数据缺失,采用 LOCF 法填补。安全集(SS)的 237 例受试者中,男性受试者占 22.8%(54 例),女性受试者占 77.2%(183 例),受试者年龄 38~83 岁,平均 62.9 岁。目标 KOA 平均发病时间为 2.43年(最小值为 0,最大值为 20.3),70%(166 例)的受试者目标膝关节发病时间<2年。所有入组的受试者目标膝关节病变程度经 Kellgren-Lawrence 放射学分级标准评分,轻度 93 例,占 40.1%;中度 179 例,占59.9%,无重度膝关节病变的受试者。入组时,目标膝关节行走痛评分均值为 56.4±10.43。受试者人口学、基线特征见表1。
本研究中,27 例(11.4%)在筛选/基线期前使用了消炎镇痛类药物如阿司匹林、非甾体抗炎药(NSAID)、关节炎止痛药(COXIBS)、镇痛药、麻醉药。整个研究阶段,47 例(19.8%)使用了上述可能影响关节痛疗效判断的消炎镇痛类药物。
二、有效性评价
1.主要疗效评价指标:第26 周研究终止时,受试者在经过连续3 次,每周注射 2ml 海兰 G-F20后,行走痛较基线明显降低 59%。232 例受试者26 周时的目标膝关节行走痛评分均值,较基线显著降低了 33.0±17.71(P<0.0001)(表2)。
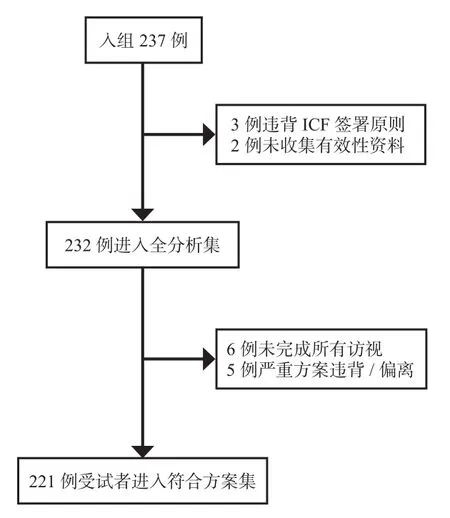
图1 受试者流向图Fig.1 Flow chart of patient enrollment
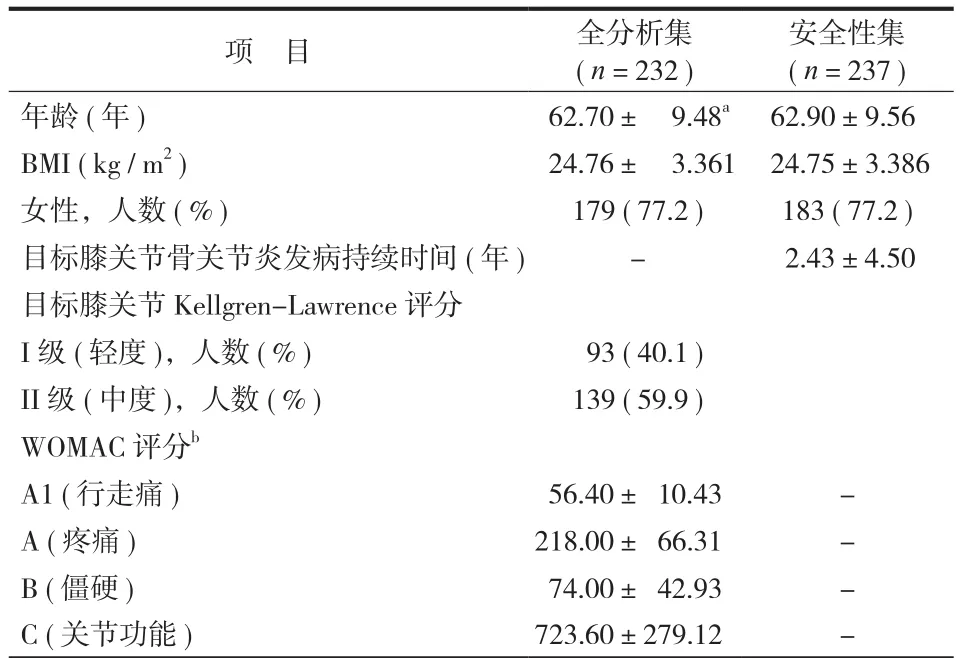
表1 受试者基线情况Tab.1 Demographic data and baseline clinical characteristics of patientsa
2.次要疗效评价指标:第8周和 12 周,目标膝关节行走痛评分均值较基线分别显著下降了 26.0 和 30.0,较基线期下降程度分别为 46%和 53%(P<0.0001)。行走痛下降趋势见图2。
此外,第8、12、26 周受试者疼痛程度(WOMAC A)、僵硬程度(WOMAC B)和关节功能(WOMAC C)评分较基线均显著降低(P<0.0001)。WOMAC A 分别下降了 92.7±71.77,109.8±73.68,121.5±77.18(26 周时比基线下降 56%);WOMAC B 分别下降了28.9±37.53,34.6±38.44,36.6±39.75;WOMAC C分别下降了 270.0±252.86,325.9±258.57,358.4±270.48(表2)。
研究终止时,受试者 PTGA 显著改善,(P<0.0001)。基线时,232 例受试者中自我评估总体状况“很好”和“好”者,仅占 0%(0 例)和1.3%(3 例),总体状况“一般”者,占 29.3%(68 例),总体状况“差”者,占 60.3%(140 例),总体状况“很差”者,占 9.1%(21 例)。在第26 周,232 例受试者中自我评估总体状况“很好”和“好”的比例上升至8.2%(19 例)和 46.6%(108 例),总体状况“一般”的比例增加到 37.1%(86 例),总体状况“差”的比例下降至7.8%(18 例),总体状况“很差”的比例仅占0.4%(1例)(图3)。
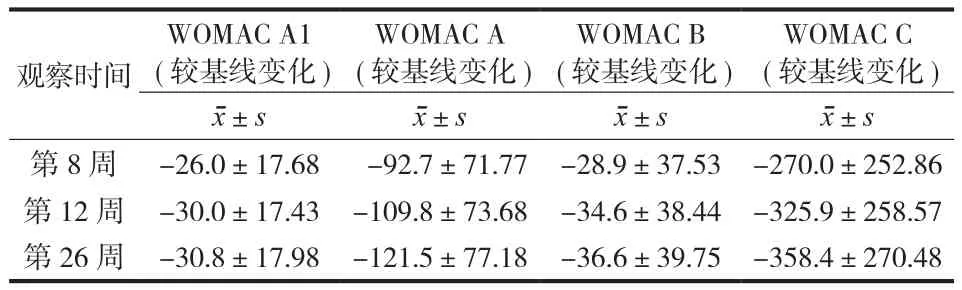
表2 海兰 G-F20 注射治疗后 WOMAC 评分指标(含 LOCF 值a)-全分析集Tab.2 WOMAC Scores(including LOCFa)after Hylan G-F20 injection-Full Analysis Set

图2 主要观察指标行走痛(WOMAC A1)评分均值变化趋势图(全分析集)Fig.2 Primary endpoint- WOMAC A1 changes over 26 weeks(Full Analysis Set)
基线时,232 例受试者 COGA 评估“很好”和“好”的仅占1.7%(4例),“一般”的占 35.3%(82 例),“差”的占 57.3%(133 例),“很差”的占 5.6%(13 例)。在第26 周,COGA 评估“很好”和“好”的受试者比例大幅上升至56.9%(132 例),“一般”的比例维持不变,为 35.3%(82 例),“差”的受试者比例急剧下降至7.8%(18 例),“很差”的为 0%(0 例)(图 4)。
三、安全性评价
截至试验完成,安全人群中共 66 例(27.8%)受试者发生了 103 例不良事件。9 例(3.8%)受试者发生与药物治疗相关的轻中度不良事件,6 例(2.5%)受试者发生与试验操作相关的轻中度不良事件。整个研究过程共发生 4例(1.7%)与试验治疗无关的严重不良事件,导致患者住院或延长住院时间,其中包括骨关节炎1例、关节痛1例、关节病1例和半月板损伤1例(表3)。无受试者死亡。
不良事件按与研究药物或试验操作相关分类。9 例(3.8%)发生与研究药物相关的不良事件,其中6 例(2.5%)发生在试验前8周,包括3 例(1.3%)关节痛,1例(0.4%)关节肿胀,2例(0.8%)注射部位痛;3 例(1.3%)发生在用药后第8周之后,为受试者关节痛。6 例(2.5%)发生与试验操作相关的不良事件。发生在前8周的包括:2例(0.8%)注射部位肿胀,3 例(1.3%)注射部位痛,1例(0.4%)关节痛;1例(0.4%)关节痛者,发生在第8周之后(表3)。
与研究药物治疗无关的最常见不良事件为关节痛,其次为上呼吸道感染。关节痛 22 例(9.3%),其中 13 例(5.5%)发生在海兰注射后前8周,9 例(3.8%)发生在海兰注射后的第8周之后。上呼吸道感染 17 例(7.2%),其中 11 例(4.6%)发生在前8周,6 例(2.5%)发生在海兰注射后的第8周之后。其它与药物治疗无关的不良事件发生率均<3%(表3)。

图3 PTGA 评分变化图示-全分析集Fig.3 PTGA Score change-Full Analysis Set

表3 不良事件汇总-安全性集Tab.3 The summary of adverse events-Safety Set
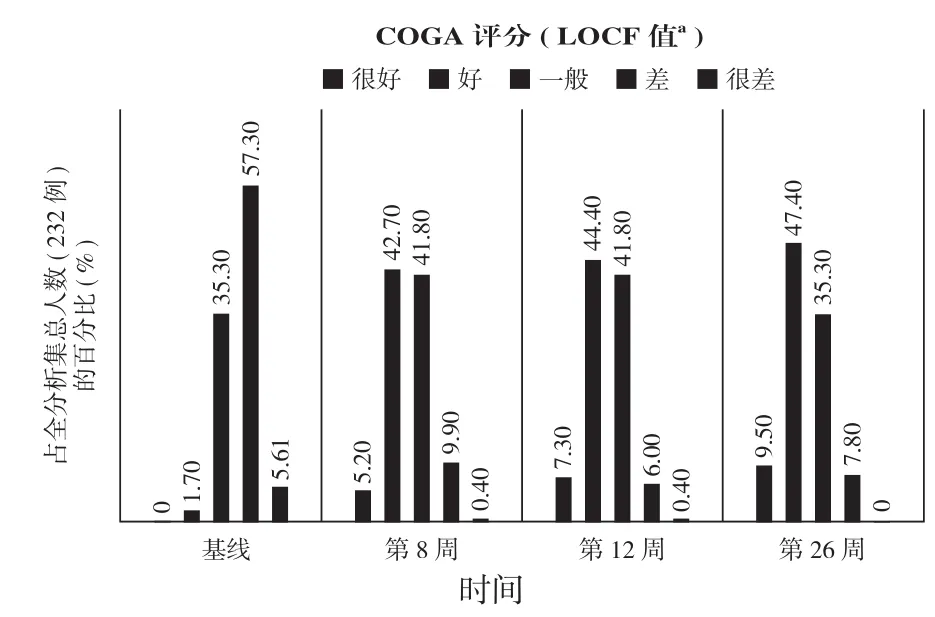
图4 COGA 评分变化图示-全分析集Fig.4 COGA Score change-Full Analysis Set
讨 论
欣维可®(海兰 G-F20)是一种高分子量的透明质酸衍生物聚合物注射剂,已在美国、欧盟和其它国家获批用于治疗 KOA 疼痛。中国在 2001年批准该药上市,广泛用于治疗关节炎。
本研究对轻中度症状性 KOA 患者连续3 次隔周膝关节内注射 2ml 海兰 G-F20,注射后第8、12 和 26 周与基线相比,患者目标膝关节疼痛、膝关节僵硬、膝关节功能、患者对目标膝关节的整体评价(PTGA)和研究者对患者疾病的整体评价(COGA)均得到有统计学意义的显著改善。主要观察指标行走痛(WOMAC A1)的平均分数在第26 周时较基线下降了 33.0±17.71。次要观察指标膝关节痛(WOMAC A)在第26 周时较基线平均下降了 121.5±77.18。患者疼痛经治疗后降低 30%常被认为具有临床意义[11-12]。本研究中,注射海兰 G-F20 后第26 周膝关节行走痛评分平均降低 59%,膝关节痛平均降低 56%。
印度一项单臂多中心开放性 IV期临床试验入组 394 例 KOA 患者,单次注射 6 ml 海兰 G-F20,发现第26 周时行走痛评分较基线显著下降了 46%[7]。欧洲 6 国的一项随机双盲对照试验中,253 例 KOA患者单次注射 6 ml 海兰 G-F20,受试者第26 周行走痛评分均值较基线降低了 36%,安慰剂组降低了29%,两组差异有统计学意义(P=0.047)[8]。
安全性方面,本研究共有 66 例(27.8%)患者发生 AE,但与海兰 G-F20 药物有关或与试验操作有关的 AE 分别只有9例(3.8%)和 7 例(2.9%),这些 AE的严重程度都在轻中度范围。研究中共发生 4例 SAE,均与海兰 G-F20 药物或操作无关,且均因住院或住院时间延长而被判定为 SAE(表4),患者转归良好。本研究与海兰 G-F20 治疗相关的AE 主要为关节痛,关节肿胀或关节注射部位疼痛。美国 FDA 在欣维可®安全性和有效性的总结报告中指出,海兰 G-F20 注射的主要临床副作用为关节疼痛,关节肿胀,关节渗液[13]。本研究中无患者发生关节渗液,其它与药物相关的副作用同美国 FDA 总结报告一致。本研究未观察到海兰 G-F20 有其它特殊的临床副作用。
在本研究过程中患者使用镇痛消炎药,在一定程度上会干扰试验中涉及疼痛测量指标判断的真实性。本研究中,19.8%患者使用过这类消炎镇痛类药物,较基线期的 11.4%上升了8.4%。一项 Euflexxa与欣维可®治疗 KOA 对比的德国研究中,Euflexxa 组49%的患者及欣维可组 81.9%的患者,在试验中的某个阶段使用过止痛补救药物[14]。另一项 Sinovial®和欣维可®治疗 KOA的多国研究中,第26 周时欣维可®组有 76.6%的患者在试验观察期使用过缓解疼痛的补救药物[15]。本研究中受试者使用缓解疼痛的补救药物少于上述其它同类研究,进一步说明在中国人群中,欣维可®用于治疗 KOA 确实有效,其有效性并非单纯来自其它补救药物的作用。
本研究的局限性是采用单组临床试验,未设置安慰剂对照组。这导致有效性指标的改善程度包含了安慰剂效应。试验未随机未设盲也会导致研究者和受试者的期望效应,从而对试验结果产生偏移。这些因素可部分解释本研究中海兰 G-F20 用于治疗KOA的有效程度大于其它研究[7-9]。但海兰 G-F20用于 KOA 治疗的有效性和安全性已被国外许多研究证实。本研究结果进一步确认海兰 G-F20 在中国人群中的有效性和安全性。
欣维可®处方指南中所列明的使用禁忌证比本研究的入排标准宽泛[16]。本研究的入选/排除标准与典型的临床随机分组双盲试验(RCT)一致,选择患者范围比较窄,与真实世界有差距。医生在临床实践中使用欣维可®治疗 KOA 时还应注意根据临床实际情况进行判断。
美国骨科医师学会(AAOS)在 2013 版的《膝关节骨关节炎循证医学指南》中不再推荐使用透明质酸治疗膝关节炎。该观点基于 14 篇采用最小临床意义变化值(minimum clinically important improvement,MCII)[17]来衡量黏度补充治疗法的高、中质量研究,均未发现该治疗方法具有临床显著性差异。而在大量国内临床试验研究基础上,由国内 23 家甲级医院组成的“玻璃酸钠在骨关节炎治疗中的应用专家委员会”发布的《玻璃酸钠在骨关节炎治疗中的应用专家共识(2012年版)》中仍肯定透明质酸治疗关节炎的作用[18]。鉴于透明质酸治疗关节炎的争议,仍需要开展更多的临床试验来验证其有效性和安全性。
本研究结果显示,患有轻中度症状性 KOA的中国患者在接受连续3 次每次间隔1周的膝关节内注射 2ml 海兰 G-F20(欣维可®)后,第26 周时,其关节疼痛、关节僵硬、关节功能都得到了有统计学意义的改善,其中关节行走痛的改善程度具有临床意义。在整个研究过程中,海兰 G-F20(欣维可®)治疗的临床副作用少,副作用严重程度低,患者耐受性好。
参 考 文 献
[1]Zhang W,Nuki G,Moskowitz RW,et al.OARSI recommendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following systematic cumulative update of research published through January 2009.Osteoarthritis Cartilage,2010,18(4):476-499.
[2]Neogi T,Zhang Y.Epidemiology of osteoarthritis.Rheum Dis Clin North Am,2013,39(1):1-19.
[3]Jones A,Doherty M.ABC of rheumatology.Osteoarthritis.BMJ,1995,310(6977):457-460.
[4]Felson DT,Lawrence RC,Dieppe PA,et al.Osteoarthritis: new insights.Part1: the disease and its risk factors.Ann Intern Med,2000,133(8):635-646.
[5]Divine JG,Zazulak BT,Hewett TE.Viscosupplementation for knee osteoarthritis: a systematic review.Clin Orthop Relat Res,2007,455:113-122.
[6]Zhang W,Moskowitz RW,Nuki G,et al.OARSI recommendations for the management of hip and knee osteoarthritis,Part II: OARSI evidence-based,expert consensus guidelines.Osteoarthritis Cartilage,2008,16(2):137-162.
[7]Pal S,Thuppal S,Reddy KJ,et al.Long-term (1-Year)safety and efficacy of a single 6-ml injection of hylan G-F 20 in Indian patients with symptomatic knee osteoarthritis.Open Rheumatol J,2014,8:54-68.
[8]Chevalier X,Jerosch J,Goupille P,et al.Single,intra-articular treatment with 6 ml hylan G-F 20 in patients with symptomatic primary osteoarthritis of the knee: a randomised,multicentre,double-blind,placebo controlled trial.Ann Rheum Dis,2010,69(1):113-119.
[9]Conrozier T,Jerosch J,Beks P,et al.Prospective,multicentre,randomised evaluation of the safety and efficacy of five dosing regimens of viscosupplementation with hylan G-F 20 in patients with symptomatic tibio-femoral osteoarthritis: a pilot study.Arch Orthop Trauma Surg,2009,129(3):417-423.
[10]Xie F,Li SC,Goeree R,et al.Validation of Chinese Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC)in patients scheduled for total knee replacement.Qual Life Res,2008,17(4):595-601.
[11]Rowbotham MC.What is a “clinically meaningful” reduction in pain? Pain,2001,94(2):131-132.
[12]Salaffi F,Stancati A,Silvestri CA,et al.Minimal clinically important changes in chronic musculoskeletal pain intensity measured on a numerical rating scale.Eur J Pain,2004,8(4): 283-291.
[13]US Food and Drug Administration,“Summary of safety and effectiveness data: hyaluronic acid,intraarticular (Synvisc one).” Aug-2009.http://www.accessdata.fda.gov/cdrh_docs/pdf/p940015s012b.pdf[2015-10-21].
[14]Kirchner M,Marshall D.A double-blind randomized controlled trial comparing alternate forms of high molecular weight hyaluronan for the treatment of osteoarthritis of the knee.Osteoarthritis Cartilage,2006,14(2):154-162.
[15]Pavelka K,Uebelhart D.Efficacy evaluation of highly purified intra-articular hyaluronic acid (Sinovial®)vs hylan G-F20 (Synvisc®)in the treatment of symptomatic knee osteoarthritis.A double-blind,controlled,randomized,parallel-group noninferiority study.Osteoarthritis Cartilage,2011,19(11): 1294-1300.
[16]Genzyme Biosurgery,a division of Genzyme Corporation,“Synvisc one®(hylan G-F 20): information for prescribers.”Mar.2009.http:// www.synviscone.com[2015-10-21].
[17]Jevsevar DS.Treatment of osteoarthritis of the knee: evidencebased guideline.J Am Acad Orthop Surg,2013,21(9):571-576.
[18]李箭,李棋.玻璃酸钠在骨关节炎治疗中的应用专家共识(2012年版).中国医学前沿杂志(电子版),2012,4(11):1-7.
(本文编辑:李贵存)
Evaluation on the efficacy and safety of Hylan G-F20(Synvisc®)for the treatment of knee osteoarthritis in Chinese patients: a prospective,single arm,multicenter study
XUAN Liang,YANG Hui-lin,XUE Qing-yun,YAN Shi-gui,KAN Wu-sheng,WANG Chen,ZHU Zhen-an.Shanghai Ninth People’s Hospital,Shanghai Jiao Tong University School of Medicine,Shanghai,200011,PRC
注:本研究由赛诺菲公司发起
【Abstract】Objective To assess the efficacy and safety of Hylan G-F20(Synvisc®)in a study on the treatment of knee steoarthritis in Chinese patients conducted as a prospective interventional single arm clinical trial.Methods Totally 237 patients with symptomatic knee osteoarthritis were enrolled.After signing the informed consent form,patients meeting the inclusion and exclusion criteria received three intra-articular injections of 2ml Hylan G-F20 at weekly intervals and were followed up for evaluating the changes in Western Ontario and McMaster Universities Osteoarthritis Index(WOMAC),Patient Global Assessment(PTGA)score and Clinical Observer Global Assessment(COGA)between baseline and weeks8,12 and 26.Results The score of walk associated pain(WOMAC A1)was changed significantly over8,12 and 26 weeks from baseline in 232 patients injected with Hylan G-F20.Particularly the primary outcome of WOMAC A1 score at week of 26 was reduced significantly by 33.0 ±17.71 (±s)(P < 0.0001)with reduction rate of 59%.At week 26,the scores of WOMAC A,WOMAC B and WOMAC C were respectivelyreduced by 121.5±77.2,36.6 ±39.8and 358.4±270.5(P < 0.0001).The pattern of PIGA and COGA assessments significantly changed at8,12 and 26 weeks,which indicate the greater improvement of knee osteoarthritis of subjects along with the proceeding of the trial.In the study,adverse effects were reported in 66 patients(27.8%),including9of whom(3.8%)were related to the treatment.Neither serious adverse effect due to the treatment nor death were reported.Conclusions This study demonstrated that in patients with knee osteoarthritis,an intra-articular injection of Hylan G-F20 is safe and effective in providing statistically significant,clinically relevant pain relief over 26 weeks.
【Key words】Osteoarthritis; Hyaluronic acid; Viscosupplementation; Knee joint; Hylan G-F20
DOI:10.3969/j.issn.2095-252X.2016.04.015 中图分类号:R684
作者单位:200011 上海交通大学医学院附属第九人民医院骨科(宣梁、朱振安);215006 苏州大学附属第一医院(杨惠林);100730 北京医院骨科(薛庆云);310009 杭州,浙江大学医学院附属第二医院骨科(严世贵);430030 武汉,华中科技大学同济医学院附属同济医院骨科(勘武生);210009 南京,东南大学附属中大医院骨科(王宸)
通信作者:朱振安,Email: zhuzhenan2006@126.com
Corresponding author:ZHU Zhen-an,Email: zhuzhenan2006@126.com
收稿日期:(2015-09-15)
