牛支原体武威株脂蛋白P48基因的克隆、原核表达及亚细胞定位
2016-06-16胡国明邢小勇李娜苏炜德温峰琴项海涛胡永浩包世俊
胡国明,邢小勇,李娜,苏炜德,温峰琴,项海涛,胡永浩,包世俊
(甘肃农业大学动物医学院,甘肃 兰州 730070)
牛支原体武威株脂蛋白P48基因的克隆、原核表达及亚细胞定位
胡国明,邢小勇,李娜,苏炜德,温峰琴,项海涛,胡永浩,包世俊
(甘肃农业大学动物医学院,甘肃 兰州730070)
摘要:【目的】 验证牛支原体P48蛋白在细胞中的位置,并为后续功能的研究奠定基础.【方法】 运用Overlap PCR扩增获得点突变后的牛支原体武威分离株P48基因,并将其克隆至pGEM-T Easy,将测序正确的质粒克隆至表达载体pET-28a中,构建原核表达质粒pET-P48,表达质粒转化大肠杆菌BL21(DE3),并在IPTG诱导下成功获得融合蛋白表达产物rMbP48,大小约为51 ku.重组蛋白纯化后免疫新西兰大白兔制备多克隆抗体.在分离牛支原体膜蛋白的基础上应用Western -blot及间接ELISA对P48蛋白在细胞中的分布进行分析.【结果】P48蛋白主要存在于牛支原体的膜分离相.全菌免疫荧光试验进一步证实脂蛋白P48位于牛支原体的膜表面.【结论】 牛支原体P48蛋白是存在于牛支原体表面的一种具有免疫原性的脂蛋白.本研究为进一步研究P48蛋白的生物学特性及建立高效的牛支原体诊断方法奠定了基础.
关键词:牛支原体;P48;基因克隆;原核表达;亚细胞定位
牛支原体(Mycoplasmabovis,Mb)是牛呼吸道疾病的重要病原体之一,于1961年被Hale等[1]从美国乳房炎病牛中首次分离,并于1976年证实其与牛呼吸系统疾病有关.现已证实,牛支原体不仅可引起牛的肺炎、耳炎、流产、关节炎、奶牛乳房炎和生殖道炎症等疾病,而且可与多杀性巴氏杆菌、牛呼吸道合胞体病毒、牛副流感病毒3型等病原微生物混合感染,加之目前尚无用于防治牛支原体感染的有效药物,因此在所有牛呼吸系统病原感染中,牛支原体感染率居高不下[2-3].支原体感染羊主要会引起肺间质增生性炎症为特征的病理变化[4].近年来,随着养牛业的不断发展和牛群的大范围迁移,牛支原体感染亦迅速扩散和蔓延[5],目前其感染已呈世界性分布.2008年,辛庆九等[6]首次从我国患肺炎的犊牛肺脏中分离到牛支原体,之后在甘肃、贵州、重庆、内蒙、青岛等多个省市均出现牛支原体病例的报道[7],给我国养牛业造成了严重的经济损失,因此,开展牛支原体相关的研究,将会为牛支原体感染的预防及控制奠定基础.
脂蛋白是一类由富含甘油三酯、固醇酯组成的疏水性内核和由磷脂、蛋白质、胆固醇等组成外壳的球状微粒[8],对于细胞外脂质的包装、储存、运输和代谢起重要作用.脂蛋白中的蛋白质组分又被称为载脂蛋白,主要参与脂质的运输和代谢,具有免疫应答、补体激活、蛋白酶抑制剂、炎症反应等功能[9].牛支原体脂蛋白在其定殖及激发免疫反应等过程中发挥重要作用.近年来,越来越多的牛支原体脂蛋白被证实与牛支原体对宿主细胞的粘附有关,例如Pmb67、P26抗原、P33蛋白、P81蛋白等[10-12].用兔抗无乳支原体P48抗血清检测到在所有牛支原体中都存在一个特定的识别位点,证明P48蛋白在结构和功能上都比较保守[13];无乳支原体P48蛋白在免疫应答中扮演重要角色[14],可以作为感染宿主的一个重要标志来对支原体进行诊断.牛支原体P48蛋白亦是牛支原体的一种脂蛋白成分,是牛支原体侵入牛机体后的特异性血清标志,因此可将P48蛋白作为诊断牛支原体的一种特异性靶标抗原[15],但是由于相应抗体获取有一定难度,因此关于牛支原体P48蛋白及其他功能的研究目前还鲜有报道.
1材料与方法
1.1试验菌株
牛支原体武威分离株为甘肃农业大学动物医学院传染病实验室保存;大肠杆菌DH5α、BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;pET-28a(+)为甘肃农业大学动物医学院传染病实验室保存.
1.2试验动物
新西兰大白兔购自兰州大学医学院实验动物中心.
1.3主要试剂
EXTaqDNA聚合酶、T4 DNA Ligase、限制性内切酶BamHI与XhoIⅠ、DL2000Marker、预染蛋白质分子量标准购自宝生物工程(大连)有限公司;DNA胶回收试剂盒、质粒小量提取试剂盒、TMB底物显色液购自天根生化科技有限公司;辣根过氧化物酶(HRP)标记山羊抗兔IgG购自北京凯瑞力枫科贸有限公司;支原体培养基购于青岛海博生物技术有限公司;其他常规试剂均为国产分析纯级产品.
1.4引物的设计与合成
参照Genebank中牛支原体P48基因序列(登录号:CP002513.1),序列全长1 458 bp,编码区总共1 407 bp,其中第86位、238位、255位、447位、461位氨基酸为编码色氨酸的密码子TGA,在大肠杆菌中为终止密码子,因此设计5对引物对上述5个氨基酸进行等义突变(TGA→TGG),引物序列如表1所示,并委托北京三博远志生物技术有限责任公司合成.

表1 引物序列
1.5牛支原体基因组的粗提
将牛支原体按10%接种于含10%马血清、800 IU/mL青霉素的液体培养基内,在5% CO2、37 ℃条件下培养40 h后收集菌液,取1 mL菌液离心弃去上清,PBS悬浮洗涤3次,加入50 μL ddH2O煮沸10 min,12 000 r/min离心取上清即为粗提基因组.粗提物可直接用于PCR扩增或置-20 ℃冻存备用.
1.6基因的扩增
以粗提的牛支原体基因组为模板,用引物对F1和R2扩增得到片段A;引物对F2和R3扩增获得片段B;引物对F3和R4扩增获得片段C;引物对F4和R5扩增获得片段D;引物对F5和R1扩增获得片段E;再以A、B、C、D、E为模板,F1和R1为引物扩增得到P48基因全长.PCR反应体系为(50 μL):模板3 μL、上下游引物各1 μL、Mix 25 μL、ddH2O 20 μL.反应条件见表2.
1.7序列测定及分析
将扩增获得的P48基因全长进行测序,并将测序结果与牛支原体其他菌株序列及无乳支原体相关基因序列进行同源性分析.

表2 PCR反应条件

引物模板反应条件产物F1+R2M.bovis基因组94℃5min,94℃1min,60℃45s,72℃1min,30×AF2+R3M.bovis基因组94℃5min,94℃1min,60℃45s,72℃1min,30×BF3+R4M.bovis基因组94℃5min,94℃1min,59℃45s,72℃1min,30×CF4+R5M.bovis基因组94℃5min,94℃1min,56℃45s,72℃1min,30×DF5+R1M.bovis基因组94℃5min,94℃1min,60℃45s,72℃1min,30×EF1+R1A+B+C+D+E94℃5min,94℃1min,60℃45s,72℃1min40s,30×全长
1.8原核表达载体的构建
上述PCR产物回收,并用BamHI与XhoI对回收产物与原核表达质粒pET-28a分别进行酶切,取酶切后回收产物6 μL、载体2 μL、T4 DNA Ligase 1 μL、10×T4 DNA Buffer 1 μL,轻轻吹打混匀后于16 ℃过夜连接,并将连接产物转化至DH5α感受态细胞中,阳性重组质粒命名为pET-P48,并送金唯智生物有限公司进行测序.
1.9重组蛋白的表达
将测序正确的重组质粒pET-P48转入大肠杆菌BL21(DE3)感受态细胞,挑取单菌落过夜培养后按照1∶100比例转接入200 mL 2YT(Kan+)培养基中,37 ℃培养2~3 h至菌液D值(600 nm)达到0.4~0.6,加入终浓度为1 mmol/L的IPTG,26 ℃诱导6 h后,菌体经超声裂解后收集上清用His·Tag蛋白纯化试剂盒进行纯化,具体步骤见试剂盒说明书.取50 μL纯化的重组蛋白与等量2×上样缓冲液混匀沸水浴10 min后迅速置冰上冷却2 min,然后12 000 r/min离心10 min,收集上清,取5 μL进行SDS-PAGE电泳,首先在电压60 V下进行,待溴酚蓝跑至分离胶界面时将电压调至120 V,直到电泳结束.
1.10多抗制备
纯化后的重组蛋白免疫新西兰大白兔以制备多克隆抗体.首免剂量为800 μg/只,将稀释好的抗原与等量弗氏完全佐剂混匀,充分乳化后多点注射.两周后进行二免,以400 μg/剂量,将抗原与等量弗氏不完全佐剂混匀,充分乳化后多点注射.此后间隔一周强化免疫一次,免疫剂量同第二次免疫.四免后第5天采血分离血清,并经间接ELISA法检测效价后,分别置-20 ℃保存备用.
1.11牛支原体膜蛋白的提取
将牛支原体按10%接种到支原体液体培养基中,于37 ℃ 5% CO2环境中培养至对数生长中后期, 12 000 r/min离心10 min,菌体沉淀用PBS悬浮洗涤3次后,用适量PBS悬浮菌体使之150倍浓缩,依次加入50 μL蛋白酶抑制剂及等量的2% Triton-114,混匀后4 ℃静置30 min,37 ℃作用10 min后,12 000 r/min离心15 min,将上层水相(胞浆蛋白)和下层油相(膜蛋白)中分别移入干净的离心管中,并分别加入3倍体积的预冷丙酮中,-20 ℃作用4 h后,12 000 r/min、4 ℃离心15 min,弃上清,沉淀自然风干后溶解于等量的相应溶剂中直接用于ELISA及Western-blot或置-80 ℃保存备用.
1.12P48在牛支原体中的初步定位
牛支原体全菌蛋白提取:取培养至对数生长中后期牛支原体5 mL,12 000 r/min离心5 min后弃上清,沉淀用PBS悬浮后洗涤3次,弃上清后沉淀悬浮于50 μL PBS中,加入等量2×上样缓冲液,混匀后沸水浴10 min, 12 000 r/min离心10 min,分离上清,直接用于Western-blot或置-80 ℃保存备用.
取等体积纯化后蛋白、牛支原体全菌蛋白、膜蛋白、胞浆蛋白,分别加入等体积2×上样缓冲液,混匀后沸水浴10 min, 12 000 r/min离心10 min,分离上清,等体积上样,经10%分离胶进行SDS-PAGE电泳,先在60 V电压下进行,待溴酚蓝跑至分离胶界面时,将电压调至120 V至电泳结束,电泳完成后用半干转印仪于15 V电压下转印30 min,将目的蛋白转至NC膜上.NC膜经5%脱脂乳中室温封闭2 h后,用TBST漂洗3次,每次10 min.洗涤后的膜于兔抗rMbF48抗血清(1∶3 000)中,37 ℃孵育2 h,经TBST漂洗3次后用HRP标记的山羊抗兔IgG(1∶8 000) 37 ℃孵育2 h,TBST漂洗3次后用DAB显色试剂盒进行显色.
分别取50 μL膜蛋白和胞浆蛋白悬液与等体积包被液混匀后4 ℃过夜包被,用TBST洗涤3次,每次5 min,拍干后每孔加入200 μL 5%脱脂乳37 ℃封闭2 h,TBST洗涤3次后每孔加入100 μL兔抗rMbF48抗血清(1∶5 000),37 ℃孵育1 h后用TBST洗涤3次,每孔加入100 μL HRP标记的山羊抗兔IgG(1∶8 000),37 ℃孵育1 h后洗涤3次,每孔加入100 μL底物显色液,室温避光孵育10 min后加入50 μL 2 mol H2SO4终止反应,并在450 nm处检测D值.
1.13免疫荧光检测
取培养至对数生长中期支原体1 mL,离心后PBS悬浮洗涤3次后悬浮于100 μL PBS中,取适量涂布于盖玻片上,待自然干燥后,用中性甲醛室温固定30 min,PBS洗涤3次,每次5 min,用5%脱脂乳封闭1 h后洗涤3次,取适量兔抗rMbF48抗血清(1∶5 000)滴加于载玻片上,湿盒内37 ℃孵育1 h,PBS洗涤3次后,滴加FITC标记的鼠抗兔IgG(1∶200),湿盒内37 ℃避光孵育1h,PBS洗涤3次后封片,于荧光显微镜下进行观察.
2结果与分析
2.1基因的PCR扩增及重组质粒的酶切鉴定
通过Overlap PCR扩增获得牛支原体Wuwei株F48基因序列,其大小约为1 407 bp,与预期大小相一致(图1).PCR产物回收后与表达质粒pET-28a分别经BamHI与XhoI双酶切,回收酶切产物并连接转化,阳性质粒酶切鉴定并测序,鉴定正确的重组表达质粒命名为pET -P48(图2).
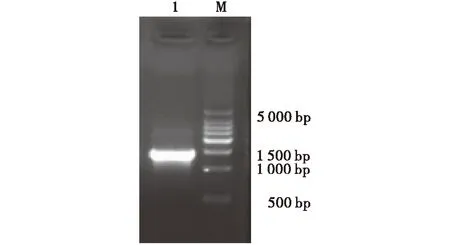
M:DNA分子质量标准;1:牛支原体武威株P48基因.图1 牛支原体P48基因的PCR鉴定Fig.1 PCR identification of P48 gene from mycoplasma bovis

M:DNA分子质量标准;1:pET -P48酶切鉴定.图2 重组质粒pET -P48的酶切鉴定Fig.2 Restriction analysis of recombinant plasmid pET -P48
2.2序列分析
牛支原体武威分离株P48基因在NCBI中的BLAST检测结果显示,该基因在牛支原体HB0801株、Hubei-1株、PG45株及CQ-W70株中均存在,且所有分离株的P48基因序列同源性为100%.P48基因与无乳支原体的某些基因亦有很高的同源性,其中与M.agalactiaePG2(ID:CU179680.1)、M.agalactiaep48andp59 genes(ID:AJ132423.1)、M.agalactiae5632(ID:FP671138.1),同源性均达到80%(表3),且上述3个基因与牛支原体P48基因相比均存在两处共9个碱基的缺失.虽然牛支原体P48基因与无乳支原体上述3个基因具有较高的同源性,但与无乳支原体其他菌株序列具有较大差异,遗传距离较远(图3).除此之外,在其他种属支原体基因组中均未发现牛支原体P48基因的同源序列.
表3P48基因核苷酸序列分析
Tab.3Sequence analysis of the nucleotide
sequence ofP48 gene

1:Ma strain VP 20 L-15/02P48 gene;2:CQ-W07;3:HB0801;4:Hubei-1;5:Ma 5632;6:MaP48 andP59;7:Ma PG2;8:Ma strain PK01ARP48 gene;9:Ma strain RL 14/95-96P48 gene;10:P48 gene;11:Ma strain 17/95-95P48 gene;12:Ma strain VP 12/05P48 gene.
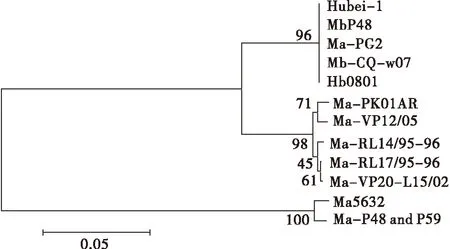
M:DNA分子质量标准;1:pET -P48酶切鉴定.图3 P48 基因核苷酸进化树分析Fig.3 Phylogenetic analysis of P48 gene
2.3重组蛋白的表达
将重组表达质粒pET-P48转入大肠杆菌BL21(DE3),经终浓度为1 mmol/L IPTG诱导,获得重组蛋白的可溶性表达产物与预期一致,其分子量大小约为51 ku(图4).
2.4兔抗rMbF8多抗的制备及P48的亚细胞定位
采集P48重组蛋白4免后的新西兰大白兔血液分离血清,所得多克隆抗体效价高达1∶25 600.牛支原体胞浆蛋白、膜蛋白Western-blot检测结果显示,牛支原体P48蛋白绝大部分存在于外膜(图5).ELISA结果进一步证明牛支原体P48蛋白在膜表面所占比例远大于胞浆蛋白(图6).
免疫荧光试验结果显示,抗rMbF48重组蛋白多克隆抗体处理的支原体表面可结合荧光标记的二抗,从而可见明显的荧光,而阴性血清处理的牛支原体则不结合荧光标记二抗,从而无荧光出现,此结果进一步说明牛支原体P48蛋白主要存在于支原体细胞膜表面(图7).

M:预染的蛋白分子质量标准;1:pET-P48未经IPTG诱导;2:pET-P48经IPTG诱导;3:pET-P48裂解后上清;4:pET-P48裂解后沉淀;5:纯化后蛋白.图4 SDS-PAGE 电泳鉴定Fig.4 The identification of SDS-PAGE

M:预染的蛋白分子质量标准;1:牛支原体全菌蛋白;2:牛支原体胞浆蛋白;3:牛支原体膜蛋白;4:牛支原体P48重组蛋白.图5 Western-blot 检测Fig.5 Western-blot test
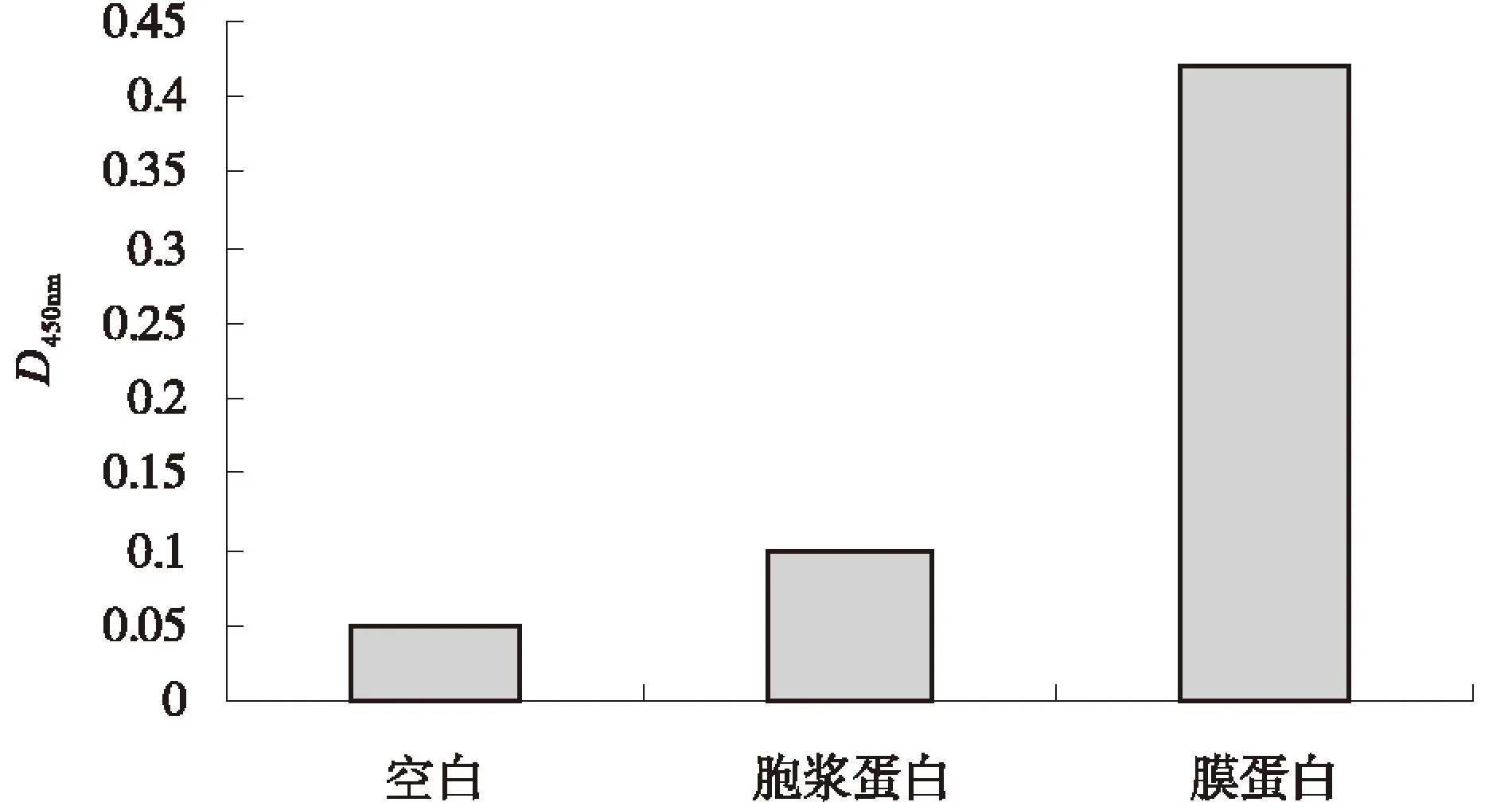
图6 P48亚定位ELISA检测Fig.6 P48 sublocalization ELISA test

7-A:阳性;7-B:阴性对照.图7 荧光抗体检测Fig.7 Fluorescent antibody test
3讨论
细菌脂蛋白是细胞外膜含量最为丰富的蛋白成分,研究表明,细菌脂多糖、脂蛋白及细菌DNA不仅自身存在致病能力,而且三者存在明显的协同作用[16].牛支原体对宿主细胞的粘附作用是其致病的关键,通过这种粘附作用,病原体侵入宿主细胞后,降低机体抵抗力,进而导致其他病原体的混合感染.粘附主要依靠支原体表面的众多脂蛋白.本研究通过原核表达系统表达出了牛支原体武威分离株的P48蛋白,并制备出了兔抗P48多克隆抗体,效价高达256 000,通过对制备出的多克隆抗体进行ELISA效价测定,结果证明该重组蛋白具有良好的免疫原性,能刺激新西兰兔产生特异性抗体且能够特异性结合P48蛋白.在此基础上,提取牛支原体膜蛋白,并运用Western-blot及ELISA对P48蛋白进行亚细胞定位,证明P48蛋白主要存在于牛支原体表面,胞浆中含量较少,全菌免疫荧光试验进一步证明P48蛋白是一种存在于牛支原体细胞膜表面的具有免疫原性的脂蛋白.
对牛支原体P48基因进行测序分析发现其与牛支原体其他菌株P48基因序列相似性达100%,无任何碱基突变,说明本试验所用支原体菌株具有稳定的遗传性以及该基因具有高度的保守性,提示P48蛋白基因对于牛支原体的生存可能具有非常重要的意义.目前关于P48蛋白的粘附与免疫功能的报道较少,而P48蛋白作为一种存在于支原体膜表面的具有免疫原性的脂蛋白,可以作为牛支原体感染宿主的一个重要标志,在牛支原体检测方面具有很大的研究空间[12],且我国目前尚无商品化产品来对牛支原体进行实验室诊断,因此,本研究的结果为进一步研究P48蛋白的生物学特性及建立高效的牛支原体诊断方法奠定了基础.
参考文献
[1]Pfutzner H,Sachse K.Mycoplasma bovis as an agent of mastitis,pneumonia,arthritis and genital disorders.Scientific and Technical Review[J].Office International Des Epizooties,1996,15(4):1477-1494
[2]王晓亮,李知新,王进香,等.宁夏牛传染性牛支原体肺炎的血清学调查[J].中国动物检疫,2011,28(6):56-57
[3]张永强,张维,王清华,等.牛支原体肺炎流行RT-PCR方法的初步诊断[J].中国动物检疫,2011,28(6):48-49
[4]赵萍,逯忠新,储岳峰,等.绵羊肺炎支原体间接血凝诊断方法的建立[J].甘肃农业大学学报,2008,43(1):29-32
[5]Nicholas R A J,Ayling R D.Mycoplasma bovis:disease,diagnosis,control[J].Research in Veterinary Science,2003,741(2):105-112
[6]辛九庆,李媛,郭丹,等.国内首次从患肺炎牛肺脏中分离到牛支原体[J].中国预防兽医学报,2008,30(9):661-664
[7]冉智光,谢建华,骆璐,等.我国部分地区牛支原体肺炎和关节炎的病原体诊断[J].中国预防兽医学报,2010,32(1):40-43
[8]Fredrickson D S,Levy R I,Lees R S.Fat transport in lipoproteins-an integrated approach to mechanisms and disorders[J].N Engl J Med,1967,276(1):34-42
[9]Schittmayer M,Birner-Gruenberger R.Functional proteomics in lipid research:lipases,lipid droplets and lipoproteins[J].J Proteomics,2009,72(6):1006-1018
[10]陈忠琼,范媛,黎晓敏.牛支原体生物学特性及其膜蛋白的研究进展[J].中国畜牧兽医,2012,39(2):183-186
[11]邹晓辉,李媛,辛九庆,等.牛支原体表面一种新的膜蛋白(P33)的特性研究[J].中国预防兽医学报,2013,35(4):255-258
[12]董慧,辛九庆,李媛,等.8株牛支原体分离株P81表面膜蛋白基因的克隆与序列分析[J].中国预防兽医学报,2010,32(3):232-234
[13]Robino P,Alberti A,Pittau M,et al.Genetic and antigenic characterization of the surface lipoprotein P48 of Mycoplasma bovis[J].Vet Microbiol,2005,109(3/4):201-209
[14]Rosati S,Robino P,Fadda M,et al.Expression and antigenic characterization of recombinant Mycoplasma agalactiae P48 major surface protein[J].Vet Microbiol,2000,71(3/4):201-210
[15]Sparwasse T,Miethke T,Lipford G,et al.Bacterial DNA causes septic shock[J].Nature,1997,386:336-337
(责任编辑胡文忠)
Gene cloning,prokaryotic expression and subcellular iocalization of lipoproteinP48 of mycoplsama bovis Wuwei strain
HU Guo-ming,XING Xiao-yong,LI Na,SU Wei-de,WEN Feng-qin,XIANG Hai-tao,HU Yong-hao,BAO Shi-jun
(College of Veterinary Medicine,Gansu Agricultural University,Lanzhou 730070,China)
Abstract:【Objective】 To verify the location of Mycoplasma bovis P48 protein in the cell,and to lay the foundation for the follow-up study its function .【Method】 The P48 gene from M.bovis Wuwei strain was amplified by Overlap PCR.Sequencing and analyzing were accomplished after P48 gene was cloned into pGEM-T Easy.Then the gene was cloned into prokaryotic expression vector pET-28a (+) and the recombinant expression plasmid pET-P48 was transformed into E.coli BL21 (DE3). After induction by IPTG,the recombinant protein rMbP48 was expressed,which the relative molecular weight was about 51ku.Then the rabbit was immunized with purified recombinant protein and the polyclonal antibodies against rMbF48 were prepared.Subsequently,the subcellular localization of P48 was accomplished using Western-blot and ELISA on the basis of the separation of the membrane proteins.【Result】 The results showed that P48 protein mainly distributed in the cytomembrane.That was further confirmed by whole cell immunofluorescence test.【Conclusion】 M.bovis P48 protein is a lipoprotein that has immunogenic and present in the surface of M.bovis,which laid the foundation for the future study of the biological characteristics and establish an efficient diagnostic methods of P48 protein of M.bovis
Key words:Mycoplasma bovis;P48;gene clone;prokaryotic expression;subcellular localization
通信作者:包世俊,男,副教授,硕士生导师,研究方向为动物传染病与流行病学、动物病原分子生物学及基因工程.E-mail:bsjdy@126.com
基金项目:甘肃省自然科学基金项目“新生犊牛传染性肺炎病原的分离、鉴定及快速诊断方法研究”(1308RTZA235).
收稿日期:2015-04-07;修回日期:2015-04-23
中图分类号:Q 7
文献标志码:A
文章编号:1003-4315(2016)02-0001-07
第一作者:胡国明(1989-),男,硕士研究生,研究方向为传染病与病原分子生物学.E-mail:hgm900915@126.com
