伊马替尼对尿毒症心肌病大鼠心肌纤维化的保护作用*
2016-06-15芶芳芳沈宏春樊均明
马 欣,王 丽,芶芳芳,沈宏春,曹 灵,樊均明,4△
(1.泸州医学院附属医院肾病内科,四川泸州 646000;2泸州医学院附属中医医院中西医结合研究中心,四川泸州 646000;3.泸州医学院中西医结合学院,四川泸州 646000;4.四川大学生物治疗国家重点实验室,成都 610041)
伊马替尼对尿毒症心肌病大鼠心肌纤维化的保护作用*
马欣1,王丽2,芶芳芳1,沈宏春3,曹灵1,樊均明1,4△
(1.泸州医学院附属医院肾病内科,四川泸州 646000;2泸州医学院附属中医医院中西医结合研究中心,四川泸州 646000;3.泸州医学院中西医结合学院,四川泸州 646000;4.四川大学生物治疗国家重点实验室,成都 610041)
[摘要]目的观察伊马替尼通过调控PDGFRα的表达改善尿毒症大鼠心肌纤维化的作用。方法将72只大鼠分为Sham 组,5/6 组和5/6+I 组,5/6组建立大鼠尿毒症模型,5/6+I组建模后行伊马替尼灌胃,Sham组仅行肾脏游离。所有大鼠于术后8周行心脏病理染色;实时定量荧光PCR、免疫组织化学测定心脏血小板衍生生长因子受体α(PDGFRα) mRNA及蛋白表达。结果5/6组和5/6+I组大鼠尿蛋白、Scr、BUN均较Sham组明显增加(P<0.01).Sham组心肌病理评分显著低于5/6组(P<0.01),而5/6+I组显著低于5/6组(P<0.01);5/6组心肌间质胶原容积分数值明显高于Sham组(P<0.01);5/6+I组高于Sham组(P<0.05),但与5/6组比较,明显下降(P<0.05);5/6组和5/6+I组的PDGFRα mRNA和蛋白表达均显著高于Sham组(均P<0.01);而5/6+I组明显低于5/6组(P<0.05)。结论伊马替尼可以通过抑制PDGFRα表达减少尿毒症大鼠心脏病理损伤及纤维化的程度。
[关键词]心肌疾病;心肌;纤维化;伊马替尼;尿毒症心肌病;PDGFR
心血管疾病(cardiovascular disease,CVD)是慢性肾脏疾病 (chronic kidney disease,CKD)最常见的并发症,是终末期肾病(ERSD)患者死亡的主要原因。尿毒症心肌病是CKD所致的心肌损害,如能有效控制尿毒症心肌病可以显著改善CKD患者的预后[1]。目前临床上针对尿毒症心肌病的治疗手段依然十分有限,治疗效果仍不甚满意,其原因可能与该病发生的具体机制尚不十分明了有关。近来研究发现,心肌的纤维化形成机制可能与血小板衍生生长因子(PDGF)过度表达有关[2]。有研究表明,心肌间质成纤维细胞在心脏PDGF-D活跃区域过度表达的情况下发生明显增殖,这导致了心脏纤维化,扩张型心肌病和随后的心脏衰竭的发生[3]。伊马替尼是一种用于治疗慢性髓细胞性白血病和胃肠道间质瘤的酪氨酸激酶抑制剂,其竞争性阻断腺嘌呤核苷三磷酸(ATP)在BCR-ABL酪氨酸激酶上的结合位置,产生治疗作用。目前研究提示[4-6],伊马替尼除抑制BCR-ABL酪氨酸激酶活力外,对PDGF受体酪氨酸激酶的活力也存在同等程度的抑制。因此,是否能通过应用该药物拮抗尿毒症心肌病的发展,是一个值得研究的临床课题。本研究拟对该设想进行探讨,为找寻尿毒症心肌病的有效方法提供新的思路。
1材料与方法
1.1材料健康雄性SD大鼠72只,购于泸州医学院SPF动物实验中心,体质量200~250 g,10~16周。主要试剂:甲磺酸伊马替尼购自诺华制药公司;免疫组织化学SP剂盒购自北京中杉金桥生物技术有限公司;兔抗大鼠血小板衍生生长因子受体α(PDGFRα)Ⅰ抗及抗大鼠Ⅱ抗购自Santa Cruz公司;mRNA 提取试剂盒RNeasyMini Kit购自Qiagen公司;逆转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser 和染料法荧光实时定量PCR试剂盒SYBR Premix Ex TaqTMⅡ购自TaKaRa公司。
1.2方法
1.2.1动物模型建立与分组
1.2.1.1尿毒症模型的建立按照Zhao等[7]5/6肾切方法构建尿毒症模型。手术主要步骤如下:戊巴比妥钠(40 mg/kg)腹腔注射麻醉后,固定大鼠于手术台,常规备皮、消毒、铺巾。取大鼠左侧腹部切口,分离出左肾并临时夹闭肾蒂,切除左肾上下极各1/3组织,吸收性明胶海绵创面止血后关闭腹腔。1周后再次手术,取右侧腹部切口摘除右肾。逐层关腹,术毕将大鼠平卧于鼠盒,清醒后分笼饲养。
1.2.1.2实验分组与处理实验分成3组(每组24只)。假手术组(Sham组):仅行肾脏游离,不切除肾脏;5/6肾切组(5/6组):予以5/6肾脏切除;伊马替尼实验组 (5/6+I组):动物先行5/6肾切,术后,以10 mg/kg剂量将伊马替尼溶解至蒸馏水中,每日灌胃。Sham组和5/6组在相同时间点给予等量生理盐水灌胃。所有大鼠均于术后2、6、8周时放于代谢笼收集尿液,同时每组处死8只大鼠,留取血清。术后8周处死时,同时收集心脏标本,分别于4%甲醛溶液中固定,石蜡包埋,-80 ℃冰箱冻存备用。
1.2.2检测指标及方法
1.2.2.1肾脏功能指标测定收集尿液后,全自动生化分析仪检测尿蛋白。干燥管腔静脉采血3 mL,离心后取上层血清,全自动血清自动生物化学仪(Beck-man CX7,美国)检测尿素氮(BUN)、血肌酐(Scr)。
1.2.2.2心脏病理改变采用苏木素-伊红(HE)染色,普通光学显微镜下观察心肌组织病理改变。对心肌组织的改变参照Rona的标准进行评分:(1)心肌纤维有无肥大、变性、坏死;(2)间质有无充血、水肿、炎细胞浸润、结缔组织增生;(3)心内膜、心外膜有无充血、水肿、炎细胞浸润。各种病变按由轻到重的程度分别评分为1、2、3、4分,无病变为0分,每张切片取8个高倍视野进行评分并取平均值,数据进行统计学处理。
1.2.2.3心肌纤维化测定采用苦味酸-天狼星红染色法行胶原染色,心肌细胞呈黄色,胶原纤维呈红色,采用光学显微镜测定。应用Image Pro Plus software 6.0 图像分析系统计算心肌组织中胶原容积分数(CVF),CVF=心肌间质胶原面积/视野总面积,每张切片取8个高倍视野,并取平均值。
1.2.2.4实时定量荧光PCR(Real-time PCR)法测定磷酸化PDGFRα mRNA表达按照说明书的步骤,将适量的心脏组织研磨成匀浆液,使用RNeasyMini Kit 提取mRNA 后,使用PrimeScriptTMRT reagent Kit with gDNA Eraser 逆转录试剂盒,先加入gDNA Eraser去除基因组的DNA,然后直接进行逆转录反应合成cDNA。在Applied Biosystems Step One Plus System Real-time PCR仪上进行实时荧光定量扩增。SYBR反应体系为20 μL。根据SYBR Premix Ex TaqTMⅡ PCR试剂盒和Applied Biosystems Step One Plus System的使用说明,PCR反应条件:95 ℃ 30 s预变性;95 ℃ 5 s,60 ℃ 30 s,40 个循环。以熔解曲线判定反应产物的特异性。利用PCR仪配套软件分析获得产物Ct值,依据公式ΔCt = Ct目的基因- Ct内参基因求得2组ΔCt 值,根据实时定量PCR原理,待扩增目的基因的Ct值与该基因的拷贝数呈反比,ΔCt值越大表明基因表达量越低,用2-ΔΔCt的方法求得各个目的基因mRNA的相对含量。
1.2.2.5免疫组织化学法测定心肌磷酸化PDGFRα 蛋白表达采用免疫组织化学法,按照实验试剂盒操作说明书进行。阳性细胞染色为棕褐色。阳性细胞表达采用半定量分析:计数每个视野下阳性细胞个数,以阳性细胞数/每视野表示,每张切片测定8个随机高倍视野,取平均值为该切片阳性表达值。

2结果
2.1肾功能检测实验至术后第2周时,5/6组和5/6+I组大鼠尿蛋白、Scr、BUN均较Sham组明显增加(P<0.01),并随时间延长增加,第8周时升高显著。但5/6组与5/6+I组比较,各指标差异无统计学意义(P>0.05),见表1。

表1 各组大鼠不同时间段肾功能指标比较±s)
a:P<0.01,与Sham组同时段比较。
2.2心肌病理损伤及纤维化程度
2.2.1心肌病理形态观察Sham组心肌组织无明显病理改变,基本正常,未见胶原组织增生;5/6组心肌细胞排列紊乱,细胞肥大,胶原组织明显增生,心肌间质纤维化明显;5/6+I组心肌组织病变明显减轻。Sham组心肌病理评分显著低于5/6组[(0.21±0.11)分vs.(10.04±1.24)分,P<0.01],而5/6+I组显著低于5/6组[(5.32±0.87)分,P<0.01],见图1。
2.2.2心肌组织CVF测量结果天狼星染色心肌细胞呈黄色,胶原纤维呈红色。5/6组心肌纤维化程度最重,心肌间质胶原含量最多,其CVF值为(28.2±9.4)%,明显高于Sham组(7.1±2.0)%,P<0.01;5/6+I组CVF值为(15.2±4.3)%,虽高于Sham组(P<0.05),但较5/6组显著减小(P<0.05),见图2。
2.3心肌组织PDGFRα的mRNA表达Real-time PCR结果显示Sham组的PDGFRα mRNA的相对表达量为0.544 4,5/6组为2.468 7,5/6+I组为1.437 5,统计分析表明5/6组和5/6+I组表达均显著高于Sham组(P<0.01);而5/6+I组明显低于5/6组(P<0.05)。
2.4心肌磷酸化PDGFRα蛋白表达免疫组织化学检测显示PDGFRα主要表达于心肌间质细胞中。结果显示,5/6组和5/6+I组均可见成棕黄色的颗粒表达于心肌间质细胞中,5/6组PDGFRα蛋白阳性表达率为(8.5±1.9)%,5/6+I组阳性表达率为(5.6±1.1)%,与Sham组[(1.6±0.3)%]比较,均显著性升高(均P<0.01);而5/6+I组的PDGFRα阳性染色率明显低于5/6组(P<0.05),见图3。
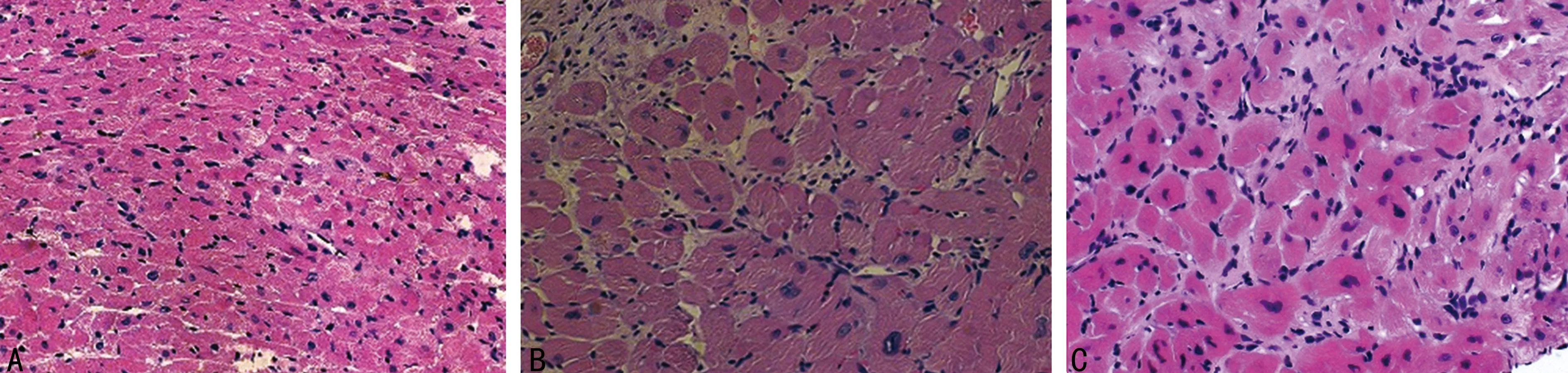
A:Sham组;B:5/6组;C:5/6+I组。
图1各组大鼠心肌组织病理学改变(HE ×200)
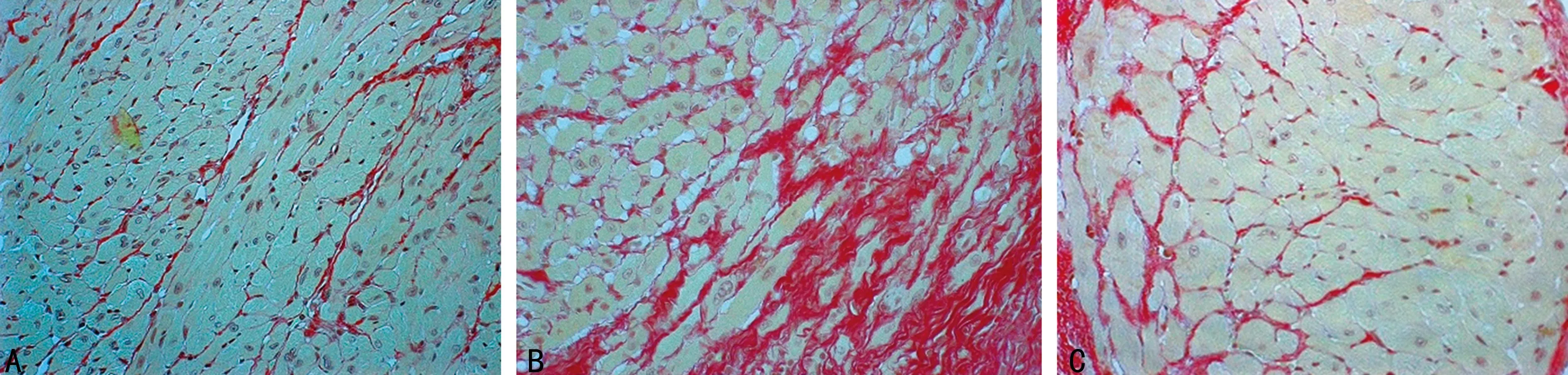
A:Sham组;B:5/6组;C:5/6+I组。
图2各组大鼠心肌组织胶原表达(天狼星红染色 ×400)
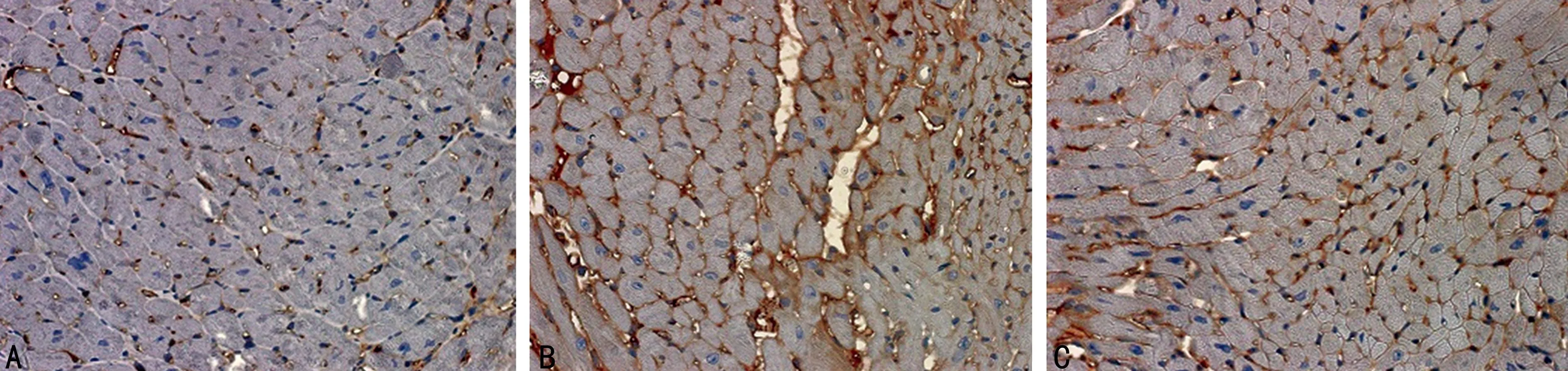
A:5/6+I组(PDGFRα表达较5/6组明显减少);B:5/6组(PDGFRα表达明显增强);C:Sham组(见少量间质细胞PDGFRα染色)。
图3各组大鼠心肌组织PDGFRα蛋白表达(免疫组织化学染色 ×400)
3讨论
尿毒症心肌病是在慢性肾脏疾病的基础上发生的心脏病变,包括形态和功能的改变,主要表现为心肌肥大,毛细血管密度下降,心肌间质纤维化及心室重塑,最终导致左室肥厚,心室舒张、收缩功能失调,心律失常和心力衰竭[8]。其中,心肌纤维化是导致该病进展的重要原因。因此,抑制心肌间质的纤维化,阻断纤维化发展的通路,对尿毒症心肌病的治疗有十分重要的意义。
近年研究发现,PDGF在心肌纤维化的发展进程中扮演了重要角色。PDGF是一种可促进成纤维细胞及血管平滑肌细胞分裂增殖,并具有趋化作用的生长因子,能够促进肌纤维母细胞产生胶原,还可通过上调组织金属蛋白酶抑制剂(TIMP-1)抑制胶原酶的作用,从而减少细胞外基质的降解,最终导致纤维化的发生、发展[9-10]。Ma等[11]在DOCA/salt诱导心肌纤维化的大鼠模型中发现,PDGF/PDGFR信号通路参与了心肌纤维化的发生,并且通过该通路可加速心肌炎性反应。在心肌纤维化的过程中,单核巨噬细胞等炎症细胞增殖,分泌大量的PDGF,活化的PDGF与PDGFR结合,导致PDGF/PDGFR信号通路活化,从而促进心肌纤维化的发生、发展。本次研究发现PDGFR蛋白的表达在尿毒症心肌病的模型动物中明显升高,这说明PDGF及其受体可能是参与尿毒症心肌病进展的重要因素之一,针对PDGF/PDGFR信号通路活化作为靶点的治疗手段,有可能成为减轻尿毒症心肌病的重要措施。
伊马替尼是一种酪氨酸激酶受体抑制剂,是能特异性抑制PDGFR酪氨酸激酶和Abl酪氨酸激酶自磷酸化的低分子拮抗剂[12]。该药对于治疗慢性髓细胞性白血病和胃肠道间质瘤有较好的疗效。同时,由于PDGFR在纤维化过程中的重要角色,目前,已有学者开始关注该药物在各种纤维化所致疾病中的应用前景。比如,Chaudhary等[13]在博来霉素诱导的肺纤维化大鼠中,给予甲磺酸伊马替尼50 mg·kg-1·d-1口服可改善肺纤维化;最近Pope等[14]发现甲磺酸伊马替尼能够通过改善皮肤的纤维化起到治疗系统性硬皮病的作用。因此,伊马替尼有可能是针对尿毒症心肌病治疗的一种极具潜力的新型药物。本研究发现,在使用伊马替尼干预之后,能明显减轻尿毒症大鼠心肌纤维化水平及病理损伤。同时,对PDGFRα的测定发现,通过该药治疗的动物心肌组织内PDGFRα的基因和蛋白表达水平均有下降,这说明,伊马替尼对尿毒症导致的心肌损伤产生保护作用,这种保护作用与其对PDGFRα的抑制所致的纤维化水平降低存在密切联系。在最近的有关报道中提到,伊马替尼可有效改善自发性高血压大鼠的心室重构,降低心肌组织中PDGFR表达水平[15]。该研究与本研究发现一致。
综上,本研究认为伊马替尼能通过对PDGFR的活化抑制,有效地减轻尿毒症心肌病引起的心脏损害。对该类药物的研究将成为尿毒症心肌病的治疗的新思路。
参考文献
[1]O′Shaughnessy MM,O′Regan JA,Lavin P.Prevention of sudden cardiac death in hemodialysis patients[J].Cardiovasc Hematol Disord Drug Targets,2014,14(3):195-204.
[2]Fan B,Ma L,Li Q,et al.Role of PDGFs/PDGFRs signaling pathway in myocardial fibrosis of DOCA/salt hypertensive rats[J].Int J Clin Exp Pathol,2013,7(1):16-27.
[3]Ponten A,Folestad EB,Pietras K,et al.Platelet-derived growth factor D induces cardiac fibrosis and proliferation of vascular smooth muscle cells in heart specific transgenic mice[J].Circ Res,2005,97(10):1036-1045.
[4]Cohen MH,Williams G,Johnson JR,et al.Approval summary for imatinib mesylate capsules in the treatment of chronic myelogenous Leukemia[J].Clin Cancer Res,2002,8(5):935-942.
[5]Moawad EY.Predicting effectiveness of imatinib mesylate in tumors expressing platelet derived growth factors(PDGF-AA,PDGF-BB),stem cell factor ligand and their respective receptors(PDGFR-α,PDGFR-β,and c-kit)[J].J Gastrointest Cancer,2015,46(3):272-283.
[6]Wang XR,Wang CD,Liu XM,et al.Effect of PDGF-Rb antagonist imatinib on endometrial injury repairing in mouse model[J].Asian Pac J Trop Med,2015,8(7):555-559.
[7]Zhao G,Zhao H,Tu L,et al.Effects and mechanism of irbesartan on tubulointerstitial fibrosis in 5/6 nephrectomized rats[J].J Huazhong Univ Sci Technolog Med Sci,2010,30(1):48-54.
[8]Semple D,Smith K,Bhandari S,et al.Uremic cardiomyopathy and insulin resistance:a critical role for AKT[J].I Am Soc Nephrol,2011,22(2):207-215.
[9]Leipner C,Grün K,Müller A,et al.Imatinib mesylate attenuates fibrosis in coxsackievirus b3-induced chronic myocarditis[J].Cardiovasc Res,2008,79(1):118-126.
[10]Leask A.Potential therapeutic targets for cardiac fibrosis TGFβ,angiotensin,endothelin,CCN2,and PDGF,partners in fibroblast activation[J].Cir Res,2010,106(11):1675-1680.
[11]Ma LK,Li Q,He LF,et al.Imatinib attenuates myocardial fibrosis in association with inhibition of the PDGFRalpha activity[J].Arq Bras Cardiol,2012,99(6):1082-1091.
[12]Okuda K,Weisberg E,Gilliland DG,et al.ARG tyrosine kinase activity is inhibited by STI571[J].Blood,2001,97(8):2440-2448.
[13]Chaudhary NI,Schnapp A,Park JE.Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model[J].Am J Respir Crit Care Med,2006,173(7):769-776.
[14]Pope J,Walker KM,de Leon F,et al.Correlations between changes in cytokines and clinical outcomes for early phase (proof of concept) trials in active diffuse systemic sclerosis using data from an imatinib study[J].Rheumatology (Oxford),2014,53(10):1830-1834.
[15]Jang SW,Ihm SH,Choo EH,et al.Imatinib mesylate attenuates myocardial remodeling through inhibition of platelet-derived growth factor and transforming growth factor activation in a rat model of hypertension[J].Hypertension,2014,63(6):1228-1234.
Protective effect of imatinib on myocardial fibrosis in uremic rats*
MaXin1,WangLi2,GouFangfang1,ShenHongchun3,CaoLing1,FanJunming1,4△
(1.DepartmentofNephrology,AffiliatedHospitalofLuzhouMedicalCollege,Luzhou,Sichuan646000,China;2.LaboratoryofOrganFibrosisProphylaxisandTreatmentbyCombineTraditionalChineseandWesternMedicine,ResearchCenterofCombineTraditionalChineseandWesternMedicine,theAffiliatedTCMHospital,LuzhouMedicalCollege,Luzhou,Sichuan646000,China;3.CollegeofTraditionalChineseMedicine,LuzhouMedicalCollege,Luzhou,Sichuan646000,China;4.StateKeyLaboratoryofBiotherapy,SichuanUniversityWestChinaHospital,Chengdu,Sichuan610041,China)
[Abstract]ObjectiveTo evaluate the effect of imatinib in improving myocardial fibrosis in uremic rats through regulating the expression of PDGFRα.MethodsSeventy two rats were divided into three groups,which were Sham group,5/6 group and 5/6+I group.All The rats in 5/6 group underwent the 5/6 nephrectomy and the rats in 5/6+I group were given imatinib by gavage after the operation of 5/6 nephrectomy.Hearts were harvested for HE and Sirius red staining at 8 weeks post surgery.The expression of PDGFRα was assessed with immunohistological staining.The real-time PCR was employed to detect the PDGFRα mRNA level in hear samples.ResultsThe urine protein,Scr,BUN of the 5/6 group and 5/6+I group were higher than that of Sham group(P<0.01).The myocardial pathological score in Sham group was significantly lower than that of 5/6 group (P<0.01),and the score in 5/6+I group was significantly lower than that of 5/6 group (P<0.01).The collagen volume fraction (CVF) in 5/6 group was significantly higher than that in Sham group (P<0.01).And the CVF in 5/6+I group was higher than that in Sham group (P<0.05),but lower than that of 5/6 group (P<0.05).The expression ratio of PDGFRα mRNA and staining rate in 5/6 group and 5/6+I group were both much higher than that in Sham group (P<0.01),and the expression in 5/6+I group was significantly lower than that in 5/6 group (P<0.05).ConclusionThese data suggest that the tyrosine kinase inhibitor imatinib reduces heart injury and attenuates myocardial fibrosis in uremic rat by mechanisms associated with the inhibition of the expression of PDGFRα.
[Key words]cardiomyopathies;myocardium;fibrosis;imatinib;uremic cardiomyopathy;PDGFR
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.03.008
*基金项目:国家自然科学基金项目(81170667);四川省科技厅项目(2011JTD0014、2013CDLZ-S20、14JC01503-LH48);泸州市科技厅项目[2015-R-55(8/16)]。
作者简介:马欣(1989-),硕士,主要从事慢性肾脏疾病的相关研究。△通讯作者,E-mail:junmingfan@163.com。
[中图分类号]R542.2
[文献标识码]A
[文章编号]1671-8348(2016)03-0313-04
(收稿日期:2015-08-18修回日期:2015-10-10)
