乌克兰龙葵毛状根诱导条件优化
2016-06-15刘立业刘金帅李秀霞
刘 琪,刘立业,刘金帅,李秀霞
(佳木斯大学生命科学学院,黑龙江佳木斯 154007)
乌克兰龙葵毛状根诱导条件优化
刘 琪,刘立业,刘金帅,李秀霞*
(佳木斯大学生命科学学院,黑龙江佳木斯 154007)
摘要[目的]利用3种发根农杆菌A4、C58C1、A1476诱导乌克兰龙葵产生毛状根,探究乌克兰龙葵毛状根诱导的最佳条件。[方法]利用植物组织培养技术,研究不同外植体、菌株、侵染时间、预培养天数、菌液浓度和共培养天数等对乌克兰龙葵毛状根诱导率的影响。[结果]叶片为最佳外植体材料;3种菌株均能诱导出毛状根,但A4诱导率最高;最佳菌液浓度为OD600=0.6;最佳侵染时间为5 min;预培养和共培养均为2 d时诱导率最高。 [结论]乌克兰龙葵毛状根诱导条件的优化,为其他植物毛状根诱导提供参考,同时为进一步利用植物毛状根生产药用成分提供试验基础。
关键词毛状根诱导;龙葵;发根农杆菌;条件优化
龙葵(SolanumnigrumL.)为茄科茄属一年生草本植物[1],广泛分布于世界温带和热带地区,在我国也遍布各地[2]。研究表明,龙葵有修复细胞正常的生理活动,抑制细胞突变,抑制肿瘤细胞的生长及增殖,促进肿瘤细胞凋亡,抑制肿瘤细胞转移和增强机体免疫的功能[3-4]。全草含茄碱(Solanine)、茄解碱(Solsonine)、澳洲茄碱(Solaonine)、澳洲茄边碱(Solsmargine)等多种生物碱[5]。现代药学研究表明,龙葵生物碱具有抗肿瘤、抗菌、抗炎、散瘀消肿、清热解毒等药理作用[6]。
发根农杆菌(Agrobacteriumrhizogenes)属根瘤菌科(Rhizobiaceae)农杆菌属(Agrobacterium)的一类具有侵染性的革兰氏阴性土壤杆菌。目前,有关毛状根的应用绝大部分集中在应用毛状根系的离体培养来生产药用植物的有效成分,如生物碱类( 萝芙木生物碱)、萜类、甙类、试类( 人参皂试、绞股蓝皂试等)等化合物[7]。在自然状态下,发根农杆菌通过伤口侵染植物,Ri质粒上的一段DNA分子(T-DNA)在宿主细胞中整合表达,使植物产生毛状根[8]。迄今,利用发根农杆菌对茄科植物如澳洲茄(Solanumaviculare)和(紫脉)少花龙葵(S.photeinocarpum)的遗传转化所产生的毛状根来产生澳洲茄胺或龙葵生物碱和总皂甙已有报道[9-10],另外发现三叶鬼针草毛状根可作为潜在修复污染水体中重金属的新材料[11]。对于龙葵毛状根的诱导条件鲜有报道,笔者以乌克兰龙葵为试验材料,利用发根农杆菌侵染乌克兰龙葵外植体获得毛状根,在此基础上,研究6种不同因素对乌克兰龙葵毛状根诱导率的影响,初步优化了乌克兰龙葵毛状根的诱导条件,为龙葵毛状根的诱导提供参考。
1材料与方法
1.1试验材料乌克兰龙葵实生苗于佳木斯大学生命科学学院植物组织培养室培养;发根农杆菌菌株A4、C58C1、A1476由佳木斯大学生命科学学院植物学研究所提供。
1.2培养基 菌株活化培养基:YEB培养基,pH 7.0;预培养培养基:MS,pH 5.8;共培养培养基:MS +乙酰丁香酮(AS,200 mg/L);除菌培养基:MS+头孢噻肟钠(400 mg/L)+羧苄青霉素(100 mg/L),pH 5.8;毛状根继代培养基:MS,pH 5.8。
1.3试验方法
1.3.1外植体的获得。乌克兰龙葵种子经常规灭菌后,种植于灭菌蛭石中,定期浇营养液,待其成苗后,取其幼叶、嫩茎、叶柄作为外植体。
1.3.2菌株的活化。将发根农杆菌A4、C58C1和A1476分别置于YEB液体培养基中,在28 ℃、160 r/min的摇床下振荡培养24 h左右,测定OD600,用于侵染外植体。
1.3.3外植体的转化。在乌克兰龙葵苗上取其幼叶、嫩茎、叶柄作为外植体,经常规灭菌后剪成边长5~10 mm的方块,接种于MS培养基,预培养2 d后将外植体浸入活化好的农杆菌液中,5 min后取出,用无菌滤纸吸去表面多余菌液。将侵染好的外植体放回原MS培养基,共培养2 d后移植除菌培养基上进行除菌,每隔5 d转接一次,经多次除菌操作培养直至培养基上无农杆菌菌落时转至MS培养基进行继代培养。
1.3.4不同试验条件梯度设置。外植体选用幼叶、嫩茎、叶柄;3种不同种类发根农杆菌为A4、C58C1、A1476;菌液浓度OD600设置为0.3、0.6、0.9;侵染时间设置为5、10、15 min;预培养时间设置为0、1、2、3、4 d;共培养时间设置为0、1、2、3、4 d。
1.3.5毛状根的PCR检测。取乌克兰龙葵无菌毛状根200 g,利用微量CATB法提取毛状根DNA,纯化后作为PCR的扩增模板,以农杆菌质粒为阳性对照,同时以非转化乌克兰龙葵根的DNA为阴性对照。参考王丽等[13]发表的rolB引物:P1 5′-GCTCTTGCAGTGGCTAGATTT-3′,P2 5′-GAAGGTGCAAGCTACCTCTC-3′;rolC引物:P1 5′-CTCCTGACATCAAACTCGTC-3′,P2 5′-TGCTTCGAGTTATGGGTACA-3′。PCR反应体系50 uL。扩增程序:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。 扩增产物使用0.9%的琼脂糖凝胶电泳和EtBr 染色,在紫外成像系统下观察DNA条带并进行拍照保存。
2结果与分析
2.1不同外植体对乌克兰龙葵毛状根诱导率的影响由表1可知,叶片的毛状根诱导率最高,达46.7%;茎段次之,为23.3%;叶柄最低,为6.7%。观察发现,被侵染的外植体在侵染7 d左右有少量白色多毛的根从被侵染的外植体长出,叶片诱导的毛状根粗壮,密集;茎段和叶柄诱导的毛状根稀疏,较细,且生根较晚(图1)。最早生根天数无明显差异。这表明乌克兰龙葵不同外植体对毛状根的诱导存在一定的影响。
表1不同外植体对乌克兰龙葵毛状根诱导率的影响
Table 1Effects of explants on the induction rate of hairy roots of UkraineS.nigrum
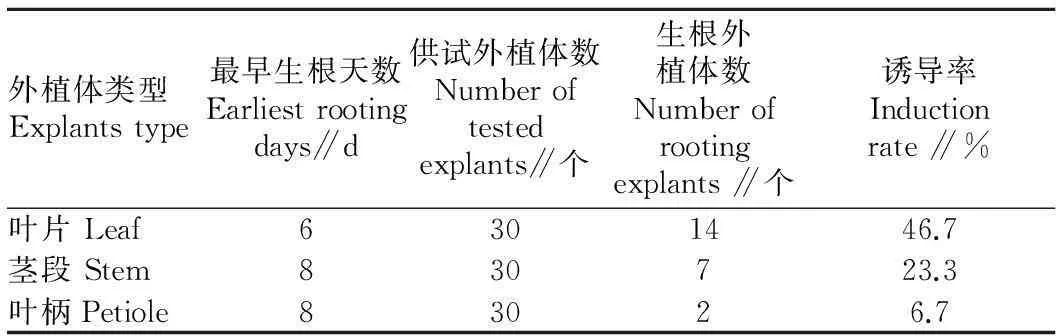
外植体类型Explantstype最早生根天数Earliestrootingdays∥d供试外植体数Numberoftestedexplants∥个生根外植体数Numberofrootingexplants∥个诱导率Inductionrate∥%叶片Leaf6301446.7茎段Stem830723.3叶柄Petiole83026.7

注:a.叶片;b.叶柄;c.茎段。Note: a. Leaf;b. Petiole;c. Stem induction. 图1 不同外植体诱导毛状根情况Fig.1 Situation of hairy roots of Ukraine S. nigrum induced by different explants
2.2不同发根农杆菌对乌克兰龙葵毛状根诱导率的影响由表2可知,3种发根农杆菌均能诱导出毛状根,诱导率差异不大,但 A4菌株毛状根的诱导率略高于其他2种菌株。A4的诱导率为53.3%;C58C1和A1476的诱导率分别为46.7%和43.3%。最早生根天数无明显差异。观察发现,A4菌株诱导的毛状根较其他2种菌株诱导的毛状根粗壮,密集(图2)。这表明不同发根农杆菌对乌克兰龙葵毛状根的诱导存在一定的影响。
表2不同发根农杆菌对乌克兰龙葵毛状根诱导率的影响
Table 2Effects of agrobacterium rhizogenes on the induction rate of hairy roots of UkraineS.nigrum

农杆菌类型Agrobacteriumtype最早生根天数Earliestrootingdays∥d供试外植体数Numberoftestedexplants∥个生根外植体数Numberofrootingexplants∥个诱导率Inductionrate∥%A46301653.3C58C16301446.7A14767301343.3
2.3不同侵染时间对乌克兰龙葵毛状根诱导率的影响由表3可知,侵染时间5 min时叶片的毛状根诱导率最高,为53.3%;侵染10和15 min的叶片毛状根诱导率分别为23.3%和10.0%,与侵染5 min的毛状根诱导率有显著差异,最早生根天数差异不大。这表明不同侵染时间对乌克兰龙葵毛状根的诱导存在较大影响。
表3不同侵染时间对乌克兰龙葵毛状根诱导率的影响
Table 3Effects of infection time on the induction rate of hairy roots of UkraineS.nigrum

侵染时间Infectiontimemin最早生根天数Earliestrootingdays∥d供试外植体数Numberoftestedexplants∥个生根外植体数Numberofrootingexplants∥个诱导率Inductionrate∥%57301653.310730723.315630310.0
2.4不同预培养时间对乌克兰龙葵毛状根诱导率的影响由表4可知,预培养2 d时叶片诱导率最高,为50.0%;不进行预培养的叶片诱导率最低,为33.3%;预培养3、4 d后叶片诱导率逐渐下降,分别为40.0%和36.7%。观察发现,预培养3 d后的叶片慢慢变黄,生命活力减弱,且最早生根天数无明显差异。这表明预培养时间过长过短均不利于马克兰龙葵毛状根的诱导。

注:a.A4;b.C58C1;c.A1476。Note: a.A4;b.C58C1;c.A1476. 图2 不同发根农杆菌诱导毛状根情况Fig.2 Situation of hairy roots of Ukraine S. nigrum induced by agrobacterium rhizogenes
Table 4Effects of precultivation days on the induction rate of hairy roots of UkraineS.nigrum

预培养天数Precultivationdaysd最早生根天数Earliestrootingdays∥d供试外植体数Numberoftestedexplants∥个生根外植体数Numberofrootingexplants∥个诱导率Inductionrate∥%06301033.317301446.726301550.036301240.047301136.7
2.5不同菌液浓度对乌克兰龙葵毛状根诱导率的影响由表5可知,菌液浓度OD600为0.6时,叶片诱导率最高,为56.7%;OD600为0.3和0.9时,诱导率分别为33.3%和13.3%。由此可知,菌液浓度过低或过高均影响诱导率,且高浓度诱导率较低。这表明菌液浓度对乌克兰龙葵毛状根的诱导存在一定的影响。
表5不同菌液浓度对乌克兰龙葵毛状根诱导率的影响
Table 5Effects of bacterial concentration on the induction rate of hairy roots of UkraineS.nigrum

菌液浓度BacterialconcentrationOD600最早生根天数Earliestrootingdays∥d供试外植体数Numberoftestedexplants∥个生根外植体数Numberofrootingexplants∥个诱导率Inductionrate∥%0.37301033.30.66301756.70.9630413.3
2.6不同共培养时间对乌克兰龙葵毛状根诱导率的影响由表6可知,共培养2 d时叶片的诱导率最高,为53.3%;叶片的诱导率随着共培养时间的延长呈先增后减的趋势。共培养4 d的叶片逐渐开始变黄,失去活力而死亡,最早生根天数无明显差异。这表明共培养天数对乌克兰龙葵毛状根的诱导存在一定的影响。
2.7乌克兰龙葵毛状根的PCR检测结果由图3可知,利用发根农杆菌诱导的毛状根均扩增出特异性条带,而未转化的乌克兰龙葵根则未扩增出条带,表明发根农杆菌的Ri质粒DNA已整合入乌克兰龙葵的毛状根基因组中。
表6不同共培养时间对乌克兰龙葵毛状根诱导率的影响
Table 6Effects of cocultivation days on the induction rate of hairy roots of UkraineS.nigrum

共培养天数Cocultivationdays∥d最早生根天数Earliestrootingdays∥d供试外植体数Numberoftestedexplants∥个生根外植体数Numberofrootingexplants∥个诱导率Inductionrate∥%0630723.31730826.727301653.33630930.04730620.0
3结论与讨论
合适的外植体是影响试验结果的一个重要因素。当细胞处于分裂期时才能与外源DNA整合[14],由于幼嫩叶片处于旺盛的分裂期,所以该试验选用乌克兰龙葵叶片作为外植体,保证了发根农杆菌与可被侵染细胞的接触,增加了生根的几率。

注:1、5、9为未转化的乌克兰龙葵根的阴性对照;2、3、4、6、7和8为转化的乌克兰龙葵毛状根;10为Ri质粒阳性对照。M为DNA分子量标准。Note: M. DNA Marker;1,5,9 were negative control of untransformed hairy roots of Ukraine S. nigrum;2,3,4,6,7 and 8 were transformed hairy roots of Ukraine S. nigrum;10 was positive control of Ri plasmid. 图3 乌克兰龙葵毛状根PCR扩增图谱Fig.3 PCR amplification hairy roots of Ukraine S. nigrum
该试验中3种发根农杆菌A4、C58C1、A1476均能诱导乌克兰龙葵外植体产生毛状根,而非农杆菌侵染的外植体则不能产生毛状根,这可能是由于龙葵为双子叶植物,对农杆菌较为敏感,更容易与其发生作用,所以普通发根农杆菌即可诱导出龙葵毛状根。
该试验结果表明,不同菌液浓度对毛状根的诱导也存在影响。当菌液浓度OD600为0.6时诱导率最高,浓度过低或过高诱导率反而下降。这可能是由于菌液浓度过低,菌液中的菌体数量较少,转化的概率降低;菌液浓度过高,菌体活力下降,侵染能力降低。同时菌液过多会附着在外植体上,加速叶片老化,不易生根。
共培培养时间同样是影响毛状根诱导的一个因素。共培养时间较短不利于农杆菌基因的转化,共培养时间过长导致外植体营养的过度缺乏,细胞活力降低,影响毛状根的生根率。适宜的共培养时间为2 d。
该试验结果发现,除菌培养基对毛状根的生长有很大影响。在共培养过程中,农杆菌会大量增殖,如不进行除菌会影响毛状根的正常生长,导致叶片褐化或死亡。但侵染后存活的叶片,均能长出毛状根。在农杆菌介导的植物基因转化中,共培养后需要利用抑菌性抗生素除去残留的农杆菌[15]。培养基的除菌用抗生素是目前常用的除菌方法,抗生素浓度过低除菌效果较差,浓度过高也会影响外植体的生长进而影响生根[16-17]。该试验结果表明,当共培养时间为2 d时,诱导效果较好,除菌MS培养基中加入头孢噻肟钠(400 mg/L)和羧苄青霉素(100 mg/L),保证了毛状根的正常生长。
毛状根培养系统克服了植物生长缓慢、有效成分积累不足的缺陷,具有不依赖外源植物激素,次生代谢物质合成能力较强,同时生产能力稳定等优点[18-19]。乌克兰龙葵毛状根诱导条件优化,有利于研究龙葵次生代谢产物,同时也为毛状根诱导提供了试验基础,利于天然药物的开发利用,但毛状根的扩大培养还有待于进一步研究。
参考文献
[1] 刘连芬,钱关泽.龙葵叶的组织培养[J].植物生理学通讯,2005,41(4):492.
[2] 徐东花,于春月,韩成花.龙葵的化学成分及药理作用研究[J].黑龙中医药,2007(2):46.
[3] SON Y O,KIM J,LIM J C. Ripe fruits of Solanum nigrumL. Inhibit cell growth and induces apoptosis in M C F-7 cel[J]l. Food and chemical taticology,2003,5(1): 1421-14275.
[4] YENG C,HSIEH C L.Evaluation of cytotoxicty,mutage-nicity and antimutagenicity of emerging edible plant[J]. Food and chemical taticology,2001,3(3):1045-10528.
[5] 卢汝梅,谭新武,周媛媛.龙葵的研究进展[J].时珍国医国药,2009,20(7):1821-1822.
[6] 吴晓凤,施和平,TSANG PO KEUNG ERIC. 褐脉少花龙葵毛状根的诱导、培养及其澳洲茄胺的产生[J].分子细胞生物学报,2008,41(3):183.
[7] 杨秀淦,高帅,王洪峰. Ri质粒诱导药用植物毛状根技术及应用[J].广东林业科技,2012,28(5):67-71.
[8] 姜伊娜,武天龙.毛状根的研究进展及应用[J].中国农业科技导报,2009,11(1):28.
[9] ARGOLO A C,CHARLWOOD B V,PLETSCH M. The regulationof solasodine production by Agrobacterium rhizogenes-transformed roots ofSolanumaviculare[J]. Planta Med,2000,66:448-451.
[10] 龚玉莲,施和平,李玲,等.少花龙葵毛状根的诱导和次生代谢物的产生[J]. 热带亚热带植物学报,2002,10(1):58-62.
[11] 谌金吾,孙一铭,王凤英,等. 三叶鬼针草毛状根的诱导及其对重金属Cd、Pb蓄积[J].环境科学学报,2015,35(5):1597-1600.
[12] 杨慧洁,杨世海.发根农杆菌介导的药用植物遗传转化研究[J].生物技术通报,2009(1):16-21.
[13] 王丽,刘琪,宁明明,等.龙葵毛状根诱导条件的研究[J]. 北方园艺,2015(4):107-108.
[14] 孟凡娟,王秋玉,谢立波,等.利用发根农杆菌诱导毛状根的研究[J].北方园艺,2008(12):12-13.
[15] 杨亚萍,李永兰,梁月荣,等. 发根农杆菌抑菌剂的抑菌效果及对茶组培苗丛生芽的影响[J].茶叶科学,2015,35(5):437.
[16] TIWARI R K,TRIVEDI M,GUANG Z C,et al.Agrobacteriumrhizogenesmediated transformation ofScutellariabaicialensisand production of flavonoids in hairy roots[J]. Biol Planta,2008,52(1):26-35.
[17] FLEM-BONHOMME V L,LAURAIN-MATTAR D,FLINIAUX M A. Hairy root induction ofPapaversomniferumvar.album,a difficult-to-transform plant,byA.rhizogensLBA9402[J]. Planta,2004,218(5):890-893.
[18] 辛萍,王有志,孙世芹.毛状根培养在植物化学成分和重组药物蛋白研究中的应用[J].时珍国医国药,2012,23(1): 2750.
[19] 张萌,高伟,王秀娟. 药用植物毛状根的诱导及其应用[J].中国中药杂志,2014,39(11):1956.
Optimization of Induction Condition of Hairy Roots of UkraineSolanumnigrumL.
LIU Qi, LIU Li-ye, LIU Jin-shuai, LI Xiu-xia*
(College of Life Sciences, Jiamusi University, Jiamusi, Heilongjiang 154007)
Abstract[Objective] To induce the hairy roots of Ukraine Solanum nigrum L. by the three agrobacterium rhizogenes A4, C58C1 and A1476, and to discuss the optimal condition of hairy roots induction of Ukraine S. nigrum. [Method] Using the plant tissue culture technology, we researched the effects of explants, strain, infection time, precultivation days, bacterium concentration and cocultivation days on the induction rate of hairy roots of Ukraine S. nigrum. [Result] Leaf was the best explants material;the three kinds of strains could all induce hairy root, but the highest was A4. The best bacterium concentration was OD600=0.6;the best time to infect was 5 min. Precultivation and cocultivation for 2 d could obtain the maximum induction rate.[Conclusion] Optimizing the induction conditions of hairy root provides technical references for the hairy root induction of other plants, and offers experiment basis for the medicinal component production by hairy roots.
Key wordsHairy roots induction;Solanum nigrum L.;Agrobacterium rhizogenes;Condition optimization
基金项目佳木斯大学大学生科技创新重点项目(XSYZ2014-001)。
作者简介刘琪(1994-),男,黑龙江大庆人,本科生,专业:生物科学。*通讯作者,博士,教授,从事植物资源学与生物技术等研究。
收稿日期2016-02-08
中图分类号S 567.21
文献标识码A
文章编号0517-6611(2016)08-128-04
