湿法消解火焰原子吸收法测定黄土复合污染修复植物金盏菊幼苗中的铅和镉
2016-06-15范春辉张颖超高雅琳
范春辉, 杜 波, 张颖超, 高雅琳, 常 敏
1. 陕西科技大学环境科学与工程学院, 陕西 西安 710021
2. 清华大学环境学院, 北京 100084
湿法消解火焰原子吸收法测定黄土复合污染修复植物金盏菊幼苗中的铅和镉
范春辉1, 杜 波1, 张颖超2, 高雅琳1, 常 敏1
1. 陕西科技大学环境科学与工程学院, 陕西 西安 710021
2. 清华大学环境学院, 北京 100084
原子吸收光谱法(AAS)广泛应用于重金属分析检测领域, 优化测试过程的操作条件, 进而保障分析结果的稳定性和重现性, 直接关系到预期研究目标的有效实现, 建立精准的检测方法往往成为科学研究的首要任务。 以金盏菊为黄土区Pb/Cd复合污染修复植物, 采用湿法消解-AAS法测定金盏菊幼苗体内Pb/Cd含量, 分析所得结果初步揭示金盏菊幼苗对Pb/Cd的富集效应。 研究发现: 湿法消解-AAS法对Pb/Cd的检出限分别为0.104和0.007 mg·L-1, Pb/Cd回收率对应于94.33%~110.78%和97.73%~107.50%之间, 同一样品重复测定(6次)的相对标准偏差(RSD)波动于4.11%~4.75%(Pb)和1.11%~2.77%(Cd), 表明该方法准确度较好, 精密度较高。 金盏菊幼苗对Pb的富集能力不强, 这可能与Pb的电负性、 植物生长周期较短及环境因子等因素有关; 但在黄土Cd浓度为50 mg·kg-1时, 金盏菊幼苗对Cd的平均富集量已达到104.85 mg·kg-1。 此外, 黄土Pb的共存一定程度上促进了金盏菊幼苗对Cd的吸收, 其间可能存在协同作用。 所建立的分析方法可以对金盏菊幼苗Pb/Cd含量进行有效检测, 预期能为后续研究提供技术支持和质量保障。
原子吸收光谱法; Pb; Cd; 金盏菊; 植物修复; 黄土
引 言
植物修复是20世纪80年代初期发展起来的污染场地修复技术, 目前已成为土壤修复的主流技术[1]。 迄今为止, 根据野外采集样本分析, 全球大约发现了500种超富集植物, 包括印度芥菜、 海州香薷、 蜈蚣草等。 金盏菊(Calendulaofficinalis)是常见的观赏花卉, 其对土壤重金属同样表现出较强的耐性和富集潜力[2]; 此外, 金盏菊直接进入食物链的概率较低, 这为土壤重金属的净化修复提供了“双保险”(效果好, 风险低)。 但在特定时空条件下, 如何精准地对金盏菊体内重金属进行定量分析, 关系到植物修复方案制定、 过程操控条件优化、 场地修复效果评价等诸多方面, 已经成为亟待解决的重要问题。
重金属修复植物体内重金属的检测方法包括电感耦合等离子体法(ICP-AES)、 紫外可见吸收光谱法(UV-Vis)、 原子荧光光谱法(AFS)、 原子吸收光谱法(AAS)等[3], 但这些方法各有利弊: 比如ICP-AES的启动和运转需要消耗大量氩气, 费用极高, 推广应用难度大; UV-Vis的测定条件不易控制, 过程干扰因素较多; AFS的分析过程可能涉及荧光淬灭效应、 散射光干扰等问题。 相比之下, AAS法灵敏度高、 选择性强、 精密度好, 其在分析检测领域的应用范围更加广泛[4]。
研究中曾以土壤圈中分布面积最广和毒性最大的重金属类污染物Pb/Cd为去除目标, 探讨了金盏菊幼苗对Pb/Cd复合污染黄土的植物修复效果。 本文旨在建立并评价湿法消解-AAS法检测金盏菊体内Pb/Cd的可行性, 分析此法的检出限、 精密度和回收率, 同时初步揭示金盏菊幼苗对Pb/Cd的富集效应, 以期为后续深入研究提供参考和借鉴。
1 实验部分
1.1 仪器和试剂
偏振塞曼原子吸收光谱仪(Z-2000, HITACHI), 电热鼓风干燥箱(WGL-125B, TAISITE), 控温式远红外消煮炉(LWY848, 四平电子); 桶装纯净水, 其余化学试剂均为优级纯。
1.2 样品制备
向黄土样品中喷洒Pb(NO3)2和CdCl2溶液, 充分搅拌使黄土润湿并混合均匀, 配制模拟Pb/Cd复合污染黄土。 Pb/Cd浓度的设定参考黄土(中)重度污染区域现状、 同类研究及《土壤环境质量标准(GB 15618-1995)》等依据, 黄土老化时间为15 d, 黄土Pb/Cd添加方案见表1。
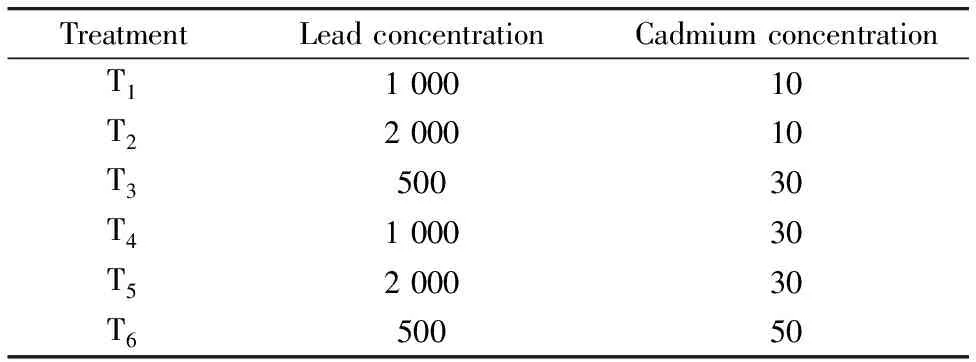
表1 模拟污染黄土Pb/Cd添加量/(mg·kg-1)
为了获得合适的幼苗期金盏菊样品, 采用盆栽土培试验进行培养。 其中盆栽容器为45 cm×20 cm×15 cm的矩形塑料盆, 每盆装有模拟污染黄土(6.0±0.1)kg。 依次向黄土中均匀施加尿素、 磷酸二氢钠和氯化钾, 三种底肥添加量分别为0.4, 0.2和0.3 g·kg-1黄土。 盆栽植物为金盏菊, 播种时间为2014年10月1日, 每盆均匀播种20粒, 置于室外天然光照条件下培养, 定期以纯净水(水中未检出重金属)浇灌, 维持黄土含水量为田间持水量的70%。 从播种之日起, 经过50 d培养收获金盏菊幼苗, 纯净水洗净后于105 ℃烘箱中杀青(30 min)、 烘干(70 ℃)至恒重, 所得金盏菊幼苗样品于玛瑙研钵中磨成粉末后备用。
1.3 样品消解和检测
将1.2节制得的样品粉末置于消煮管中, 依次加入20 mL HNO3和4 mL HClO4, 常温静置12 h后, 在控温式远红外消煮炉上消解至白烟基本消尽。 将冷却后的消解液转移至容量瓶, 纯净水定容后摇匀备用。 采用原子吸收光谱仪测定样品Pb/Cd含量[5], 仪器为空气-乙炔火焰, 乙炔气体压力160 kPa, 其他工作参数见表2。 同时, 计算金盏菊幼苗对Pb/Cd的生物富集系数(BCF)。

表2 原子吸收光谱仪工作条件
1.4 质量控制
所用玻璃器皿使用前均经10% HNO3浸泡24 h, 经纯净水洗净后备用。 原子吸收光谱仪的运行条件经过多次摸索; 仪器经过充分预热, Pb/Cd含量检测在最佳工作条件下进行, 确保基线不漂移和测定过程的平稳性。 测定标准曲线及其他样品时, 每个样品平行测定三次, 同时按照Pb/Cd浓度从小到大的顺序检测, 以尽量消除仪器自身的记忆效应。
2 结果与讨论
2.1 标准曲线
实验条件下测得的Pb/Cd标准曲线如图1和表3所示。 Pb的标准曲线为A=0.001 5c-1.0×10-4, 相关系数r为0.999 3; Cd的标准曲线为A=0.021 8c+2.9×10-5, 相关系数r为0.999 9;Pb/Cd标准曲线的线性范围较宽。 说明在实验条件下,Pb/Cd溶液浓度与吸光度线性关系良好, 能够满足实验的基本要求。
2.2 检出限
在既定实验条件下, 连续测定空白样品溶液11次, 用吸光度信号标准偏差的3倍与对应斜率的比值作为分析方法检出限[6]。 经计算可知, 本研究中原子吸收光谱Pb/Cd的检出限分别为0.104和0.007mg·L-1, 说明本方法对Cd的检测灵敏度更高, 预期能够有效识别金盏菊幼苗Pb/Cd含量。
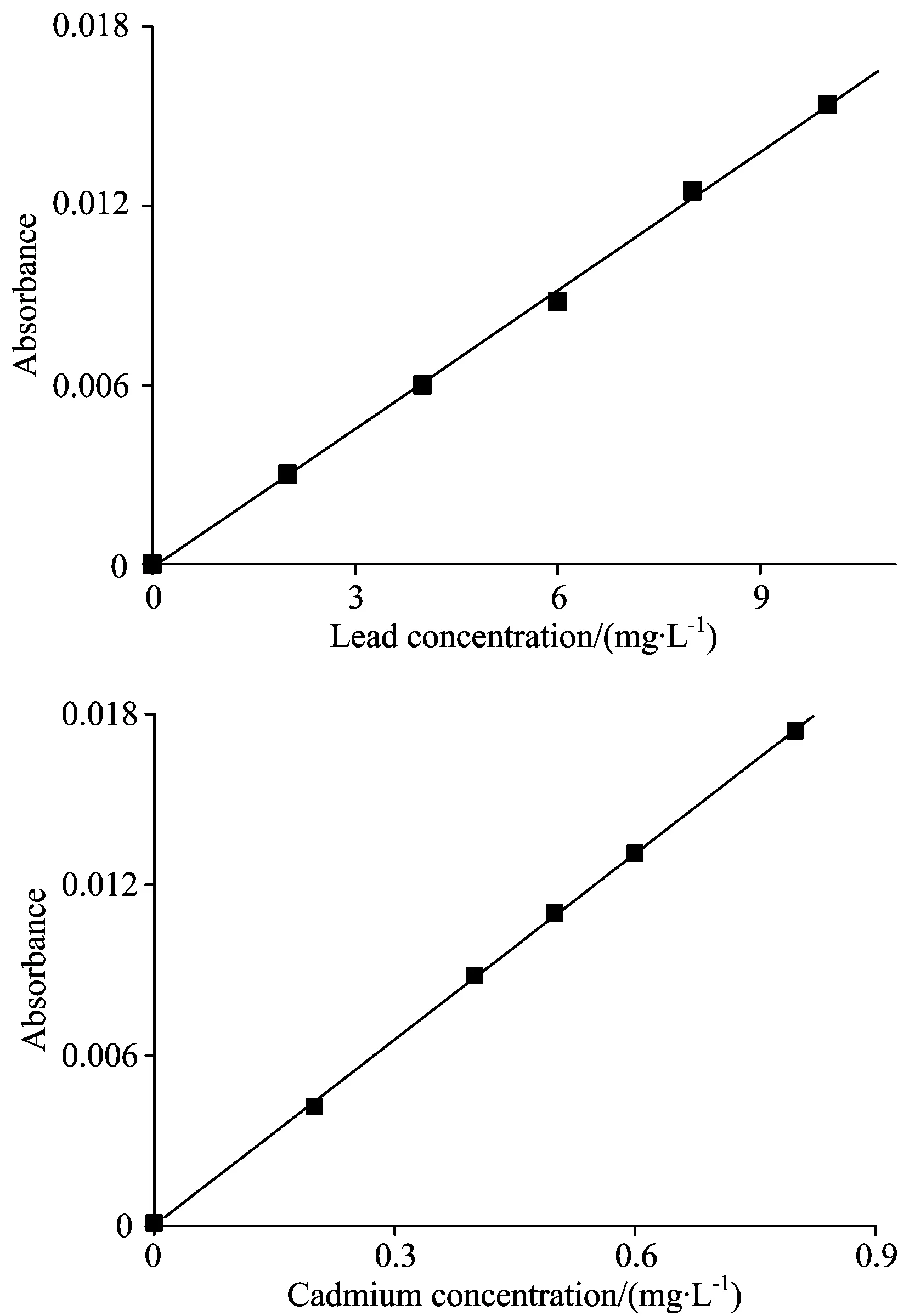
图1 Pb/Cd标准曲线
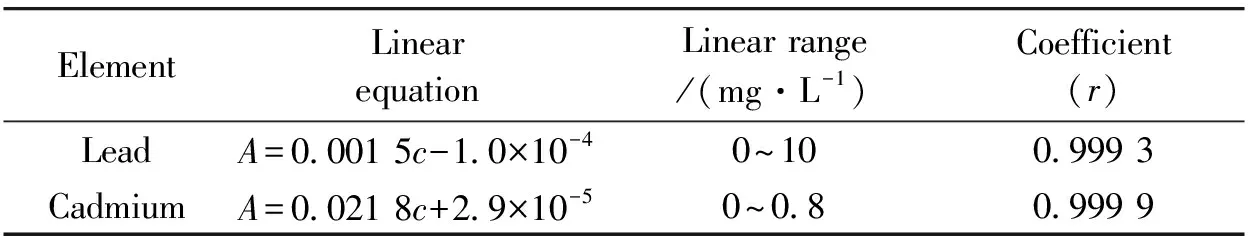
ElementLinearequationLinearrange/(mg·L-1)Coefficient(r)LeadA=0 0015c-1 0×10-40~100 9993CadmiumA=0 0218c+2 9×10-50~0 80 9999
2.3 回收率
结合土壤污染实际情况和黄土地区污染水平, 选取T1处理组消解液进行加标回收实验, 各加标水平重复实验6次, 得到的Pb/Cd回收率结果见表4。 总体上看, Cd的回收率略好(97.73%~107.50%), 说明原子吸收光谱法准确度较高; 相对标准偏差(RSD)波动于1.11%~2.77%, 显示该方法的精密度较好; 而Pb的回收率在94.33%~110.78%之间, RSD在4%左右, 其准确度和精密度都不如Cd, 但其检测结果也是可以接受的。 综上所述, 认为湿法消解火焰原子吸收光谱法能够对Pb/Cd含量进行有效定量检测。
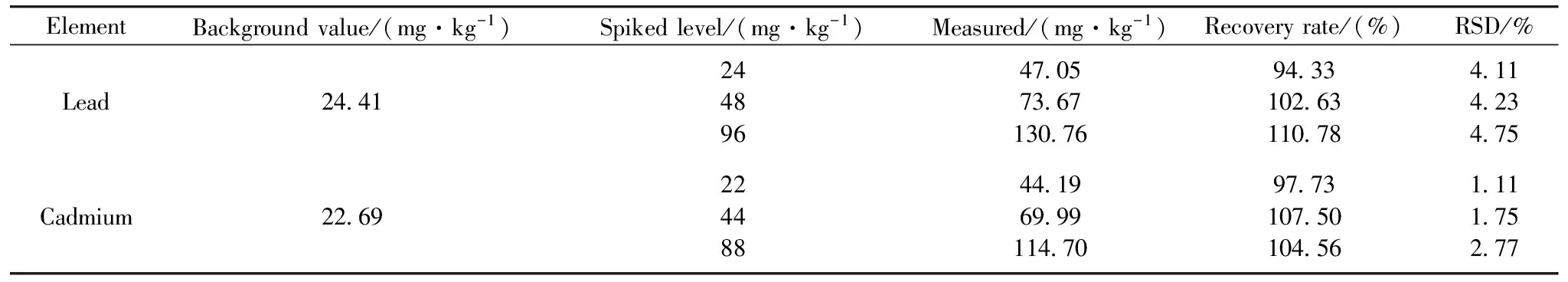
表4 样品Pb/Cd的回收率(n=6)
2.4 金盏菊幼苗对Pb/Cd的富集效应
基于上述建立的原子吸收光谱法, 初步探讨金盏菊幼苗对Pb/Cd复合污染黄土的修复效果, 结果如表5所示。 总体上看, 金盏菊幼苗对Pb/Cd污染都有较强的富集效果, 但对Pb/Cd胁迫的响应度略有不同。 金盏菊幼苗对黄土Pb的富集量与Pb浓度密切相关: 随着黄土样品Pb含量的不断增加, 金盏菊幼苗对Pb的富集量也随之上升。 比如, T2和T5实验组的Pb含量均为2 000 mg·kg-1(详见表1, 下同), 对应的Pb富集量均值为28.08和35.03 mg·kg-1; 当黄土Pb浓度降为500 mg·kg-1(T3和T6组)时, 金盏菊幼苗体内Pb含量降为15.90和21.36 mg·kg-1。 这可能与重金属种类和形态、 植物种类和生物量、 环境背景值等因素有关[7]。 但若以生物富集系数(BCF)为衡量指标, 发现实验条件下金盏菊幼苗对Pb的富集系数普遍较小(0.014~0.043), 说明金盏菊幼苗对Pb的富集能力较差, 这可能与Pb的电负性有关: Bradl[8]曾发现Pb在土壤中易与碳酸盐和Fe与Mn等化合物形成共价键, 导致其很难被植物高效吸收。

表5 不同条件下金盏菊幼苗体内Pb/Cd含量(mg·kg-1) 及富集系数
注: RSD(相对标准偏差), BCF(生物富集系数), 金盏菊体内Pb/Cd含量×100%/黄土Pb/Cd含量
相比之下, 金盏菊幼苗对Cd的富集效果更好: 在黄土Cd浓度为50 mg·kg-1(T6组)时, Cd的平均富集量为104.85 mg·kg-1, 基本达到超富集植物标准[9]。 实验条件下Cd的BCF参数值波动于2.097~4.919之间, 明显高于同等条件下Pb的BCF值, 暗示了金盏菊可能对黄土Cd污染的修复潜力更大。 值得注意的是, 随着黄土Cd含量的增加, 对应的BCF值总体下降; 在黄土Cd浓度为50 mg·kg-1时, BCF降到最低为2.097。 这可能源于黄土高浓度Cd胁迫严重干扰了金盏菊幼苗的正常生长, 进而直接或间接抑制其对Cd的吸收累积。 深入对比Pb/Cd对金盏菊幼苗富集效果的影响, 发现黄土Pb浓度的增加有助于提高金盏菊幼苗对Cd的富集量。 这说明黄土中与Pb的共存不但没有抑制对Cd的竞争吸收, 反而促进了金盏菊幼苗对Cd的富集, 这可能与重金属污染物性质、 植物自身特质及生态环境因子等有关, 其中不排除协同作用的存在[10], 尚需进一步深入研究。 此外, 不同实验处理组测定结果的相对标准偏差(RSD)均介于0.10%~3.95%, 验证了湿法消解火焰原子吸收法对本研究的适用性和有效性。
3 结 论
湿法消解火焰原子吸收光谱法能够对金盏菊幼苗中的Pb/Cd进行有效检测。 该方法对Pb/Cd的检出限分别为0.104和0.007 mg·L-1; 相比之下, 对Cd的检测灵敏度更高。 实验条件下Pb/Cd回收率分别为94.33%~110.78%和97.73%~107.50%, 表明该方法准确度较好, 精密度较高。 在黄土Cd浓度为50 mg·kg-1时, 金盏菊幼苗对Cd的平均富集量达到104.85 mg·kg-1; 但其对Pb的富集能力不强, 这可能与Pb的电负性、 金盏菊生长周期较短及生态环境因子等有关。 本研究建立的检测方法是有效、 可行的, 预期能为后续分析检测提供支持和保障。
[1] Chaney R L, Malik M, Li Y M, et al. Current Opinions in Biotechnology, 1997, 8: 279.
[2] Loescher C M, Morton D W, Razic S, et al. Journal of Pharmaceutical and Biomedical Analysis, 2014, 98: 52.
[3] Vigil M, Marey-Pérez M F, Huerta G M, et al. Science of the Total Environment, 2015, 505: 844.
[4] Roccotiello E, Serrano H C, Mariotti M G, et al. Chemosphere, 2015, 119: 1372.
[5] BAO Shi-dan(鲍士旦). Agrochemistry Analysis(土壤农化分析), 3rd Edition(3版). Beijing: China Agriculture Press(北京: 中国农业出版社), 2005. 373.
[6] MacDougall D, Crummett W B. Analytical Chemistry, 1980, 52: 2242.
[7] Mani D, Kumar C, Patel N K. Ecotoxicology and Environmental Safety, 2015, 111: 86.
[8] Bradl H B. Journal of Colloid and Interface Science, 2004, 277: 1.
[9] Ali H, Khan E, Sajad M A. Chemosphere, 2013, 91: 869.
[10] Liu J N, Zhou Q X, Sun T, et al. Journal of Hazardous Materials, 2008, 151: 261.
Determination of Lead and Cadmium inCalendulaOfficinalisSeedlings for Phytoremediation of Multi-Contaminated Loess by Using Flame Atomic Absorption Spectrometry with Wet Digestion
FAN Chun-hui1, DU Bo1, ZHANG Ying-chao2, GAO Ya-lin1, CHANG Min1
1. School of Environmental Science & Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China
2. School of Environment, Tsinghua University, Beijing 100084, China
Atomic absorption spectrometry (AAS) is widely used in the analysis and detection of heavy metals. The optimal operation conditions on metals detection are important for the stabilization and repeatability of scientific research, which affects the expected investigation objectives greatly. Thus, it becomes a key issue to establish appropriate detection methods in scientific works.Calendulaofficinaliswas used for lead/cadmium remediation in contaminated loess, and the flame atomic absorption spectrometry (FAAS) with wet digestion was applied to analyze the contents of lead/cadmium inCalendulaofficinalisseedlings. The investigation data was further studied to reveal the bioaccumulation efficiency of lead/cadmium inCalendulaofficinalisseedlings. The results showed: the limits of detection are 0.104 and 0.007 mg·L-1for lead and cadmium; the recovery rates of lead and cadmium are from 94.33% to 110.78% and 97.73% to 107.50% respectively. The relative standard deviations (RSD) are between 4.11% and 4.75% for lead while between 1.11% and 2.77% for cadmium, and It’s been proved that the method is accurate and reliable. The low accumulation efficiency of lead withCalendulaofficinalisseedlings might be related to the electronegativity of lead while the growth period ofcalendulaofficinalisseedlings and environmental factors. The accumulation content of cadmium is 104.85 mg·kg-1with cadmium concentration of 50 mg·kg-1. The co-existing of lead in loess is positive for cadmium accumulation byCalendulaofficinalisseedlings, and the synergistic effect might work in the process. The established detection method is effective for quantitative analysis of lead and cadmium incalendulaofficinalisseedlings and significant for future research.
Atomic absorption spectrometry (AAS); Lead; Cadmium;Calendulaofficinalis; Phytoremediation; Loess
Jan. 14, 2015; accepted May 18, 2015)
2015-01-14,
2015-05-18
国家自然科学基金项目(21407103), 中国博士后科学基金项目(2012M511968)和陕西科技大学科研基金项目(2014xhbz-06)资助
范春辉, 1982年生, 陕西科技大学环境科学与工程学院讲师 e-mail: frank_van391@163.com
X53
A
10.3964/j.issn.1000-0593(2016)08-2625-04
