黄土区金盏菊幼苗对Pb/Cd次生非生物胁迫响应的红外光谱研究
2016-06-15范春辉张颖超高雅琳
范春辉, 常 敏, 张颖超, 高雅琳
1. 陕西科技大学环境科学与工程学院, 陕西 西安 710021
2. 清华大学环境学院, 北京 100084
黄土区金盏菊幼苗对Pb/Cd次生非生物胁迫响应的红外光谱研究
范春辉1, 常 敏1, 张颖超2, 高雅琳1
1. 陕西科技大学环境科学与工程学院, 陕西 西安 710021
2. 清华大学环境学院, 北京 100084
植物修复法是重金属污染场地修复的重要手段, 这种“绿色修复技术”得到了学者们的广泛关注和期待。 在重金属胁迫条件下, 植物自身会出现相应的响应反映, 进而逐渐适应并有效减缓重金属的直接毒害作用。 这种微尺度的调控行为往往多维度和不可见, 需要借助精密仪器分析技术加以剖析。 现阶段, 相关方面的研究还略显欠缺。 以黄土修复植物金盏菊幼苗为研究对象, 分析Pb/Cd复合胁迫对其表观形貌的影响, 采用傅里叶变换红外光谱法(FTIR)识别其地下和地上部分样本的官能团性质, 初步推断金盏菊对Pb/Cd胁迫的响应途径和耐受机制。 研究表明: 随着Pb/Cd胁迫程度的加剧, 金盏菊根冠弯曲萎缩, 根毛数量明显减少, 而其地上部分形貌差异很小。 Pb/Cd胁迫对金盏菊幼苗地下和地上部分的FTIR图谱影响较大: 3 573 cm-1附近的—OH峰强减弱且发生移动, 随着Pb/Cd胁迫浓度的增加, 峰形更趋复杂化; 这表明Pb/Cd与—OH间存在配位结合效应, Pb/Cd胁迫干扰了有机物的合成和分泌。 饱和C—H振动峰整体红移, 可能与细胞膜的膜脂氧化程度有关。 1 631和1 574 cm-1处吸收峰强下降, 说明与之关联的蛋白质组分特性可能有异。 1 385 cm-1处峰位有所偏移, 推测金盏菊通过改变果胶质和油脂的甲基化程度, 完成细胞组织对Pb/Cd胁迫的“直接排斥→逐步适应→增强抗逆性”的过程转变。 FTIR对于识别土壤重金属的植物修复机制具有重要指导意义。
FTIR; 金盏菊; 黄土; Pb/Cd胁迫
引 言
植物修复是利用植物来移除、 容纳或分解土壤污染物(重金属、 有机物等), 进而恢复土壤生态功能的净化过程。 自20世纪90年代以来, 应用植物修复法处理土壤重金属污染已成为环境治理领域的前沿性课题[1]。 理论上来讲, 每种植物或多或少都有吸收重金属的能力, 但目前全球仅发现500余种超富集植物(对重金属吸收量超过一般植物100倍以上), 这些植物对重金属都有较强的忍耐和抵抗能力。 Clemens[2]认为: 植物对土壤重金属的解毒机制包括可控吸收、 螯合固定、 胞内分隔、 生化隐忍和平衡调控等方面。 但鉴于植物体系新陈代谢的复杂性以及微观研究的不确定性, 重金属解毒的响应途径和调控机制尚不十分明晰。 这也成为学者们关注的热点问题。
植物在受到土壤重金属胁迫和毒害时, 往往会伴随一系列的应激响应, 比如叶片萎蔫、 组织坏死、 局部畸形或无花无果等。 这些表观病态较易发现, 但植株内部的生理生态变化过程较难察觉, 需要借助先进的微尺度分析手段精准识别。 傅里叶变换红外光谱(FTIR)就是其中的一类重要工具[3]。 FTIR的分析对象侧重于物质分子的化学键和官能团信息, 能从量子化学层面提供重要的检测证据。 近几年, 诸多学者开始研究重金属胁迫对植物体FTIR的影响, 证实了FTIR应用的可行性和优越性[4-5]; 这也从较新角度阐释了植物体对重金属胁迫的抗性机制, 为同类研究提供了很有价值的第一手数据。
金盏菊(Calendulaofficinalis)是常见的观赏花卉, 对土壤重金属表现出较强的富集潜力[6]; 其直接进入食物链的概率较低, 这与土壤修复原则(效果好, 风险低)具有很好的契合度。 前期笔者研究了金盏菊幼苗对黄土区Pb/Cd复合污染的修复效果, 建立了金盏菊体内Pb/Cd定量分析的湿法消解-火焰原子光谱法。 本文重点分析Pb/Cd次生非生物胁迫对金盏菊幼苗FTIR性质的影响, 推断可能存在的响应途径和规避机制, 力图为后续研究提供参考和借鉴。
1 实验部分
1.1 仪器和试剂
电热鼓风干燥箱(WGL-125B, TAISITE), 台式扫描电子显微镜(TM-1000, HITACHI), 傅里叶变换红外光谱仪(VECTOR-22, BRUKER)。 实验用水为桶装纯净水, KBr为光谱纯, Pb(NO3)2和CdCl2等其余化学试剂均为优级纯。
1.2 方法
1.2.1 污染黄土制备
所用黄土取自陕西科技大学教学区南侧树林-草坪植被带[7]。 向黄土样品中喷洒Pb(NO3)2和CdCl2溶液, 充分搅拌使黄土润湿并混合均匀, 配制模拟Pb/Cd复合污染黄土, 黄土老化时间为15 d。 实验设计黄土Pb浓度为0, 500, 1 000, 2 000 mg·kg-1, Cd浓度为0, 10, 30, 50 mg·kg-1; 选取其中代表性的三组浓度梯度组合作为黄土基质, 具体方案见表1。
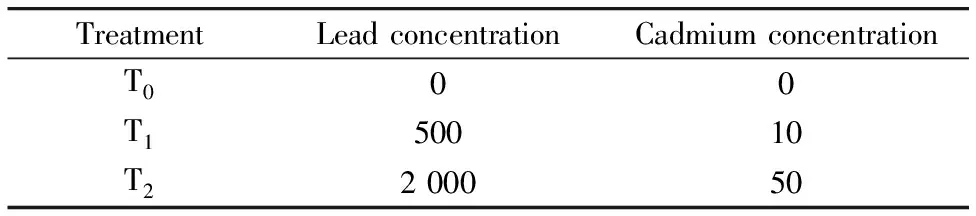
表1 模拟污染黄土Pb/Cd添加量/(mg·kg-1)
1.2.2 金盏菊幼苗培养
金盏菊种子购自西安三色园艺有限责任公司; 为了获得合适的金盏菊幼苗, 采用盆栽土培实验进行培养。 其中盆栽容器为45 cm×20 cm×15 cm的矩形塑料盆, 每盆装有模拟污染黄土(6.0±0.1)kg; 依次向黄土中均匀施加尿素、 磷酸二氢钠和氯化钾, 三种底肥添加量分别为0.4, 0.2和0.3 g·kg-1黄土。 金盏菊播种时间为2014年10月1日, 每盆均匀播种20粒, 置于室外天然光照条件下培养, 定期以纯净水(水中未检出重金属)浇灌, 维持黄土含水量为田间持水量的70%。 从播种之日起, 经过45 d的培养收获金盏菊幼苗。
1.3 分析方法和质量控制
金盏菊幼苗生长周期较短(45 d), 故没有将金盏菊的根、 茎和叶三部分做精细区分研究, 而以地下和地上部分为检测对象。 收获后的金盏菊幼苗以纯净水漂洗3次, 用刀片将其截成地下和地上两部分; 再将得到的地下和地上部分分别纵向剖切, 使其断面组织形态暴露; 直接将所得鲜样粘附于导电胶带上进行形貌观察, 以尽量降低脱水定形、 冷冻干燥、 喷金镀膜等操作对样品形貌的干扰。 为了保证SEM观察的针对性和高效性, 金盏菊幼苗地下和地上部分的放大倍数分别为×500和×1 000倍。
另取一份纯净水洗净后的金盏菊幼苗于105 ℃干燥箱中杀青(30 min)、 烘干(70 ℃)至恒重, 所得样品于玛瑙研钵中磨成粉末备用。 FTIR测试采用KBr压片法, 扫描范围4 000~400 cm-1, 分辨率2 cm-1, 扫描累加次数为32次, 样品与KBr的质量比约为1∶100。 玻璃器皿使用前均经10% HNO3浸泡24 h, 纯净水洗净后备用。 所得数据采用Origin 6.0软件处理和绘图。
2 结果与讨论
2.1 SEM
Pb/Cd复合胁迫对金盏菊幼苗地下和地上部分表观形貌的影响如图1所示。 总体上看, 地下部分样本的根毛浓密圆润、 数量较多, 地上部分没有发现绒毛或类似附属物存在; 除此之外, 地下和地上部分基本没有明显的、 稳定的区别特征。 对金盏菊地下部分样本横向比较, 发现Pb/Cd胁迫的干扰效应较大。 随着胁迫程度的加剧(T0→T1→T2), 地下部分根冠弯曲、 严重萎缩, 根毛皱折、 粗细不均, 根毛数量明显减少; 而地上部分的表观形态差异不大, 截面纹路清晰, 偶现腺毛类附属物, 可初步识别出维管束和纤维束, 纤维壁较薄。 造成这种形貌差异的原因可能与金盏菊生长周期较短有关, 也可能是Pb/Cd胁迫对金盏菊幼苗(尤其是地下部分)毒害作用的直接反映。

图1 黄土Pb/Cd胁迫对金盏菊幼苗地下和地上部分表观形貌的影响
2.2 FTIR
2.2.1 地下部分

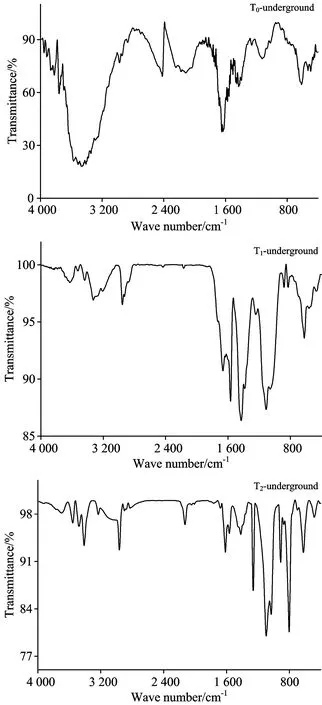
图2 黄土Pb/Cd胁迫对金盏菊幼苗地下部分FTIR的影响
Fig.2 FTIR spectra of underground parts ofCalendulaofficinalisseedlings under lead and cadmium stress in loess

图3 黄土Pb/Cd胁迫对金盏菊幼苗地上部分FTIR的影响
相比之下, Pb/Cd复合胁迫对金盏菊幼苗地下部分FTIR图谱的影响较大。 其中位于3 573 cm-1附近的—OH峰强减弱, 此处原有的宽大吸收峰变为若干弱峰, 峰形变窄; 随着Pb/Cd胁迫浓度的增加, 该吸收区间的峰形趋于复杂化; 这说明地下部分相关组分的微观行为较为活跃, 推测可能是Pb/Cd胁迫促进了金盏菊根系分泌物(多糖、 蛋白质、 脂类等)的生成, 进而有效抵抗和适应不良坏境, 同时也不排除Pb/Cd与—OH间的配位结合效应导致吸收峰的性质差异[8]。 2 976和2 870 cm-1处的吸收峰发生整体红移, 但峰形变化不大, 这可能与细胞膜的膜脂过氧化程度有关, 也可能存在有机酸类分泌物与Pb/Cd结合能力周期性变化的贡献[9]。 1 631和1 574 cm-1处的吸收峰略有变化, 表明Pb/Cd胁迫导致金盏菊幼苗细胞壁和细胞膜受到破坏, 与之相关联的蛋白质组分特性可能有异。 1 324 cm-1处的峰强减弱暗示了油脂化合物甲基化程度的改变, 这种变化有助于增强金盏菊幼苗根际圈对Pb/Cd胁迫的抗逆性和适应性, 是植物自解毒效应的体现[10]。
2.2.2 地上部分
金盏菊幼苗地上部分的FTIR图谱如图3所示。 3 500 cm-1附近的吸收峰值变化较大, 表明Pb/Cd胁迫与—OH发生吸附结合, 导致样品氢键含量减少; T1实验组的自由羟基(O—H, 3 558 cm-1)和分子间氢键(O—H, 3 232 cm-1)的伸缩振动效应更易识别, 可能源于Pb/Cd干扰下的羟基耦合效应[11]。 随着Pb/Cd胁迫浓度的增加, 该区域吸光度先降低(T1)后升高(T2)。 这说明较低浓度的Pb/Cd胁迫可能抑制了有机物的合成和分泌, 而Pb/Cd的高度胁迫则促进了有机物的分泌和运输[12]; 有机物的大量分泌能够形成“缓冲屏障”, 有效缓解Pb/Cd对植物细胞的界面毒害效应, 这种有机物分泌及渗透作用的规律性变化有助于增强植物对Pb/Cd胁迫的适应性和抗逆性[13]。 2 925 cm-1附近(T0)的饱和C—H吸收峰定位于2 923 cm-1处(T1和T2), 峰形变化较小, 说明Pb/Cd胁迫对地上部分的运输功能和细胞过氧化程度干扰很小。 1 637 cm-1处的特征峰值有所下降, 表明Pb/Cd胁迫导致蛋白质肽键间氢键结合力减弱, 促进了相关蛋白的诱导合成, 这可能与金盏菊适应Pb/Cd胁迫的自我调控过程有关[14]。 1 385 cm-1处(T0)的吸收峰分别移动到1 383 cm-1(T1)和1 387 cm-1处(T2), 推测细胞组织通过改变果胶质和油脂的甲基化程度, 影响金盏菊幼苗对Pb/Cd的富集行为, 可以认为是金盏菊对Pb/Cd胁迫的“直接排斥→逐步适应→增强抗逆性”的动态适应过程。 此外, 在1 060和892 cm-1等处的波峰差异同样暗示了糖类组分的调控贡献[15]。
植物修复法是最有前途的重金属污染场地修复技术之一, 在超富集植物筛选、 植物抗性驯化、 修复分子机制等方面有很大的发掘潜力[16]。 本研究初步揭示了Pb/Cd复合胁迫对金盏菊幼苗地下和地上部分FTIR光谱的影响; 但对于胁迫过程的应答途径和自我调控策略, 本文的说服力还远远不够。 因此, 下一步要对胁迫响应机制进行深入解析, 拟将XAFS, MS, INNA等技术和金属组学、 蛋白质组学、 基因组学等方法学研究相结合, 全面识别Pb/Cd在金盏菊不同组织器官的微分布、 分子形态和亚细胞结构。 同时, 鉴于细胞壁是植物抵抗重金属胁迫的首要屏障, 有必要深入研究植物细胞壁与重金属富集的代谢通路和信号传导机制, 为超富集植物的基因改造和基因修饰提供微尺度证据。
3 结 论

[1] Ali H, Khan E, Sajad M A. Chemosphere, 2013, 91: 869.
[2] Clemens S. Planta, 2001, 212: 475.
[3] Mularczyk-Oliwa M, Bombalska A, Kaliszewski M, et al. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2012, 97: 246.
[4] Alonso-Simón A, Encina A E, García-Angulo P, et al. Plant Science, 2004, 167: 1273.
[5] Abidi N, Cabrales L, Haigler C H. Carbohydrate Polymers, 2014, 100: 9.
[6] Liu J N, Zhou Q X, Sun T, et al. Journal of Hazardous Materials, 2008, 151: 261.
[7] FAN Chun-hui, ZHANG Ying-chao, WANG Xiao-na, et al(范春辉, 张颖超, 王晓娜, 等). Spectroscopy and Spectral Analysis(光谱学与光谱分析), 2014, 34(4): 1035.
[8] Schmohl N, Horst W J. Plant, Cell and Environment, 2000, 23: 735.
[9] Yang J, Yen H E. Plant Physiology, 2002, 130: 1032.
[10] Zurayk R, Sukkariyah B, Baalbaki R. Water, Air, and Soil Pollution, 2001, 127: 373.
[11] Alam M J, Ahmad S. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 136: 961.
[12] Bidwell S D, Woodrow I E, Batianoff G N, et al. Functional Plant Biology, 2002, 29: 899.
[13] Horst W J, Fecht M, Naumann A, et al. Journal of Plant Nutrition and Soil Science, 1999, 162: 263.
[14] Didierjean L, Frendo P, Nasser W, et al. Planta, 1996, 199: 1.
[15] Kanokkantapong V, Marhaba T F, Panyapinyophol B, et al. Journal of Hazardous Materials, 2006, 136: 188.
[16] Yang X E, Feng Y, He Z L, et al. Journal of Trace Elements in Medicine and Biology, 2005, 18: 339.
FTIR Analysis of Secondary Abiotic Stress Response of
CalendulaOfficinalisSeedlings to Lead and Cadmium in Multi-Contaminated Loess
FAN Chun-hui1, CHANG Min1, ZHANG Ying-chao2, GAO Ya-lin1
1. School of Environmental Science & Engineering, Shaanxi University of Science & Technology, Xi’an 710021, China
2. School of Environment, Tsinghua University, Beijing 100084, China
As an environmentally-friendly technology attracting great attention from current researchers, phytoremediation is significant for site remediation contaminated by heavy metals. The plant will appear related physiological response to reduce direct harm caused by the stress of heavy metals. The microscale behavior is always multi-dimensional and difficult to detect. The advanced instruments are effective to resolve the scientific issues, while the related researches are seldom investigated. Takingcalendulaofficinalisseedlings as experimental samples, scanning electron microscope (SEM) and Fourier transform infrared spectroscopy (FT-IR) were applied to compare the surface characteristics and functional groups variation, respectively. The response process and tolerance mechanism ofcalendulaofficinalisseedlings to lead and cadmium stress were further analyzed. The results showed: with the increasing concentration of lead and cadmium in loess, the calyptra ofcalendulaofficinalisseedlings become bending and wilting; the amount of root hairs decreases greatly while no significant variations of aerial parts are found on surface characteristics. The stress of lead and cadmium are responsible for the difference of FTIR spectra of Calendula officinalis seedlings. The peak absorbance at 3 573 cm-1decreases and the peak becomes more complex with the increasing contents of lead and cadmium. It might be the coordination effect between lead/cadmium and hydroxyl, which affects the synthesis and secretion of organic matters. The movement of C—H vibration peak is associated with the lipid oxidationwhile the changes at 1 631 and 1 574 cm-1suggest the protein component differences. The shifting peak at 1 385 cm-1might be associated with the methylation of pectin and lipid, and the behavior is positive for the adaption process ofcalendulaofficinalisseedlings to lead and cadmium stress. The FTIR spectra are effective to reveal the phytoremediation mechanism on heavy metals contamination in pedosphere.
Fourier transform infrared spectroscopy (FTIR);Calendulaofficinalis; Loess; Lead/cadmium stress
Jan. 20, 2015; accepted May 10, 2015)
2015-01-20,
2015-05-10
国家自然科学基金项目(21407103), 中国博士后科学基金项目 (2012M511968) 和陕西科技大学科研基金项目(2014xhbz-06)资助
范春辉, 1982年生, 陕西科技大学环境科学与工程学院讲师 e-mail: frank_van391@163.com
O657.3
A
10.3964/j.issn.1000-0593(2016)08-2442-05
