针对变异链球菌的人源特异性靶向抗菌肽C16LL-37的生物学特性
2016-06-15车春晓姜科宇马媛媛曾飒周建业李志强何祥一兰州大学口腔医学研究所兰州730000甘肃省口腔疾病研究重点实验室西北民族大学兰州730030
车春晓 姜科宇 马媛媛 曾飒 周建业 李志强 何祥一.兰州大学口腔医学研究所,兰州 730000;.甘肃省口腔疾病研究重点实验室(西北民族大学),兰州 730030
针对变异链球菌的人源特异性靶向抗菌肽C16LL-37的生物学特性
车春晓1姜科宇1马媛媛1曾飒1周建业2李志强2何祥一1
1.兰州大学口腔医学研究所,兰州 730000;2.甘肃省口腔疾病研究重点实验室(西北民族大学),兰州 730030
[摘要]目的研究针对变异链球菌(S.mutans)的人源特异性靶向抗菌肽C16LL-37的生物学特性。方法通过标准固相合成技术(Fmoc保护法)合成人源抗菌肽LL-37、S.mutans感受态刺激肽(CSP)C端16个氨基酸组成的多肽CSPC16及二者的重组多肽C16LL-37;以LL-37、CSPC16为对照组,采用平板菌落计数法检测C16LL-37对S.mutans、黏性放线菌、大肠埃希菌、嗜酸乳杆菌、金黄色葡萄球菌的抗菌活性及其对S.mutans的靶向性。通过扫描电子显微镜(SEM)观察,浓度为32 µmol·L-1的C16LL-37作用后S.mutans的细胞形态学变化;利用酶联免疫吸附法测定C16LL-37的红细胞溶血率以及不同条件对C16LL-37抗菌活性的影响。结果1)C16LL-37对S.mutans的最小抗菌浓度为16 µmol·L-1,最小杀菌浓度为64 µmol·L-1。2)C16LL-37浓度为64 µmol·L-1时,作用30 min后S.mutans存活率为3.46%,作用60 min后细菌存活率降至0%,其他4种细菌在各时间的存活率均大于60%(P<0.05)。3)SEM观察:经C16LL-37 (32 µmol·L-1)作用后,部分S.mutans细胞形态出现不规则改变,部分细胞的细胞膜粗糙、细胞质外溢或出现细胞裂解。4)C16LL-37浓度不超过64 µmol·L-1时,红细胞溶血率低于0.33%,与阴性对照组无明显差异(P>0.05)。5)不同温度、pH值、盐浓度及低浓度胰蛋白酶处理后,C16LL-37的抗菌活性无明显变化(P>0.05)。结论C16LL-37对变异链球菌具有靶向特异性,并且具有较强的抗菌活性、较高的生物安全性及良好的稳定性。
[关键词]变异链球菌; 感受态刺激肽; 抗菌肽; 特异性靶向抗菌肽
Supported by: Fund for Less Developed Regions ofNatural Science Foundation of China (31160124/C0309);Natural Science Foundation of Gansu Province (1204FKCA16, 1308RJZA248).Correspondence: He Xiangyi, E-mail: hexy@lzu.edu.cn.
龋病是最常见的口腔慢性感染性疾病。变异链球菌是人类龋病最主要的致病菌[1-2],抑制变异链球菌的增殖对阻断龋病的发生发展具有重要意义。
抗菌肽是一种具有生物活性的小分子多肽,主要破坏细菌细胞膜,使细菌内容物外溢导致细菌死亡,这一抗菌机制赋予了其不易产生耐药性,对大多数耐药微生物具较强抗菌活性的优势[3-4];但抗菌肽也存在抗菌谱广、生物效能低、筛选难度高及蛋白水解不稳定等缺点。随着临床耐药致病菌日趋增多,研发具备较强抗菌活性的特异性靶向抗菌肽(specifically targeted antimicrobial peptides,STAMP)尤为迫切[5]。人源抗菌肽LL-37是如今唯一发现的具有α-螺旋结构的Cathelicidins家族抗菌肽[6-7],不仅具备极高的生物安全性,且不易导致病原菌发生抗性突变,是新型抗生素设计及合成的理想模板和分子骨架[7-8]。
STAMP由靶向定位区域、抗菌区域和(或)连接体区域组成。STAMP通过靶向定位区域增加目标细菌表面抗菌肽浓度,使抗菌肽的杀伤效力及动态性能全面提升[9-10]。Guo等[9]以变异链球菌感受态刺激肽(competence stimulating peptide,CSP)C端16个氨基酸序列作为靶向定位区域即CSPC16,通过连接体(-GGG-)与抗生素Novinspirin G2连接合成新型抗菌肽C16G2。C16G2对变异链球菌有靶向特异性,抗菌活性强[9,11];但Novinspirin G2作为化学合成抗生素,具有一定的细胞毒性[12]。
本研究以LL-37为抗菌区域,以变异链球菌CSPC16为靶向定位区域合成一种人源重组抗菌肽C16LL-37,并对其靶向特异性、抗菌活性、生物安全性及稳定性等生物学特性进行研究。
1 材料和方法
1.1设备与材料
主要设备:全自动菌落计数器(北京起航博达科技有限公司),S-3400N型扫描电子显微镜(scanning electron microscopy,SEM,日本日立高新技术公司),DG5033A型酶联免疫检测仪(南京华东电子集团医疗装备有限责任公司)。主要试剂:MH肉汤(Mueller-Hinton broth,MHB)培养基、MH琼脂(Mueller-Hinton agar,MHA)培养基(青岛高科园海博生物技术有限公司)。标准菌株:变异链球菌ATCC25175、黏性放线菌ATCC15987、大肠埃希菌ATCC25922、嗜酸乳杆菌ATCC4356、金黄色葡萄球菌ATCC25923,各标准菌株均由甘肃省口腔疾病研究重点实验室培育基地提供。
1.2实验方法
1.2.1多肽的合成及细菌悬液的配置多肽CSPC16、LL-37、C16LL-37由兰州大学化学化工学院采用标准固相合成技术(Fmoc保护法)合成,应用反相高效液相色谱法(reversed phase-high performance liquid chromatography,RP-HPLC)纯化,应用电喷雾电离质谱对纯化产物进行鉴定,要求多肽纯度≥95%(表1)。将各多肽溶解于无菌去离子水中配置成母液,浓度为5 120 µmol·L-1,-20 ℃储存备用。

表1 多肽的氨基酸序列、纯度及相对分子质量Tab 1 Amino acid sequence, purity and relative molecular mass of peptides
将冻存的各细菌复苏后置于恒温摇床(37 ℃,120 r·min-1)过夜培养,通过麦氏标准比浊法,测定浊度于0.5~1.0之间(1×108CFU·mL-1),利用MHB培养基将各菌液稀释至1×106CFU·mL-1,备用。
1.2.2抗菌活性实验通过抗菌活性实验比较并分析3种多肽对各细菌的最小抗菌浓度(minimum inhibitory concentration,MIC)及最小杀菌浓度(minimum bactericidal concentration,MBC)[13]。设LL-37为阳性对照组,CSPC16及MHB培养基为阴性对照组,C16LL-37为实验组。采用二倍梯度稀释法将LL-37、CSPC16及C16LL-37母液分别稀释至256、128、64、32、16、8 µmol·L-1。取不同浓度抗菌肽分别加至含5种细菌悬液(1×106CFU·mL-1)的各无菌离心管内(每支100 µL),充分混匀,置于37 ℃恒温培养箱孵育2 h。2 h后,将每组样品行1×103倍稀释,并各取30 µL分别均匀涂布于MHA平板,置于37 ℃恒温培养箱中孵育16~18 h。利用菌落计数仪计数,计算各组细菌的存活率。各组实验均设3个平行。
1.2.3C16LL-37对变异链球菌靶向特异性的测定设变异链球菌为实验组,其他4种细菌为对照组。将浓度为64 µmol·L-1的C16LL-37加至分别含5种细菌悬液(1×106CFU·mL-1)的无菌离心管内(每支100 µL),充分混匀,置于37 ℃恒温培养箱内培养,分别以30、60、120 min为两种抗菌肽作用观察时间点。菌落计数法同1.2.2。各组实验均设3个平行。
1.2.4时间—杀菌实验 分别选取100 µL稀释后的C16LL-37(16、32、64 µmol·L-1)加至含100 µL变异链球菌悬液(1×106CFU·mL-1)的无菌离心管内,充分混匀,并置于37 ℃恒温培养箱孵育,分别以0、30、60、90、120、150 min为C16LL-37作用观察时间点。菌落计数法同1.2.2。各组均设3个平行。
1.2.5红细胞溶血实验 设0.2% TritonX-100为阳性对照组,PBS为阴性对照组。经知情同意后取健康人(血检合格)新鲜静脉血4.5 mL分装至含1 g·L-1肝素钠的无菌离心管内(每支1.5 mL),离心(1 000 g,10 min)后弃上清,PBS清洗2~3次后,配制成体积分数4%的红细胞悬液。将红细胞悬液分别加至含不同浓度(256、128、64、32、16、8 µmol·L-1)C16LL-37及LL-37的96孔聚苯乙烯板各孔内(每孔100 µL),置于37 ℃恒温培养箱孵育2 h。2 h后离心(1 000 g,10 min),取上清,利用酶标仪检测各孔内上清的吸光度A值(450 nm)。各孔均设3个平行。
1.3SEM观察
设MHB培养基为阴性对照组,LL-37为阳性对照组。取500 µL C16LL-37(64 µmol·L-1)加至含500 µL变异链球菌悬液(1×106CFU·mL-1)的无菌离心管内,充分混匀(C16LL-37终浓度32 µmol·L-1),置于37 ℃恒温培养箱孵育2 h,离心(10 000 r·min-1,5 min),弃上清,PBS清洗2~3次。向各样品中分别加入2.0%戊二醛缓冲剂于4 ℃条件下固定24 h,PBS清洗2~3次,乙醇梯度脱水,100%叔丁醇置换乙醇 2~3次,最终溶于100%叔丁醇。吸取细菌—叔丁醇悬液滴于覆有盖玻片的样品台,置冷冻干燥机内真空干燥,喷金,SEM观察[14]。各组均设3个平行。
1.4C16LL-37的稳定性分析
1.4.1不同温度 以C16LL-37作为阳性对照组。将C16LL-37(64 µmol·L-1)分别置于17、27、37、47、57 ℃条件下处理30 min,再将各组样品置于恒温孵育箱30 min后使其温度恢复至37 ℃。
1.4.2不同pH值设HCl及NaOH缓冲液为阴性对照组,C16LL-37为阳性对照组。分别利用HCl及NaOH缓冲液将3组C16LL-37(64 µmol·L-1)的pH值调至5.5、6.5、7.5。
1.4.3不同浓度盐设各浓度的盐作为阴性对照组,C16LL-37为阳性对照组。向C16LL-37(64 µmol·L-1)中分别加入不同浓度的NaCl溶液,充分混匀,使各组C16LL-37中NaCl的浓度分别为100、200、300、400 µmol·L-1。
1.4.4不同浓度胰蛋白酶以MHB培养基作为阴性对照组,以未处理的C16LL-37(64 µmol·L-1)作为阳性对照组。将C16LL-37分别采用不同浓度(2、20、200、2 000 µmol·L-1)的胰蛋白酶处理6 h。
取经上述处理后的C16LL-37 各100 µL分别加至含100 µL变异链球菌悬液(1×106CFU·mL-1)的96孔聚苯乙烯板各孔内,置于37 ℃恒温培养箱孵育2 h后,酶标仪检测各组的吸光度A值(600 nm),各孔均设3个平行。
1.5统计分析
应用SPSS 17.0软件对实验数据进行t检验分析,检验水准为双侧α=0.05。
2 结果
2.1抗菌活性实验
抗菌活性实验结果见表2:5种标准菌对C16LL-37的敏感性较LL-37均减弱;但相对其他4种细菌,变异链球菌对C16LL-37的敏感性最强(MIC=16 µmol·L-1,MBC=64 µmol·L-1)(P<0.05);CSPC16的抗菌活性与阴性对照组没有明显差异(P>0.05)。
2.2C16LL-37对变异链球菌的靶向特异性测定
C16LL-37(64 µmol·L-1)作用30 min后,变异链球菌的存活率明显下降(3.46%),60、120 min后变异链球菌的存活率为0%;其他4种细菌在各培养时间的存活率均大于60% (P<0.05) (图1)。
2.3时间—杀菌实验
C16LL-37浓度为4倍MIC(即64 µmol·L-1)时,作用于变异链球菌60 min后,可以杀灭全部细菌;150 min后细菌存活率仍为0。C16LL-37浓度为2倍MIC(32 µmol·L-1)时,在60 min内抗菌效果最为明显,细菌存活率小于10%;C16LL-37浓度为1倍MIC(16 µmol·L-1)时,抗菌活性最弱,120 min后细菌呈增殖趋势(图2)。

表2 3种多肽抗菌活性实验Tab 2 Antimicrobial activity of three kinds of peptides µmol·L-1
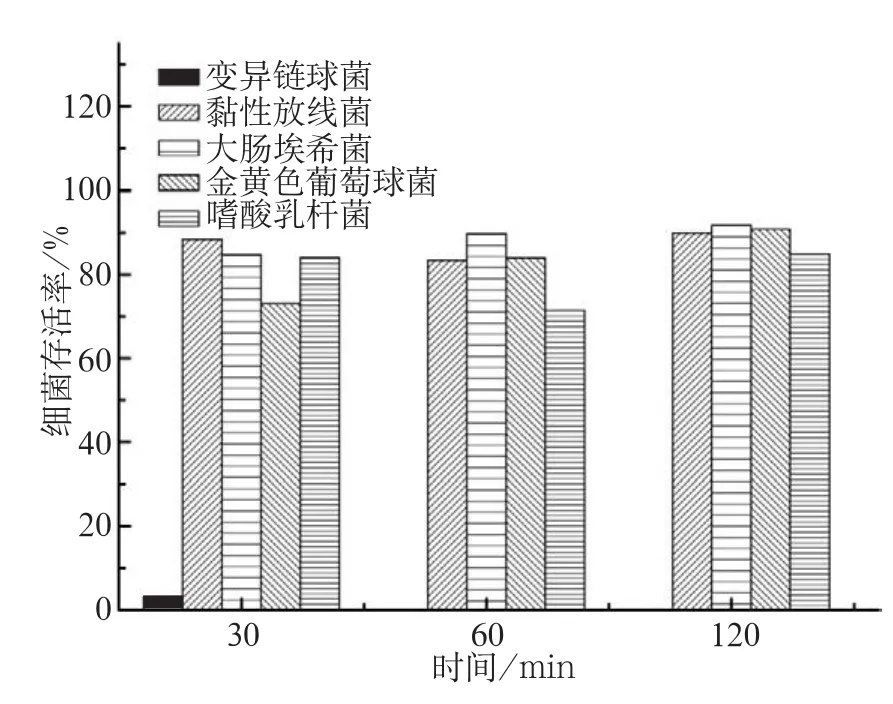
图1 C16LL-37对变异链球菌的靶向特异性Fig 1 The specificity of C16LL-37 against Streptococcus mutans
2.4SEM观察
用浓度为32 µmol·L-1的C16LL-37作用于变异链球菌2 h后,置于SEM下观察,结果可见:变异链球菌正常形态呈球状或短棒状,表面光滑完整(图3A、B);C16LL-37作用后,部分细菌细胞形态发生不规则改变(图3C),细胞膜粗糙,细胞质外溢(图3D)或细胞裂解,可见大量细胞外碎屑(图3E);部分细菌与阴性对照组细胞相似,未见细胞裂解或碎屑形成(图3F)。
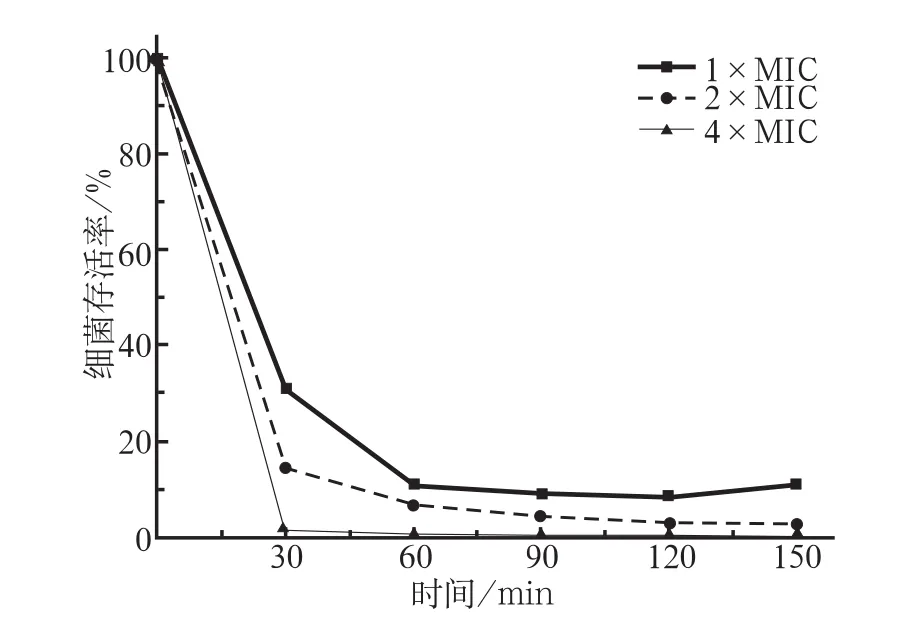
图2 不同浓度C16LL-37对变异链球菌ATCC25175的时间—杀菌曲线Fig 2 The time-kill curves of different concentrations of C16LL-37 against Streptococcus mutans ATCC25175

图3 变异链球菌ATCC25175的细胞形态学变化 SEM × 15 000Fig 3 Morphological observation of Streptococcus mutans ATCC25175 SEM × 15 000
2.5红细胞溶血实验
C16LL-37、LL-37的红细胞溶血率见图4,两种多肽的溶血率与阴性对照组均没有明显差异(P>0.05)。当浓度为32 µmol·L-1时,C16LL-37的溶血率为0.16%, LL-37为0.24%;浓度为64 µmol·L-1时,C16LL-37溶血率为0.33%,LL-37为0.38%;浓度达到128、256 µmol·L-1时,C16LL-37和LL-37的溶血率仍低于30%。
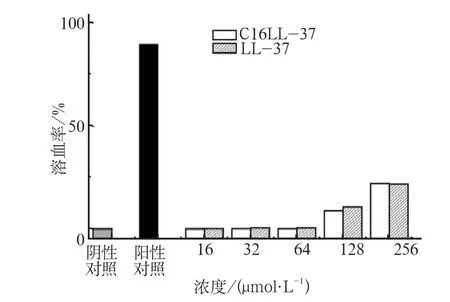
图4 C16LL-37、LL-37的红细胞溶血实验Fig 4 The hemolysis assay of C16LL-37 and LL-37
2.6C16LL-37的稳定性分析
不同温度、pH值、盐浓度及较低浓度的胰蛋白酶(2、20 µmol·L-1)处理后,C16LL-37的抗菌效果与阳性对照组无明显差异(P>0.05);但较高浓度胰蛋白酶(200、2 000 µmol·L-1)处理后,C16LL-37的抗菌活性减弱(P<0.05,图5)。
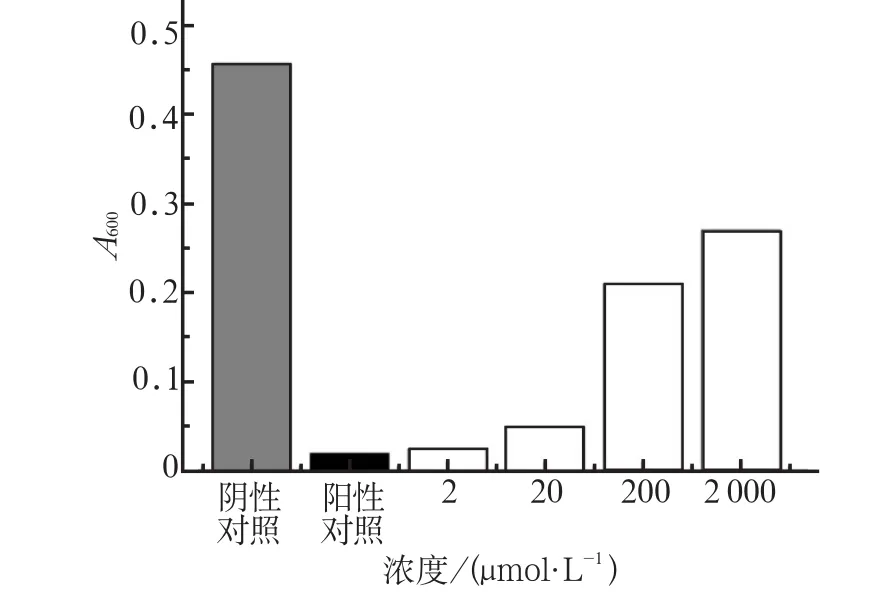
图5 不同浓度胰蛋白酶处理后C16LL-37对变异链球菌 ATCC-25175的抗菌活性ig 5 The antibacterial activity of C16LL-37 against Streptococcus mutans ATCC25175 after treatment by trypsin at different con-centrations
3 讨论
20世纪初,化学合成抗生素的问世极大地推动了龋病预防工作的进程。近年来,由于抗生素的滥用,口腔菌群失衡和耐药致病菌增多等问题接踵而至[15-16]。研发出一种安全有效且能靶向抑制口腔致病菌生长繁殖的新型抗生素迫在眉睫。本研究以变异链球菌CSP的C端16个氨基酸序列(CSPC16)为靶向定位区域,以人源抗菌肽LL-37的氨基酸序列为抗菌区域,两者通过连接体(-GGG-)连接,成功地合成了人源特异性靶向抗菌肽C16LL-37。
CSP具有介导细菌进入基因感受态,影响细胞聚集、黏附等重要作用[17-18]。Syvitski等[19]通过对CSP的构效分析发现,CSP的C端区域稳定,去除部分氨基酸残基后仍能竞争性抑制变异链球菌的密度感应,证明CSP的C端更适合作为变异链球菌特异性靶向抗菌肽的靶向定位区域。Mai等[20]将从比目鱼表皮中分离的多肽Pleurocidin的变异体NRC-4为抗菌区域,以CSP的C端部分氨基酸序列为靶向定位区域,合成了变异链球菌特异性靶向抗菌肽IMB-2,并对其结构及生物活性分析,结果发现:IMB-2对变异链球菌具有靶向特异性,且抗菌活性较强。LL-37为宿主天然免疫系统产生的小分子多肽,广泛分布于人体,具有较高的生物安全性[21-22]。与传统抗生素不同,LL-37主要通过破坏细菌细胞膜使细胞内容物外溢发挥抗菌活性,这一抗菌机制使其不仅不易导致耐药菌株的出现,对大部分耐药菌株也具有较强的抗菌作用[3-4,22-23]。
比较C16LL-37与LL-37的抗菌活性可以发现,C16LL-37抗菌活性较LL-37减弱,但相对其他4种标准菌,C16LL-37对变异链球菌的抗菌活性最强,且随浓度增高,抗菌效果增强,作用持续时间延长。由此可见,C16LL-37对变异链球菌具备靶向特异性。然而,LL-37为α-螺旋结构抗菌肽,抗菌活性主要依赖α-螺旋结构的维持[24-25]。LL-37与CSPC16重组后,α-螺旋结构受到一定程度破坏,导致C16LL-37的抗菌活性较LL-37略减弱。
C16LL-37靶向特异性的发挥通过靶向定位区域(CSPC16)靶向诱导抗菌肽到达变异链球菌表面并与其表面受体特异性结合,使细菌细胞表面抗菌肽浓度短时间内急剧上升实现的。为进一步观察C16LL-37的抗菌机制,通过SEM对经C16LL-37处理后的变异链球菌进行观察,发现部分细菌形态发生不规则改变,细胞膜破坏,可见细胞被碎屑包绕;由于抗菌肽浓度较低(32 µmol·L-1),仍可见部分形态正常的变异链球菌。这证实C16LL-37主要通过破坏细菌细胞膜使细胞内容物外溢导致细菌裂解死亡。这一抗菌机制同样赋予了C16LL-37不易产生耐药性的特点,有望解决临床上化学合成抗生素导致的耐药菌株增多等问题。
此外,通过比较不同浓度C16LL-37与LL-37的红细胞溶血率发现,有效浓度的C16LL-37与LL-37溶血率甚小[26],即便在高浓度条件下,二者溶血率仍低于30%。这表明C16LL-37具有较高的生物安全性,为其日后投入临床应用提供了保障。
口腔有着复杂的理化环境。口腔自身的温度、湿度、酸碱度等维持着口腔生境,还可以通过食物刺激分泌唾液间接地改变口腔环境[27-28]。本研究将C16LL-37(64 µmol·L-1)分别经不同温度、pH值、不同浓度的盐以及胰蛋白酶处理后作用于变异链球菌,检测C16LL-37的抗菌活性,以对其稳定性进行分析,结果发现,除了极高浓度的胰蛋白酶会导致C16LL-37的抗菌活性降低外,在不同的温度、pH值、盐浓度等条件下,C16LL-37具备较高的稳定性,可充分发挥抗菌作用。
值得注意的是,本研究所选用天然抗菌肽LL-37全部(37个)的氨基酸作为抗菌区域,导致重组抗菌肽氨基酸数目多,相对分子质量大,结构不稳定,合成、分离及纯化过程费时、费力。因此,多肽合成前应对LL-37进行构效分析,以确定其氨基酸序列的主要功能区域,在保证具备较强抗菌活性的基础上尽量减少氨基酸数目,使得STAMP的合成及处理过程高效快捷,结构更加稳定。
综上所述,人源特异性靶向抗菌肽C16LL-37具备抗菌谱窄、不易产生耐药性、抗菌活性强、生物安全性高、稳定性良好等比较优越的生物学特性。因此,C16LL-37的成功合成为人类龋病防治及相关药物的开发奠定了一定的基础。
[参考文献]
[1]Loman AA, Ju LK.Inhibitory effects of arabitol on cariesassociated microbiologic parameters of oral Streptococci and Lactobacilli[J].Arch Oral Biol, 2015, 60(12):1721-1728.
[2]Chaffee BW, Cheng J, Featherstone JD.Non-operative anticaries agents and dental caries increment among adults at high caries risk: a retrospective cohort study[J].BMC Oral Health, 2015, 15(1):111.
[3]Hiemstra PS.Parallel activities and interactions between antimicrobial peptides and complement in host defense at the airway epithelial surface[J].Mol Immunol, 2015, 68 (1):28-30.
[4]Wang G.Human antimicrobial peptides and proteins[J].Pharmaceuticals, 2014, 7(5):545-594.
[5]Ghosh C, Haldar J.Membrane-active small molecules: designs inspired by antimicrobial peptides[J].Chem Med Chem,2015, 10(10):1606-1624.
[6]Andrault PM, Samsonov SA, Weber G, et al.Antimicrobial peptide LL-37 is both a substrate of cathepsins S and K and a selective inhibitor of cathepsin L[J].Biochemistry, 2015, 54(17):2785-2798.
[7]Kuroda K, Okumura K, Isogai H, et al.The human cathelicidin antimicrobial peptide LL-37 and mimics are potential anticancer drugs[J].Front Oncol, 2015, 5:144.
[8]Bonucci A, Caldaroni E, Balducci E, et al.A spectroscopic study of the aggregation state of the human antimicrobial peptide LL-37 in bacterial versus host cell model membranes [J].Biochemistry, 2015, 54(45):6760-6768.
[9]Guo L, McLean JS, Yang Y, et al.Precision-guided antimicrobial peptide as a targeted modulator of human microbial ecology[J].Proc Natl Acad Sci USA, 2015, 112(24):7569-7574.
[10]He J, Yarbrough DK, Kreth J, et al.Systematic approach to optimizing specifically targeted antimicrobial peptides against Streptococcus mutans[J].Antimicrob Agents Chemother, 2010, 54(5):2143-2151.
[11]Kaplan CW, Sim JH, Shah KR, et al.Selective membrane disruption: mode of action of C16G2, a specifically targeted antimicrobial peptide[J].Antimicrob Agents Chemother, 2011, 55(7):3446-3452.
[12]Khandelia H, Kaznessis YN.Molecular dynamics investigation of the influence of anionic and zwitterionic interfaces on antimicrobial peptides’ structure: implications for peptide toxicity and activity[J].Peptides, 2006, 27(6):1192-1200.
[13]刘奕, 费伟, 王丽娜, 等.人工合成抗菌肽对口腔细菌抗菌性能的初步研究[J].华西口腔医学杂志, 2014, 32(6):601-605.Liu Y, Fei W, Wang LN, et al.Antibacterial activity of synthetic antimicrobial decapeptide against oral bacteria[J].West Chin J Stomatol, 2014, 32(6):601-605.
[14]Wang Y, Chen J, Zheng X, et al.Design of novel analogues of short antimicrobial peptide anoplin with improved antimicrobial activity[J].J Pept Sci, 2014, 20(12):945-951.
[15]Oberoi SS, Dhingra C, Sharma G, et al.Antibiotics in dental practice: how justified are we[J].Int Dent J, 2015, 65(1):4-10.
[16]Li LN, Guo LH, Lux R, et al.Targeted antimicrobial therapy against Streptococcus mutans establishes protective noncariogenic oral biofilms and reduces subsequent infection [J].Int J Oral Sci, 2010, 2(2):66-73.
[17]Tian X, Syvitski RT, Liu T, et al.A method for structureactivity analysis of quorum-sensing signaling peptides fromnaturally transformable streptococci[J].Biol Proced Online, 2009, 11:207-226.
[18]Wang WL, Liu J, Huo YB, et al.Bacteriocin immunity proteins play a role in quorum-sensing system regulated antimicrobial sensitivity of Streptococcus mutans UA159[J].Arch Oral Biol, 2013, 58(4):384-390.
[19]Syvitski RT, Tian XL, Sampara K, et al.Structure-activity analysis of quorum-sensing signaling peptides from Streptococcus mutans[J].J Bacteriol, 2007, 189(4):1441-1450.
[20]Mai J, Tian XL, Gallant JW, et al.A novel target-specific, salt-resistant antimicrobial peptide against the cariogenic pathogen Streptococcus mutans[J].Antimicrob Agents Chemother, 2011, 55(11):5205-5213.
[21]Lim R, Barker G, Lappas M.Human cathelicidin antimicrobial protein 18 (hCAP18/LL-37) is increased in foetal membranes and myometrium after spontaneous labour and delivery[J].J Reprod Immunol, 2015,107:31-42.
[22]Grönberg A, Mahlapuu M, Ståhle M, et al.Treatment with LL-37 is safe and effective in enhancing healing of hard-toheal venous leg ulcers: a randomized, placebo-controlled clinical trial[J].Wound Repair Regen, 2014, 22(5):613-621.
[23]Wang G, Mishra B, Epand RF, et al.High-quality 3D structures shine light on antibacterial, anti-biofilm and antiviralactivities of human cathelicidin LL-37 and its fragments[J].Biochim Biophys Acta, 2014, 1838(9):2160-2172.
[24]Jiang Z, Higgins MP, Whitehurst J, et al.Anti-tuberculosis activity of α-helical antimicrobial peptides: de novo designed L- and D-enantiomers versus L- and D-LL-37[J].Protein Pept Lett, 2011, 18(3):241-252.
[25]Wang G.Structures of human host defense cathelicidin LL-37 and its smallest antimicrobial peptide KR-12 in lipid micelles[J].J Biol Chem, 2008, 283(47):32637-32643.
[26]Jacob B, Park IS, Bang JK, et al.Short KR-12 analogs designed from human cathelicidin LL-37 possessing both antimicrobial and antiendotoxic activities without mammalian cell toxicity[J].J Pept Sci, 2013, 19(11):700-707.
[27]Rodríguez PN, Martínez Reinoso J, Gamba CA, et al.Association among salivary flow rate, caries risk and nutritional status in pre-schoolers[J].Acta Odontol Latinoam, 2015, 28(2):185-191.
[28]Donoghue M, Basandi PS, Adarsh H, et al.Habit-associated salivary pH changes in oral submucous fibrosis—a controlled cross-sectional study[J].J Oral Maxillofac Pathol, 2015, 19 (2):175-181.
(本文编辑吴爱华)
Biological characteristics of a human specifically targeted antimicrobial peptide C16LL-37 against Streptococcus mutans
Che Chunxiao1, Jiang Keyu1, Ma Yuanyuan1, Zeng Sa1, Zhou Jianye2, Li Zhiqiang2, He Xiangyi1.(1.School of Stomatology, Lanzhou University, Lanzhou 730000, China;2.Key Laboratory of Oral Diseases of Gansu Province, Northwest University for Nationalities, Lanzhou 730030, China)
[Key words]Streptococcus mutans;competence stimulating peptide;antimicrobial peptide;specifically targeted antimicrobial peptide
[Abstract]Objective This study aimed to evaluate the biological characteristics of a human specifically targeted antimicrobial peptide C16LL-37 against Streptococcus mutans (S.mutans).MethodsIn this study, an antimicrobial peptide LL-37, a peptide derived from CSPC16(S.mutans competence stimulating peptide), and recombinant peptide C16LL-37 were synthesized by Fmoc-chemistry-based strategy.The selectivity and antibacterial activity of C16LL-37 were identified by the colony counting method on microbial culture plates.After treatment of C16LL-37 at 32 µmol·L−1, the morphological changes in S.mutans were observed by using scanning electron microscopy (SEM).In addition, enzyme-linked immunosorbent assay was used to evaluate the hemolytic activity and antibacterial activity of C16LL-37 under different conditions.Results1) The minimum inhibitory concentration of C16LL-37 was 16 µmol·L−1, and the minimum bactericidal concentration was 64 µmol·L−1.2)The survival rate of S.mutans was 3.46% after C16LL-37 treatment at 64 µmol·L−1for 30 min, whereas it was 0% at 64 µmol·L−1for 60 min.The survival rates of four other kinds of bacteria were more than 60% at any time (P<0.05).3) The morphological change in S.mutans was observedafter C16LL-37 treatment at 32 µmol·L−1by using SEM.S.mutans presented an irregular shape, rough surface, and evident splitting.4) The hemolysis rate of C16LL-37 (≤64 µmol·L−1) was less than 0.33%.5) This study showed no significant influence on the antibacterial activity of C16LL-37 under different conditions, such as temperature, pH, salinity, and trypsin at low concentration (P>0.05).ConclusionC16LL-37 exhibited obvious specificity for S.mutans, strong antibacterial activity, low toxicity, and high stability.Thus, C16LL-37 has good potential in caries research and clinical application.
[中图分类号]R 783
[文献标志码]A [doi]10.7518/hxkq.2016.03.016
[收稿日期]2015-12-05; [修回日期]2016-03-02
[基金项目]国家自然科学基金地区科学基金(31160124/C0309);甘肃省自然科学基金(1204FKCA16,1308RJZA248)
[作者简介]车春晓,硕士,E-mail:chechx13@lzu.edu.cn
[通信作者]何祥一,教授,博士,E-mail:hexy@lzu.edu.cn
