马铃薯内生细菌的分离鉴定及种群多样性分析
2016-06-15屈青松彭万里翟立明林榕姗山东农业大学生命科学学院山东农业微生物菌种资源保藏中心山东泰安271018
屈青松 彭万里 翟立明 刘 晓 林榕姗(山东农业大学生命科学学院,山东农业微生物菌种资源保藏中心,山东泰安 271018)
马铃薯内生细菌的分离鉴定及种群多样性分析
屈青松 彭万里 翟立明 刘 晓 林榕姗*
(山东农业大学生命科学学院,山东农业微生物菌种资源保藏中心,山东泰安 271018)
摘 要:为了分离鉴定马铃薯内生细菌,对相同种植地点的3个不同品种马铃薯内生细菌的群落结构进行分析;从不同品种马铃薯中分离纯化菌株,进行基因序列分析和生理生化鉴定;取相同部位马铃薯组织进行PCR-DGGE操作,并对DGGE图谱上的条带进行差异性分析。最终分离得到9株内生细菌,鉴定1-1、1-2为枯草芽孢杆菌(Bacillus subtilis sp.),1-3为类芽孢杆菌(Paenibacillus sp.),1-4为韩国假单胞菌(Pseudomonas koreensis sp.),1-5、1-6、2-3为解淀粉芽孢杆菌(Bacillus amyloliquefaciens sp.),2-2为苍白杆菌(Ochrobactrum sp.),3-6为副球菌(Paracoccus sp.)。DGGE图谱表明不同品种的马铃薯内生细菌既有差异性又有相似性。最终结果表明3个品种马铃薯内生细菌具有较丰富的种群多样性,且差异性明显,品种可能是影响马铃薯内生细菌群落结构的重要因素。
关键词:马铃薯;DGGE;内生细菌;鉴定
屈青松,男,本科生,专业方向:生物科学,E-mail:quqingsong@ outlook.com
植物内生菌是指在植物生活史的一定阶段或全部阶段存在于健康植物内部组织的微生物类群,而被感染的寄主植物不会表现明显感染症状(Herre et al.,2007;陈雪英 等,2008;李瑞 等,2009)。内生菌要从严格消毒的组织和汁液中分离,或从植物组织内直接扩增微生物DNA来证明其存在(Stone et al,2000;石晶盈 等,2006)。内生细菌广泛存在于植物体内,分布于植物的叶、茎、花、果实、种子等器官、组织或细胞间隙之中。部分内生细菌的次生代谢物中有时含有与宿主植物相同或相似的活性成分(Fisher et al.,1993;何劲 等,2006)。
由于内生细菌长期生长于寄主内部,并与之协同进化,故具有促进植物生长、抵抗病虫害的能力,部分内生细菌还有增加寄主对环境胁迫的抗性作用(Munif et al.,2001)。研究表明马铃薯的块茎中具有丰富的内生菌资源(文才艺 等,2004),因此研究马铃薯内生细菌的分类及其生物多样性对后续的研究有很大的指导意义。
一些不可培养的微生物可通过扩增出其DNA分子的手段证明其存在,变性梯度凝胶电泳(DGGE)就是一种常用的非培养手段研究微生物种群的方法,根据DNA在不同浓度变性剂中变性行为的不同而导致电泳迁移率发生变化的原理,将片段大小相同而碱基组成不同的DNA片段分开,从而对微生物群落进行分析(张一 等,2012)。根据DGGE图谱中条带的数量、亮度和位置可反映出样品中微生物群落的部分信息,从而可用来对环境样品中的微生物多样性进行定性、半定性分析(刘敏 等,2000)。
前人关于马铃薯内生细菌的筛选多是建立在富集、筛选的传统方法上,这样会忽略掉马铃薯内生细菌中的大部分不可培养的菌株(Stenberg,1999),而利用分子生物学的方法可以克服传统方法的缺点,更快速、更准确地检测内生细菌的种群数目。
本试验以泰山1号、中薯5号、荷兰15号3个马铃薯品种为研究对象,从其块茎中筛选内生细菌,并鉴定其所属种群;同时对这3个马铃薯品种的相同位置块茎进行了PCR-DGGE分析,分析块茎中内生细菌的生物多样性。
1 材料与方法
1.1 试验材料
供试马铃薯品种分别为:泰山1号(编号1,泰安市农业科学研究院作物研究所选育)、中薯5号(编号2,中国农业科学院蔬菜花卉研究所选育)、荷兰15号(编号3,荷兰费乌瑞它系列品种),均由泰安市农业科学研究院经济作物研究所种植,于2015年1月采集,长势良好。所用引物参考林榕姗(2012)设计(表1),由南京金斯瑞生物科技有限公司合成。
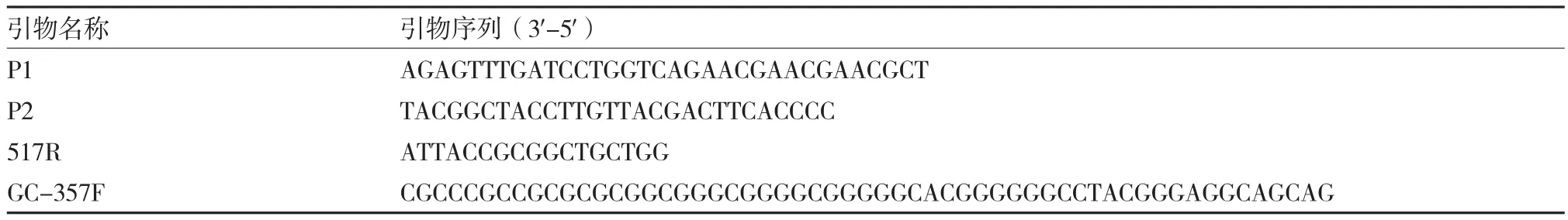
表1 扩增引物
1.2 试验方法
试验于2015年1~9月在山东农业大学生命科学院,山东农业微生物菌种资源保藏中心进行。
1.2.1 马铃薯内生细菌的分离与纯化 参照Ying等(2011)和Kumar等(2013)的方法,分别对3个品种的马铃薯进行表面消毒,用干净的打孔器对马铃薯块茎进行打孔,取距离马铃薯表皮0.5~1.0 cm处块茎进行研磨,将研磨液用无菌水稀释至1×10-2、1×10-3、1×10-43个梯度,稀释后的悬液分别取100 μL涂布于869培养基(蛋白胨10 g、酵母膏10 g、NaCl 5 g、葡萄糖1 g、CaCl20.261 g、琼脂20 g、水1 L、pH 7.0。)、LB培养基,每个梯度悬液涂布3个平行,将培养皿置于28 ℃培养箱培养3~5 d。挑取单菌落于培养基上进行纯化,观察纯化后的菌落形态;并参照《常见细菌系统鉴定手册》方法进行革兰氏染色,选取不同种的菌落再次纯化,并制作斜面及甘油管保藏。
1.2.2 马铃薯内生细菌的鉴定 ① 16S rRNA 序列分析:采用细菌基因组DNA提取试剂盒(OMEGA)提取分离、纯化后的菌株DNA。以所提取DNA为模板,使用P1/P2引物(表1)进行PCR扩增。PCR反应体系(50 μL):10×buffer 5 μL,MgCl23 μL,dNTP 4 μL,引物各1 μL,Taq DNA聚合酶(TAKARA)0.2 μL,DNA模板2 μL,用ddH2O补足50 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性1 min,58 ℃退火30 s,72 ℃延伸1 min30 s,35个循环;72 ℃延伸10 min。PCR产物用1%的琼脂糖凝胶电泳检测后,送上海生工生物工程有限公司进行测序。根据测序结果,将扩增得到的序列在GenBank中进行BLAST分析,利用MEGA 6.06软件进行ClustalW分析,并以Neighbor-joining方法构建系统发育树,用Bootstrat (1 000次重复)进行检验。② 菌株生理生化特征、菌落特征和细胞形态测定:参照《伯杰细菌鉴定手册》第8版分类系统及《常见细菌系统鉴定手册》方法对所纯化菌株的生理生化特征、形态特征等指标进行测定。
1.2.3 马铃薯块茎总DNA的提取 取3个品种马铃薯相同位置块茎,方法同1.2.1,利用E.Z.N.A.Soil DNA Kit和E.Z.A.N. Cycle-Pure Kit(OMEGA)提取并纯化马铃薯块茎总DNA。
1.2.4 PCR-DGGE分析 ① PCR扩增及定量:以提取所得马铃薯块茎总DNA 为模板,使用 GC-357F/517R 引物(表1)进行PCR扩增。PCR反应体系(50 μL):10×buffer 5 μL,MgCl23 μL,dNTP 4 μL,DNA模板1 μL,引物各2 μL,Taq DNA聚合酶0.2 μL,用ddH2O补足50 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸30 s,24个循环;72℃延伸10 min。PCR产物使用E.Z.A.N.Cycle-Pure Kit进行纯化,纯化后使用1%的琼脂糖凝胶电泳检测,-20 ℃保存备用。② DGGE电泳:严格按照Bio-Rad的DGGE说明手册步骤操作。
2 结果与分析
2.1 马铃薯内生细菌的筛选
从3个不同品种马铃薯块茎中共分离得到18株内生菌,其中6株菌筛选自泰山1号,分别编号1-1、1-2、1-3、1-4、1-5、1-6;6株菌筛选自中薯5号,分别编号2-1、2-2、2-3、2-4、2-5、2-6;6株菌筛选自荷兰15号,分别编号3-1、3-2、3-3、3-4、3-5、3-6。经形态学的观察排除重复菌株和放线菌,共得到9株内生细菌分别为1-1、1-2、1-3、1-4、1-5、1-6、2-2、2-3、3-6,通过革兰氏染色结果可知(图1),1-1、1-2、1-5、1-6、2-3为革兰氏阳性菌,1-3、1-4、2-2、3-6为革兰氏阴性菌。
2.2 马铃薯内生细菌菌株的鉴定
2.2.1 16S rRNA序列分析结果 对9株马铃薯内生细菌所提取的DNA进行1%琼脂糖凝胶电泳检测,各条带均较清晰,且无特异性条带,说明这9株菌株的基因组DNA浓度较高,纯度较好。以所提取的9株菌株基因组DNA为模板进行PCR扩增,并将扩增后的产物进行测序,分别得到这9株菌株的16S rRNA片段,DNA长度均在1 300~1 500 bp之间,将9株菌株的序列上传至GenBank,获得GenBank登录号分别如下,1-1:KT781674、1-2:KT831431、1-3:KT831432、1-4:KU041145、1-5:KT831433、1-6:KT831434、2-2:KT831435、2-3:KT831436、3-6:KT831437。
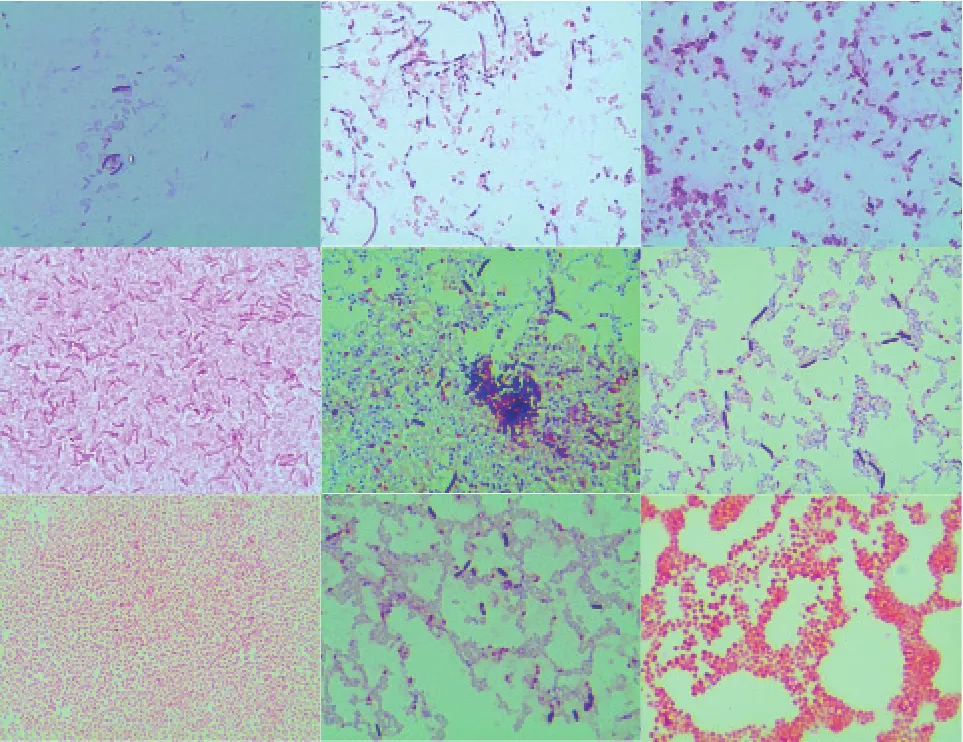
图1 9株马铃薯内生细菌的革兰氏染色显微图(光学显微镜,100倍×10倍)彩色图片参见《中国蔬菜》网站:www.cnveg.org。
对这9株菌株的16S rRNA 进行Blast分析,均在GenBank中找到相似性在95%以上模式菌株,下载这些相似性较高的序列,用MEGA 6.06软件进行多重比对,并构建了系统发育树(图2)。依据系统发育树可知,1-1、1-2、1-5、1-6、2-3之间的相似性较高,且与Bacillus subtilis sp.和Bacillus amyloliquefaciens sp.亲缘关系较近;1-3与Paenibacillus sp.亲缘关系较近;1-4 与Pseudomonas koreensis sp.亲缘关系较近;2-2 与Ochrobactrum ciceri sp.亲缘关系较近;3-6与Paracoccus chinensis sp.亲缘关系较近。
2.2.2 生理生化特征鉴定结果 根据生理生化鉴定与形态观察(表2),结合16S rRNA 基因鉴定结果,鉴定1-1、1-2为枯草芽孢杆菌(Bacillus subtilis sp.),1-3为类芽孢杆菌(Paenibacillus sp.),1-4为韩国假单胞菌(Pseudomonas koreensis sp.),1-5、1-6、2-3为解淀粉芽孢杆菌(Bacillus amyloliquefaciens sp.),2-2为苍白杆菌(Ochrobactrum sp.),3-6为副球菌(Paracoccus sp.)
2.3 马铃薯内生细菌的DGGE指纹图谱分析结果
依据DGGE图谱分析可知(图3),马铃薯块茎的内生细菌种类较多,且不同马铃薯品种之间存在差异性。采用Quantity One 分析软件对DGGE图谱进行聚类分析,并生成系统树(UPGMA)发现,相同种植地区不同品种的马铃薯内生细菌在DGGE图谱中电泳的条带数目、亮度、迁移率均存在明显的差异。由系统树可知(图4),相同地区不同品种的马铃薯内生细菌的群落结构的差异性较大。
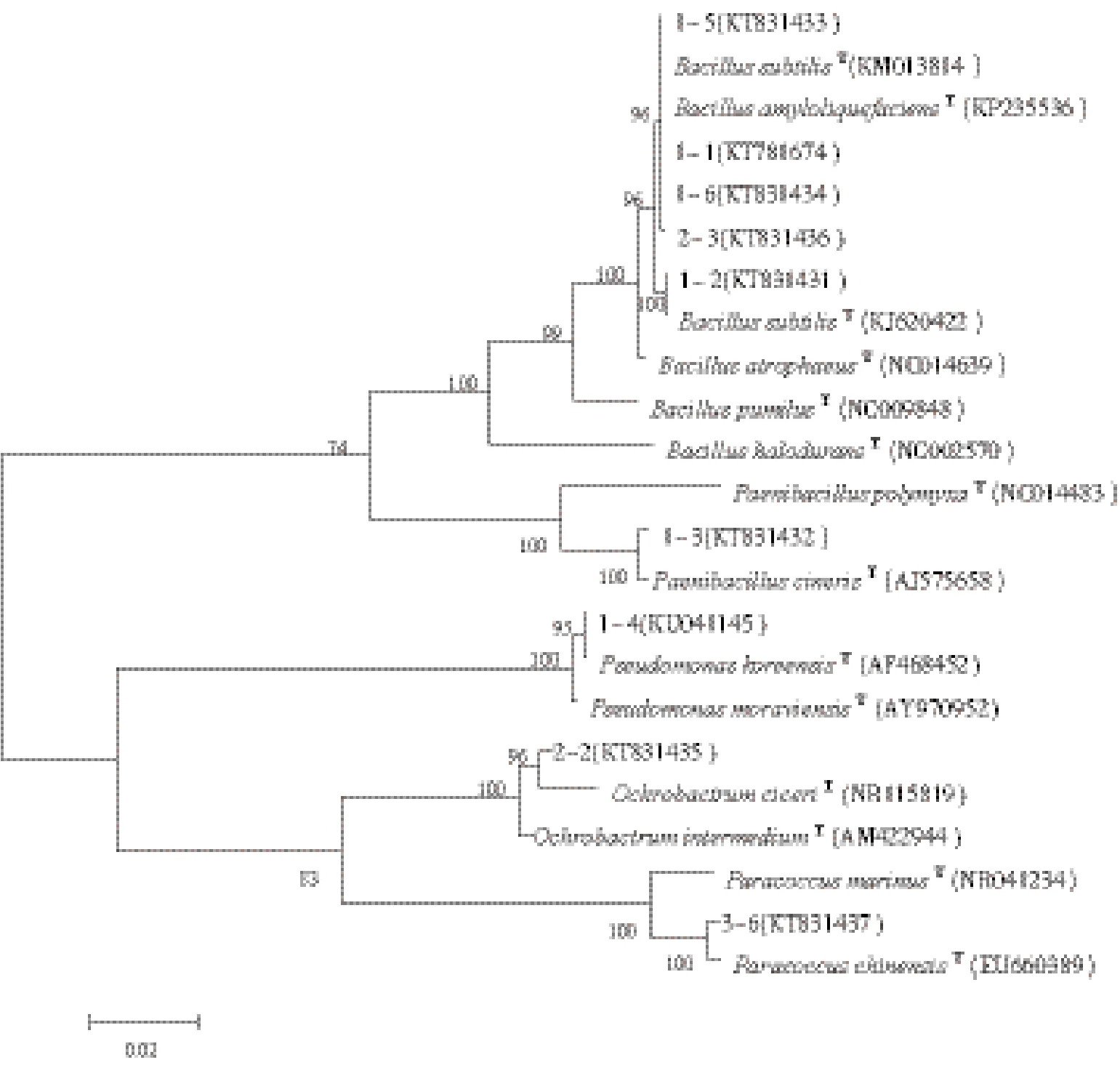
图2 基于16S rDNA序列的马铃薯内生细菌系统发育树括号中的代码表示GenBank登录号。

表2 9株内生细菌的生理生化试验结果和细胞特征
其中P1、P2的条带数目相对较多,说明泰山1号、中薯5号的内生细菌的菌落结构最为复杂,P3条带数目较少并且亮度较弱,说明荷兰15号的内生细菌的菌落结构相对简单。除P1、P2、P3中的共有条带外,p1-6、p1-10为P1特有条带;p2-1为P2特有条带。这些条带的分布特征也可以说明相同种植地区不同品种的马铃薯内生细菌有较大的群落差异。
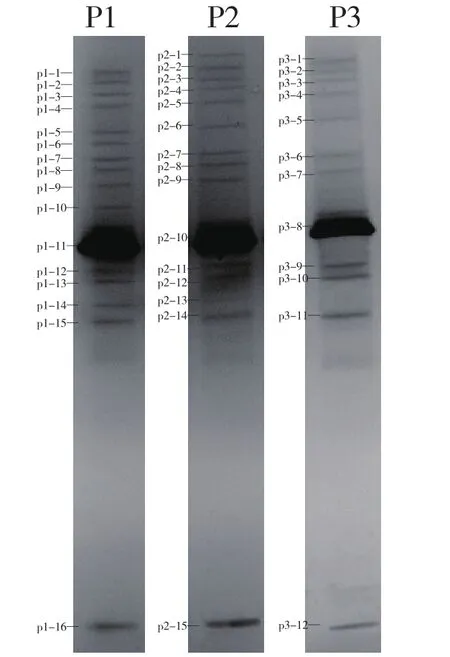
图3 3个马铃薯品种内生细菌的DGGE分析P1、P2、P3分别代表泰山1号、中薯5号、荷兰15号马铃薯内生细菌的DGGE条带。
3 结论与讨论
3.1 马铃薯内生细菌细菌株
利用生理生化鉴定可以将微生物的不同类群分开。将16S rDNA基因序列同源性分析与生理生化试验相结合是一种能够比较快速精确分离细菌的方法。本试验中系统发育学分析有较好的相关性。
16S rRNA 基因序列分析表明,菌株1-1、1-2为枯草芽孢杆菌(Bacillus subtilis sp.),1-5、1-6、2-3为解淀粉芽孢杆菌(Bacillus amyloliquefaciens sp.),这5株内生细菌均属于芽孢杆菌属。因为芽孢杆菌在分离中的内生细菌有较大比重,所以初步将芽孢杆菌确定为3种马铃薯的优势菌株。此外1-3为类芽孢杆菌(Paenibacillus sp.)、1-4为韩国假单胞菌(Pseudomonas koreensis sp.)、3-6为副球菌(Paracoccus sp.)这3类菌株均为植物内生菌的常见菌株。2-2为苍白杆菌(Ochrobactrum sp.),虽然关于苍白杆菌的植物内生菌相关报道较少,但也有人在植物根部分离到苍白杆菌(刘杰 等,2011;刘芳 等,2014)。
芽孢杆菌是一种有较高农业生产价值的细菌,具有繁殖速度快、生命力强、体积大等特征(Stenberg,1999)。特别是在抑菌方面有较大的开发价值,能够较好地抑制有害菌、病原菌等有害微生物的的生长繁殖,在生防菌肥的工业化生产中已经被投入使用。芽孢杆菌还能产生丰富的代谢生成物,从而被农作物利用促进作物生长(张霞 等,2007)。本试验所筛选到的内生菌种类在应用上有较高的价值,后续的研究仍待开展。
3.2 DGGE
关于内生菌的分离鉴定方法一般都是依赖于传统的平板分离,这种方法简单易行,较为普遍,但其分离得到的菌株都为可培养的细菌,而无法分离不可培养的内生菌。近年来关于利用非培养方法研究微生物种群变得普遍起来。而DGGE又是一种常用的非培养手段研究微生物种群的方法,本试验根据电泳所得DGGE图谱的条带数量和亮度对马铃薯内生细菌进行研究。但是DGGE方法还是有一定的局限性,包括DNA模板长度过短、PCR扩增的偏向性、无法获得菌株等制约因素的存在。
本试验对相同地点种植的不同品种马铃薯内生细菌进行DGGE分析,结果表明相同地区种植的不同品种的马铃薯内生细菌的群落结构差异性较大(图4)。由于这3种不同品种的马铃薯生长于相同的地点,所以也受到相似的外部环境因素的影响,在排除外部因素的影响后,推测造成这种内生菌的群落结构差异的主要原因是马铃薯品种这一内因的差异。不同品种马铃薯的生长代谢不同造就了马铃薯内生细菌所生长的外环境的差异,这是造成内生菌群落差异的根本原因。
而这些不同品种马铃薯的内生细菌中还有一些共有菌株,这说明不同品种马铃薯内生细菌除了差异性之外还有共有性,一些生态幅较广的内生细菌对不同环境有较强的适应性,从而造成了这种结果。
此外,在DGGE图谱中条带p1-11、p2-10、p3-8条为P1、P2、P3的共有条带,相比于其他条带也更亮,而本试验所筛选出的内生细菌中芽孢杆菌的数量占绝大部分,故推测该共有条带所对应的内生细菌为本试验所筛选出的芽孢杆菌,是本试验所用样品内生细菌的优势菌株,但也不排除该条带对应不可培养内生菌的可能性。
参 考文献
陈雪英,都晓伟,李斌.2008.内生菌与药用活性成分相关性研究进展.国外医药:植物药分册,23(2):47 52.
何劲,刘蕴哲,康冀川.2006.植物内生菌及其在农业和医学上的用途.贵州农业科学,(3):113-115.
李瑞,郭利伟,郭伟云,李延兰.2009.抗肿瘤药用植物及其内生菌活性代谢产物的研究.安徽农业科学,37(16):7508-7509.
林榕姗.2012.细菌型豆豉发酵机理及功能性研究〔博士论文〕.泰安:山东农业大学.
刘芳,袁宗胜,张国防,陈威.2014.毛竹内生细菌种群多样性分析.福建农业学报,29(12):1236-1239.
刘杰,汪恩涛,陈文新.2011.豆科植物根瘤内生细菌的发现及其研究进展.微生物学报,51(8):1010-1006.
刘敏,朱开玲,李洪波,张涛,尚天.2000.应用PCR-DGGE技术分析黄海冷水团的细菌群落组成.生态学报,20(6):1021-1027.
石晶盈,陈维信,刘爱媛.2006.植物内生菌及其防治植物病害的研究进展.生态学报,26(7):2395-2401.
文才艺,吴元华,田秀玲.2004.植物内生菌研究进展及其存在的问题.生态学杂志,23(2):86-91.
张霞,唐文华,张力群.2007.枯草芽孢杆菌B931防治植物病害和促进植物生长的作用.作物学报,33(2):236-241.
张一,王凤忠,杜秉海,靳志刚,李研,韩明渠.2012.基于变性梯度凝胶电泳的青县苹果再植障碍园与丰产园土壤细菌多样性研究.山东农业科学,44(1):71-74.
Fisher P J,Petrini O,Sutton B C.1993.A comparative study of fungal endophytes in leaves,xylem and bark of Eucalyptus in Australia and England.Sydowia,45:338-345.
Herre E A,Mejia L C,Kyllo D A,Rojas E,Maynard Z,Butler A,Van Bael S A.2007.Ecological implication of anti-pathogen effects of tropical fungal endophytes and mycorrhizae.Ecology,88 (3):550-558.
Kumar N R,Raman R P,Jadhao S B,Brahmchari R K,Kumar K,Dash G.2013.Effect of dietary supplementation of Bacillus licheniformis on gut microbiota,growth and immune response in giant freshwater prawn,Macrobrachium rosenbergii(de Man,1879).Aquaculture International,(2):387-403.
Munif A,Hallmann J,Sikora R A.2001.Induced systemic resistance of selected endophytic bacteria against Meloidogyne incognita on tomato.Meded Rijksuniv GentFak Landboenvkd Toegep Biol Wet,66(2b):663-669.
Stenberg B.1999.Monitoring soil quality of arable land:microbiological indicators.Soil Plant Sci,49(1):1-24.
Stone J K,Bacon C W,White J F Jr.2000.An overview of endophytic microbes:endophytism defined.New York:Microbial endophytes:29-33.
Ying M,Rajkumar M,Luo Y M,Freitas H.2011.Inoculation of endophytic bacteria on host and non-host plants-effects on plants growth and Ni uptake.Journal of Hazardous Materials,195:30-237.
Isolation and Identification of Endophytic Bacteria and Analysis of Population Diversity in Different Potato Varieties
QU Qing-song,PENG Wan-li,ZHAI Li-ming,LIU Xiao,LIN Rong-shan*
(College of Life Science,Shandong Agricultural University,Shandong Agricultural Resource Collection of Microorganisms,Tai'an 271018,Shandong,China)
Abstract:In order to isolate and identify endophytic bacteria in potato and analyze the community structure of 3 different potato varieties,this experiment isolated and purified strains from different potato varieties,and carried out gene sequence analysis and physiological and biochemical identification.The PCR-DGGE operation was performed on the same site in potato,and analyzed the bands on DGGE.Nine strains of endophytic bacteria were isolated,identified 1-1,1-2 as Bacillus subtilis sp.,1-3 as Paenibacillus sp.,1-4 as Pseudomonas koreensis sp.,1-5、1-6、2-3 as Bacillus amyloliquefaciens sp.,2-2 as Ochrobactrum sp.,3-6 as Paracoccus sp.The DGGE bands indicated that there were both differences and similarities in different potato varieties.The results showed that 3 potato varieties had rich population diversity,and their differences were also obvious.The species may be an important factor influencing the structure of endophytic bacteria community.
Key word:DGGE;Potato;Endophytic bacteria;Identification
*通讯作者(
Corresponding author):林榕姗,女,副教授,硕士生导师,专业方向:资源与环境微生物,E-mail:lrs2680@163.com
收稿日期:2016-01-18;接受日期:2016-04-20
基金项目:国家级大学生创新创业训练计划项目(201410434084)
