某县级医院2012
—2014年不同临床标本分离大肠埃希菌ESBLs检出率及其耐药性
2016-06-15夏浩海王学敏
夏浩海, 王学敏
(通山县人民医院, 湖北 通山 437600)
·论著·
某县级医院2012
—2014年不同临床标本分离大肠埃希菌ESBLs检出率及其耐药性
夏浩海, 王学敏
(通山县人民医院, 湖北 通山437600)
[摘要]目的分析某山区县级医院大肠埃希菌临床感染分布及耐药性,为该区域临床合理治疗大肠埃希菌感染提供依据。 方法对2012—2014年某院临床送检的各类标本进行细菌培养、菌株鉴定与药敏试验,超广谱β-内酰胺酶(ESBLs)检测用微量稀释法初筛,纸片扩散法做确证试验;采用 WHONET 5.6及SPSS 19.0软件对数据进行统计分析。 结果271株大肠埃希菌, 主要分离自中段尿(占26.94%)。产ESBLs大肠埃希菌检出率为49.82%,以痰标本检出率最高(56.52%),但不同标本分离的大肠埃希菌中产ESBLs菌株检出率比较,差异无统计学意义(P>0.05)。药敏结果显示,对青霉素类耐药率最高(>90%),对头孢噻吩和头孢呋辛的耐药率>75%,对阿米卡星和哌拉西林/他唑巴坦敏感性较好(耐药率<10%),未发现对碳青霉烯类抗生素耐药的大肠埃希菌,产ESBLs株对大多数抗菌药物的耐药率高于非产ESBLs株。结论分离大肠埃希菌的标本主要来自中段尿,产ESBLs菌株耐药性更高。
[关键词]大肠埃希菌; 超广谱β-内酰胺酶; 临床分布; 抗药性,微生物; 耐药性
[Chin J Infect Control,2016,15(5):327-329,333]
随着广谱和超广谱抗菌药物的不合理使用,致病菌对抗菌药物的耐药性也日趋严重。大肠埃希菌是人类肠道最重要的定植菌,也是临床常见的致病菌,是最常见的产超广谱β-内酰胺酶(extended-spectrum β-lactamases,ESBLs)细菌之一。2013年 CHINET耐药监测显示大肠埃希菌为临床分离率最高的病原菌,占所有病原菌的19.86%[1]。产ESBLs是大肠埃希菌主要的耐药机制,此类菌株一般有较高的耐药性,能达到有效治疗的抗菌药物较少。本院是鄂南山区一所综合性县级医院,近年来,抗菌药物的不规范使用,尤其是昂贵的广谱和超广谱抗菌药物的不合理使用,导致各种致病菌的耐药性也日趋严重。因此,分析大肠埃希菌临床感染分布及耐药性,尤其是产ESBLs大肠埃希菌,对指导本区域临床医生合理使用抗菌药物,控制医院感染具有重要意义。本研究对2012—2014年住院及门诊患者送检的各种标本中分离的大肠埃希菌及其耐药性进行统计分析,现报告如下。
1材料与方法
1.1菌株来源
收集2012年1月—2014年12月某院住院及门诊患者送检各类标本分离的大肠埃希菌,剔除同一患者重复分离株。质控菌株为大肠埃希菌ATCC 25922和肺炎克雷伯菌ATCC 700603,购自湖北省临床检验中心。
1.2细菌鉴定及药敏
根据第3版《 全国临床检验操作规程》[2]及梅里埃试剂提供的试剂说明书规定,革兰阴性杆菌接种于O/F反应管,发酵型细菌上梅里埃提供的ID32E板进行鉴定和ATB G5板进行药敏试验,16~24 h后,采用梅里埃ATB Expression型微生物鉴定与药敏测试仪测定,ATB G5药敏板条的判断标准依据2011版美国临床实验室标准化协会(CLSI) M100-S21标准执行。
1.3ESBLs检测
按照CLSI 规定,利用梅里埃ATB G5板条上1 μg/mL的头孢他啶初筛,初筛阳性者,利用30 μg的头孢他啶、30 μg/10 μg的头孢他啶/克拉维酸和30 μg的头孢噻肟、30 μg/10 μg的头孢噻肟/克拉维酸的药敏纸片进行产 ESBLs菌株表型确证实验。
1.4统计学方法
临床感染标本分布及耐药性采用WHONET 5.6统计,应用SPSS 19.0 统计软件进行分析,P≤0.05为差异有统计学意义。
2结果
2.1标本来源分布
2012年1月—2014年12月共送检各种临床标本9 515份,1 664份标本培养阳性,阳性率为17.49%;分离大肠埃希菌271株,其中 135 株为产ESBLs,产ESBLs大肠埃希菌检出率为49.82%。大肠埃希菌主要分离自中段尿,占26.94%。产ESBLs菌株检出率以痰标本最高(56.52%),但不同标本分离的大肠埃希菌中产ESBLs菌株检出率比较,差异无统计学意义(P>0.05)。具体分布情况见表1。
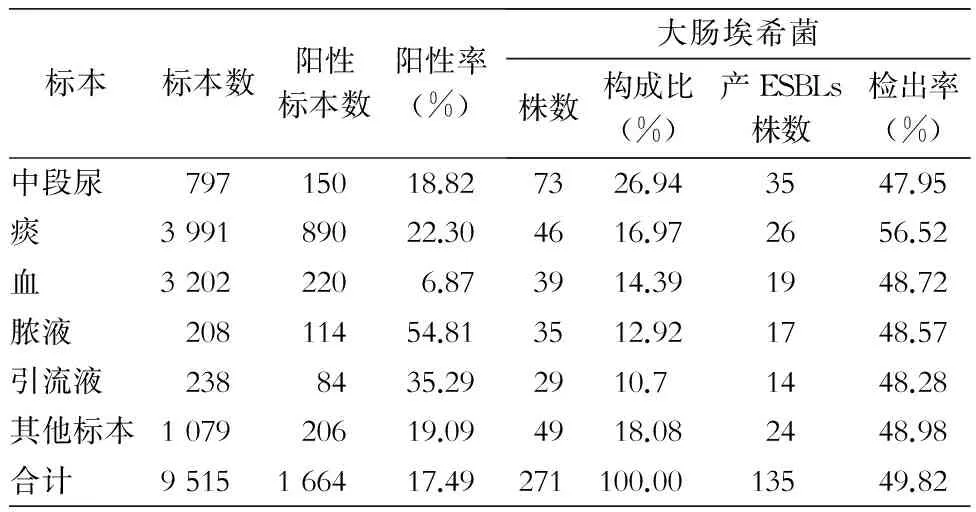
表1 2012—2014年大肠埃希菌及其产ESBLs株标本分布
2.2药敏试验结果
271株大肠埃希菌对20种临床常用抗菌药物药敏结果显示,对青霉素类耐药率最高>90%;对头孢噻吩和头孢呋辛的耐药率>75%;对阿米卡星和哌拉西林/他唑巴坦敏感性较好,耐药率均<10%;未检出耐亚胺培南或美罗培南的大肠埃希菌。除亚胺培南、美罗培南、阿米卡星和哌拉西林/他唑巴坦外,产ESBLs的菌株耐药性高于非产ESBLs菌株(χ2=9.69~167.99,均P<0.05)。大肠埃希菌对头孢西丁的耐药率低于青霉素类和头孢菌素类抗生素(χ2=6.42~217.24,均P<0.05)。大肠埃希菌对第三代头孢菌素类抗生素中头孢噻肟的耐药率高于头孢他啶(χ2=14.29,P<0.05)。见表2。
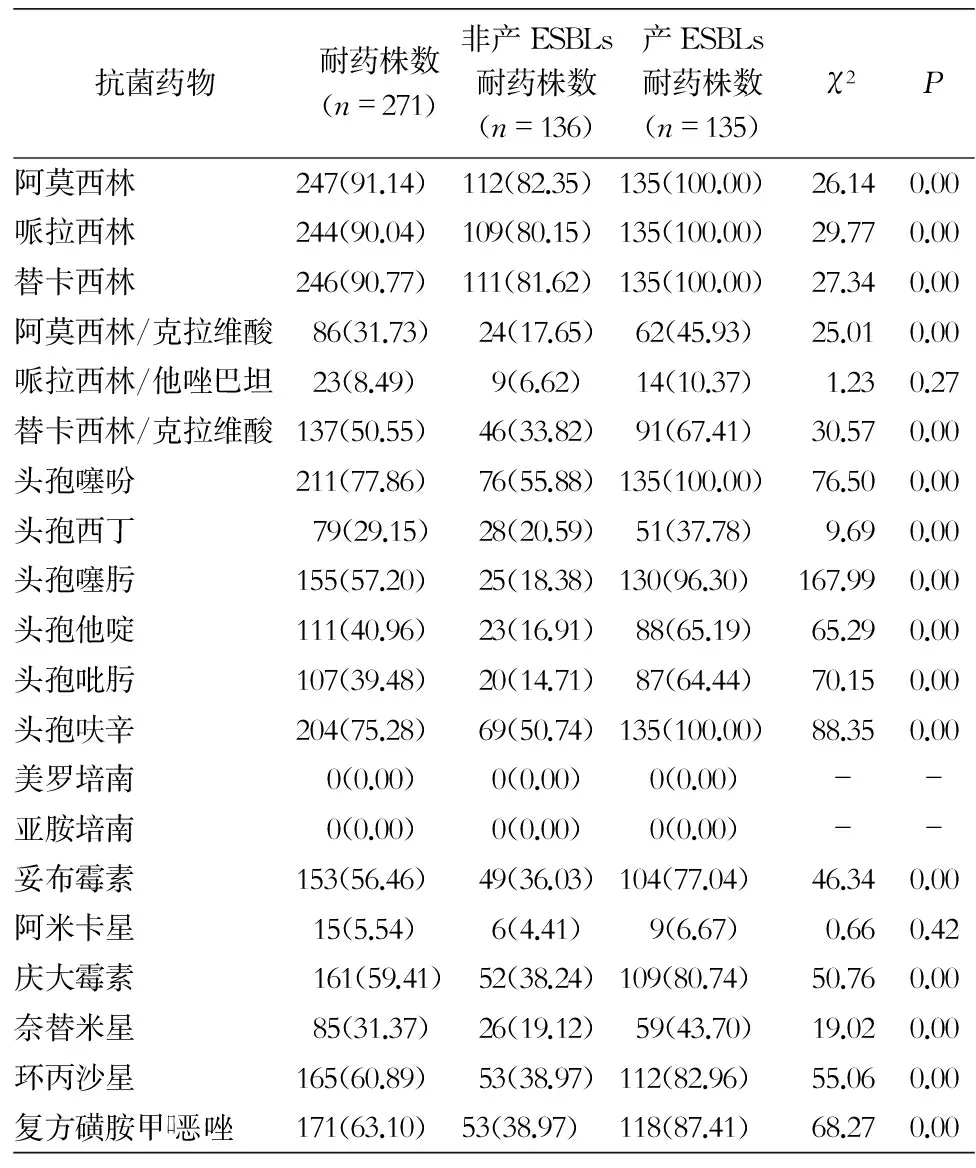
表2 产ESBLs与非产ESBLs大肠埃希菌对常用抗菌药物耐药情况(株数,%)
3讨论
大肠埃希菌是临床感染性疾病中最常见致病菌, 其广泛分布于自然环境中,可引起泌尿系统、呼吸系统,以及伤口感染等,严重时可引起血流感染。本研究结果显示,大肠埃希菌主要分布于中段尿,与黄家祥、岑叶平等[3-4]报道的结果一致,在中段尿阳性标本中占48.67%,说明大肠埃希菌是引起泌尿系统感染的主要病原菌。
药敏结果显示,271株大肠埃希菌对亚胺培南、美罗培南、阿米卡星和哌拉西林/他唑巴坦的耐药率<10%,对阿莫西林/克拉维酸、奈替米星和头孢西丁耐药率在30%左右,而对其他被检测的抗菌药物耐药率均>39%,对青霉素类抗生素的耐药率>90%,可见本区域大肠埃希菌耐药性已经十分严峻,可供经验性使用的抗菌药物非常有限。虽然碳青霉烯类抗生素治疗大肠埃希菌引起的感染效果显著,但碳青霉烯类抗生素的价格昂贵,且抗菌谱广,易致菌群失调造成二重感染[5],因此,碳青霉烯类抗生素应作为治疗大肠埃希菌感染的最后选择。
2012—2014年271株大肠埃希菌中135株产ESBLs,检出率为49.82%, 略低于2013年中国CHINET关于大肠埃希菌产ESBLs检出率54.00%的报道[1], 接近于本省某县级医院48.75%的报道[6],但是高于国内何卫平、储从家等[7-8]低于40%的报道,可能与本区域大量使用第三代头孢类抗生素有关。 头孢西丁是头霉素类抗生素,具有高度抗β-内酰胺酶活性,此也是本研究中大肠埃希菌对头孢西丁敏感性高于青霉素类和头孢菌素类抗生素的原因。第三代头孢菌素类抗生素中,头孢他啶对大肠埃希菌的耐药率明显低于头孢噻肟,这与我国主要流行CTX-M型ESBLs有关[9],CTX-M型ESBLs对头孢噻肟的水解能力明显强于头孢他啶。本研究中,产ESBLs的大肠埃希菌对大多数抗菌药物的耐药率高于非产ESBLs株,且表现出多重耐药性,可能是由于ESBLs由质粒介导,携带ESBLs编码质粒的菌株往往同时携带AmpC酶,以及氨基糖苷类、喹诺酮类等抗菌药物的耐药基因,而呈现多重耐药性[10]。
综上所述,大肠埃希菌对常用抗菌药物耐药形势较为严峻,尤其是产ESBLs大肠埃希菌的高检出率应引起重视。临床上应及时掌握细菌耐药特性,严格按照药敏结果指导临床用药,合理谨慎使用抗菌药物。
[参 考 文 献]
[1]胡付品, 朱德妹, 汪复, 等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志, 2014, 14(5):365-374.
[2]叶应妩, 王毓三, 申子瑜.全国临床检验操作规程[M].3版.南京:东南大学出版社, 2006:890-923.
[3]黄家祥, 叶书来, 周馨.临床分离的2 208株病原体分布及耐药性[J].中国感染控制杂志, 2014, 13(1):36-39.
[4]岑叶平, 常燕子, 费红军, 等.大肠埃希菌和肺炎克雷伯菌的临床分布及耐药分析[J].检验医学与临床, 2012, 9(7):838-840.
[5]王忠臣, 穆金智.94株泌尿系统感染产ESBLs大肠埃希菌的耐药性分析[J].检验医学与临床, 2015, 12(7):961-962.
[6]赵华.某县级医院大肠埃希菌和肺炎克雷伯菌的耐药性差异[J].中国感染控制杂志, 2014, 13(11):693-695.
[7]何卫平, 崔恩博, 王钱, 等.235株血流感染大肠埃希菌耐药性分析[J].中国感染控制杂志, 2015, 14(3):170-173.
[8]储从家, 孔繁林, 王树坤, 等.149株血培养大肠埃希菌的检测及耐药性[J].中国感染控制杂志, 2011, 10(5):376-377.
[9]Liu W, Chen L, Li H, et al. Novel CTX-M (bete)-lactamase genoptype distribution and spread into multiple species of Enterobacteriaceae in Changhai, Southern China [J].J Antimicrob Chemother,2009,63(5):895-900.
[10] 秦湧, 冯旰珠, 赵水娣, 等.2005—2007年医院感染大肠埃希菌产ESBLs、AmpC酶及耐药性分析[J].中华医院感染学杂志, 2009, 19(17):2337-2340.
(本文编辑:文细毛)
Detection of extended-spectrum β-lactamases and antimicrobial resistance ofEscherichiacoliisolated from different clinical specimens of a county hospital in 2012-2014
XIAHao-hai,WANGXue-min(ThePeople’sHospitalofTongshanCounty,Tongshan437600,China)
[Abstract]ObjectiveTo analyze the distribution and antimicrobial resistance of Escherichia coli (E. coli) causing infection in a county hospital, and provide basis for clinical treatment of E. coli infection. MethodsFrom 2012 to 2014, all kinds of clinical specimens in a hospital were performed bacterial culture, identification, and antimicrobial susceptibility testing; extended-spectrum β-lactamases (ESBLs) were initially screened by broth microdilution method, and confirmed by disc diffusion method; data were statistically analyzed by WHONET 5.6 and SPSS 19.0 software. Results271 isolates of E. coli were detected, and mainly isolated from midstream urine (26.94%). The detection rate of ESBLs-producing E. coli was 49.82%, most were isolated from sputum specimens ( 56.52%), but there was no significant difference in detection rates of ESBLs-producing E.coli isolated from different specimens (P>0.05). Antimicrobial susceptibility testing results showed that the resistance rate of E.coli to penicillins was the highest (>90%), to cefalotin and cefuroxime were both >75%, susceptibility rates to amikacin and piperacillin / tazobactam were both high (resistance rates<10%), carbapenem-resistant strain was not found, resistance rates of ESBLs-producing strains to most antimicrobial agents were significantly higher than non-ESBLs-producing strains.ConclusionE. coli is mainly isolated from midstream urine specimens, antimicrobial resistance of ESBL-producing strains is more serious.
[Key words]Escherichia coli; extended-spectrum β-lactamase; clinical distribution; drug resistance, microbial; drug resistance
[收稿日期]2015-09-29
[作者简介]夏浩海(1979-),男(汉族),湖北省通山县人,主管检验师,主要从事细菌耐药性监测研究。 [通信作者]夏浩海E-mail:xiahh008@163.com
DOI:10.3969/j.issn.1671-9638.2016.05.010
[中图分类号]R378.2+1
[文献标识码]A
[文章编号]1671-9638(2016)05-0327-04
猜你喜欢
杂志排行
中国感染控制杂志的其它文章
- 微生物核糖体工程在抗生素研发中的应用Application of microbial ribosome engineering in the research and development of antibiotics
- 34例中心静脉导管相关感染病例调查Report of 34 cases of central venous catheter-related infection
- 清菌片电热熏蒸法对幼儿园室内空气消毒的效果Effectiveness of electric heating fumigation with air disinfection mat in indoor air disinfection in the kindergarten
- 常规清洗消毒对胃镜HBV污染的清除效果Effect of routine cleaning and disinfection on eliminating HBV contamination of gastroscopes
- 医院感染管理中培育医院执行力文化的实践与思考
- 某综合ICU耐碳青霉烯鲍曼不动杆菌下呼吸道医院感染暴发调查
