NK细胞受体群谱偏移与肿瘤免疫逃逸及逆转①
2016-06-15田志刚
张 彩 田志刚
(山东大学药学院免疫药物学研究所,济南250012)
·专家述评·
NK细胞受体群谱偏移与肿瘤免疫逃逸及逆转①
张彩田志刚②
(山东大学药学院免疫药物学研究所,济南250012)
[摘要]NK细胞功能的发挥取决于其表面活化受体和抑制性受体识别靶细胞表面相应配体后所传递信号的平衡状态。肿瘤在发生发展的过程中进化出许多机制,调控NK细胞活化受体和抑制性受体的表达及肿瘤细胞NK细胞识别的配体表达的平衡状态,通常表现为活化受体/配体表达受到抑制而抑制性受体/配体表达增强的群谱偏移现象,成为肿瘤细胞削弱肿瘤微环境中NK细胞功能、诱导NK细胞免疫耐受甚至功能耗竭,最终导致肿瘤免疫逃逸的重要机制。本文就肿瘤发生发展过程中NK细胞受体/配体表达的失衡与肿瘤免疫逃逸的关系及基于逆转NK受体及其配体失衡的免疫治疗策略(尤其是抑制性受体的Checkpoint阻断疗法和CAR修饰的NK细胞治疗)等方面的研究进展做一综述。
[关键词]NK细胞;NK细胞受体;肿瘤免疫逃逸;免疫治疗;Checkpoint阻断疗法;CAR-NK

张彩(1965年-),山东大学药学院免疫药物学研究所教授,博士生导师。中国免疫学会肿瘤免疫与生物治疗分会委员,山东免疫学会常务理事,山东免疫学会基础免疫专业委员会副主任委员;国家科学技术奖励评审专家。《中国免疫学杂志》和《Cytokine》编委。主要从事肿瘤免疫学和肝脏免疫学研究。为首承担多项国家自然科学基金项目,作为学术骨干参与国家重点基础研究计划项目二项。为首或作为通讯作者在Hepatology、Mol Cancer Ther等杂志发表SCI收录论文20余篇。

田志刚(1956年- ),中国科学技术大学生命科学学院教授、博士生导师,现任中国科技大学生命科学学院免疫学研究所所长、中国免疫学会理事长、中国免疫学会英文会刊(Cell Mol Immunol)执行主编、中文会刊《中国免疫学杂志》主编。2001 年国家杰出青年获得者、2007 年教育部创新团队负责人、2008 和2011 年国家基金委《天然免疫与重大疾病发生发展》创新群体负责人、2008 年国家自然科学二等奖(首位)、2011 年国家科技进步二等奖(第二位)。主要从事天然免疫和肝脏免疫学研究,以通讯作者在Cell、Nat Immunol、Immunity、J Clin Invest、J Exp Med、PNAS、Nature Commun、Gastroenterology、Hepatology、J Allergy Clin Immunol、PloS Pathogen、J Hepatol等SCI 收录的国外杂志发表论文220篇。
NK细胞是机体重要的天然免疫细胞,不需要预先刺激即可识别并杀伤肿瘤和病毒感染的细胞,同时又能通过早期分泌多种细胞因子和趋化因子来调节获得性免疫应答,位于抗肿瘤和抗病毒感染的第一道防线。近年的研究发现,NK细胞亦具有获得性免疫细胞的特点,如针对某些病毒感染的记忆性二次应答。NK细胞在肿瘤免疫监视过程中发挥关键作用,许多肿瘤病人存在NK细胞功能低下的现象,而NK细胞活性低下的人群具有较高的罹患癌症的危险,各种癌症的发病率较高。NK细胞功能的发挥取决于其表面所表达的活化受体和抑制性受体识别靶细胞表面相应配体后所传递信号的平衡状态。通过活化受体和抑制性受体对靶细胞上相应配体的识别,NK细胞得以感受危险信号,区分正常和异常(受到感染或发生恶性转化)的细胞,发挥其免疫监视作用。抑制性受体能特异性识别靶细胞表面的MHC I类分子并保护正常细胞不被杀伤,由于抑制性受体与其配体结合的亲和力大于活化受体,因此通常以抑制性信号占优势。当细胞发生恶性转化或病毒感染时,细胞表面MHC I类分子表达降低、丢失或发生变异,或高表达能够克服抑制性信号的NK细胞活化受体的配体(如NKG2D配体)时,NK细胞通过受体识别,启动活化信号、增殖,介导对靶细胞的杀伤、分泌IFN-γ等细胞因子而发挥效应功能。但是,在肿瘤从恶性转化至发生发展的过程中,肿瘤细胞与NK细胞间的长期相互作用使肿瘤细胞进化出多种机制来逃避NK细胞的识别和攻击。本文就肿瘤发生发展过程中NK细胞受体/配体表达的失衡与肿瘤免疫逃逸的关系及基于逆转NK受体及其配体失衡的免疫治疗策略等方面的研究进展做一综述。
1NK受体在抗肿瘤免疫应答中的作用
NK细胞表达多种活化受体和抑制性受体,活化受体包括NKG2D、NKG2C、CD226 (DNAM-1)、2B4、CD16和天然细胞毒受体(NCR)家族的NKp46、NKp30及NKp44等,抑制性受体主要有杀伤细胞免疫球蛋白样受体(KIRs)、CD94/NKG2A、TIGIT和CD96等。NK细胞通过抑制性受体识别自我与非我而防止对自身正常细胞的杀伤,更需要强大的活化信号来启动对感染细胞和肿瘤细胞的免疫应答。NKG2D、NCR、CD226和CD16是目前公认的在抗肿瘤免疫应答中发挥关键作用的活化受体。NKG2D表达于所有的NK细胞,在CD8+T细胞、γδT细胞和巨噬细胞表面亦有表达,是分布最为广泛的NK细胞受体,其识别多种由感染、应急、恶性转化或DNA损伤等诱导的配体,包括MICA、MICB及ULBP1-ULBP4等。尤为重要的是,NKG2D与其配体的结合能够克服MHC I类分子介导的抑制性信号对NK活化的抑制作用。因此,NKG2D介导的NK细胞活化能够清除正常表达MHC I类分子的肿瘤细胞[1]。NKG2D缺失小鼠或经NKG2D中和抗体处理后的小鼠极易自发上皮和淋巴系肿瘤,显示了NKG2D在肿瘤免疫监视中的重要作用[2]。
NCR是NK细胞防御和抵抗肿瘤发生发展的重要NK细胞受体,NCR选择性表达于NK细胞,是NK细胞可靠的标志,静止和活化的NK细胞均表达NKp46和NKp30,而NKp44仅表达于活化的NK细胞。NCR在NK细胞的表达水平与NK细胞的杀伤强度呈正相关,NCR相应的抗体阻断可明显削弱NK细胞的杀伤能力。尽管NCR识别的配体尚未完全阐明,已有足够的证据表明NCR配体表达于发生恶性转化或受到病毒感染的多种细胞类型[3]。目前已明确B7-H6和BAT3是NKp30识别的配体,B7-H6在正常细胞不表达,特异表达于肿瘤细胞,包括白血病、淋巴瘤、黑色素瘤等;BAT3亦表达于未成熟DC,介导NK细胞对未成熟DC的杀伤[3,4]。尽管肿瘤细胞表达的NKp46配体尚未鉴定出来,但NKp46缺失的小鼠抵抗淋巴瘤、黑色素瘤、肺癌生长和转移的能力受到明显削弱[5]。
CD226(DNAM-1)表达于多数NK细胞、αβT细胞、γδT细胞和单核细胞表面,作为NK细胞的活化受体,启动NK细胞的活化和对肿瘤细胞的杀伤,且可作为T细胞的共刺激分子促进T细胞的活化[6]。CD226的配体为PVR和nectin-2,在多种肿瘤细胞中(包括卵巢癌、乳腺癌、结肠癌、宫颈癌、血液系统肿瘤和肉瘤等)高表达,且卵巢癌、急性髓样白血病等肿瘤细胞高表达的PVR可下调NK细胞CD226的表达,为其逃避NK细胞攻击的机制之一[6]。CD226介导的NK细胞活化可以被抑制性受体TIGIT和CD96(与CD226识别相同的配体)所拮抗。
2NK受体/配体群谱的偏移促进肿瘤的免疫逃逸
尽管NK细胞能够早期迅速识别恶性转化的肿瘤细胞,具有强大的杀伤肿瘤细胞的能力,但是肿瘤细胞及其微环境在其发生发展的过程中逐渐进化出许多机制来抑制NK细胞的活化和功能,削弱NK细胞介导的抗肿瘤作用。越来越多的证据表明,肿瘤细胞能够通过改变NK细胞受体或配体的表达,抑制活化受体的表达,促进抑制性受体的表达,影响NK细胞受体或配体表达的平衡状态,而抑制NK细胞的活化和杀伤功能[7,8]。肝癌、乳腺癌、肺癌、结直肠癌、宫颈癌、胰腺癌和胃癌等病人NK细胞均存在NKG2D表达下调的现象。而且,随病情的进展,NKG2D水平的下降与NK细胞杀伤功能的降低呈正相关,与肿瘤的发生率和进展程度密切相关[8]。肿瘤细胞表面NKG2D配体与NKG2D的长期接触或慢性刺激,肿瘤细胞释放的外泌体(exosome)表面的NKG2D配体或TGF-β及膜型NKG2D配体剪切成可溶性NKG2D配体的释放均可下调NKG2D的表达水平,使NK细胞处于无功能状态,削弱NKG2D介导的NK细胞免疫监视作用[9,10]。肿瘤细胞或微环境中的免疫负调细胞Treg或MDSC分泌的TGF-β、PGE2和IDO均可抑制NKG2D的表达[11]。NKp30和NKp46表达的下调也是削弱NK细胞活性,促进肿瘤进展的免疫逃逸机制之一。多种实体瘤和血液系统肿瘤(包括乳腺癌、肝癌、胰腺癌、胃癌、结直肠癌、肺癌、宫颈癌、卵巢癌、急性髓样白血病、慢性淋巴细胞性白血病)等均可见NKp30和NKp46表达的下调和NK细胞功能的降低,并与疾病的进展相关[8]。其他NK细胞活化受体,如NKG2C、CD226、CD244及NKp44等的下调亦见于多种肿瘤[8]。肿瘤微环境不仅影响NK细胞活化受体的表达,NK细胞功能的丧失还与抑制性受体表达的上调有关。许多肿瘤微环境中的NK细胞表现为抑制性受体(如NKG2A、KIR)表达增加,用KIR或NKG2A阻断性抗体处理可明显恢复NK细胞的活化和功能[8]。
另一方面,肿瘤细胞亦通过调节自身NK细胞受体配体的表达(如下调活化受体的配体、上调抑制性受体的配体)来逃逸NK细胞的识别与攻击。主要表现为活化受体NKG2D配体MICA、MICB及ULBPs和NKp30的配体(B7-H6,BAG6)在基质金属蛋白酶的剪切下释放出可溶性配体形式,一方面降低了肿瘤细胞膜表面NK细胞配体的表达,削弱了NK细胞活化信号的传递;另一方面,可溶性的NKG2D或NKp30配体进一步遮蔽或抑制NK细胞表面NKG2D和NKp30活化受体的表达,降低NK细胞的活性和功能[9,12]。多种肿瘤病人血清可溶NKG2D配体的水平与病程进展相关,可作为病情诊断和预测预后的生物学标志[8,13]。抑制性受体的配体(如CD94/NKG2A的配体HLA-E和ILT2/4及KIR2DL4的配体HLA-G)在多种肿瘤(包括骨髓瘤、白血病、黑色素瘤、胶质瘤、乳腺癌、结直肠癌、肺癌和肾癌等)呈现高表达,且与不良预后密切相关[14]。高表达的HLA-G和HLA-E抑制NK细胞的杀伤活性,且可诱导肿瘤微环境MDSC的扩增;可溶性HLA-G(sHLA-G)作为肿瘤微环境的抑制因子削弱肿瘤浸润的NK细胞和T细胞的效应功能,促进肿瘤的免疫逃逸,且与肿瘤的进程及肿瘤大小成正相关[14]。
总之,肿瘤微环境的多种因素促使NK细胞受体/配体谱发生偏移,活化受体/配体表达降低,抑制性受体/配体表达增强,使NK细胞识别信号平衡向抑制方向倾斜,抑制NK细胞的活化和杀伤功能,甚至导致NK细胞失功能或功能耗竭,促进肿瘤的免疫逃逸。
3基于纠正NK受体/配体群谱偏移的免疫治疗策略
鉴于NK细胞在抗肿瘤免疫中的重要作用,基于NK细胞的抗肿瘤免疫治疗在血液系统肿瘤已取得了较好的治疗效果,在黑色素瘤、肾癌、肺癌、肝癌等实体瘤的治疗中亦显示出良好的治疗前景。这些治疗策略主要是基于NK细胞发挥作用的功能特点,以纠正肿瘤微环境中NK受体/配体群谱偏移、逆转NK细胞的功能失调状态、恢复或加强NK细胞的抗肿瘤免疫应答能力为目的(图1)。
3.1免疫检查点阻断疗法(Checkpoint Blockade)靶向抑制T细胞表面抑制性受体的免疫检查节点阻断疗法已成为近年抗肿瘤免疫治疗的热点,尤其是抗CTLA-4和PD-1或PD-L1单克隆抗体用于黑色素瘤等实体瘤的治疗取得了引人注目的效果[15,16]。其能够通过阻断抑制T细胞活化的抑制性信号,激活肿瘤微环境中受到抑制的T细胞应答,纠正免疫耐受状态,开辟了肿瘤免疫治疗的新时代,被Science杂志评为2013年十大科技突破的榜首。
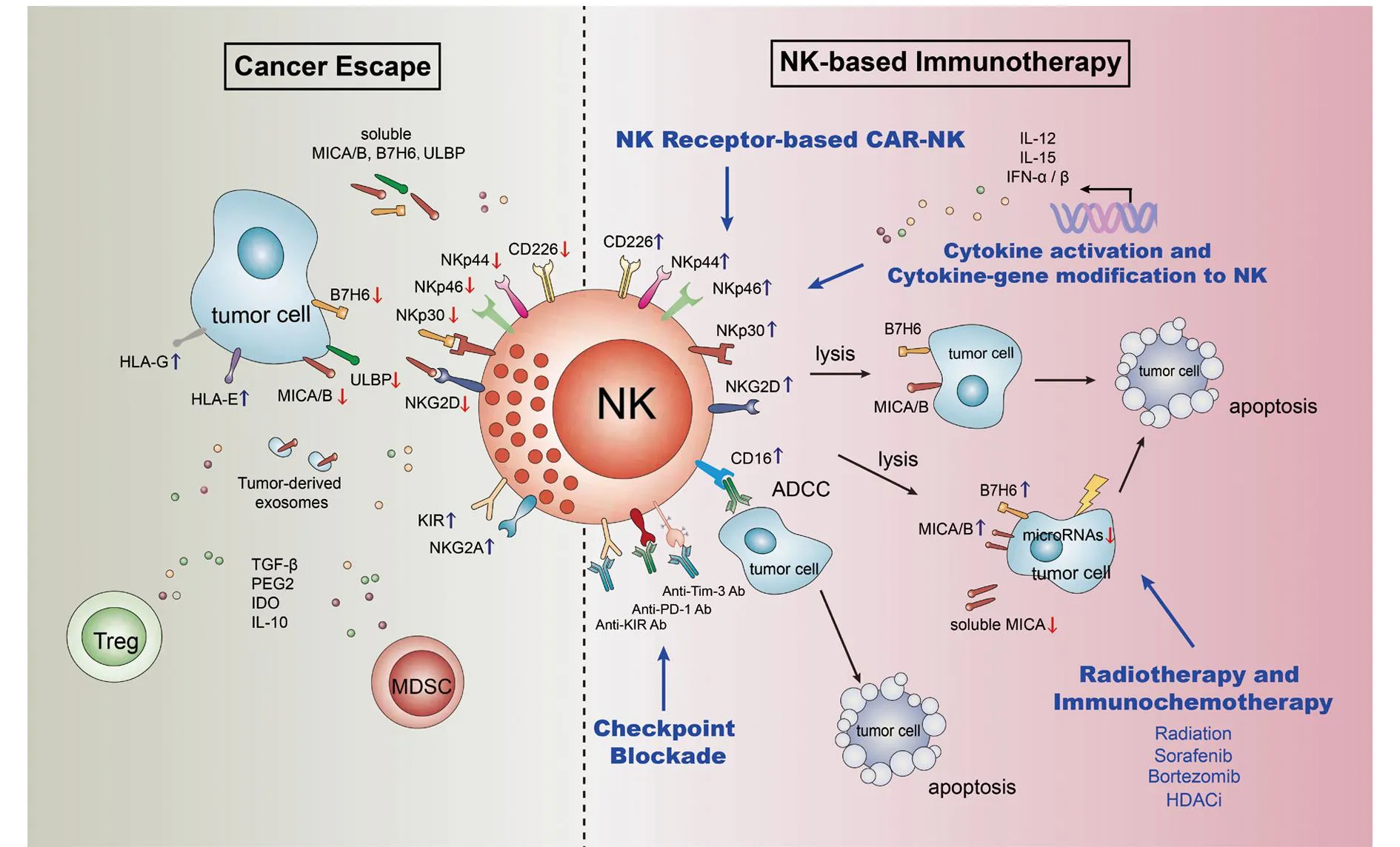
图1 NK细胞受体群谱偏移与肿瘤免疫逃逸及逆转策略Fig.1 Imbalance of NK cell receptors and tumor escape as well as reversal therapeutic strategies
由于抑制性受体在调控NK细胞活化中发挥关键的免疫checkpoint作用,且肿瘤微环境存在NK细胞抑制性受体表达占优势的免疫耐受状态,这种checkpoint阻断疗法亦适用于基于激活NK细胞的抗肿瘤免疫治疗,通过阻断NK细胞抑制性信号纠正NK受体失衡的免疫失功能状态增强NK细胞抗肿瘤免疫应答,从而展示出很好的应用前景。已发现多发性骨髓瘤病人NK细胞高表达PD-1,用抗PD-1单抗治疗可恢复NK细胞的抗肿瘤活性[17]。而靶向NK细胞抑制性受体KIR的单抗(IPH2102)作为直接的NK 细胞 checkpoint blockade已被应用于血液系统肿瘤(如白血病、淋巴瘤和多发性骨髓瘤)的Ⅰ期和Ⅱ期临床实验性治疗,并显示出安全性和有效性[11]。抗KIR单抗与抗CTLA-4单抗(Ipilimumab)联合应用亦已完成针对非小细胞肺癌、前列腺癌、黑色素瘤等进展期实体瘤病人的I期临床实验性治疗(NCT01750580),与抗PD-1单抗联合治疗进展期实体瘤病人正在进行I期临床实验性治疗(NCT01714739)。靶向另一重要的NK细胞抑制性受体NKG2A的单抗药物 IPH2201正在进行复发或难治性慢性淋巴细胞白血病的Ⅰ期和Ⅱ期实验治疗(NCT02557516)。NK细胞表达TIM-3和LAG-3抑制性checkpoint受体,此二者在肿瘤患者NK细胞高表达,促进肿瘤微环境NK细胞的免疫抑制状态,目前,抗TIM-3单抗药物MBG453正开始招募参与者单独或与抗PD-1单抗联合用于肺癌、肾癌等恶性肿瘤的Ⅰ期和Ⅱ期临床实验性治疗(NCT 02608268);抗LAG-3单抗正在进行难治性或复发性白血病、淋巴瘤和多发性骨髓瘤的I期临床实验性治疗(NCT 02061761)或与抗PD-1单抗联合用于肝癌、宫颈癌、卵巢癌、膀胱癌、肾癌和非小细胞肺癌等进展期实体瘤的实验性治疗(NCT 01968109)。我们实验室发现免疫抑制性受体TIGIT表达于NK细胞,且在小鼠急性病毒性肝炎和肝再生模型中观察到其对NK细胞活化的负调节作用,阻断TIGIT信号可增强NK细胞的活化和IFN-γ产生[18,19]。我们亦观察到TIGIT在不同小鼠荷瘤模型NK细胞高表达,且肿瘤微环境TIGIT+NK细胞呈现功能耗竭状态,用抗体阻断TIGIT信号可恢复NK细胞的抗肿瘤功能(未发表资料)。这些结果提示,TIGIT有望作为一个免疫checkpoint阻断靶点以激活NK细胞的抗肿瘤免疫应答能力并用于肿瘤的治疗。
3.2NK细胞过继免疫治疗自体或同种异体NK细胞过继转输用于抗肿瘤免疫治疗已应用于临床,对于血液系统肿瘤显示出良好的治疗效果。由于能够消除KIR识别MHCⅠ类分子传递的抑制性信号,体外活化扩增的KIR不匹配的异基因NK细胞过继转输,较自体或KIR类型相同来源的NK细胞具有更好的抗白血病治疗效果,降低白血病的复发率,且不会引起GVHD反应。IL-12、IL-15、Ⅰ型干扰素等细胞因子不仅能够促进NK细胞活化、维持NK细胞的存活,且可增强NK细胞活化受体的表达、下调抑制性受体的表达,从而增强NK细胞的抗肿瘤功能[20,21]。因此利用细胞因子体外活化的NK细胞进行肿瘤的过继细胞免疫治疗显示出一定的优势,已在体内观察到IL-12、IL-15与IL-18联合激活的NK细胞输入体内后具有更长的生存期和更高的分泌IFN-γ的能力[22],并可在低剂量IL-2作用下大量扩增。重要的是其具有记忆性的特点,再次刺激可明显增强其细胞毒活性和IFN-γ分泌能力[23]。此细胞因子联合诱导的记忆样NK细胞过继转输疗法正在进行复发或难治性急性髓样白血病的临床实验性治疗(NCT01898793)。而IL-15、IFN-α等基因修饰的NK细胞可避免细胞因子直接应用的毒性作用而显示出更好的优势[24,25]。
嵌合抗原受体修饰的免疫细胞主要是对T细胞进行修饰改造(即CAR-T技术),将能够特异性识别肿瘤抗原的单链抗体与T细胞的胞内信号CD3ζ或共刺激信号分子相连,使T细胞能特异性结合肿瘤细胞表面抗原的受体而将T细胞靶向“锚定”在肿瘤细胞上,且无MHC限制性,可避免因肿瘤细胞MHC下调或丢失导致的免疫逃逸。因此,被重新编码的T细胞能获得特异性识别和攻击杀伤肿瘤细胞的能力,尤其对白血病等血液系统肿瘤细胞有很强的识别能力。该技术在血液系统肿瘤及进展期黑色素瘤取得了明显的临床治疗效果。尤其是CD19-CAR T细胞能够明显减低B细胞淋巴瘤病人的长期复发[26]。目前该技术亦开始探讨应用于其他免疫细胞,即扩展为CAR-NK、CAR-NKT和CAR-γδT技术等。鉴于NK细胞在抗肿瘤免疫应答中的重要作用及其具有非肿瘤抗原限制性迅速杀伤肿瘤和ADCC效应等特点,CAR修饰的NK细胞治疗具有与CAR-T细胞治疗相媲美甚至优于CAR-T细胞的应用前景,近年的研究亦取得了特别可喜的进展。特异性靶向B细胞淋巴瘤的CD19和CD20、靶向上皮来源肿瘤的HER2、EPCAM及黑色素瘤相关抗原gp100、前列腺癌干细胞相关抗原PSCA、多发性骨髓瘤CD138等CAR修饰的NK细胞技术已相继建立,并转染入NK细胞系NK-92或原代NK细胞,正在进行临床前研究,表现出明显增强的抗肿瘤活性,并在异基因移植瘤模型中显示出明显的抑制肿瘤生长的效应[27,28]。靶向CD19的CAR修饰的半相合NK细胞用于B细胞急性淋巴细胞白血病的临床实验性治疗一项已完成I期治疗(美国St.Jude儿童研究医院,NCT00995137),另一项正在进行II期临床实验性治疗(新加坡国立大学,NCT01974479)。而基于NK细胞识别和功能特点,构建胞外表达NK细胞活化受体的CAR-NK技术展示出独特的优势,目前已有表达NKG2D的CAR-NK细胞成功建立,并表现出对急性淋巴细胞白血病、骨肉瘤、前列腺癌等多种肿瘤明显增强的杀伤效果[29]。这种嵌合表达的NK活化受体能够特异性地靶向识别肿瘤细胞表面相应的配体,并激发胞内活化信号。由于不会因与其配体的长期接触而内化表达下降,从而能够保持其活化受体的优势表达,而且由于其胞内表达一个或多个共刺激信号区,使CAR-NK细胞具有更强的细胞毒活性、细胞增殖和分泌细胞因子的能力。其他NK细胞活化受体(如NKp30、NKp46、CD226等)亦有望成为CAR-NK细胞技术的候选靶标。尤为重要的是,CAR-NK细胞的优势在于由于其体内较短的存活期,不需要引入自杀基因来限制其扩增,不会产生CAR-T细胞治疗易造成的细胞因子风暴等副作用[27,28]。
3.3增强肿瘤细胞表面NK受体配体的表达提高肿瘤对NK细胞杀伤的敏感性鉴于NK细胞受体配体的表达水平在调控NK细胞受体表达和功能方面的关键作用,许多肿瘤通过下调NK细胞活化受体配体的表达而上调抑制性配体的表达来逃逸NK细胞介导的杀伤,某些治疗策略旨在通过调节肿瘤细胞表面NK受体配体的表达水平、纠正NK受体配体表达的偏移或失衡来增强NK细胞的抗肿瘤效应,关注最多的是NKG2D配体MICA/B或ULBPs。Ⅰ型干扰素和TLR激动剂可增强肿瘤细胞或DC/mφ表面NKG2D配体的表达而增强NK细胞的杀伤活性[30-32],此为其促进NK细胞抗肿瘤免疫应答的机制之一。近年的研究发现,某些化疗药物不仅具有直接的抑制肿瘤增殖、促进肿瘤凋亡的作用,还能调节肿瘤细胞NK受体配体的表达,增加肿瘤细胞对免疫细胞杀伤的敏感性。索拉菲尼是一种新型的多靶向抗肿瘤药物,既可阻断RAF/MEK/ERK介导的细胞信号传导通路,直接抑制肿瘤细胞的增殖;又可抑制新生血管的形成,抑制肿瘤生长。近年发现,索拉菲尼还可促进肝癌细胞膜型MICA的表达,降低可溶性MICA的释放从而增强NK细胞介导的抗肿瘤活性[33]。低剂量蛋白酶抑制剂硼替佐米(bortezomib)亦因促进肝癌细胞表面MICA/B的表达而具有抑制肝癌细胞增殖和增强NK细胞抗肿瘤效应的双重作用[34]。组蛋白去乙酰化酶抑制剂(HDACi)亦可促进多种肿瘤细胞MICA/B的表达,增强肿瘤细胞对NK杀伤的敏感性。其不仅可直接通过促进组蛋白的乙酰化增强MICA/B的转录,而且可表观抑制靶向调控MICA/B相关miRNA(如miR-20a、miR-93、miR-106b及miR-17-92)的转录[35]。放射治疗由于DNA损伤和电离辐射等细胞应激效应可诱导肿瘤细胞表面NKG2D配体的表达,增强肿瘤细胞对NK细胞杀伤的敏感性[36,37]。除NKG2D配体之外,我们实验室最近发现,化疗(如顺铂、5-氟尿嘧啶)或放疗及热休克、细胞因子治疗均可促进肿瘤细胞表面NKp30配体B7-H6表达的增加,从而增强对NK细胞杀伤的敏感性[38]。因此,将化疗或化疗与免疫治疗联合应用具有协同增强的抗肿瘤治疗效果。
4展望
由于NK细胞在抗肿瘤免疫应答中的关键作用,且NK细胞具有不需预先刺激即可识别和杀伤恶性转化的肿瘤细胞、NK细胞易于分离和大量体外扩增及体内生存期相对较短等特点,基于NK细胞的免疫治疗已成为具有独特优势的抗肿瘤免疫治疗手段。目前已有外周血、脐血、胚胎干细胞或诱导的多能干细胞(iPS)来源的NK细胞正在进行各种肿瘤的实验研究或临床实验性治疗。基于纠正NK受体/配体群谱偏移的免疫治疗策略(尤其是抑制性受体的checkpoint阻断疗法和CAR修饰的NK细胞治疗)更有利于纠正肿瘤微环境中NK细胞的功能失调状态、增强NK细胞的活性和抗肿瘤免疫应答能力,具有诱人的应用前景。但是其成功地应用于临床仍存在着许多亟待解决的问题,例如,CAR修饰的NK细胞治疗中病毒性载体的安全性及非病毒载体的研发;需要加强NK细胞迁移、浸润入实体瘤内部并维持活性的能力,如改变NK细胞趋化因子受体的表达或增强肿瘤微环境趋化因子的丰度等,此为增强NK细胞对实体瘤治疗效果的关键;根据不同肿瘤类型、不同病人的个体化特点,合理地将不同的免疫治疗方法或与放疗/化疗联合应用,既提高NK细胞的抗肿瘤活性又增强肿瘤细胞对免疫治疗的敏感性,将会取得更理想的治疗效果。
参考文献:
[1]Bauer,Groh V,Wu J,etal.Activation of NK cells and T cells by NKG2D,a receptor for stress-inducible MICA[J].Science,1999,285 (5428):727-729.
[2]Guerra N,Tan YX,Joncker NT,etal.NKG2D-deficient mice are defective in tumor surveillance in models of spontaneous malignancy[J].Immunity,2008,28(4):571-580.
[3]Kruse PH,Matta J,Ugolini S,etal.Natural cytotoxicity receptors and their ligands[J].Immunol Cell Biol,2014,92(3):221-229.
[4]Koch J,Steinle A,Watzl C,etal.Activating natural cytotoxicity receptors of natural killer cells in cancer and infection[J].Trends Immunol,2013,34(4):182-191.
[5]Glasner A,Ghadially H,Gur C,etal.Recognition and prevention of tumor metastasis by the NK receptor NKp46/NCR1[J].J Immunol,2012,188(6):2509-2515.
[6]Wu MR,Zhang T,Alcon A,etal.DNAM-1-based chimeric antigen receptors enhance T cell effector function and exhibit in vivo efficacy against melanoma[J].Cancer Immunol Immunother,2015,64(4):409-418.
[7]Zhang C,Zhang J,Wei H,etal.Imbalance of activating and inhibitory killer cell receptors of the NKG2 family:why tumors escape from innate immunity?[J].Int Immunopharmacol,2005,5(7-8):1099-1111.
[8]Sun C,Sun H,Zhang C,etal.NK cell receptor imbalance and NK cell dysfunction in HBV infection and hepatocellular carcinoma[J].Cell Mol Immunol,2015,12(3):292-302.
[9]Ullrich E,Koch J,Cerwenka A,etal.New prospects on the NKG2D/NKG2DL system for oncology[J].Oncoimmunology,2013,2(10):e26097.
[10]Lundholm M,Schröder M,Nagaeva O,etal.Prostate tumor-derived exosomes down-regulate NKG2D expression on natural killer cells and CD8+T cells:mechanism of immune evasion[J].PLoS One,2014,9(9):e108925.
[11]Morvan MG,Lanier LL.NK cells and cancer:you can teach innate cells new tricks[J].Nat Rev Cancer,2015,6(1):7-19.
[12]Schlecker E,Fiegler N,Arnold A,etal.Metalloprotease-mediated tumor cell shedding of B7-H6,the ligand of the natural killer cell-activating receptor NKp30[J].Cancer Res,2014,74(13):3429-3440.
[13]Kumar V,Yi Lo PH,Sawai H,etal.Soluble MICA and a MICA variation as possible prognostic biomarkers for HBV-induced hepatocellular carcinoma[J].PLoS One,2012,7:e44743.
[14]Kochan G,Escors D,Breckpot K,etal.Role of non-classical MHC class I molecules in cancer immunosuppression[J].Oncoimmunology,2013,2(11):e26491.
[15]Pico de Coaa Y,Choudhury A,Kiessling R.Checkpoint blockade for cancer therapy:revitalizing a suppressed immune system[J].Trends Mol Med,2015,21(8):482-491.
[16]Mellman I,Coukos G,Dranoff G.Cancer immunotherapy comes of age[J].Nature,2011,480(7378):480-489.
[17]Benson DM Jr,Bakan CE,Mishra A,etal.The PD-1/PD-L1 axis modulates the natural killer cell versus multiple myeloma effect:a therapeutic target for CT-011,a novel monoclonal anti-PD-1 antibody[J].Blood,2010,116(13):2286-2294.
[18]Bi J,Zhang Q,Liang D,etal.T-cell Ig and ITIM domain regulates natural killer cell activation in murine acute viral hepatitis[J].Hepatology,2014,59(5):1715-1725.
[19]Bi J,Zheng X,Chen Y,etal.TIGIT safeguards liver regeneration through regulating natural killer cell-hepatocyte crosstalk[J].Hepatology,2014,60(4):1389-1398.
[20]Zhang C,Zhang J,Niu J,etal.Interleukin-12 improves cytotoxicity of natural killer cells via upregulated expression of NKG2D[J].Human Immunol,2008,69(8):490-500.
[21]Zhang C,Zhang J,Niu J,etal.Interleukin-15 improves cytotoxicity of natural killer cells via up-regulating NKG2D and cytotoxic effector molecule expression as well as STAT1 and ERK1/2 phosphorylation[J].Cytokine,2008,42(1):128-136.
[22]Cooper MA,Elliott JM,Keyel PA,etal.Cytokine-induced memory-like natural killer cells[J].Proc Natl Acad Sci USA,2009,106(6):1915-1919.
[23]Berrien-Elliott MM,Wagner JA,Fehniger TA.Human cytokine-induced memory-like natural killer cells[J].J Innate Immun,2015,7(6):563-571.
[24]Jiang W,Zhang C,Tian Z,etal.hIFN-alpha gene modification augments human natural killer cell line anti-human hepatocellular carcinoma function[J].Gene Ther,2013,20(11):1062-1069.
[25]Jiang W,Zhang C,Tian Z,etal.hIL-15 gene-modified human natural killer cells (NKL-IL15) augments the anti-human hepatocellular carcinoma effect in vivo[J].Immunobiology,2014,219(7):547-553.
[26]Maus MV,Grupp SA,Porter DL,etal.Antibody-modified T cells:CARs take the front seat for hematologic malignancies[J].Blood,2014,123(17):2625-2635.
[27]Glienke W,Esser R,Priesner C,etal.Advantages and application of CAR-expressing natural killer cells[J].Front Pharmacol,2015,6:21.
[28]Hermanson DL,Kaufman DS.Utilizing chimeric antigen receptors to direct natural killer cell activity[J].Front Immunol,2015,6:195.
[29]Chang YH,Connolly J,Shimasaki N,etal.A chimeric receptor with NKG2D specificity enhances natural killer cell activation and killing of tumor cells[J].Cancer Res,2013,73(6):1777-1786.
[30]Zhang C,Niu J,Zhang J,etal.Opposing effect of IFNα and IFNγ on expression of MHC class I chain-related A in tumors[J].Cancer Sci,2008,99(6):1279-1286.
[31]Ebihara T,Masuda H,Akazawa T,etal.Induction of NKG2D ligands on human dendritic cells by TLR ligand stimulation and RNA virus infection[J].Int Immunol,2007,19(10):1145-1155.
[32]Zhou Z,Zhang C,Zhang J,etal.Macrophages help NK cells to attack tumor cells by stimulatory NKG2D ligand but protect themselves from NK killing by inhibitory ligand Qa-1[J].PloS One,2012,7(5):e36928.
[33]Kohga K,Takehara T,Tatsumi T,etal.Sorafenib inhibits the shedding of major histocompatibility complex class I-related chain A on hepatocellular carcinoma cells by down regulating a disintegrin and metalloproteinase 9[J].Hepatology,2010,51(4):1264-1273.
[34]Armeanu S,Krusch M,Baltz KM,etal.Direct and natural killer cell-mediated antitumor effects of low-dose borte zomib in hepatocellular carcinoma[J].Clin Cancer Res,2008;14(11):3520-3528.
[35]Yang H,Lan P,Hou Z,etal.Histone deacetylase inhibitor SAHA epigenetically regulates miR-17-92 cluster and MCM7 to up regulate MICA expression in hepatoma[J].Br J Cancer,2015,112(1):112-121.
[36]Raulet DH,Gasser S,Gowen BG,etal.Regulation of ligands for the NKG2D activating receptor[J].Annu Rev Immunol,2013,31:413-441.
[37]Rosental B,Appel MY,Yossef R,etal.The effect of chemotherapy/radiotherapy on cancerous pattern recognition by NK cells[J].Curr Med Chem,2012,19(12):1780-1791.
[38]Cao G,Wang J,Zheng X,etal.Tumor Therapeutics Work as Stress Inducers to Enhance Tumor Sensitivity to Natural Killer (NK) Cell Cytolysis by Up-regulating NKp30 Ligand B7-H6[J].J Biol Chem,2015,290(50):29964-29973.
[收稿2016-01-20]
(编辑许四平)
Imbalance of NK cell receptors and tumor immune escape as well as reversal strategies
ZHANGCai,TIANZhi-Gang.
InstituteofImmunopharmacologyandImmunotherapy,SchoolofPharmaceuticalSciences,ShandongUniversity,Ji′nan250012,China
[Abstract]The effector functions of NK cells are regulated by integrated signals across the array of stimulatory and inhibitory receptors engaged upon interaction with target cell surface ligands.Tumor cells and tumor microenvironment have evolved several mechanisms to regulate the expression of activating/inhibitory receptors on NK cells or ligands for NK cell receptors on tumor cells,leading to imbalance of NK cell receptors or ligands and negatively influence the activity and function of NK cells,thus finally leading to NK cell tolerance or exhaustion as well as tumor escape.In this review,we focus on the association of imbalance expression of NK cell receptors or ligands and tumor immune escape.We discuss specifically on the development of novel mono- and combinatorial strategies (particularly the inhibitory receptor checkpoint blockade and CAR-NK therapy) to rescue the imbalance of NK cell receptors and dysfunction of NK cells for successful and effective tumor therapy.
[Key words]Natural killer cell;NK cell receptor;Tumor immune escape;Immunotherapy;Checkpoint blockade;CAR-NK
doi:10.3969/j.issn.1000-484X.2016.05.001
中图分类号R392.12
文献标志码A
文章编号1000-484X(2016)05-0609-06
①本文受国家重点基础研究发展计划(973)项目(2013CB944901)和国家自然科学基金项目(81273220, 81472646, 91442114)资助。
②中国科学技术大学免疫学研究所,合肥230026。