转胡杨PeDREB2b基因白三叶表型变异及抗旱性评价
2016-06-14钱瑭璜雷江丽刘建华宋凤鸣
钱瑭璜,雷江丽,刘建华,宋凤鸣,马 楠
(1.深圳市中科院仙湖植物园,南亚热带植物多样性重点实验室,广东 深圳 518004;2.深圳市铁汉生态环境股份有限公司,广东 深圳 518040)
转胡杨PeDREB2b基因白三叶表型变异及抗旱性评价
钱瑭璜1,2,雷江丽1,刘建华2,宋凤鸣2,马 楠1
(1.深圳市中科院仙湖植物园,南亚热带植物多样性重点实验室,广东 深圳 518004;2.深圳市铁汉生态环境股份有限公司,广东 深圳 518040)
摘要:选取W1-2、W1-3、W4-2、W13-4、W17-1、W28-2、W33-3这7个转胡杨(Populus euphratica) PeDREB2b基因白三叶(Trifolium repens)株系为试材,以非转基因白三叶海发为对照,测定了植株的形态特征和永久萎蔫率,以及在不同时间、不同浓度PEG模拟干旱胁迫下的叶片相对含水量、相对电导率和丙二醛含量的变化,旨在评价转基因白三叶株系的抗旱能力。结果表明:1)部分转基因白三叶株系的叶形、叶色、叶片斑纹及叶片大小发生了较明显的变化;2)转基因株系W1-3、W28-2永久萎蔫率明显低于对照,且能维持较长时间的正常生长,表现出一定的抗旱性;3)随着模拟干旱胁迫程度的增加及时间的延长,参试材料的叶片相对含水量呈不同程度下降的趋势,叶片相对电导率、丙二醛含量均有不同程度升高。但转基因株系W1-3、W28-2的叶片相对含水量始终保持较高水平,未出现较大波动,且株系W1-3的相对电导率、丙二醛含量始终保持较低水平,变化较小。综合分析表明,7个转基因白三叶株系的抗旱性强弱依次为W1-3>W33-3>W28-2>W1-2>W13-4>W17-1>W4-2,均优于对照白三叶海发品种。
关键词:白三叶;转基因;表型变异;抗旱性
白三叶(Trifoliumrepens)属于豆科(Leguminosae)多年生草本地被植物,具有外观优美、适应性强、根系发达等特点,是良好的水土保持植物,同时白三叶营养丰富、产量高,也是优良牧草[1-2]。干旱胁迫是影响白三叶生长最主要的环境胁迫因子之一,限制了其在我国干旱半干旱地区的种植。伴随植物基因工程技术的日益成熟,通过导入抗旱相关基因培育抗旱植物新品种是改良植物抗旱性的有效手段之一[3-4]。DREB转录因子能够识别与干旱、高盐及低温等胁迫应答相关的基因启动子区域中的DRE 顺式作用元件并与之结合,启动其下游抗逆基因的表达,引起脯氨酸及可溶性糖含量提高,从而增强植株对多种逆境(旱、冻及盐)的抵抗性[5-7]。目前已从水稻(Oryzasativa)、棉花(Gossypiumhirsutum)、毛白杨(Populustomentosa)等几十种植物中分离并鉴定出调控干旱、高盐及低温耐性的DREB基因;并通过转基因技术将外源DREB转录因子基因转入小麦(Triticumaestivum)、棉花、苜蓿(Medicagosativa)等植物中,研究显示胁迫条件下转基因后代较受体材料抗性显著增强[8-10]。
深圳市仙湖植物园抗旱转基因课题组前期已通过农杆菌浸种法将课题组克隆的胡杨(Populuseuphratica)PeDREB2b基因导入白三叶海发品种中,对其无性繁殖后代跟踪检测,筛选获得了一批转基因株系,但对其抗旱特性还未进行系统研究。本研究通过测定其中生长表现较好的7个白三叶抗旱转基因株系及非转基因对照植株的表型特征、植株永久萎蔫率,以及在PEG模拟干旱胁迫下的相对含水量、相对电导率、丙二醛(MDA)含量等生理指标,客观地评价了转基因白三叶株系与对照在表型及抗旱性方面的差异,旨在为抗旱转基因白三叶新品系培育奠定基础。
1材料与方法
1.1试验材料
试验地位于深圳市仙湖植物园科普实验园,前期采用农杆菌浸种遗传转化法获得35株转胡杨PeDREB2b基因的白三叶,后对其匍匐茎进行跟踪分子检测,筛选出7个转基因白三叶新材料,通过无性扩繁形成新株系(分别命名为W1-2、W1-3、W4-2、W13-4、W17-1、W28-2、W33-3),以非转基因白三叶海发为对照。采其茎段进行扦插繁殖,成活后移入盆中,常规养护管理半年得到试验用苗,植株生长健壮、长势一致。模拟试验采用长41 cm,宽26 cm,高19 cm的塑料盆作为水培器材,将塑料泡沫板打孔后置于盆表面,将试验苗插于盆内的营养液中,营养液选用Hoagland营养液配方。
1.2研究方法
1.2.1转基因白三叶表型特征的观测试验前记录白三叶海发品种及其转基因株系植株的叶形、叶色等数据,然后每株系取从匍匐茎顶端起2~3片成熟叶,共10片于扫描仪下进行扫描,通过Photoshop进行叶长、叶宽及叶面积的测定。
1.2.2转基因白三叶抗旱性研究选取长势基本一致的白三叶海发品种及其转基因株系苗,洗净根部后分别插入泡沫板的孔中,用海绵固定,置于盛有1/2Hoagland营养液的塑料盆上,在营养液中缓苗2 d。配制不同胁迫浓度的聚乙二醇(PEG6000)溶液,浓度分别为50 g·L-1PEG(T1,轻度胁迫)、100 g·L-1PEG(T2,中度胁迫)、150 g·L-1PEG(T3,重度胁迫),对应渗透势分别为-0.5、-1.5、-3.0 MPa。渗透势计算公式如下[11-12]:
ψS=-(1.18×10-2)C-(1.18×10-4)C2+(2.67×10-4)CT+(8.39×10-7)C2T.
式中,ψS为渗透势,C为PEG-6000浓度(g·L-1),T为温度(25 ℃)。
试验各处理均在培养箱内进行,温度为25 ℃,相对湿度为75%~85%,光照周期为12 h/12 h(光照/黑暗)。每胁迫处理选取5株幼苗为重复。以不加PEG6000的幼苗作为对照,于胁迫开始前0 h(CK),胁迫24 h(D1)、胁迫48 h(D2)取样。选择从匍匐茎顶端起2~3片生长良好、大小均一的成熟叶片,每个指标取5株幼苗混合采样,重复3次,进行各项生理指标的测定。
1.3生理指标测定
植株永久萎蔫率采用称重法测定[13]。试验前,将所有参试植株,同一时间浇透水后,断水观察,发现参试植株叶片萎蔫下垂、翌日清晨不能恢复正常,即取盆中土壤测定土壤含水量,即为植物的永久萎蔫率。叶片相对含水量按照饱和含水量法测定[14]。叶片相对电导率采用电导法。MDA含量采用TBA法测定[15]。
1.4数据处理
采用Excel进行原始数据整理;采用SAS 9.0软件进行显著性分析;使用隶属函数法对其耐旱性进行综合评价。
2结果与分析
2.1转基因白三叶株系表型特征变异
部分转基因白三叶株系的叶形、叶色、叶片斑纹及叶片大小等表型特征发生了明显变异(表1)。如株系W13-4叶片形态表现为圆形、深绿色(图1-Ⅳ);W1-2(图1-Ⅱ)、W1-3为椭圆形、浅绿色;而W17-1、W28-2、W33-3则仍表现为倒卵形、绿色与未转基因的白三叶无差异;W4-2叶片斑纹缺失,显示为纯绿色(图1-Ⅲ)。从叶片大小来看,转基因株系W17-1和W28-2的叶长、叶宽及叶面积均显著变小(P<0.05),而W4-2叶片大小较对照显著增大。节间长度除W13-4显著变长外,其它株系同对照无显著差异(P>0.05)。
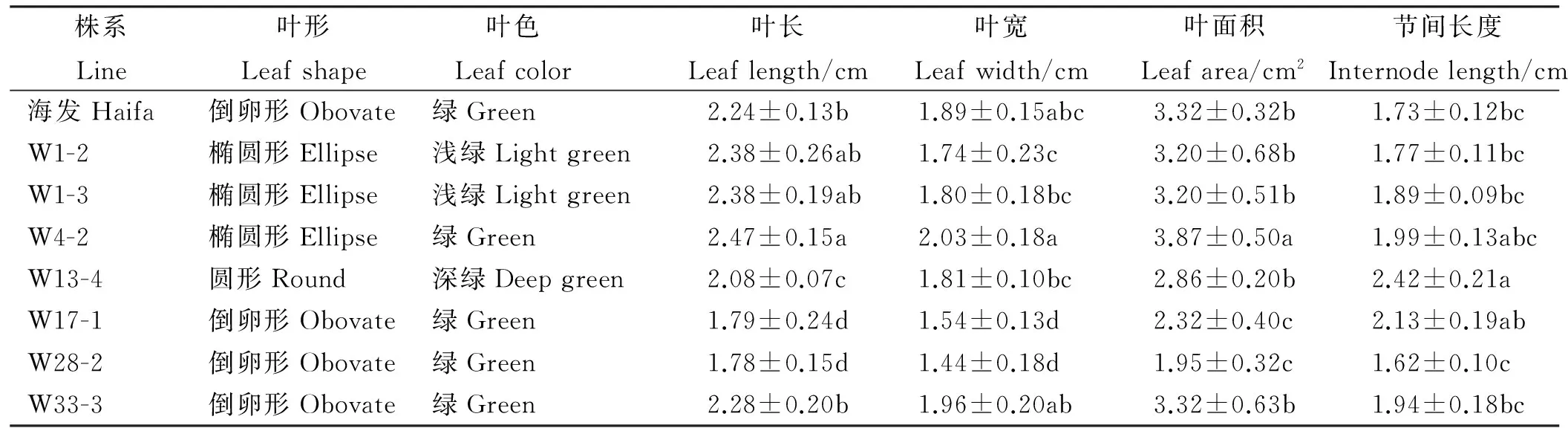
表1 参试白三叶株系表型特征
注:同列不同小写字母表示不同株系间差异显著(P<0.05)。W1-2、W1-3、W4-2、W13-4、W17-1、W28-2、W33-3为转基因株系。下同。
Note:Different lower case letters within the same column indicate significant difference among different lines at 0.05 level. W1-2, W1-3, W4-2, W13-4 ,W17-1, W28-2, W33-3 are all transgenic line. The same below.

图1 部分参试白三叶株型形态
2.2转基因白三叶株系永久萎蔫率的比较
7个白三叶转基因株系的永久萎蔫率均低于对照,表现出一定的抗旱性(表2)。其中W1-3、W28-2永久萎蔫率较对照降低较多,分别降低了36.1%和26.27%,结合断水天数来看,这两个株系均能维持较长时间的正常生长,具有较强的抗旱性。
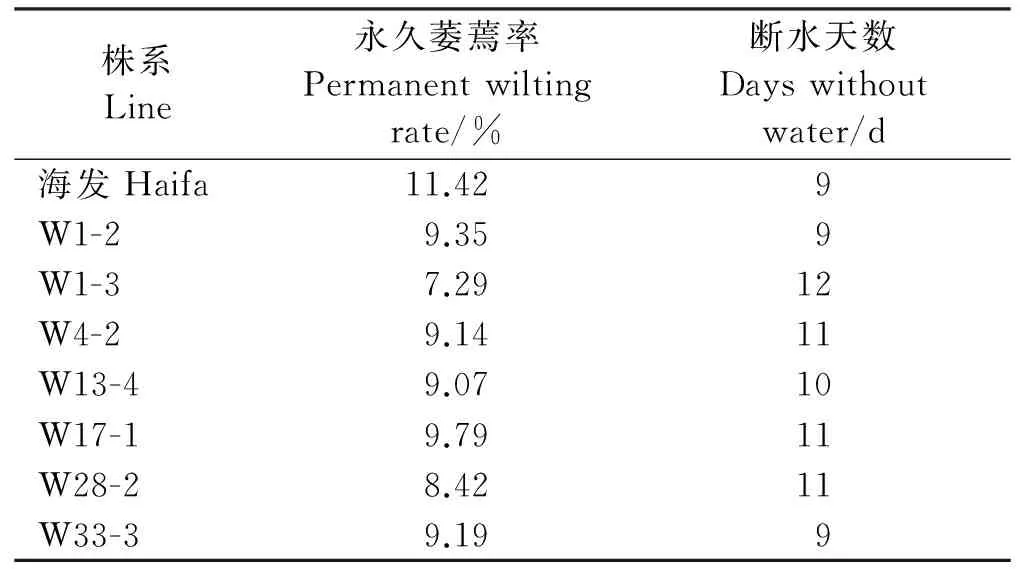
表2 参试白三叶株系永久萎蔫率

图2 模拟干旱胁迫对参试白三叶叶片相对含水量的影响
注:不同小写字母表示不同渗透势不同胁迫时间间差异显著(P<0.05)。下同。
Note: Different lower case letters indicate significant difference among different treatments at 0.05 level. The same below.
2.3干旱胁迫对植物叶片相对含水量的影响
模拟干旱胁迫对7个白三叶转基因株系及对照海发植株叶片的相对含水量产生了较大的影响,随着胁迫时间的延长及胁迫程度的加大,其叶片相对含水量总体呈下降趋势(图2)。在胁迫24 h后,白三叶株系W1-3随胁迫程度的增加呈小幅增高再降低的趋势,梯度间变化差异不显著(P>0.05)。其它株系和对照则随胁迫程度的增加叶片相对含水量下降,其中株系W4-2和W13-4在最高胁迫浓度下,降幅均在40%以上,变化显著(P<0.05)。在模拟干旱胁迫48 h后,除株系W1-3、W33-3随着胁迫浓度的增加降低趋势不显著外,其它白三叶株系及对照的叶片相对含水量均大幅度降低。在T3的胁迫浓度下,对照白三叶海发、株系W13-4的叶片相对含水量降幅均在50%以上;而株系W1-3、W28-2、W1-2、W33-3等4个株系叶片相对含水量降幅较低,分别为20.3%、23.6%、25.5%、26.6%。从白三叶海发及7个转基因株系的叶片相对含水量的变化上来看,在胁迫24和48 h时,株系W1-3、W28-2的叶片相对含水量始终保持较高水平且高于试验组其它株系,在变化趋势上也未随着胁迫的加剧有较大波动,体现出其叶片有较强的保水能力,植株的抗旱能力较强。

图3 模拟干旱胁迫对参试白三叶叶片相对电导率的影响
2.4干旱胁迫对植物叶片相对电导率的影响
白三叶海发及7个转基因株系的叶片相对电导率随胁迫浓度加剧及胁迫时间延长均有不同程度的升高(图3),但动态变化及增加幅度明显不同。在胁迫24 h后,白三叶株系W17-1及W1-3随胁迫浓度的增加呈降低再升高的趋势,其中,W1-3在不同浓度下电导率变化不显著(P>0.05)。其它株系则随胁迫浓度的增加叶片相对电导率呈明显升高趋势,其中对照海发和转基因株系W4-2在最高胁迫浓度下,电导率增幅是其对照的两倍以上。在模拟干旱胁迫48 h后,除白三叶海发、株系W17-1叶片相对电导率随胁迫浓度的增加呈降低再升高的趋势外,其它株系均大幅度升高。

图4 模拟干旱胁迫对参试白三叶叶片丙二醛含量的影响
在T3的胁迫浓度下,对照白三叶海发增幅是对照的4.85倍;而株系W1-3叶片相对电导率增幅则较低,仅为对照的0.53倍。从叶片相对电导率的变化趋势来看,在胁迫24和48 h时,株系W1-3、W1-2、W13-4的叶片相对电导率随着胁迫浓度的加剧变化幅度相对较小,说明了其叶片细胞膜受到的破坏程度较低,具有较强的抗旱能力。
2.5干旱胁迫对植物叶片丙二醛含量的影响
植物器官在逆境条件下,往往发生膜脂过氧化作用,丙二醛(MDA)是其产物之一,通常作为干旱伤害的指标[16-18]。白三叶海发及7个转基因株系的叶片丙二醛含量随胁迫浓度加剧及胁迫时间的延长总体有不同程度的升高(图4)。模拟干旱胁迫24 h后,白三叶株系W4-2、W33-3随胁迫浓度的增加其叶片丙二醛含量呈先增加后小幅降低的趋势;株系W28-2则随胁迫浓度的增加先小幅降低后升高;海发及其它株系植株叶片丙二醛含量随胁迫浓度增加而持续升高。干旱胁迫48 h后,除株系W4-2、W33-3随胁迫浓度的增加呈先增加后小幅降低的趋势外,其它株系植株随胁迫浓度的增加显著升高(P<0.05)。在本研究中,从植株叶片MDA含量的变化积累来看,株系W1-3在试验中其MDA含量始终保持较低水平,且随胁迫的加剧变化较小,说明其叶片受伤害的程度较小,植株耐旱性较强。
2.6白三叶海发及7个转基因株系抗旱性综合评价
植物抗旱性是受多种因素影响的复杂综合性状,这些因素的综合作用才促进了抗旱性的形成[19]。因此,对于植物抗旱性的评价应用尽可能多的指标来综合评价,从而弥补单个指标对于评定植物抗旱性所造成的片面性,使评定结果与实际结果更为接近[20-21]。本研究通过测定白三叶海发及其7个转基因株系的相对含水量、相对电导率、MDA含量3个生理指标在不同浓度的模拟干旱胁迫下,胁迫24和48 h的变化值,并利用隶属函数法,对参试植物的各个指标隶属值进行累加,求取平均值,平均数越大,抗旱性就越强,结果表明(表3),白三叶海发及7个转基因株系抗旱性大小排序为:W1-3>W33-3>W28-2>W1-2> W13-4>W17-1>W4-2>海发。
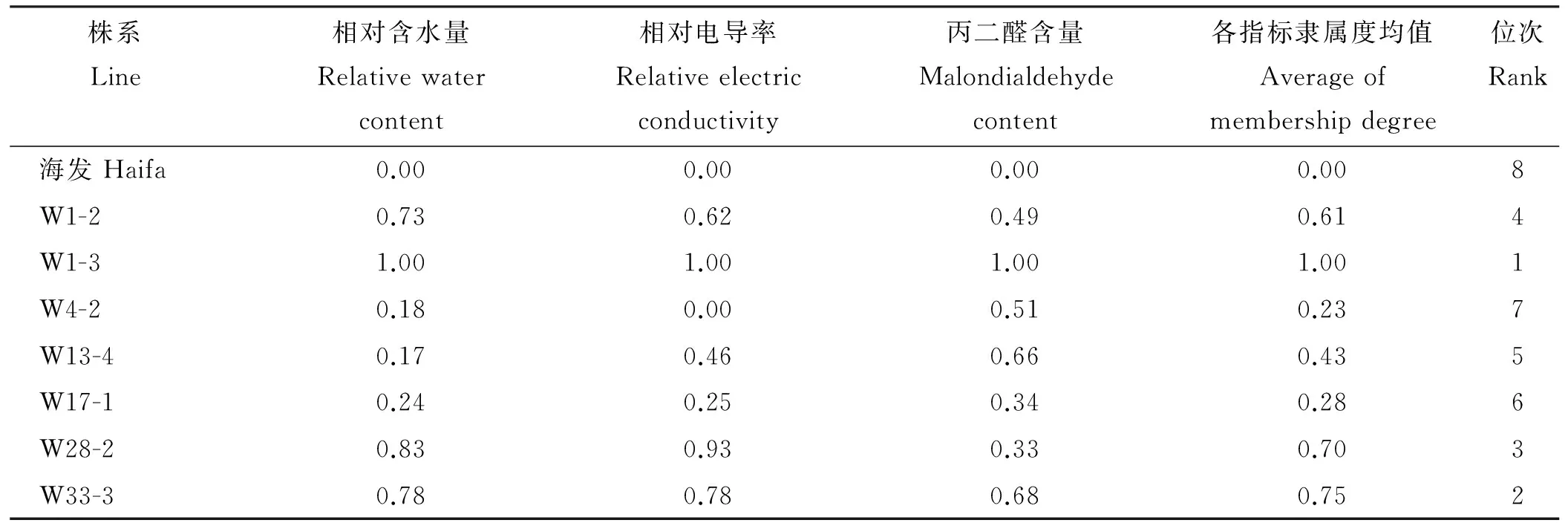
表3 参试白三叶抗旱能力综合评价结果
3讨论与结论
干旱是影响植物生长和发育的主要非生物胁迫因素之一。虽然植物有其自身抵御干旱胁迫的能力,但植物种内和种间抵御干旱胁迫的能力有所不同,这就为培育抗旱植物新品种奠定了物质基础。植物的抗旱性是一个复杂的多基因控制的数量性状,通过转入单个功能基因改良抗旱性的方法,作用单一且有限。已有研究表明,DREB转录因子含有非常保守的DNA结合区,即AP2/EREBP结构域,由58个氨基酸残基组成,它们的N-末端都有碱性氨基酸序列,起核定位信号的作用[22];DREB转录因子能够调控下游一系列与干旱、低温、盐害等逆境胁迫相关的功能基因的表达[23],因此,导入或改良植物的DREB基因是提高植物抗逆性更为有效的方法和途径。
通常植物处于逆境时,由于受外界不利环境的刺激,细胞内产生大量的活性氧物质,在这些物质的作用下,膜脂发生过氧化反应,细胞质膜透性发生变化,大量的电解质和非电解质物质被动的向细胞外渗漏。 植物永久萎蔫率、叶片相对含水量、电导率及MDA含量,常被作为衡量植物抗干旱胁迫能力的有效指标被广泛应用[24-25]。植物永久萎蔫率可以反映植物根系从土壤中吸收水分的能力,本研究抗旱能力综合评价相对较强的转基因株系,如W1-3、W28-2,可以忍受较低的土壤含水量及维持较长时间的正常生长;而对照株系白三叶海发则在短时间内即出现植株萎蔫且不可恢复的现象,其植株永久萎蔫率也最高。转DREB基因马铃薯(Solanumtuberosum)和高羊茅(Festucaarundinace)在干旱和盐渍逆境胁迫下的相对电导率和MDA含量均显著低于对照,表现出抗旱、耐盐性提高[26-27];本研究也证实,在PEG模拟干旱胁迫的环境下转基因株系W1-3、W33-3的叶片可以保持较高的含水量,且相对电导率和MDA含量变化幅度较小,细胞膜受伤害程度较低,抗旱性较非转基因对照植株显著增强,因此,PeDREB2b外源基因的导入在一定程度上提高了白三叶植株的抗逆性。研究发现AP2/EREBP基因家族包含有DREB1A-C和DREB2A-B等许多转录因子[28];DREB2B基因提高植物抗旱性的机理可能是由于在逆境胁迫下DREB2类基因不仅有转录因子的作用,而且可能还具有对如磷酸化酶的应急激活调节作用[29];DREB2B基因转录产物是植物受水分胁迫下激活,是调节许多下游功能靶基因所必需的[30],从而提高植物对水分胁迫的耐受性。DREB2B基因在转基因植株受水分胁迫后,在叶、根和茎中存在组织特异性表达的差异[28],脯氨酸、可溶性糖等渗透调节物质明显增加,从而减轻水分胁迫对植物叶肉细胞的伤害,降低水分胁迫对叶片PSⅡ系统的伤害,维持正常的细胞代谢活动[31]。但来源于胡杨的PeDREB2b基因在白三叶抗旱转基因株系中的表达模式,及其基因拷贝数、插入位点等对提高植株抗水分胁迫逆境的作用机制尚有待进一步研究。
本研究发现,采用农杆菌浸种法导入胡杨PeDREB2b外源基因,所获得的白三叶转基因株系间不仅抗旱水平存在差异,如转基因株系W1-3、W28-2、W33-3抗旱性显著增强;而且转基因株系间的表型如W17-1、W28-2、 W4-2的叶长、叶宽及叶面积等,与对照非转基因白三叶海发相比也发生了不同程度的变异。这种表型变异现象在水稻、棉花、大豆(Glycinemax)、毛白杨等转基因植物中普遍存在[32-34],这可能与目的基因插入核基因的位点的随机性有关。对获得的转基因突变材料通过分子标记、Tail-PCR、插入位点两侧基因片段测序等手段克隆相关基因,可进一步挖掘控制转基因白三叶变异表型的功能基因。因此,对于转基因表型突变材料变异特征的跟踪研究为植物功能基因的挖掘提供了一条便捷有效的途径。
参考文献References:
[1]宋满珍.优美的观赏性地被植物——白花三叶草.园林绿化,2001(11):43.
[2]张飞龙,杨燕梅.白三叶的特性及栽培要点.云南农业,2005(11):7.
[3]李金博,李诗刚,徐义炎,吴燕民.白三叶基因工程及逆境生理研究进展.草业科学,2013,30(11):1842-1851.
Li J B,Li S G,Xu Y Y,Wu Y M.Research progress of genetic engineering and stress physiology in white clover.Pratacultural Science,2013,30(11):1842-1851.(in Chinese)
[4]赵桂琴,王锁民,任继周.白三叶转基因及其生态适应性研究进展.生态学报,2004,24(3):592-598.
Zhao G Q,Wang S M,Ren J Z.Research progress on genetic transformation and ecological adaptability in white clover.Acta Ecologica Sinica,2004,24(3):592-598.(in Chinese)
[5]王少侠,王振英,彭永康.DREB转录因子及其在植物抗逆中的作用.植物生理学通讯,2004,40(1):7-13.
Wang S X,Wang Z Y,Peng Y K.Dehydration responsive element binding (DREB) transcription activator and its function in plant tolerance to environmental stresses.Plant Physiology Communications,2004,40(1):7-13.(in Chinese)
[6]杨春霞,李火根,程强,陈英.南林895杨抗旱耐盐基因DREB1C的转化.林业科学,2009,45(2):17-21.
Yang C X,Li H G,Cheng Q,Chen Y.Transformation of drought and salt resistant gene (DREB1C) inPopulus×euramericanacv. Nanlin 895.Scientia Silvea Sinicae,2009,45(2):17-21.(in Chinese)
[7]周永斌.转W16小麦回交株系基因表达特性及其抗旱机制研究.杨凌:西北农林科技大学硕士学位论文,2012.
Zhou Y B.The expression ofW16 in the backcross lines of transgenic bread wheat and its relation with drought tolerance.Master Thesis.Yangling:Northwest Agriculture and Forestry University,2012.(in Chinese)
[8]郝晓燕,陈明,徐惠君,高世庆,程宪国,李连成,杜丽璞,叶兴国,马有志.GH-DREB基因转化小麦及转基因植株后代的抗旱生理指标鉴定.西南农业学报,2005,18(5):616-620.
Hao X Y,Chen M,Xu H J,Gao S Q,Cheng X G,Li L C,Du L P,Ye X G,Ma Y Z.Obtaining of transgenic wheats withGH-DREBgene and their physiological index analysis on drought tolerance.Southwest China Journal of Agricultural Sciences, 2005,18(5):616-620.(in Chinese)
[9]文益东,才华,柏锡,纪巍,王臻昱,魏正巍,朱延明.转AtDREB2A基因苜蓿的耐碱性分析.作物杂志,2012(3):32-35.
Wen Y D,Cai H,Bo X,Ji W,Wang Z Y,Wei Z W,Zhu Y M.Alkaline tolerance analysis of transgenic alfalfa withAtDREB2Agene.Crops,2012(3):32-35.(in Chinese)
[10]李永亮,董雪妮,雷志,杨沛燕,陶飞,唐益雄,徐秉良,吴燕民.转HhERF2和PeDREB2a基因棉花对胁迫的耐受能力分析.中国农业科技导报,2015,17(3):19-28.
Li Y L,Dong X N,Lei Z,Yang P Y,Tao F,Tang Y X,Xu B L,Wu Y M. Analysis of stress resistance ability of transgenic cotton expressingHhERF2 andPeDREB2agenes.Journal of Agricultural Science and Technology,2015,17(3):19-28.(in Chinese)
[11]Taylor A G,Motes J E,Kirkham M B.Germination and seedling growth characteristics of three tomato species affected by water deficits.Journal American Society for Horticultural Science,1982,107(2):282-285.
[12]刘沁芳.PEG-6000溶液引发对番茄种子活力及酶活性的影响.种子,2010,29(11):24-28.
Liu Q F.Effects of PEG-6000 solution on germination viability and enzymes activities of tomato seeds by priming. Seed,2010,29(11):24-28.(in Chinese)
[13]贾彩娟,赖尚海,徐滔,雷江丽,徐义炎.穿破石等植物的耐早能力初步研究.深圳职业技术学院学报,2005,4(3):27-30.
Jia C J,Lai S H,Xu T,Lei J L,Xu Y Y.Drought-resistance of 13 kinds of planting species.Journal of Shenzhen Polytechnic,2005,4(3):27-30.(in Chinese)
[14]李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:194-261.
[15]陈建勋,王晓峰.植物生理学实验指导.广州:华南理工大学出版社,2002:66-74.
[16]钱瑭璜,雷江丽,许建新,徐义炎.华南地区8种地被植物的耐旱性及繁殖移栽效果.草业科学,2013,30(11):1718-1724.
Qian T H,Lei J L,Xu J X,Xu Y Y.Drought resistance and transplanting of 8 plants in South China.Pratacultural Science,2013,30(11):1718-1724.(in Chinese)
[17]Shinozaki K,Yamaguchi-Shinozaki K.Gene networks involved in drought stress response and tolerance.Environment and Experimental Botany,2007,58:221-227.
[18]曲涛,南志标.作物和牧草对干旱胁迫的响应及机理研究进展.草业学报,2008,17(2):126-135.
Qu T,Nan Z B.Research progress on responses and mechanisms of crop and grass under drought stress.Acta Prataculturae Sinica,2008,17(2):126-135.(in Chinese)
[19]钱瑭璜,雷江丽,庄雪影.华南地区8种常见园林地被植物抗旱性比较研究.西北植物学报,2012,32(4):759-766.
Qian T H,Lei J L,Zhuang X Y.Comparative research on frought tesistance of 8 common garden ground cover plants in South China.Acta Botanica Boreali-Occidentalia Sinica,2012,32(4):759-766.(in Chinese)
[20]陈立松,刘星辉.作物抗旱鉴定指标的种类及其综合评价.福建农业大学学报,1997,26(1):48-55.
Chen L S,Liu X H.Kinds of index for crop drought resistance identification and comprehensive evaluation.Joural of Fujian Agricultural University,1997,26(1):48-55.(in Chinese)
[21]陶向新.模糊数学在农业科学中的初步应用.沈阳农学院学报,1982,(2):96-107.
Tao X X.A preliminary application of fuzzy mathematics in agricultural science.Journal of Shenyang Agricultural College,1982(2):96-107.(in Chinese)
[22]王军卫,杨凤萍,陈绪清,梁荣奇,张立全,耿东梅,张晓东,宋亚珍,张改生.外源脱水应答转录因子DREB基因在转基因小麦中的诱导型表达与抗干旱生理效果研究.遗传学报,2006,33(5):468-476.
Wang J W,Yang F P,Chen X Q,Liang R Q,Zhang L Q,Geng D M,Zhang X D,Song Y Z,Zhang G S.Induced expression ofDREBtranscriptional factor and study on its physiological effects of drought tolerance in transgenic wheat.Acat Genetica Sinica,2006,33(5):468-476.(in Chinese)
[23]Fowler S,Thomashow M F.Arabidopsis transcription profiling indicates that multiple regulatory pathways are activated during cold acclimation in addition to the CBF cold response pathway.Plant Cell,2002,14(8):1675-1690.
[24]刘颖,张巨明.暖季型草坪草对干旱胁迫的反应.草业科学,2013,30(11):1732-1738.
Liu Y,Zhang J M.Review on the response of warm-season turfgrass to drought stress.Pratacultural Science,2013,30(11):1732-1738.(in Chinese)
[25]许桂芳.PEG胁迫对2种过路黄抗性生理生化指标的影响.草业学报, 2008,17(1):66-70.
Xu G F.Effects of PEG stress on resistance physiological and biochemical indexes of adversity of twoLysimachiaspecies.Acta Prataculturae Sinica.2008,17(1):66-70.(in Chinese)
[26]麻冬梅,金凤霞,许兴,李会文,魏睿,郭伶娜.高羊茅耐盐转基因抗性苗的耐盐性研究.草地学报,2013,21(6):1144-1147.
Ma D M,Jin F X,Xu X,Li H W,Wei R,Guo L N.Study on the salt tolerance of transgenic tall fescue.Acta Agrestia Sinica,2013,21(6):1144-1147.(in Chinese)
[27]贾小霞,齐恩芳,马胜,胡新元,王一航,文国宏,龚成,李建武.转DREB1A/Bar双价基因马铃薯的耐旱性及除草剂抗性分析.草业学报,2015,24(11):58-64.
Jia X X,Qi E F,Ma S,Hu X Y,Wang Y H,Wen G H,Gong C,Li J W.Analysis of drought tolerance and herbicide resistance in transgenic potato plants over-expressingDREB1A/Bar.Acta Prataculturae Sinica,2015,24(11):58-64.(in Chinese)
[28]李科友,朱海兰.植物非生物逆境胁迫DREB/CBF转录因子的研究进展.林业科学,2011,47(1):124-134.
Li K Y,Zhu H L.Research progress ofDREB/CBFtranscription factor in response to abiotic-stresses in plants.Scientia Silvea Sinicae,2011,47(1):124-134.(in Chinese)
[29]Liu Q,Kasuqa M,Sakuma Y,Abe H,Miura S,Yamaquchi-Shinozaki K,Shinozaki K.Two transcription factors, DREB1 and DREB2, with an ERFBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought- and low-temperature-responsive gene expression, respectively, inArabidopsis.Plant Cell,1998,10(8):1391-1406.
[30]Nakashima K,Shinwari Z K,Sakuma Y,Seki M,Miura S,Shinozaki K,Yamaguchi-Shinozaki K.Organization and expression of two ArabidopsisDREB2 genes encoding DRE-binding proteins involved in dehydration and high-salinity responsive gene expression.Plant Molecular Biology,2000,42(4):657-665.
[31]沈海涛,冯玉杰,王爱英,李予霞,胡鸢雷,祝建波.转OvDREB2B基因陆地棉鉴定及其对水分渗透胁迫的分析.西北植物学报,2013,33(12):2395-2400.
Shen H T,Feng Y J,Wang A Y,Li Y X,Hu Y L,Zhu J B.Identify and analysis of transgenic upland cotton withOvDREB2Bgene under osmotic stress.Acta Botanica Boreali-Occidentalia Sinica,2013,33(12):2395-2400.(in Chinese)
[32]Liu W,Torisky R S,Mcallister K P,Avdiushko S,Hidebrand D,Colins G B. Somatic embryo cycling:Evaluation of a novel transformation and assay system for seed-specific gene expression in soybean.Plant Cell Tissue and Organ Culture,1996,47:33-42.
[33]刘冬梅.转基因棉花材料获得及主要农艺性状变异分析.北京:中国农业科学院硕士学位论文,2006.
Liu D M.Production analysis of chief agronomic traits of variations of transgenenic cotton (Gossypiumhirsutum)lines.Master Thesis.Beijing:Chinese Academy of Agricultural Sciences,2006.(in Chinese)
[34]辛蓓,李伟,骈瑞琪,黄天伟,陈晓阳.rolB-pttGA20ox双价基因在毛白杨中的表达及转化植株的形态特征.河北农业大学学报,2009,32(4):33-37.
Xin B,Li W,Pian R Q,Huang T W,Chen X Y.Expression ofrolB-pttGA20oxdouble genes inPopulustomentosaand morphological character of the transgenic lines.Journal of Agricultural University of Hebei,2009,32(4):33-37.(in Chinese)
(责任编辑王芳)
The phenotype variation and drought resistance appraise of transgenicTrifoliumrepenswithPeDREB2bgene fromPopuluseuphratica
Qian Tang-huang1,2, Lei Jiang-li1, Liu Jian-hua2, Song Feng-ming2, Ma Nan1
(1.Fairylake Botanical Garden, CAS and Shenzhen, Shenzhen 518004, China;2.Shenzhen Techand Eeology & Environment CO., LTD. Shenzhen 518040, China)
Abstract:Seven transgenic lines were selected from transgenic Trifolium repens obtained before,including W1-2, W1-3, W4-2, W13-4, W17-1, W28-2 and W33-3, while non-transgenic lines were used as control.Morphological characteristics and permanent wilting rate of plant were determined. Changes of foliage relative water content, electric conductivity and malon-dialdehyde(MDA) were measured under simulated drought stress by PEG. Results showed that: 1)leaf shape,leaf color, leaf mottling and leaf size of some transgenic T. repens lines changed obviously; 2)The drought-resistant capability of W1-3, W28-2 was strong, which had the lower permanent wilting rate and grew normally for long time; 3)With time and drought stress going on, the relative water content of plants decreased in different degree, but W1-3 and W28-2 could still maintain high level. And the relative electric conductivity and malondialdehyde content of plants had increased, but W1-3 had less change. Through comprehensive analysis, it was concluded that the drought resistant abilities of these seven transgenic lines were ranked as W1-3>W33-3>W28-2>W1-2>W13-4>W17-1>W4-2. Transgenic T. repens lines are superior to the control.
Key words:Trifolium repens; transgenic; phenotype; drought-resistance
DOI:10.11829/j.issn.1001-0629.2015-0425
*收稿日期:2015-08-06
基金项目:深圳市生物、互联网、新能源产业发展专项资金项目“利用转基因技术培育抗旱植物新品系关键技术研发及产业化”(JSA201104260008A);深圳市战略性新兴产业发展专项资金项目“深圳市生态修复生物工程技术研究开发中心”(GCZX20120618100801416)
通信作者:雷江丽(1971-),女,新疆石河子人,教授级高工,博士,主要从事园林植物资源评价与创新利用。E-mail:lei-jl@163.com
中图分类号:S541+.203.4;Q945.78
文献标志码:A
文章编号:1001-0629(2016)5-0907-10*1
Corresponding author:Lei Jiang-liE-mail:lei-jl@163.com
钱瑭璜,雷江丽,刘建华,宋凤鸣,马楠.转胡杨PeDREB2b基因白三叶表型变异及抗旱性评价.草业科学,2016,33(5):907-916.
Qian T H,Lei J J,Liu J H,Song F M,Ma N.The phenotype variation and drought resistance appraise of transgenicTrifoliumrepenswithPeDREB2bgene fromPopuluseuphratica.Pratacultural Science,2016,33(5):907-916.
接受日期:2016-01-19
第一作者:钱瑭璜(1985-),女,河北石家庄人,工程师,硕士,主要从事园林植物应用与植物生理方面的研究。Email:582546461@qq.com
