玉米Argoanute基因家族的全长cDNA克隆与表达分析
2016-06-14翟立红周兰庭韩鹏腾峰
翟立红+周兰庭+韩鹏+腾峰


摘要:Argonaute(AGO)蛋白是小RNA分子诱导的沉默复合体(RISC)的核心因子,以玉米自交系B73为材料,利用RLM-RACE技术,克隆得到玉米17个AGO基因的全长cDNA序列,发现6个成员具有5′非翻译外显子,可能其表达受此机制调控。同时,利用半定量RT-PCR对其在玉米幼苗不同根系组织(包括初生胚根、冠根、次生胚根和侧根)进行表达分析,结果表明:未检测到ZmAGO5b、ZmAGO18b表达,ZmAGO1a/b、ZmAGO2a、ZmAGO10在各类根系中高水平表达,其他11个ZmAGOs表达水平较低,因此揭示选择性表达不同的ZmAGOs可能是不同类型的根系分化及其功能的精细调控所必需的。
关键词:Argonaute基因;克隆;5′非翻译外显子;表达
中图分类号: S513.01;Q785
文献标志码: A
文章编号:1002-1302(2016)04-0041-04
在真核生物中,小RNA(small RNA:sRNA)介导转录水平、转录后水平以及染色质水平的基因沉默。植物内源 sRNA 包括microRNA (miRNA)和各类小干扰RNA(short interfering RNA,siRNA)[1]。在已知的由sRNA介导的基因表达调控途径中,sRNA必须与Argonaute(AGO)蛋白形成沉默复合体(RNA-induced silencing complex:RISC)引导sRNA通过序列互补与靶标(RNA或DNA)结合,进而降解mRNA、抑制翻译或修饰染色质[1]。由此可见,AGO蛋白是sRNA行使其功能的重要因子。Argonaute蛋白最初是在植物中发现的[2],是一类分子量较大、含有可变的N端、PAZ、MID和PIWI结构域的蛋白质[3-4],其中PAZ和PIWI属于保守结构域。在细菌和人类中的研究揭示了PAZ、MID、PIWI结构域在小RNA调控途径中的作用[5-6]。其中,MID结合小RNA的5′-磷酸端,使小RNA锚定在AGO蛋白上;PAZ识别小RNA突出的3′ 端[3-4];PIWI会形成一种类似于RNase H酶的折叠结构,具有内源核酸酶的活性。有研究发现,PIWI内存在保守的活性位点Asp-Asp-His(DDH motif)[7],但DDH motif存在与否并不能完全代表AGO蛋白是否具有催化功能[8]。在拟南芥中,证实有催化功能的AGO蛋白有AtAGO1、AtAGO4、AtAGO7 和AtAGO10[9-13]。
不同物种中,AGO蛋白的数目不同。拟南芥基因组中注释有10个AGO蛋白,水稻中有19个AGO蛋白,玉米中有17个AGO蛋白。拟南芥的AGO蛋白大致可分为三大类,AGO1、AGO5 和AGO10为第1类,AGO2、AGO3、AGO7为第2类,AGO4、AGO6、AGO8和AGO9为第3类[14]。Kapoor等把水稻和拟南芥AGO蛋白划分为四大类,分别为AGO1、MEL1/AGO5、ZIPPY/AGO7和AGO4[15]。Zhai等将玉米中的AGO蛋白划分为五大类,将与OsAGO18同源性较高的2个蛋白单独划为一类[16]。目前证实,植物中的AGO1主要参与miRNA通路,在植物的各个生长发育阶段均起着重要的调控作用[9,17]。在拟南芥中,与AtAGO1亲缘关系最近的AtAGO10突变后表现为茎尖分生组织发育异常,AtAGO1和AtAGO10竞争结合miR165/miR166,调节HD-ZIP Ⅲ 的表达,进而调节SAM发育和保持[18]。拟南芥中的AtAGO5仅在生殖组织中表达[19],与水稻中的OsMEL1表达相似[15]。AGO7在反式作用的短干扰RNA(trans-acting short interfering RNAs,tasiRNA)的形成及其功能途径中起重要作用[12]。AtAGO2与AtAGO3结构高度相似且功能冗余,AGO2在植物逆境环境下高效表达[15],暗示在抗逆过程中起重要作用。AGO4蛋白主要是围绕RNA介导的DNA甲基化(RdDM)过程中的作用机制展开,在整个发育过程中均有较高水平表达[15]。AGO6、AGO4在DNA甲基化上存在部分功能冗余,最近的研究证实AtAGO6在拟南芥茎和根的分生组织中存在RNA介导转录水平基因沉默的功能[20]。AtAGO8、AtAGO9序列相似度很高,其中,AtAGO8在拟南芥所有组织中表达量均较低,被认为是一个假基因[21]。最近的报道发现拟南芥中的 AtAGO9 在胚珠和花药中的表达量非常高[22]。而与AtAGO9高度同源的玉米AGO104基因,控制玉米的无融合生殖,在性母细胞旁的体细胞大量富集[23]。截至目前,植物不同根系中AGO基因家族的表达模式还未见报道。
玉米(Zea mays L.)是当今世界最重要的粮、饲、能源、工业原料兼用的高产作物。根系是玉米重要的组织器官,在保持植株形态、水分和营养吸收与运输、响应植物对环境胁迫等方面起着重要的作用。本研究以玉米测序自交系B73为材料,选取玉米幼苗不同根系组织包括初生胚根、冠根、次生胚根和侧根对17个AGO基因进行表达分析,为探索AGO基因在根系形态建成方面的调控机制奠定基础,与此同时,利用RACE技术对玉米17个AGO基因的全长cDNA进行克隆测序分析,以完善玉米AGO基因的序列信息,为全面解析玉米的AGO基因提供基础。
1 材料与方法
1.1 供试材料
本试验选用的材料玉米自交系B73,为美国优良自交系,配合力好,具有参考基因组序列。
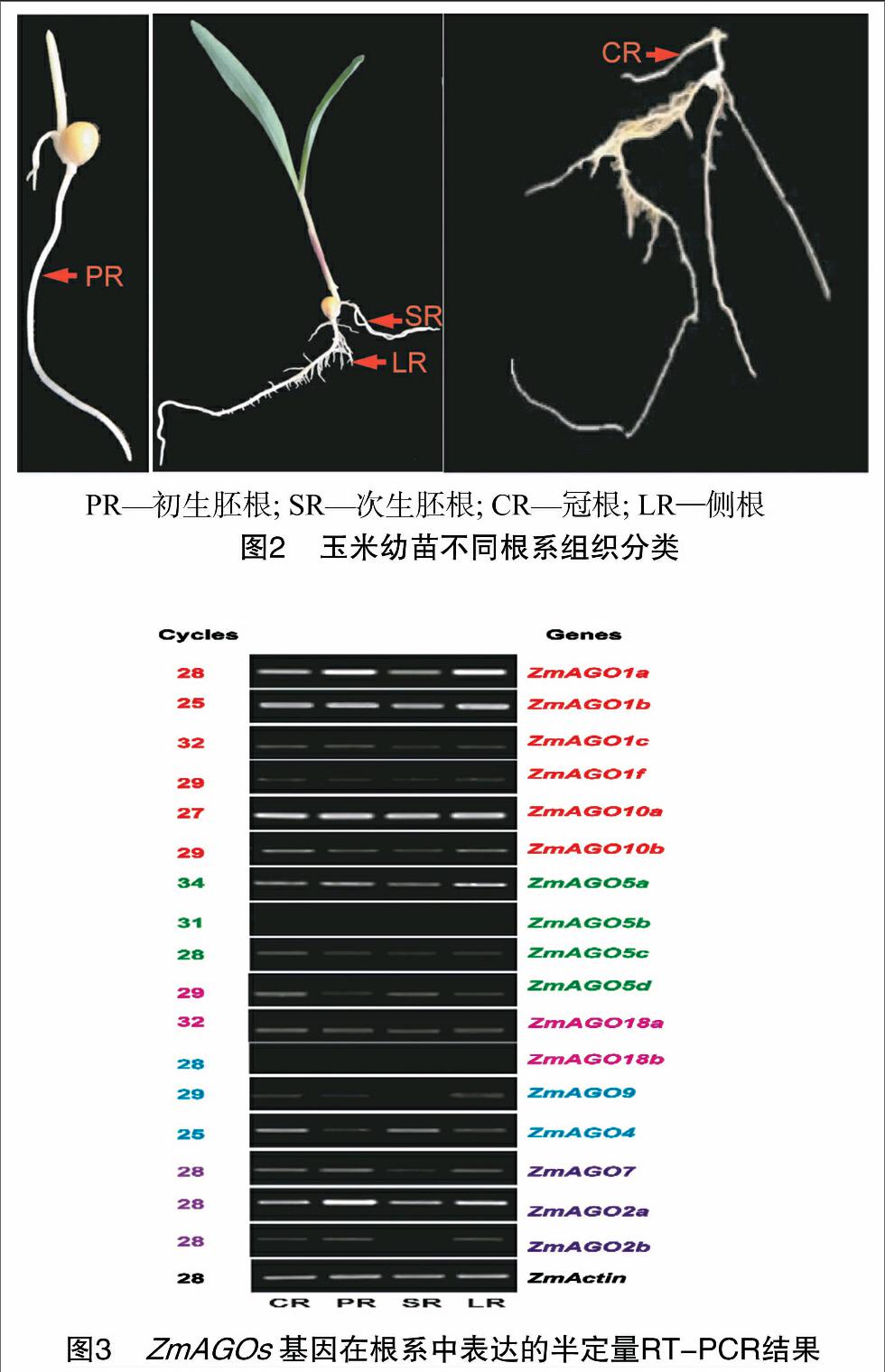
选取大小均匀、籽粒饱满的玉米B73种子用15%的H2O2浸泡30 min进行表面消毒处理后,灭菌蒸馏水冲洗3次,播种于沙钵中(沙子高压灭菌),室内培养。当初生胚根和次生胚根长出时,分别取样,最后取侧根、冠根,每种根系取样不少于3株,液氮速冻,-80 ℃冰箱保存。
1.2 方法
1.2.1 全长cDNA克隆 使用FirstChoice RLM-RACE(Ambion公司)试剂盒(货号:AM1700)对玉米中鉴定到的ZmAGO基因进行5′末端和3′ 末端的扩增,试验步骤严格按照说明书执行,5′-RACE和3′-RACE所用的巢式引物见Zhai等发表的文章[16],最后一步扩增得到的PCR产物进行琼脂糖凝胶电泳,将目的条带切胶回收,连接至pGEM-T Easy载体(Promega公司),4 ℃连接过夜后进行转化,筛选约10个阳性克隆送至Invitrogen公司进行菌液测序。
1.2.2 半定量RT-PCR 以Zhai等报道的17个玉米AGO基因家族[16]作为研究对象,利用NCBI网站上在线工具 Primer-Blast 进行基因特异引物设计(http://www.ncbi.nlm.nih.gov),扩增产物进行测序以确保扩增片段的特异性,所使用的引物信息见表1,以Actin(NM_001155179)作为内参基因,进行玉米AGO基因家族成员的半定量RT-PCR。首先用内参引物对4个组织的cDNA进行不同循环数目的PCR扩增,确定处于指数扩增期的循环数并调整模板加入体积使其在相同的循环数下亮度一致,然后利用内参调好的模板体积进行基因扩增,此时同样要进行指数扩增期循环数的确定,最终得出不同基因在不同组织中的相对表达水平。
2 结果与分析
2.1 AGO家族基因的全长cDNA克隆及分析
基于所预测的基因序列设计基因特异性引物,使用RACE技术扩增所有17个基因的全长cDNA,我们共得到了11个ZmAGOs的5′末端和17个ZmAGOs的3′末端。大多数基因的转录本与B73 RefGen v2所预测的相似,但ZmAGO1b与B73 RefGen v2 所预测的基因结构存在较大差异,实际扩增所得到的5′-UTR第1个184 bp长度的非编码外显子(untranslated exon)位于预测基因的第1内含子区域,起始密码子后移15 bp,说明该基因可能存在多个选择性剪切转录本。通过序列分析发现,ZmAGO1a/b/f、ZmAGO5c、ZmAGO4、ZmAGO9存在5′非编码外显子,有可能这6个ZmAGO基因受该机制调控。
2.2 AGO家族基因在不同类型根组织中的表达分析
为详细鉴定ZmAGOs基因在各类根系组织中的表达,将各类根组织细分为:冠根、初生胚根、次生胚根、侧根并分别取样(图2)。图3的RT-PCR结果表明:ZmAGO5b和 ZmAGO18b 在被测的玉米根系组织中未检测到表达,15个ZmAGOs在玉米根系组织中表达,其中ZmAGO1a、ZmAGO1b、ZmAGO2a、ZmAGO10在各类根系都高水平表达,暗示这些基因在玉米根系发育中的重要作用;其他11个ZmAGOs基因的表达水平则相对较低。另外,有些ZmAGOs基因也显示出其在不同类型根组织中表达的特异性,如ZmAGO2b、ZmAGO9在冠根、初生胚根和侧根中表达,但在次生胚根中未检测到其表达;ZmAGO5d、ZmAGO4则在冠根、次生胚根和侧根中表达,但在初生胚根中未检测到其表达。不同类型的根组织中大多数ZmAGOs基因具有相似的表达模式,说明这些ZmAGOs基因是各种根系组织生长发育共同需要的,以保持根系的基本组织特性;而不同类型的根组织表达不同的ZmAGOs基因,说明选择性地表达不同的ZmAGOs基因可能是不同类型的根系分化及其功能的精细调控所必需的。
2.3 ZmAGOs与OsAGOs的微共线性分析
通过微共线性分析发现(图4),玉米第10染色体的ZmAGO1c、ZmAGO2b,第2染色体的ZmAGO2a和ZmAGO1b与水稻第4染色体的OsAGO1b、OsAGO2的片段高度同源;玉米第9染色体的ZmAGO10a,第6染色体的ZmAGO10b与水稻第6染色体的OsPNH1高度同源;玉米第2染色体的ZmAGO18a,第1染色体的ZmAGO18b与水稻第7染色体的OsAGO18高度同源。由此推测玉米和水稻分化后,可能玉米的部分基因组序列发生了重复或加倍。
3 讨论
小RNA介导的基因沉默在植物的生长发育和抗逆胁迫响应等方面均发挥重要作用,RISC作为小RNA 行使功能的主要组分,AGO蛋白是核心元件,甚至有学者认为研究AGO蛋白所结合的小RNA的表达量比整体研究小RNA的表达量更能说明某种小RNA的功能[24]。近年来,在植物中开展关于AGO蛋白功能及其结合的小RNA类型的研究越来越多,使得AGO蛋白的研究成为小RNA调控途径的热点。目前,AGO基因的功能在模式植物拟南芥中的研究最为全面和透彻,而在玉米中的报道较少。Qian等利用B73 RefGen v1的基因组序列对玉米全基因组的AGO蛋白进行了预测和表达分析,结果显示,玉米基因组存在18个AGO基因,并以玉米幼苗为材料对AGO基因家族在干旱和盐胁迫下的表达模式进行了分析[25]。许鑫等以玉米自交系昌7-2为材料,研究了6个AGO基因在玉米幼苗第1叶、第2叶、第3叶、第4叶、总根、茎尖和胚芽鞘中的表达情况[26]。Zhai等利用B73 RefGen v2基因组序列发现了17个编码AGO蛋白的基因,并选取了8个包含营养组织和生殖组织的材料进行了表达分析,结果显示,所有AGO家族基因在生殖组织的表达远高于营养组织[16],这与水稻中OsAGOs的表达模式相似[15],预示着小RNA在生殖生长阶段发挥重要的调控作用。
根系是玉米重要的组织器官,在保持植株形态、水分和营养吸收与运输、响应植物对环境胁迫等方面起着重要的作用。本研究以Zhai等报道的17个ZmAGO基因为研究对象,以玉米自交系B73为材料,对该基因家族成员的基因结构进行了解析,并将玉米幼苗的4种根系分别取材进行表达分析,结果发现,ZmAGOs有6个成员存在5′非翻译外显子,可能AGO基因家族受到此机制的调控[16];对ZmAGOs在各类根系中的表
达分析表明,有些ZmAGOs基因显示出其在不同类型根组织中表达的特异性,如ZmAGO2b、ZmAGO9在冠根、初生胚根和侧根中表达,但在次生胚根中未检测到其表达,ZmAGO5d、ZmAGO4则冠根、次生胚根和侧根中表达,但在初生胚根中未检测到其表达,说明选择性地表达不同的ZmAGOs基因可能是不同类型的根系分化及其功能的精细调控所必需的。
参考文献:
[1]Voinnet O. Origin,biogenesis,and activity of plant microRNAs[J]. Cell,2009,136(4):669-687.
[2]Bohmert K,Camus I,Bellini C,et al. AGO1 defines a novel locus of Arabidopsis controlling leaf development[J]. The EMBO Journal,1998,17(1):170-180.
[3]Tolia N H,Joshua-Tor L. Slicer and the argonautes[J]. Nature Chemical Biology,2007,3(1):36-43.
[4]Hutvagner G,Simard M J. Argonaute proteins:key players in RNA silencing[J]. Nature Reviews Molecular Cell Biology,2008,9(1):22-32.
[5]Song J J,Smith S K,Hannon G J,et al. Crystal structure of argonaute and its implications for RISC slicer activity[J]. Science,2004,305(5689):1434-1437.
[6]Liu J,Carmell M A,Rivas F V,et al. Argonaute2 is the catalytic engine of mammalian RNAi[J]. Science,2004,305(5689):1437-1441.
[7]Rivas F V,Tolia N H,Song J J,et al. Purified argonaute2 and an siRNA form recombinant human RISC[J]. Nature Structural & Molecular Biology,2005,12(4):340-349.
[8]Vaucheret H. Plant argonautes[J]. Trends in Plant Science,2008,13(7):350-358.
[9]Qi Y,Denli A M,Hannon G J. Biochemical specialization within Arabidopsis RNA silencing pathways[J]. Molecular Cell,2005,19(3):421-428.
[10]Qi Y,He X,Wang X J,et al. Distinct catalytic and non-catalytic roles of argonaute4 in RNA-directed DNA methylation[J]. Nature,2006,443(7114):1008-1012.
[11]Baumberger N,Baulcombe D C. Arabidopsis argonaute1 is an RNA Slicer that selectively recruits microRNAs and short interfering RNAs[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(33):11928-11933.
[12]Montgomery T A,Howell M D,Cuperus J T,et al. Specificity of argonaute7-miR390 interaction and dual functionality in TAS3 trans-acting siRNA formation[J]. Cell,2008,133(1):128-141.
[13]Ji L J,Liu X G,Yan J,et al. Argonaute10 and argonaute1 regulate the termination of floral stem cells through two microRNAs in Arabidopsis[J]. PLoS Genetics,2011,7(3):e1001358.
[14]Morel J B,Godon C,Mourrain P,et al. Fertile hypomorphic argonaute(ago1) mutants impaired in post-transcriptional gene silencing and virus resistance[J]. The Plant Cell,2002,14(3):629-639.
[15]Kapoor M,Arora R,Lama T,et al. Genome-wide identification,organization and phylogenetic analysis of Dicer-like,argonaute and RNA-dependent RNA polymerase gene families and their expression analysis during reproductive development and stress in rice[J]. BMC Genomics,2008,9(1):451.
[16]Zhai L,Sun W,Zhang K,et al. Identification and characterization of argonaute gene family and meiosis-enriched argonaute during sporogenesis in maize[J]. Journal of Integrative Plant Biology,2014,56(11):1042-1052.
[17]Wu L,Zhang Q,Zhou H,et al. Rice MicroRNA effector complexes and targets[J]. The Plant Cell,2009,21(11):3421-3435.
[18]Zhu H,Hu F,Wang R,et al. Arabidopsis argonaute10 specifically sequesters miR166/165 to regulate shoot apical meristem development[J]. Cell,2011,145(2):242-256.
[19]Schmid M,Davison T S,Henz S R,et al. A gene expression map of Arabidopsis thaliana development[J]. Nature Genetics,2005,37(5):501-506.
[20]Changho E,Lorkovic Z J,Ulf N,et al. AGO6 functions in RNA-mediated transcriptional gene silencing in shoot and root meristems in Arabidopsis thaliana[J]. PLoS One,2011,6(10):e25730.
[21]Takeda A,Iwasaki S,Watanabe T,et al. The mechanism selecting the guide strand from small RNA duplexes is different among argonaute proteins[J]. Plant & Cell Physiology,2008,49(4):493-500.
[22]Durán-Figueroa N,Vielle-Calzada J P. Argonaute9-dependent silencing of transposable elements in pericentromeric regions of Arabidopsis[J]. Plant Signaling & Behavior,2010,5(11):1476-1479.
[23]Singh M,Goel S,Meeley R B,et al. Production of viable gametes without meiosis in maize deficient for an argonaute protein[J]. The Plant Cell,2011,23(2):443-458.
[24]Thomson D W,Pillman K A,Anderson M L,et al. Assessing the gene regulatory properties of Argonaute-bound small RNAs of diverse genomic origin[J]. Nucleic Acids Research,2015,43(1):470-481.
[25]Qian Y,Cheng Y,Cheng X,et al. Identification and characterization of Dicer-like,argonaute and RNA-dependent RNA polymerase gene families in maize[J]. Plant Cell Reports,2011,30(7):1347-1363.
[26]许 鑫,李丹丹,李双江,等. 玉米AGO基因的克隆与表达分析[J]. 西北植物学报,2014,34(3):449-453.肖 松,周棱波,张国兵,等. 酱香型白酒用糯高粱种质遗传多样性分析[J]. 江苏农业科学,2016,44(4):45-49.
