东北传统豆酱发酵过程中微生物的多样性
2016-06-13高秀芝易欣欣刘慧王晓东崔宗均
高秀芝易欣欣刘慧王晓东崔宗均
(1. 北京农学院食品科学与工程学院 农产品有害微生物及农残安全检测与控制北京市重点实验室 食品质量与安全北京实验室,北京102206;2. 中国农业大学农学与生物技术学院 中国农业大学生物质工程中心,北京 100193)
东北传统豆酱发酵过程中微生物的多样性
高秀芝1易欣欣1刘慧1王晓东1崔宗均2
(1. 北京农学院食品科学与工程学院 农产品有害微生物及农残安全检测与控制北京市重点实验室 食品质量与安全北京实验室,北京102206;2. 中国农业大学农学与生物技术学院 中国农业大学生物质工程中心,北京 100193)
以东北传统发酵豆酱为研究对象,分析豆酱发酵过程中微生物群落的动态变化。分别选择发酵豆酱0、35、65、75和105 d(成品豆酱)作为研究材料,通过PCR-DGGE分析微生物多样性,检测了豆酱发酵过程中蛋白质和氨基酸态氮的变化。结果表明,豆酱发酵过程中主要优势细菌为芽孢杆菌和乳酸菌,芽孢杆菌包括枯草芽孢杆菌、短小芽孢杆菌、淀粉液化芽孢杆菌、地衣芽孢杆菌的近缘种等;主要乳酸菌为乳球菌、明串珠菌、魏斯氏菌等种属细菌的近缘种;东北豆酱发酵过程中优势真菌为米曲霉、散囊菌和谢瓦氏曲霉的近缘种,随发酵时间延长数量逐渐减少;粗蛋白相对含量先略有平稳上升后下降,最后成品酱粗蛋白含量下降为24.76%;氨基态氮含量一直在增加,成品酱中为101.2 g/kg。
PCR-DGGE;传统发酵豆酱;微生物多样性
豆酱又称黄豆酱、黄酱或大豆酱,是以大豆为主要原料,经过自然发酵而成的半流动状态的发酵食品[1]。我国制酱的历史久远,起源于我国的制酱工艺早已普及到韩国、日本、印度尼西亚等东南亚国家和地区。东北作为我国大豆的主产区,其大豆年产量占全国总产量的50%左右,东北传统豆酱的制作也是非常普遍的,同时也是我国自制豆酱的主要生产地区。
豆酱作为主要发酵豆制品之一,其传统发酵过程在多种微生物的参与下,发生了多种生化反应,产生了多种风味物质,这些风味物质赋予了豆酱特殊的香味、适宜的口感和色泽[2]。豆酱发酵过程中有多种微生物的参与,目前研究发现的主要类群有霉菌、酵母菌和细菌[3,4]。霉菌能够分泌蛋白酶、淀粉酶、糖化酶、纤维素酶、植酸酶等多种酶类,这些酶可以将原料中的蛋白质水解为多肽和多种氨基酸,将淀粉水解为葡萄糖、双糖、三糖及糊精等物质,为酵母菌和细菌发酵产生风味物质创造了条件。本研究结合传统分离方法和现代分子生态学的手段分析东北传统发酵豆酱中微生物菌群的变化,结合蛋白质和氨基酸态氮的变化分析微生物在豆酱发酵过程中的主要作用。
1 材料与方法
1.1 材料
根据东北豆酱的发酵工艺,分别选择发酵豆酱0、35、65、75和105 d(成品豆酱)作为研究材料。1.2 方法
1.2.1 豆酱样品总DNA提取 取不同时期的豆酱样品各2.0 g,采用氯苯法[5],直接从各豆酱样品中提取豆酱中的基因组总DNA,然后用RNA酶进行纯化[6]。
1.2.2 PCR-DGGE
1.2.2.1 细菌PCR 以基因组总DNA为模板,357FGC和517R作为细菌的引物[6]。PCR反应体系为(50 μL):10×PCR Buffer(Tiangen)5 μL,2 mmol/L dNTP mix 4 μL,45 pmol 357F和517R各0.5 μL,5 unit/μL Taq DNA 聚合酶(Tiangen)0.2 μL,模板10 ng/μL DNA 1 μL。反应程序为95℃ 10 min,93℃变性1 min,48℃ 退火1 min,72℃ 延伸1 min 20 s,共30个循环;72℃延伸5 min。扩增产物以2% 琼脂糖凝胶电泳检测。
1.2.2.2 真菌PCR 以基因 组总DNA为模板,NL1-GC和LS2作为真菌引物[6]。PCR反应体系为(50 μL):10×PCR Buffer(Tiangen)5 μL,2 mmol/L dNTP mix 4 μL,45 pmolNL1-GC和LS2各0.5 μL,5 unit/μL Taq DNA 聚合酶(Tiangen)0.3 μL,模板10 ng/μL DNA 1 μL。反应程序为:95℃ 5 min,95℃变性1 min,56℃ 退火45 s,72℃延伸1 min,共35个循环;72℃延伸7 min。扩增产物以2% 琼脂糖凝胶电泳检测。
1.2.2.3 DGGE及条带测序 对样品DNA的PCR产物进行变性梯度凝胶电泳(DGGE),仪器采用Bio-Rad DCode突变检测系统。胶浓度为20%-60%,取PCR产物13 μL,加入7 μL DGGE loading buffer,混匀后进样,200 V恒压,61℃恒温,电泳5 h。
电泳结束后,使用SYBRRGreen I染色30 min,用凝胶成像仪302 nm下观察,照相,对特征性条带进行切胶,回收条带,对胶回收的条带再进行一次无GC-夹子的PCR扩增。PCR产物经电泳检测后,委托上海生工生物工程技术服务有限公司进行测序。根据16S rDNA和26S rDNA查询互联网数据库,分析亲缘关系及相似性。
1.2.3 蛋白质及氨基酸的测定
1.2.3.1 粗蛋白的测定 凯氏定氮法测定样品中粗蛋白[2],将不同时期豆酱样品自然干燥,样品过40目筛,称取0.1 g左右放入样品管,每个样品做3个重复。然后将样品进行消煮、蒸馏及滴定。称取0.1 g左右的蔗糖,代替样品,按以上步骤做空白测定,要求消耗盐酸的体积不超过0.2 mL;精确称取0.1 g左右的(NH4)2SO4,按以上步骤做蒸馏回收率测定。
1.2.3.2 氨基酸态氮的测定 甲醛滴定法测定样品中氨基酸态氮[6],称取0.2 g样品于烧杯中,加去离子水50 mL,加2-3滴麝香草酚酞指示剂,摇匀,用0.100 N NaOH溶液滴定至淡蓝色。加入中性甲醛20 mL,摇匀,静置1 min,此时蓝色应消失。再用0.100 N NaOH溶液滴定至淡蓝色。记录两次滴定消耗的碱液毫升数。
2 结果
2.1 东北豆酱发酵过程中细菌的多样性
东北豆酱发酵过程中细菌的PCR-DGGE图谱如图1所示,0 d样品(原材料)中有多条菌带,条带具体信息见表1,其中b、d、k 和l 均维持较长时间,其它条带在随后的检测中很快消失;图谱中35 d条带最少,优势种为b、g、k和l,35 d之后仍存在很长时间,数据库比对结果为魏斯氏菌属、乳酸菌和弗氏柠檬酸杆菌的近缘种,它们在整个发酵过程中起到一定的作用;发酵65 d以后条带数逐渐增多,在最后的成品酱中,条带较集中,优势种明显,h、k、l、o和u形成成品酱的最主要的5个条带。
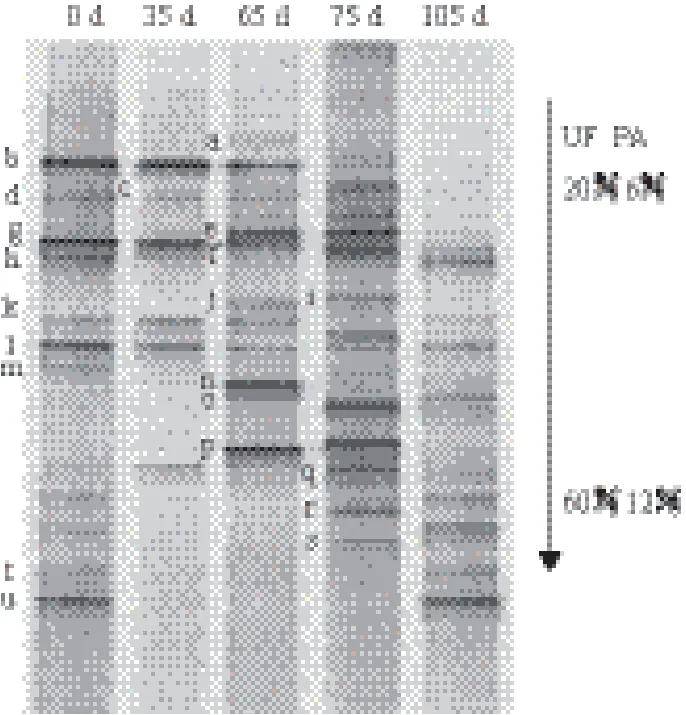
图1 东北豆酱发酵各阶段细菌的DGGE分析图谱

表1 图1中DGGE条带的近缘菌
2.2 东北豆酱发酵过程中真菌的多样性分析
东北豆酱发酵过程中真菌PCR-DGGE结果如图2所示,各条带具体分析信息见表2。0 d原料中真菌组成较简单,k、l 和 p 为优势菌条带,k、l 为假丝酵母属近缘种,条带 k 和 p 持续到发酵中后期一直存在,但含量逐渐降低,其它条带(i 和 j)很快消失;豆酱发酵中期(35-75 d)真菌种类较丰富,有明显的优势条带(h、k 和p),成品豆酱(105 d)真菌条带很少,含量很低。条带a、b、c、d、e、f和g 在发酵中期检测到,成品酱中消失,其中 a 和 d均为曲霉菌(Aspergillus bridgeri)近缘种,b 和 f 均为散囊菌(Eurotium rubrum),可能为同一种菌具有的两个条带。

图2 东北豆酱发酵各阶段真菌的DGGE分析图谱
2.3 东北豆酱发酵过程中蛋白质与氨基酸态氮的变化
东北豆酱在发酵过程中粗蛋白含量呈现出平稳上升然后又迅速下降的变化趋势(图3),0 d粗蛋白含量为40.4%,随后在豆酱发酵过程中平稳上升,65 d粗蛋白含量最高为43.4%,发酵开始时微生物消耗环境中的糖,使得豆酱中蛋白质的相对比例提高,最后成品酱105 d中粗蛋白含量下降为24.8%。豆酱发酵过程中氨基酸态氮呈逐步上升最后趋于平稳的变化趋势(图3),0 d氨基酸态氮的含量为58.8 g/kg,最后成品豆酱105 d氨基酸态氮含量为121.3 g/kg,比0 d增加了接近1.1倍,略低于75 d的氨基酸态氮的含量,究其原因可能是豆酱抽取酱油时流失到酱油中部分氨基酸态氮;说明豆酱在发酵微生物体系中蛋白酶系的作用下,水解产生游离氨基酸,使得环境中氨基酸态氮含量逐渐上升。

表2 图2中DGGE条带的近缘菌

图3 东北豆酱发酵过程中粗蛋白与氨基酸态氮的变化
3 讨论
在细菌DGGE图谱中条带h为明串珠菌属(91%)近缘种,明串珠菌能够代谢产生葡聚糖、甘露醇等有益物质,同时代谢能生成风味物质[7];条带l为乳酸乳球菌(100%)的近缘种,该种菌在发酵食品中尤其是乳制品中常被分离到[8,9],乳酸菌在生长代谢过程中能产生乳酸,与酵母菌代谢产物作用生成酯类物质,认为该菌在成品酱风味形成中起到重要的作用,另外乳酸菌合成的肽聚糖对免疫系统具有调节作用[10];条带o为解脲芽孢杆菌(98%)近缘种,该菌也常参与物质分解,分析对豆酱发酵有一定的作用;条带u为梭菌属(90%)近缘种,在0 d曾出现,发酵过程中没有检测到,而成品酱又重新出现,分析可能为发酵过程中污染杂菌。
近年来多种散囊菌在砖茶中被分离和鉴定[11],研究发现散囊菌发酵液可促进α-淀粉酶对淀粉的酶解、胃蛋白酶和胰蛋白酶对蛋白质的酶解,有利于淀粉、蛋白质消化吸收,同时还能抑制脂肪在消化系统中的降解、吸收,从而改善人体肠道功能[12],分析对豆酱的保健功能的形成具有一定的作用;条带 c 和 g 为谢瓦氏曲霉(Aspergillus chevalieri)近缘种,仅在75 d样品中有明显条带,为四川茯砖茶优势菌,分析可协同散囊菌共同作用于豆酱发酵。条带 p 为米曲霉(Aspergillus oryzae)近缘种,发酵过程基本一直存在,0 d含量甚微,15 d含量最高,45 d后含量逐渐下降,成品酱(90 d)隐约可见,可产生蛋白酶、淀粉酶及糖化酶等多种酶类,将原料中的蛋白质降解为蛋白胨、多肽及各种氨基酸,将淀粉降解为糊精及各种低分子糖类,如麦芽糖、葡萄糖;条带 m 和 n 均为尖孢镰刀菌(Fusarium oxysporum)近缘种,仅在65 d出现,尖孢镰刀菌是大豆根腐病的主要致病菌,条带m、n和条带e、o分析可能为发酵过程中污染的杂菌。
与山东的传统发酵豆酱比较分析,山东豆酱中的细菌和真菌种类更丰富,原料不同和环境条件差异是导致两种豆酱中微生物种类不同的主要原因[13]。其主要的细菌类型为芽孢杆菌和乳酸菌,其中芽孢杆菌基本贯穿整个豆酱发酵过程,淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)以及乳酸菌中明串珠菌(Leuc onostoc)和魏斯氏菌(Weissella)为首次从豆酱中分离到的细菌[13]。国内一些研究人员认为芽孢杆菌有可能对发酵不利,但据国外报道韩国传统发酵豆酱[14]和尼日利亚传统发酵豆制品“Soy-daddawa”[15]中芽孢杆菌为发酵主要作用细菌,本研究结果与国外报道是一致的。而乳酸菌在豆酱发酵后期起作用,产生风味物质。真菌主要是存在于豆酱发酵过程中的前期和中期,说明真菌主要是在豆酱发酵的前期和中期起作用。其中山东豆酱分离特有菌为卷枝毛霉(Mucor circinelloides),东北豆酱PCR-DGGE分析特有散囊菌(Eurotium rubrum)和谢瓦氏曲霉(Aspergillus chevalieri),两种豆酱共有酵母菌为(Saccharomyces dairensis)。东北豆酱和山东豆酱粗蛋白和氨基酸态氮发酵过程中变化趋势相同[16],延吉豆酱的粗蛋白发酵前期至中期高于山东豆酱,原因是延吉豆酱原材料为纯大豆,而山东豆酱原料为大豆和玉米(大豆75%,玉米25%);延吉豆酱发酵过程中氨基酸态氮含量明显高于山东豆酱氨基酸态氮含量,最后东北豆酱成品酱的氨基酸态氮含量为山东成品豆酱的1.2倍。氨基酸本身就是重要的呈味物质,特别是游离氨基酸与豆酱独特风味的形成密切相关[17]。
4 结论
东北豆酱发酵过程中芽孢杆菌(Bacillus)和乳酸菌(Lactobacteria)为优势细菌,主要芽孢杆菌包括枯草芽孢杆菌(Bacillus subtilis)、短小芽孢杆菌(Bacillus pumilus)、淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)、地衣芽孢杆菌(Bacillus licheniformis)等;主要乳酸菌为乳球菌(Lactococcus)、明 串 珠 菌(Leuconostoc)、 魏 斯 氏 菌(Weissella cibaria)等种属的近缘种。东北豆酱发酵过程中主要工作真菌为米曲霉(Aspergillus oryzae)、散囊菌(Eurotium rubrum)和谢瓦氏曲霉(Aspergillus chevalieri)的近缘种,为豆酱发酵过程中优势真菌,随发酵时间延长数量逐渐减少。粗蛋白相对含量先略有平稳上升后下降,最后成品酱粗蛋白含量下降为24.76%;氨基态氮含量一直在增加,成品酱中为101.2 g/kg。
[1] 包启安. 酱及酱油的起源及其生产技术(一)[J]. 中国调味品, 1992, 9:1-4.
[2] 石彦国. 大豆制品工艺学[M]. 北京:中国轻工业出版社, 2005:152-153.
[3] 牛天娇, 马莺. 中国传统发酵豆制品中微生物的发掘与利用[J]. 中国酿造, 2005(2):1-5.
[4] 辛星, 宋刚, 周晓杭, 等. 传统发酵豆酱中乳酸菌的分离、筛选及鉴定[J]. 中国食品学报, 2014, 14(9):202-206.
[5] Zhu H, Qu F, Zhu LH. Isolation of genomic DNAs from plants, fungi and bacteria using benzyl chloride[J]. Nucleic Acids Res, 1993, 21:5278-5280.
[6] 高秀芝, 王小芬, 刘慧, 等. PCR-DGGE分析天源酱园豆酱发酵过程中微生物多样性[J]. 食品科学, 2011, 32(1):112-114.
[7] 高莉莉, 张伯林. 明串珠菌在乳制品和功能性食品中的应用[J]. 现代食品科技, 2005, 21(4):107-111.
[8] 刘红霞, 徐 杰, 云月英, 等. 蒙古戈壁地区自然发酵乳中乳酸菌的分离鉴定[J]. 微生物学杂志, 2007, 27(3):42-46.
[9] 刘慧, 熊利霞, 易欣欣, 等. 藏灵菇中高产胞外多糖乳酸菌的筛选及其发酵性能的研究[J]. 食品科学, 2007, 28(5):211-215.
[10] 姚光国, 姚文, 陆扬, 等. 乳酸菌肽聚糖部分免疫增强作用的研究[J]. 微生物学通报, 2007, 34(1):105-107.
[11] 陈云兰, 于汉寿, 吕毅, 等. 康砖和青砖茶中散囊菌的分离、鉴定及其生物学特性研究[J]. 茶叶科学, 2006, 26(3):232-236 .
[12] 黄群, 陈林杰, 李彦坡, 等. 冠突散囊菌黑茶发酵液对消化酶活性影响的研究[J]. 微生物学通报, 2007, 34(5):917-920.
[13] Gao XZ, Liu H, Yi XX, et al. Microbial floral dynamics of chinese traditional soybean paste(Doujiang)and commercial soybean paste[J]. J Microbiol Biotechnol, 2013, 23(12):1717-1725.
[14] Yoo SK, Cho WH, Kang SM, et al. Isolation and identification of microorganisms in korean traditional soybena paste and soybean sauce[J]. Korean Journal of Applied Microbiology and Biotechnology, 1999, 27(2):113-117.
[15] Omafuvbe BO, Shonukan OO, Abiose SH. Microbiological and biochemical changes in the traditional fermentation of soybean for ‘soy-daddawa’-nigerian food condiment[J]. Food Microbiology, 2000, 17:469-474.
[16] 高秀芝, 王小芬, 李献梅, 等. 传统发酵豆酱发酵过程中养分动态及细菌多样性[J]. 微生物学通报, 2008, 35(5):748-753.
[17] 武俊瑞, 岳喜庆, 张苗. 东北传统发酵豆酱中游离氨基酸分析及综合评价[J]. 食品与生物技术学报, 2015, 34(2):158-164.
(责任编辑 李楠)
Microbial Diversity of Traditional Soybean Paste During Fermentation in Northeastern China
GAO Xiu-zhi1YI Xin-xin1LIU Hui1WANG Xiao-dong1CUI Zong-jun2
(1. Faculty of Food Science and Engineering,Beijing University of Agriculture,Beijing Key Laboratory of Agricultural Product Detection and Control of Spoilage Organisms and Pesticide Residue,Beijing Laboratory of Food Quality and Safety,Beijing 102206;2. Center of Biomass Engineering,College of Agronomy and Biotechnology,China Agricultural University,Beijing 100193)
This work is to analyze the dynamic variation of microbial community during the fermentation of traditional soybean paste in northeastern China. Selecting the fermented 0 d,35 d,65 d,75 d and 105 d soybean pastes as research materials,the microbial diversity was analyzed,and the changes of proteins and amino acid-nitrogen were detected,by PCR-DGGE technique. The results showed that the dominant bacteria during the fermentation of soybean paste were Bacillus and Lactobacteria,and the Bacillus mainly covered the closely related species of B. subtilis,B. pumilus,B. amyloliquefaciens,B. licheniformis,et al. The main species of Lactobacteria included the closely related ones of Lactococcus,Leuconostoc,Weissella cibaria,et al. The dominant fungi during the fermentation of soybean paste were the closely related species of Aspergillus oryzae,Eurotium rubrum,and Aspergillus chevalieri,and they decreased gradually with the fermentation time. The crude protein of the soybean paste finally decreased to 24.76% after increasing smoothly in former fermentation process. The amino acidnitrogen kept on increasing during whole progress and its concentration was up to 101.2 g/kg in final soybean paste.
PCR-DGGE;traditional fermented soybean paste;microbial diversity
10.13560/j.cnki.biotech.bull.1985.2016.04.034
2015-07-30
北京市教委面上项目(KM201310020010)
高秀芝,女,博士,副教授,研究方向:食品微生物;E-mail:gxz@bac.edu.cn
崔宗均,男,教授,研究方向:微生物分子生态学;E-mail:acuizj@cau.edu.cn
