基于抗氧化活性的抗坏血酸-氨基酸衍生物制备工艺的优化
2016-06-13闻霞李娜滕右露范娟林周婷乔艳红张强
闻霞,李娜,滕右露,范娟林,周婷,乔艳红,张强
安徽科技学院生命科学学院,安徽 蚌埠 233100
基于抗氧化活性的抗坏血酸-氨基酸衍生物制备工艺的优化
闻霞,李娜,滕右露,范娟林,周婷,乔艳红,张强
安徽科技学院生命科学学院,安徽 蚌埠 233100
[摘要]以抗氧化活性(还原力)为考察指标,先采用单因素试验探讨了氨基酸种类、体积比、pH和加热时间4个因素对抗坏血酸-氨基酸衍生物制备反应的影响,再通过正交试验确定了抗坏血酸-氨基酸衍生物的最佳制备工艺。结果表明,抗坏血酸-氨基酸衍生物的最佳制备工艺如下:抗坏血酸与精氨酸发生反应,二者的体积比为2∶1,pH为10.0,沸水浴90min,此条件下制备的衍生物还原力最强,大约是同浓度抗坏血酸的2.17倍,提示该方法是改善抗坏血酸抗氧化活性的有效方法。
[关键词]抗坏血酸;精氨酸;抗氧化活性 ;制备工艺
氧化应激是指机体活性氧自由基簇(ROS)产生过多或/和机体抗氧化能力下降、ROS清除不足而导致的活性氧在体内增多并引起细胞氧化损伤的病理过程[1]。从人体的衰老到老年神经退行性疾病,从死亡率最高的心脑血管疾病到最可怕的癌症,人类的许多疾病都与体内的氧化应激反应有关[2]。抗氧化剂(天然、人工合成)可预防机体因氧化应激所造成的生物大分子的系列损伤。由于人工合成的抗氧化剂如2,6-二叔丁基-4-甲基苯酚(BHT)、丁基羟基茴香醚(BHA)等具有一定的毒性和致癌作用[3,4],所以评价和筛选具有强抗氧化活性的天然抗氧化剂已成为生物学、医学和食品科学研究的新趋势。L-抗坏血酸(L-ascorbic acid)又名维生素C,广泛存在于各种新鲜的蔬菜和水果中,是含有6个碳原子的酸性多羟基化合物,也是一种重要的以抗氧化功能为特色的水溶性维生素。抗坏血酸具有抗癌活性,能够预防心血管疾病、提高人体的免疫力,还能够通过清除人体正常代谢产生的自由基而起到延缓衰老的作用[5,6]。抗坏血酸作为抗氧化剂在食品、化妆品及医药等领域已得到广泛应用。但是,由于抗坏血酸分子中有烯二醇基团,在热、空气和金属离子的存在下,易于氧化变质,因而不稳定性成为其使用过程中的一大障碍[7,8]。对抗坏血酸进行结构改性,可以增强其稳定性,甚至可以提高其抗氧化活性,扩大应用范围,已成为当前食品科学领域研究的热点之一[9]。除了已成功开发的抗坏血酸钙、抗坏血酸钠、抗坏血酸硬脂酸酯等衍生物外,近年来壳聚糖抗坏血酸盐[10]、抗坏血酸肉桂酸酯[11]和抗坏血酸没食子酸酯[12]等一些新的抗坏血酸衍生物合成的研究相继被报道,但有关抗坏血酸-氨基酸衍生物合成的研究报道鲜见。因此,本研究探讨了抗坏血酸-氨基酸衍生物的制备工艺,以期为新型抗坏血酸衍生物的合成与应用提供参考。
1材料与方法
1.1材料与仪器
1.1.1材料
抗坏血酸、精氨酸、谷氨酸、酪氨酸、脯氨酸、赖氨酸、亮氨酸均为BR(沪试),购自国药集团化学试剂总公司;铁氰化钾、三氯乙酸及三氯化铁等试剂,除特别注明外均为国产分析纯。
1.1.2主要仪器
精密pH计:PHS-3C型,上海雷磁仪器厂产品;数显恒温水浴锅:HH-4型,国华电器有限公司产品;万分之一电子天平:BT354S-XM型,北京赛尔斯精密仪器有限公司产品;紫外可见分光光度计:TU-1810型,北京普析通用仪器有限公司产品。
1.2试验方法
1.2.1抗坏血酸-氨基酸衍生物制备的单因素试验
1)氨基酸种类对制备反应的影响0.02mol/L的抗坏血酸分别与0.02mol/L的亮氨酸、脯氨酸、赖氨酸、谷氨酸、精氨酸、酪氨酸等体积混合于具塞试管中,然后用1mol/L的HCl和NaOH调节pH至9.0,反应体系总体积为10mL,将试管置于沸水中加热30min,于冰浴冷却,测定产物的还原力。
2)抗坏血酸与氨基酸的体积比对制备反应的影响分别按体积比4∶1、3∶1、2∶1、1∶1、1∶2、1∶3移取0.02mol/L的抗坏血酸和0.02mol/L精氨酸,用1mol/L的HCl和NaOH调节溶液的pH值至9.0,反应体系的总体积为10mL,将试管置于沸水中加热30min,于冰浴冷却,测定产物的还原力。
3)pH对制备反应的影响按体积比2∶1分别取0.02mol/L的抗坏血酸和0.02mol/L的精氨酸于试管中,然后用1mol/L的HCl和NaOH分别调节溶液的pH至6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0,反应体系的总体积为10mL,将试管置于沸水中加热30min,于冰浴冷却,测定产物的还原力。
4)加热时间对制备反应的影响按体积比2∶1分别取0.02mol/L的抗坏血酸和0.02mol/L的精氨酸于试管中,然后用1mol/L的HCl和NaOH调节溶液的pH至10.0,反应体系总体积为10mL。将各试管置于沸水中分别加热30、60、90、120、150、180min,于冰浴冷却,测定产物的还原力。
1.2.2抗坏血酸-氨基酸衍生物制备的正交试验
在单因素试验的基础上,采用L9(34)正交表进行正交试验设计,各因素、水平的设计如表1所示。

表1 正交试验设计的因素、水平表
1.2.3还原力的测定
参照Duan等[13]的方法并略作修改。于试管中加入样品液0.5mL,用0.2mol/L pH6.6的磷酸盐缓冲溶液补足至2.5mL,再加入5mL 1%铁氰化钾,混匀。各试管置于50℃水浴20min,然后加入10% 的三氯乙酸(TCA)2.5mL,摇匀,3500r/min离心10min。吸取上清液2.5mL,加入0.5mL 0.1%的三氯化铁溶液和2.5mL蒸馏水,摇匀,静置3~5min,于700nm处测定光密度,光密度值越大,还原力越强,抗氧化活性也越强。
1.2.4紫外光谱扫描
为判定反应的发生,分别对抗坏血酸、氨基酸和最佳反应条件下制备的抗坏血酸-氨基酸衍生物溶液于波长190~400nm范围内进行紫外光谱扫描。
2结果与分析
2.1抗坏血酸-氨基酸衍生物制备的单因素试验2.1.1氨基酸种类对制备反应的影响
不同的氨基酸所含有的基团不同,酸碱性不同,极性大小也不同,从而会影响制备反应的发生。从图1可以看出,在6种氨基酸中,精氨酸与抗坏血酸反应产物的还原力最大,6种氨基酸与抗坏血酸反应后产物还原力的大小顺序依次为:精氨酸>赖氨酸>亮氨酸>谷氨酸>脯氨酸>酪氨酸。
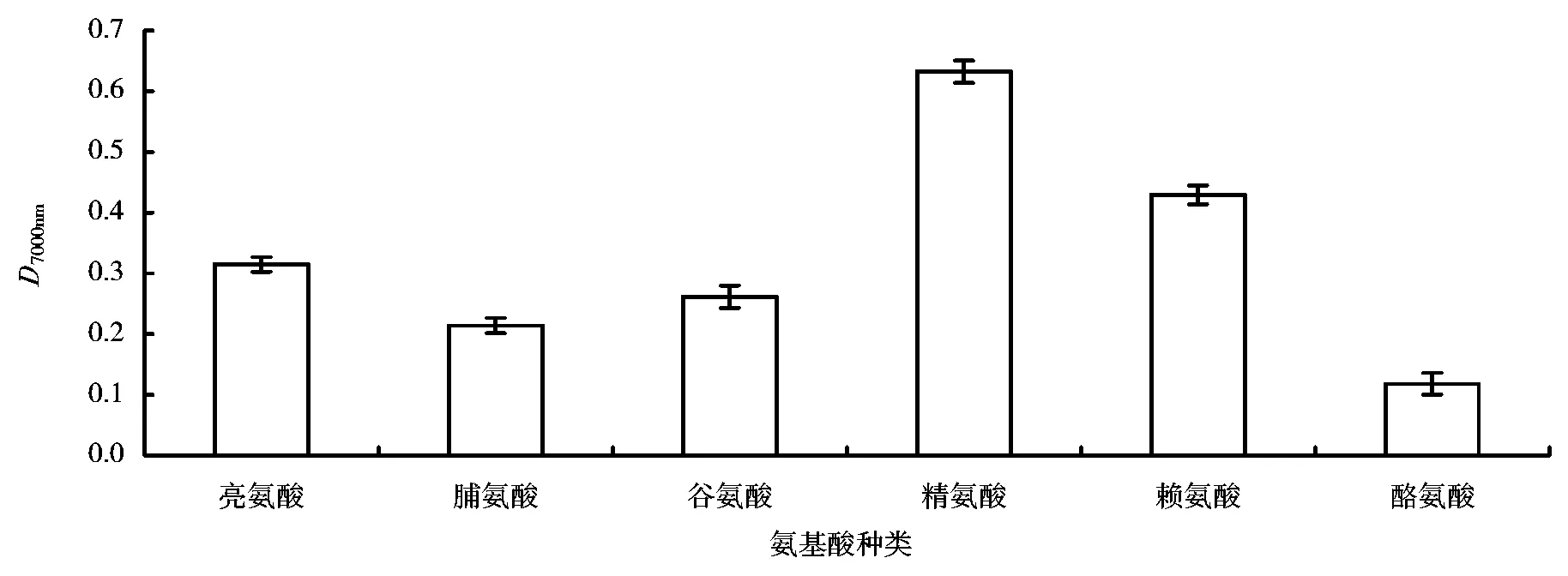
图1 氨基酸种类对制备反应的影响
2.1.2抗坏血酸与氨基酸的体积比对制备反应的影响
抗坏血酸与氨基酸的体积比会影响二者间的碰撞,从而影响反应的发生。从图2可知,随着反应体系中氨基酸所占比例的增加,产物抗氧化活性呈先增后减的变化趋势,当抗坏血酸与精氨酸的体积比为2∶1时,产物的抗氧化性最强。

图2 体积比对制备反应的影响
2.1.3pH对制备反应的影响
pH会影响反应物分子上各种基团的解离,从而会对反应的发生产生影响。从图3可以看出,随着反应体系pH的增加,产物的抗氧化活性呈先增后减的变化,在pH为10.0时,产物的抗氧化性也最强。

图3 pH对制备反应的影响
2.1.4加热时间对制备反应的影响
加热时间会影响反应的进程,从而会影响产物的抗氧化活性。从图4可知,随着加热时间的延长,产物的抗氧化活性呈先增后减的变化,在加热时间为60min时,产物的抗氧化性最强。
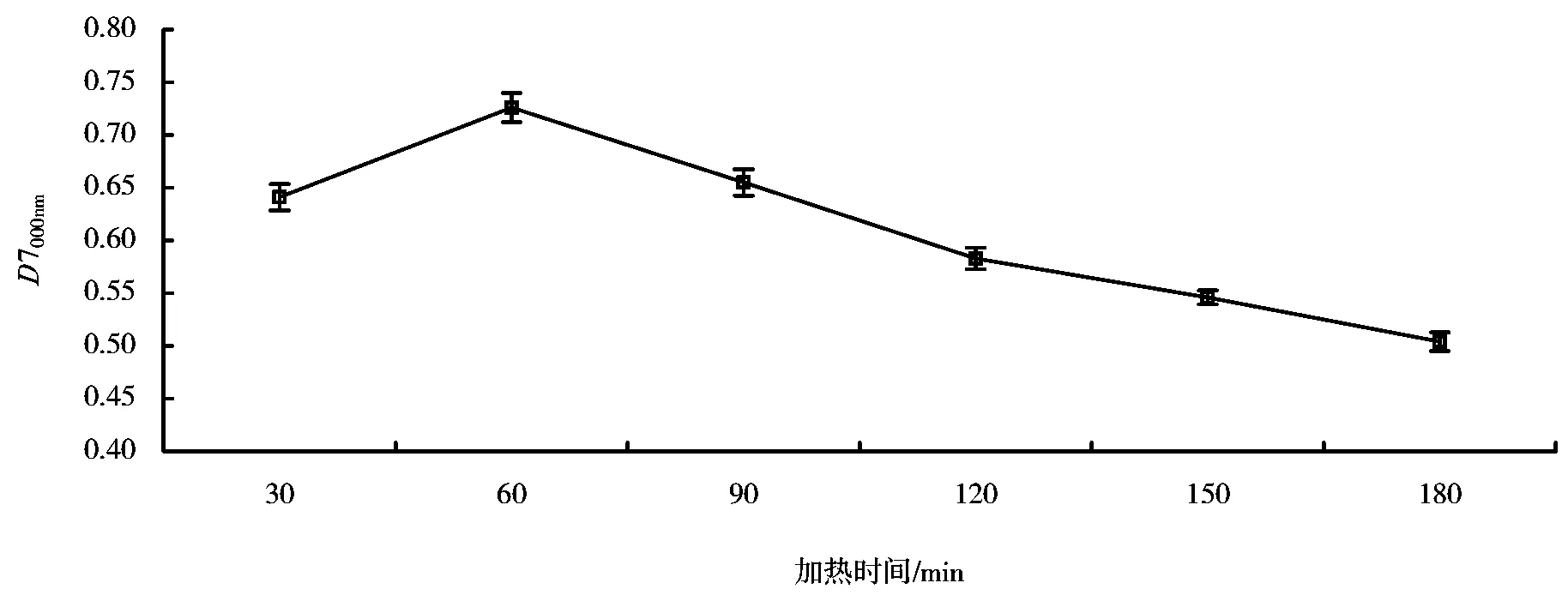
图4 加热时间对制备反应的影响
2.2抗坏血酸-氨基酸衍生物制备的正交实验
抗坏血酸-氨基酸衍生物制备的正交试验结果分别如表2和表3所示。从表2的极差分析和表3的方差分析可知,影响抗坏血酸-氨基酸衍生物制备的各因素的排列顺序为:B>C>D>A,即体积比>pH>加热时间>氨基酸种类;体积比和pH对制备反应的影响极显著(P<0.01),加热时间对制备反应的影响显著(P<0.05);抗坏血酸-氨基酸衍生物的最佳制备工艺为A2B1C2D3,即抗坏血酸与精氨酸进行反应,二者的体积比2∶1、pH为10.0、加热时间为90min,在此条件下制备的产物的还原力最强。

表2 正交试验的极差分析表
注:*表示显著水平在0.05,**表示显著水平在0.01。
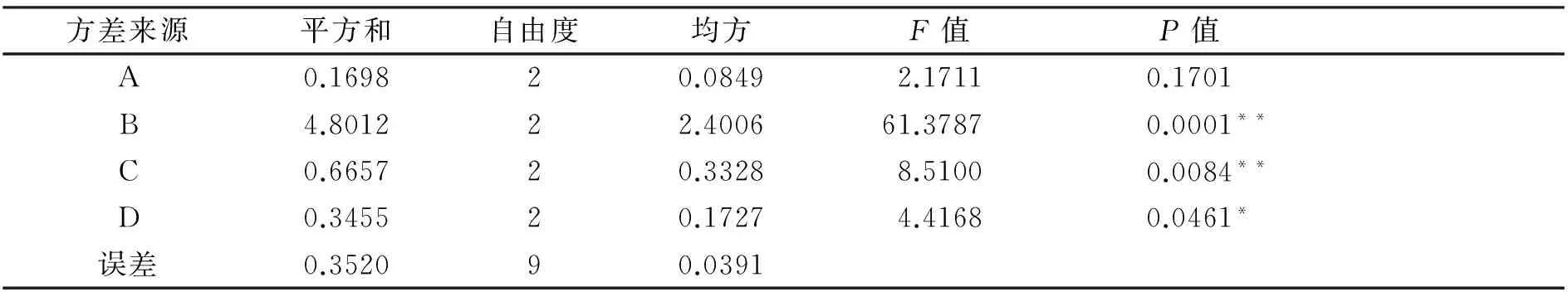
表3 正交试验的方差分析表
2.3抗坏血酸反应前后抗氧化活性的比较

图5 抗坏血酸-氨基酸衍生物与抗坏血酸还原力的比较
由图5可知,抗坏血酸在与氨基酸发生反应前后抗氧化活性的差异很大,在最佳制备工艺条件下制备的抗坏血酸-精氨酸衍生物的还原力大约是反应前的2.17倍,表明抗坏血酸经过氨基酸的衍生反应以后抗氧化性得到明显提高。
2.4产物鉴定
由图6的紫外扫描图谱可知,与精氨酸和抗坏血酸相比,抗坏血酸-精氨酸衍生物的紫外扫描图谱有明显的不同,精氨酸在205nm附近有最大吸收峰,抗坏血酸在230nm附近有最大吸收峰,而抗坏血酸-精氨酸衍生物在200nm和255nm附近分别有2个最大吸收峰,说明精氨酸与抗坏血酸反应后生成了全新的物质,即本研究所制备的抗坏血酸-精氨酸衍生物。

图6 抗坏血酸、精氨酸及抗坏血酸-精氨酸衍生物的紫外扫描图谱
3结论
抗坏血酸-氨基酸衍生物的最佳制备工艺为:抗坏血酸与精氨酸发生反应,二者的体积比为2∶1,pH为10.0,沸水浴90min,此条件下所获得的衍生物的还原力最大;抗坏血酸-氨基酸衍生物的抗氧化性较原抗坏血酸有大幅度的提高,还原力大约是反应前的2.17倍,表明本方法是改善抗坏血酸抗氧化活性的有效方法。此外,抗坏血酸-精氨酸衍生物是在沸水浴条件下制备的,因此,热稳定性较抗坏血酸已明显增强,但空气、金属离子等其他方面因素对于抗坏血酸-精氨酸衍生物的影响还有待于进一步的研究。
[参考文献]
[1]Sarmadi B H,Ismail A.Antioxidative peptides from food proteins:a review[J].Peptides,2010,31:1949~1956.
[2]Chen Z,Bertin R,Froldi G.EC 50 estimation of antioxidant activity in DPPH assay using several statistical programs[J].Food chemistry,2013,138:414~420.
[3]Power O,Jakeman P,FitzGerald R J.Antioxidative peptides:enzymatic production,invitroand invivoantioxidant activity and potential applications of milk-derived antioxidative peptides[J].Amino Acids,2013,44:797~820.
[4]Girgih A T,He R,Hasan F M,etal.Evaluation of theinvitroantioxidant properties of a cod (Gadusmorhua) protein hydrolysate and peptide fractions[J].Food Chemistry,2015,173:652~659.
[5]郑大贵,肖竹平,余衍文,等.5,6-O-苯乙烯基亚甲基-L-抗坏血酸的合成及其清除自由基和抗菌性能研究[J].化学试剂,2010,32(5):403~406.
[6]Gan L,Seib P A.Preparation and antioxidant activities of phenolic esters and ethers of L-ascorbic acid[J].Journal of carbohydrate chemistry,1998,17:397~404.
[7]Kuwabara K,Watanabe Y,Adachi S,etal.Stability of Saturated Acyl L-Ascorbates in Aqueous Solution[J].Journal of food science,2005,70:7~11.
[8]Kuwabara K,Watanabe Y,Adachi S,etal.Synthesis of 6-O-unsaturated acyl L-ascorbates by immobilized lipase in acetone in the presence of molecular sieve[J].Biochemical Engineering Journal,2003,16:17~22.
[9]刘建伟,赵海珍,吕凤霞,等.L-抗坏血酸脂肪酸酯抗氧化活性[J].食品与生物技术学报2011,30(2):207~212.
[10]刘静娜,庄远红,耿微微.壳聚糖抗坏血酸盐的制备及其抗氧化性的研究[J].食品工业科技,2011,32(10):139~141,145.
[11]王园,惠爱玲,潘见,等.L-抗坏血酸肉桂酸酯的合成及其抗氧化活性研究[J].现代食品科技,2013,29(6):1337~1341.
[12]范广璞,刘菊香,刘长春.L-抗坏血酸没食子酸酯的酶催化合成及抗氧化性[J].食品与发酵工业,2013,39(12):123~127.
[13]Duan X,Ocen D,Wu F,etal.Purification and characterization of a natural antioxidant peptide from fertilized eggs[J].Food Research International,2014,56:18~24.
[收稿日期]2015-11-12
[基金项目]大学生创新创业训练计划项目(108792015048);大学生创新科研基金项目(15XSZ36)。
[作者简介]闻霞(1995-),女,现从事食品生物技术研究。通信作者:张强,zq7964@163.com。
[中图分类号]TS201.2+4
[文献标识码]A
[文章编号]1673-1409(2016)03-0048-06
[引著格式]闻霞,李娜,滕右露,等.基于抗氧化活性的抗坏血酸-氨基酸衍生物制备工艺的优化[J].长江大学学报(自科版) ,2016,13(3):48~53.
