艾赛布考抑制兔动脉粥样硬化的作用及可能机制
2016-06-13李婷婷郭媛张建宁刘天骄李俊张运
李婷婷,郭媛,张建宁,刘天骄,李俊,张运
艾赛布考抑制兔动脉粥样硬化的作用及可能机制
李婷婷,郭媛,张建宁,刘天骄,李俊,张运
摘要
目的:艾赛布考是普罗布考代谢稳定的衍生物,具有抗氧化、抗炎、抗增殖特性。本研究旨在探讨艾赛布考对高胆固醇血症兔腹主动脉损伤后动脉粥样硬化发展的影响。
方法:45只雄性新西兰兔随机分为对照组、艾赛布考组、普罗布考组3组,每组15只,分别给予高脂饮食(对照组),高脂饮食+1%艾赛布考(艾赛布考组)或1%普罗布考(普罗布考组),2周后,行腹主动脉内膜球囊损伤术,继续药物干预10周。12周末,行血管内超声评价三组兔腹主动脉粥样硬化斑块面积和斑块负荷;通过免疫组织化学法观察斑块内巨噬细胞的含量,免疫组织化学法、实时定量聚合酶链式反应分别检测斑块组织内炎症因子细胞间黏附分子-1、单核细胞趋化蛋白-1、基质金属蛋白酶-9蛋白及信使核糖核酸的表达。
结果:与对照组相比,艾赛布考组兔血中低密度脂蛋白胆固醇及氧化应激水平显著降低,腹主动脉粥样硬化斑块内巨噬细胞含量及炎症因子表达也降低,斑块面积及斑块负荷显著减少(P均<0.01)。与普罗布考组相比,艾赛布考组兔腹主动脉斑块面积及斑块负荷降低更加显著,差异具有统计学意义(P均<0.01)。
结论:艾赛布考通过调脂、抗炎、抗氧化作用,抑制内膜损伤后动脉粥样硬化进展。
关键词动脉粥样硬化;高脂血症;动脉损伤;氧化性应激
作者单位:250012山东省济南市,山东大学齐鲁医院老年医学科(李婷婷、李俊),心内科(郭媛、刘天骄、张运),重症监护室(张建宁)
Effect and Possible Mechanism of Elsibucol Inhibiting Atherosclerosis in Experimental Rabbits
LI Ting-ting,GUO Yuan,ZHANG Jian-ning,LIU Tian-jiao,LI Jun,ZHANG Yun.
Department of Geriatrics,Shandong University Qilu Hospital,Jinan (250012),Shandong,China
Abstract
Objective:Elsibucol is a metabolically stable derivative of probucol with the properties of anti-oxidation,anti-inflammation and anti-proliferation.We want to explore the effect of elsibucol on abdominal aorta injury in hypercholesterolemia rabbits.
Methods:A total of 45 male New Zealand rabbits were divided into 3 groups:Control group,the rabbits were fed by high cholesterol diet,Elsibucol group,the rabbits received high cholesterol diet with 1% elsibucol and Probucol group,the rabbits received high cholesterol diet with 1% probucol.n=15 in each group.All animals were treated for 2 weeks followed by the procedure of abdominal aortic balloon injury and then,drug therapy was continued for 10 weeks.The area and load of atherosclerosis in abdominal aorta were evaluated by IVUS,the amount of macrophages in plaque were observed by immunohistochemistry,mRNA and protein expressions of MCP-1,MMP-9 were examined by RT-PCR and immunohistochemistry.
Results:Compared with Control group,Elsibucol group showed decreased blood LDL-C and oxidative stress,decreased amount of macrophages and lower expression of inflammatory factors in atherosclerosis plaque,reduced plaque area and load,all P<0.01.Compared with Probucol group,Elsibucol group presented even lower plaque area and load,all P<0.01.
Conclusion:Elsibucol inhibits the progress of atherosclerosis in experimental rabbits via regulating blood lipids,antiinflammation and anti-oxidation.
Key wordsAtherosclerosis; Hyperlipidemias; Artery injuries; Oxidative stress
(Chinese Circulation Journal,2016,31:449.)
动脉粥样硬化(AS)是目前对人类健康影响最严重、最常见的慢性病之一,是冠心病、脑血管病和血栓栓塞性疾病等缺血性心脑血管病的主要病理基础[1]。到目前为止,AS 的发病机制尚未完全清楚,以致临床缺乏有效的防治药物[2]。大量的基础和临床研究表明,AS的发生可能为脂质代谢紊乱、炎性细胞浸润、氧化应激、血管内皮细胞损伤、平滑肌细胞激活等多种机制相互作用的结果。因此,深入探讨AS的发病机制,寻找能够同时作用于AS进程中多种因素的新的治疗策略,对AS的防治具有重要意义。
普罗布考(丙丁酚)是美国食品药品监督管理局唯一认证的抗氧化药物,作为调血脂药于1977年首先在美国上市,近年发现其具有抗氧化、降脂外的其他作用,如抗炎症、抑制平滑肌细胞增殖等[3]。动物实验表明,普罗布考可抑制球囊损伤后猪冠状动脉及大鼠、兔颈动脉新生内膜增殖[4-6]。临床研究发现,普罗布考能够抑制颈AS斑块的进展[7],抑制冠状动脉成形术后再狭窄[8]。本课题组前期研究通过建立兔AS易损斑块模型,发现普罗布考能够降低斑块内炎症反应及平滑肌细胞凋亡,抑制AS进展,增强斑块稳定性[9]。然而,因其降低高密度脂蛋白胆固醇(HDL-C)、延长 QT 间期的不良反应,普罗布考在临床的长期应用受到限制[3,10]。艾赛布考(AGI-1096)是普罗布考代谢稳定的衍生物[11],其对普罗布考的结构进行修饰,保留了普罗布考的抗氧化特性,而对HDL-C和QT间期没有不良影响[12]。艾赛布考最初被用于抑制器官移植排斥反应,其在体外被证明具有抗炎、抗增殖作用,从而抑制主动脉移植模型的血管病变[13]。本研究利用高脂喂养+球囊损伤腹主动脉建立兔AS模型,观察艾赛布考对血管损伤后粥样硬化斑块形成的影响,并阐明其可能的作用机制。
1 材料与方法
实验动物:雄性纯种新西兰大白兔45只,体重1.6~2.0 kg,购于山东省农业科学院。
主要试剂与仪器:普罗布考(北京诺华医药公司赠送);艾赛布考(Astellas Pharma,日本);超氧化物岐化酶(SOD)试剂盒、丙二醛试剂盒(南京建成生物工程研究所产品);氧化型低密度脂蛋白(ox-LDL)酶联免疫吸附试验(ELISA)试剂盒(美国A﹠D 公司产品);小鼠抗兔巨噬细胞单克隆抗体(RAM11,丹麦 DAKO 公司产品);链霉亲和素/过氧化物酶(SP)试剂盒和二氨基联苯胺染色试剂(购自北京中杉生物试剂有限公司);核糖核酸(RNA)提取试剂 TRIZOL(购自美国 Invitrogen 公司);逆转录试剂盒及 SYBR 实时定量聚合酶链式反应(RTPCR)Kit DRR045S(美国 Promega 公司和 Takara 大连宝生物工程有限公司产品)。美国波士顿Galaxy血管内超声(IVUS),探头频率为40 MHz。
兔AS模型的建立及药物干预:45只新西兰兔饲养观察2周后,随机分为对照组、艾赛布考组、普罗布考组,每组15只,高脂对照组给予高脂饲料(1%胆固醇,5%猪油,100 g/d)喂养,艾赛布考组、普罗布考组在高脂饲料喂养的基础上分别给予1% w/w(1 g/d) 艾赛布考和1% w/w(1 g/d)普罗布考[9,14],持续12周。高脂喂养2周后行腹主动脉内膜球囊损伤术。戊巴比妥钠(3%,30 mg/kg) 麻醉动物后,穿刺右股动脉,沿0.014导 丝 将 内 径3.5 mm、长15 mm的球囊导管送入腹主动脉约20 cm,8个大气压充盈球囊并缓慢回拉球囊平切口处,反复回拉3次,以造成腹主动脉内膜损伤。
IVUS检查:于12周末动物处死前行IVUS检查,操作如下:常规应用4 F穿刺针穿刺左股动脉,在0.014英寸导引钢丝及扩张管辅助下,插入5 F鞘管,固定,立即按100 U/kg给予肝素静注抗凝,沿导引钢丝在体表血管超声的引导下,插入IVUS探头导管,通过左股动脉至主动脉弓,然后以0.5 mm/s的速度回撤探头导管并记录图像,录像供脱机分析和存档。测量指标:血管外弹力膜面积(EEMA)、管腔面积(LA)、斑块面积(PA),按照公式计算斑块负荷(PB)。
生化检测血脂水平及氧化指标:实验末空腹抽取实验兔耳中动脉血液,应用自动生化分析仪(Roche Hitachi 917,日本)检测血清总胆固醇(TC)、甘油三酯(TG)、HDL-C水平,并计算低密度脂蛋白胆固醇(LDL-C)水平,由本院检验科专人质控完成;夹心ELISA测定血清 ox-LDL含量;用黄嘌呤氧化酶法检测总 SOD 活性;硫代巴比妥酸反应法测定血清丙二醛含量。操作步骤严格按照试剂盒说明书进行。
免疫组织化学检测兔腹主动脉粥样硬化斑块内巨噬细胞及炎症因子:分离动物腹主动脉,制成4 μm厚的石蜡切片,抗原修复,3% H2O2处理10 min,5%正常山羊血清封闭,室温孵育20 min后,滴加适当稀释的巨噬细胞(RAM11)、细胞间黏附分子-1(ICAM-1)、单核细胞趋化蛋白-1(MCP-1)、基质金属蛋白酶-9(MMP-9)一抗工作液,4℃过夜,辣根过氧化物酶标记的二抗室温1 h,二氨基联苯胺显色,阳性表达呈棕黄色。采用 Image-Pro Plus 5.0图像分析软件测量斑块内阳性染色面积及阳性染色面积占内膜面积的比例。每个样本取4~5 张切片的平均值。
RT-PCR检测斑块内ICAM、MMP-9和MCP-1信使核糖核酸(mRNA)的表达:分别抽提3组腹主动脉组织总RNA,紫外分光光度计测定其A260/ A280,计算RNA纯度。根据逆转录试剂盒的要求逆转录为cDNA,Light Cycler扩增仪进行扩增,通过检测PCR反应液中SYBR GreenⅠ的荧光信号强度来实时定量 PCR反应。所有引物均参照Gene-bank提供的序列,用Primer 5.0合成,由上海生物工程公司合成。MMP-9的引物序列:上游5'-TGTGTCTTCCCCTTCGTCTTCC-3',下游5'-GCCCCACTTCTTGTCGCTG T-3';ICAM 的引物序列:上游5'-AACCGG AAGGTGTATGAACTG-3',下游 5'-GGAGGTGTTCTCAAACAGCTC-3';MCP-1 的引物序列:上游 5'-CAGCCAGATGCCGTGAA-3',下游5'-CGGTCACCCTTC TCCAACT-3';甘油醛-3-磷酸脱氢酶(GAPDH)的引物序列:上游 5'-GAGCTGAACGGGAAACTCA C-3',下游5'-TTGGGTTGTGGAATAAGAGGT-3'。通过计算机中分析软件得出PCR产物标准曲线,得出目的基因与内参基因GAPDH扩增产物的浓度比,用以表示目的基因的相对表达量。
统计学处理:采用SPSS 19.0统计软件包进行数据分析。计量资料以均数±标准差表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著差异t(LSD-t)检验,P<0.05为差异有统计学意义。
2 结果
三组兔血脂水平比较(表1):与对照组相比,艾赛布考组兔TC及 LDL-C水平显著降低,差异有统计学意义(P均<0.01),普罗布考组TC及LDL-C有所降低,但差异并无统计学意义(P>0.05)。三组间TG水平差异无统计学意义(P>0.05)。与对照组相比,普罗布考组HDL-C水平显著降低,差异有统计学意义(P<0.01),而艾赛布考组HDL-C水平有所降低,但差异并无统计学意义(P>0.05)。
表1 三组兔血脂水平比较(mmol/L,±s,n=15)
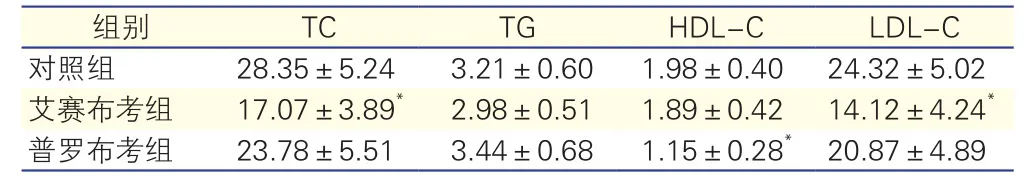
表1 三组兔血脂水平比较(mmol/L,±s,n=15)
注:TC:总胆固醇;TG:甘油三酯;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。与对照组比较*P<0.01
组别 TC TG HDL-C LDL-C对照组 28.35±5.24 3.21±0.60 1.98±0.40 24.32±5.02艾赛布考组 17.07±3.89* 2.98±0.51 1.89±0.42 14.12±4.24*普罗布考组 23.78±5.51 3.44±0.68 1.15±0.28*20.87±4.89
三组兔血清 SOD、丙二醛及ox-LDL水平(表2):与对照组比较,艾赛布考组及普罗布考组兔血清SOD活性升高,血清丙二醛和ox-LDL含量降低,差异均有统计学意义(P均<0.01)。
表2 三组兔血清 SOD、丙二醛及 ox-LDL水平比较(±s,n=15)

表2 三组兔血清 SOD、丙二醛及 ox-LDL水平比较(±s,n=15)
注:SOD:超氧化物岐化酶;ox-LDL:氧化型低密度脂蛋白。与对照组比较*P<0.01
组别 SOD (kU/L) 丙二醛 (μmol/L)ox-LDL (μg/L)对照组 76.25±12.31 8.08±1.23 158.38±18.41艾赛布考组 128.36±13.24* 4.90±0.83* 94.60±14.51*普罗布考组 115.40±14.37* 4.25±0.95* 103.76±15.83*
IVUS测量三组兔腹主动脉斑块面积、斑块负荷(表3、图1):定量IVUS分析表明,与对照组相比,艾赛布考组及普罗布考组兔病变血管的外弹力膜面积、斑块面积及斑块负荷显著降低,差异具有统计学意义(P均<0.01)。与普罗布考相比,艾赛布考组兔腹主动脉斑块面积及斑块负荷降低更加显著,差异具有统计学意义(P均<0.01)。
表3 三组兔血管内超声检测指标比较(±s,n=15)

表3 三组兔血管内超声检测指标比较(±s,n=15)
注:EEMA:外弹力膜面积;LA:管腔面积;PA:斑块面积;PB:斑块负荷。与对照组比较*P<0.01;与普罗布考组比较△P<0.01
组别 EEMA (mm2)LA (mm2) PA (mm2) PB (%)对照组 11.02±1.31 6.79±1.09 3.83±0.50 34.75±6.15艾赛布考组 8.89±1.24* 7.54±1.33 1.35±0.31*△ 15.19±3.03*△普罗布考组 8.53±1.05* 6.57±1.37 1.96±0.37* 22.98±4.12*

图1 血管内超声检测下三组兔腹主动脉斑块形态
三组兔腹主动脉斑块中巨噬细胞含量比较(图2):与对照组[(33.45±5.77)%]相比,艾赛布考组[(10.02±2.56)%]及普罗布考组[(15.45±3.46)%]兔腹主动脉斑块内巨噬细胞的含量均显著降低,差异均有统计学意义(P均<0.01)。

图2 免疫组织化学染色检测三组兔腹主动脉斑块中巨噬细胞含量(×400)
三组兔腹主动脉斑块中ICAM-1、MCP-1 和MMP-9表达水平比较(图3):免疫组织化学染色可见,对照组兔腹主动脉粥样斑块内有明显的ICAM-1、MCP-1 和MMP-9的表达,主要存在于内皮细胞、巨噬细胞、泡沫细胞的细胞浆及细胞膜上。与对照组相比,艾赛布考组及普罗布考组兔腹主动脉斑块内ICAM-1[依次为(24.61±3.89)%、(11.32±3.04)%、(13.47±3.22)%]、MCP-1[依次为(20.89±3.78)%、(9.45±2.55)%、(11.07±2.31)%]、MMP-9[依次为(30.72±5.60)%、(15.34±4.56)%、(12.97±4.21)%]阳性染色强度及面积百分率显著降低,差异均有统计学意义(P均<0.01)。
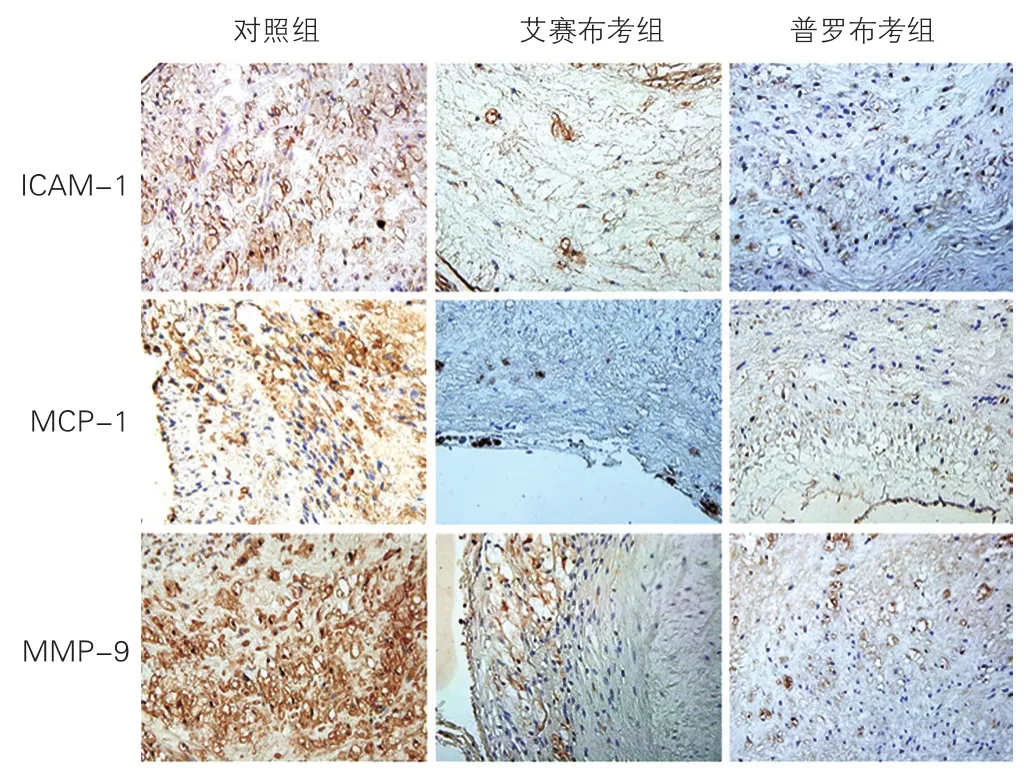
图3 免疫组织化学染色检测三组兔腹主动脉斑块中炎症因子的表达(×400)
三组兔腹主动脉斑块内ICAM、MMP-9 和MCP-1 mRNA表达比较(图4):与 对 照 组 相 比,艾赛布考组及普 罗 布 考 组 兔腹主动脉 斑 块 内ICAM-1、MMP-9 和MCP-1 mRNA的表达量明显降低(P均<0.01)。
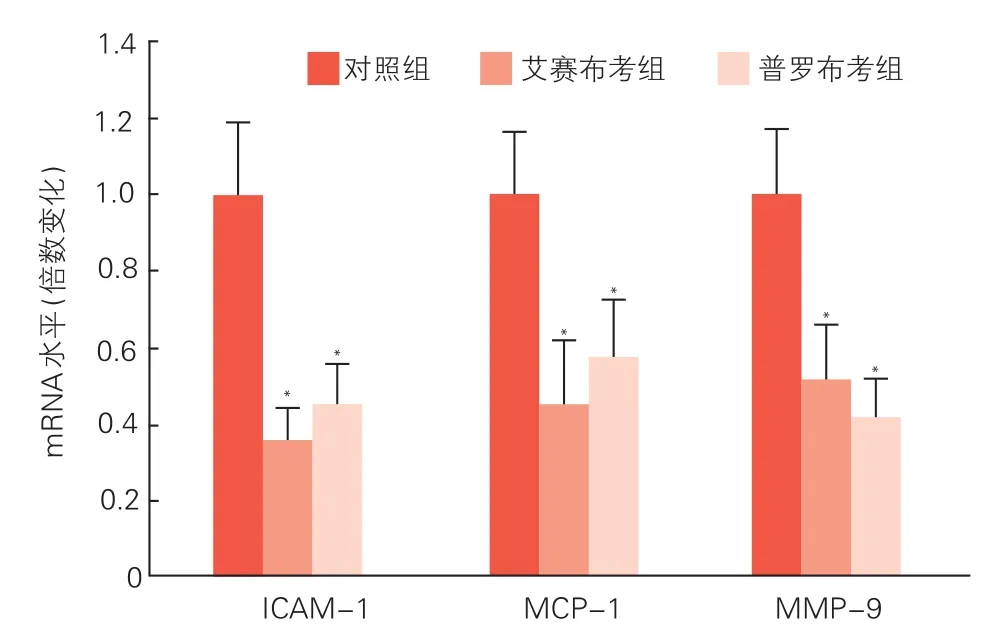
图4 实时定量聚合酶链式反应检测三组兔腹主动脉斑块组织ICAM-1、MCP-1 和MMP-9 mRNA的表达(n=15)
3 讨论
尽管近年血管介入技术飞速发展,血运重建技术如冠状动脉旁路移植术(CABG)和经皮冠状动脉介入治疗(PCI)在治疗晚期冠状动脉粥样硬化中常规应用,但从根本上抑制AS进程的方法仍非常有限。以降低LDL-C为治疗基础的他汀类药物已经证明能够促进AS病变的消退[15],但是PROVE-IT研究发现,尽管接受强化他汀治疗2年,纳入的患者中仍有22.4%发生急性冠状动脉事件[16]。另外,他汀类药物有肝酶升高、肌溶解等不良作用,限制其在部分患者的应用[17]。因此,寻找能够限制AS病变发生发展,甚至促使AS病变消退的治疗新策略,仍然是临床上亟待解决的问题。艾赛布考是普罗布考代谢稳定的衍生物,最初用于预防免疫介导的器官移植排斥,其具有抗炎和体外抗增殖特性,可防止移植物血管疾病[16]。本研究发现,艾赛布考可降低AS模型兔血胆固醇含量,抑制腹主动脉斑块内炎症及氧化应激反应,抑制AS发生、发展。
迄今为止,大多数全身性应用的常规药物未能抑制AS或再狭窄,普罗布考是一个例外,其除具有降低胆固醇的作用外,还具有抗氧化、抗炎症等特性,多项动物实验包括本课题组的前期研究表明,普罗布考能够抑制AS进展,临床试验证实其能够防止冠状动脉支架置入术后再狭窄。然而,因其降低HDL-C、延长QT间期的副作用,普罗布考的临床应用受到限制。因此,研究人员对普罗布考的结构进行修饰,研制出新的衍生物,以保留普罗布考的抗氧化特性,去除对HDL-C和QT间期不良影响。本研究结果表明,艾赛布考能显著抑制高胆固醇血症兔动脉损伤后斑块的形成,且其作用比普罗布考更为有效。在降低TC和LDL-C水平方面,艾赛布考的作用比普罗布考更为显著,且对HDL-C没有显著影响。这意味着艾赛布考具有潜在的临床应用前景,因为在ARISE研究中普罗布考的另一衍生物琥珀布考(succinobucol或AGI-1067)与升高的LDL-C水平相关,且对主要心血管终点无改善作用[18]。
除了其降低血胆固醇水平的作用,本研究发现,艾赛布考具有多方面的血管保护作用。有研究表明艾赛布考可以抑制体外H2O2刺激细胞的ROS形成[13]。同样,我们的体内实验结果显示,艾赛布考增加AS兔血SOD酶活力水平,降低丙二醛、ox-LDL含量,进一步证明艾赛布考具有抗氧化特性。另外,与对照组相比,艾赛布考组斑块组织内ICAM-1、MCP-1、MMP-9 mRNA和蛋白水平显著降低,提示其可通过其抗炎作用来抑制 AS 的进展。与此结果一致的是,体外实验表明艾赛布考抑制人肺动脉内皮细胞血管细胞黏附分子-1、E-选择素和MCP-1的表达[13]。我们的研究结合其他实验结果表明,艾赛布考具有抗炎、抗氧化的血管保护作用。鉴于炎症和氧化应激在内皮功能障碍和血管疾病发展中的重要地位[2],我们的结果表明,艾赛布考可能成为抑制AS病变进展的有力治疗工具。
综上所述,艾赛布考具有抗 AS进展的作用,其效应不仅归功于降脂作用,还与其抗氧化、抗炎症作用有关。与他汀类调脂药不同,艾赛布考不会引起肌病和肝酶升高,且没有普罗布考降低HDL-C、延长QT间期的副作用,在AS的防治方面具有良好的临床应用前景。
参考文献
[1]Hansson GK.Inflammation,atherosclerosis,and coronary artery disease.N Engl J Med,2005,353:429-430.
[2]Ross R.The pathogenesis of atherosclerosis:a perspective for the 1 990s.Nature,1993,362:801-809.
[3]Yamashita S,Matsuzawa Y.Where are we with probucol:a new life for an old drug? Atherosclerosis,2009,207:16-23.
[4]Schneider JE,Berk BC,Gravanis MB,et al.Probucol decreases neointimal formation in a swine model of coronary artery balloon injury.A possible role for antioxidants in restenosis.Circulation,1993,88:628-637.
[5]Ishizaka N,Kurokawa K,Taguchi J,et al.Inhibitory effect of a single local probucol administration on neointimal formation in ballooninjured rat carotid artery.Atherosclerosis,1995,118:53-56.
[6]Shinomiya M,Shirai K,Saito Y,et al.Inhibition of intimal thickening of the carotid artery of rabbits and of outgrowth of explants of aorta by probucol.Atherosclerosis,1992,97:143-148.
[7]Sawayama Y,Shimizu C,Maeda N,et al.Effects of probucol and pravastatin on common carotid atherosclerosis in patients with asymptomatic hypercholesterolemia.Fukuoka Atherosclerosis Trial (FAST).J Am Coll Cardiol,2002,39:610-616.
[8]Tardif JC,Cote G,Lesperance J,et al.Probucol and multivitamins in the prevention of restenosis after coronary angioplasty.Multivitamins and Probucol Study Group.N Engl J Med,1997,337:365-372.
[9]Li T,Chen W,An F,et al.Probucol attenuates inflammation and increases stability of vulnerable atherosclerotic plaques in rabbits.Tohoku J Exp Med,2011,225:23-34.
[10]Klein L.QT-interval prolongation produced by probucol.Arch Intern Med,1981,141:1102-1103.
[11]Shizuya Y,Daisaku M,Yuji M.Did we abandon probucol too soon?Curr Opin Lipidol,2015,26:304-316.
[12]Meng CQ,Somers PK,Rachita CL,et al.Novel phenolic antioxidants as multifunctional inhibitors of inducible VCAM-1 expression for use in atherosclerosis.Bioorg Med Chem Lett,2002,12:2545-2548.
[13]Murata S,Sundell CL,Lijkwan MA,et al.Effects of AGI-1096,a novel antioxidant compound with anti-inflammatory and antiproliferative properties,on rodent allograft arteriosclerosis.Transplantation,2004,77:1494-1500.
[14]Wu BJ,Kathir K,Witting PK,et al.Antioxidants protect from atherosclerosis by a heme oxygenase-1 pathway that is independent of free radical scavenging.J Exp Med,2006,203:1117-1127.
[15]Arsenault BJ,Kritikou EA,Tardif JC.Regression of atherosclerosis.Curr Cardiol Rep,2012,14:443-449.
[16]Gibson CM,Pride YB,Hochberg CP,et al.Effect of intensive statin therapy on clinical outcomes among patients undergoing percutaneous coronary intervention for acute coronary syndrome.PCI-PROVE IT:A PROVE IT-TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy-Thrombolysis In Myocardial Infarction22)Substudy.J Am Coll Cardiol,2009,54:2290-2295.
[17]Alsheikh-Ali AA,Maddukuri PV,Han H,et al.Effect of the magnitude of lipid lowering on risk of elevated liver enzymes,rhabdomyolysis,and cancer:insights from large randomized statin trials.J Am Coll Cardiol,2007,50:409-418.
[18]Tardif JC,McMurray JJ,Klug E,et al.Effects of succinobucol (AGI-1067) after an acute coronary syndrome:a randomised,double-blind,placebo-controlled trial.Lancet,2008,371:1761-1768.
(编辑:朱柳媛)
作者简介:李婷婷硕士研究生主要从事冠心病基础与临床研究Email:shandonglitingting@163.com通讯作者:郭媛Email:guoyuan9092@ 163.com
中图分类号:R541.4
文献标识码:A
文章编号:1000-3614(2016)05-0449-05
doi:10.3969/j.issn.1000-3614.2016.05.008
Corresponding Author:GUO Yuan,Email:guoyuan9092@ 163.com
收稿日期:(2015-09-30)
