重组融合蛋白Trx-IFN-CSP复性工艺研究
2016-06-10黄演婷卢雪梅杨小蓉金小宝朱家勇
黄演婷卢雪梅杨小蓉金小宝朱家勇
(1. 广东药学院附属第一医院,广州 510006;2. 广东药学院基础学院药用生物活性物质研究所,广州 510006;3. 广东省生物活性药物研究重点实验室,广州 510006)
重组融合蛋白Trx-IFN-CSP复性工艺研究
黄演婷1,2,3卢雪梅2,3杨小蓉1金小宝2,3朱家勇2,3
(1. 广东药学院附属第一医院,广州 510006;2. 广东药学院基础学院药用生物活性物质研究所,广州 510006;3. 广东省生物活性药物研究重点实验室,广州 510006)
旨在建立并优化融合蛋白Trx-IFN-CSP的复性工艺。对重组融合Trx-IFN-CSP进行体外复性研究,考查pH、温度、蛋白浓度、氧化还原体系及辅助复性小分子等复性条件对融合蛋白重折叠的影响。结果显示,适合Trx-IFN-CSP复性的方法为,反复冻融联合超声破菌获得包涵体;用含有1% TritonX-100、2 mol/L尿素、2% DOC洗涤液初步纯化包涵体;再用6 mol/L盐酸胍溶解液变性包涵体;脉冲加样稀释变性液后4℃条件下梯度透析复性,使用L-Arg辅助复性。经肠激酶切去Trx标签后,每升发酵液最终获得110-130 mg肝靶向干扰素,每批蛋白纯度都在95%以上,比活性在1.9-2.4×108U/mg之间,制备工艺稳定。
融合蛋白;肝靶向干扰素;包涵体;脉冲稀释;梯度透析
近年来,重组DNA技术的快速发展和蛋白质表达系统的多样性为利用微生物大规模生产蛋白质药物开辟了广阔的空间。但是,重组蛋白的高表达常常导致其在胞内发生错误折叠和聚集,形成包涵体(Inclusoin bdoy)。目前,包涵体的形成机制仍不清楚,但一般认为包涵体是由部分折叠的中间态之间疏水性相互作用形成的,是蛋白质过量表达的结果,而与其相对分子质量、疏水性以及折叠途径等内在性质没有必然的联系[1]。即对于任何蛋白质和任何表达系统来说,在过量表达的情况下都可能形成包涵体。包涵体表达量高且一级结构正确,经过变复性即可恢复蛋白生物活性,因此许多蛋白质药物的生产依赖于蛋白质复性技术的提高。
1961年,Anfinsen[2]在研究RNaseA中发现蛋白质多肽链的折叠是一个自发的过程,主要决定于它的氨基酸序列,这也被称为生物体内的第二套遗传密码。目前,虽然仍无法明确解释蛋白质如何从伸展态转变为具有生理活性的天然态。但普遍认为,分子间疏水作用是导致蛋白质聚集、变性蛋白复性收率降低的主要原因。随着对蛋白质折叠机理的深入研究发现,暴露在变性蛋白表面的疏水基团既有通过分子内疏水作用逐步折叠为天然态蛋白质的趋势,也有通过分子间相互作用形成二聚体、三聚体等无活性沉淀的趋势。蛋白质的分子间疏水基团各不相同,所以没有任何一种复性方法能复性所有的蛋白。对于某一特定蛋白的复性最佳方案,需要经过具体实验研究确定。探讨各种复性方法及相关因素,有助于寻找到最适宜的复性方案,对蛋白药物的开发生产具有重要指导意义。
Trx-IFN-CSP是本实验室通过基因工程方法构建的重组融合蛋白,初步研究证实具备了CSP I-plus高效而特异的肝细胞靶向性与IFN的抗HBV作用。本研究在前期基础上旨在筛选出一套适合Trx-IFNCSP复性的方法,采用反复冻融联合超声破菌收集包涵体,经过洗涤后选用盐酸胍溶解变性;考查pH、温度、蛋白浓度、氧化还原体系及辅助复性小分子等复性条件对融合蛋白重折叠的影响,并验证优化得出的制备工艺的稳定性,旨在为获得一套稳定的肝靶向干扰素制备工艺和足够肝靶向干扰素开展后续研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株 含Trx-IFN-CSP基因的重组菌株E.coli
BL21/pET32a-IFN-CSP,系本课题组构建。
1.1.2 主要试剂 蛋白预染Marker购自Fermentas生物公司;DTT、GSSG、GSH、DOC购自Sigma公司;其余常用试剂均为国产分析纯。
1.1.3 主要溶液 (1)细菌裂解液:30%蔗糖、1 mmol/L EDTA、50 mmol/L Tris-HCl,pH 8.0。(2)IBs洗涤液:10 mmol/L EDTA、1% Triton X-100、2 mmol/L尿 素、2% DOC、50 mmol/LTris-HCl。(3)IBs溶解液:6 mol/L盐酸胍、5 mmol/L EDTA、2.5 mmol/L DTT、50 mmol/L Tris-HCl。(4)IBs稀释液:2 mol/L盐酸胍、0.1 mol/L精氨酸、2 mmol/L GSH、0.2 mmol/L GSSG、5%甘 油、50 mmol/L Tris-HCl。(5)透析外液A:1.5 mol/L盐酸胍、0.1 mol/L精氨酸、2 mmol/L GSH、0.2 mmol/L GSSG、5%甘油、50 mmol/L Tris-HCl。(6)透析外液B:1.0 mol/L盐酸胍、0.05 mol/L精氨酸、2 mmol/L GSH、0.2 mmol/LGSSG、3%甘油、50 mmol/L Tris-HCl。(7)透析外液C:0.5 mol/L盐酸胍、1 mmol/L GSH、0.1 mmol/L GSSG、3%甘油、50 mmol/L Tris-HCl。(8)透析外液D:1%甘油、50 mmol/L Tris-HCl。
1.2 方法
1.2.1 包涵体的释放 发酵液经6 000 r/min 离心10 min 后,弃上清收集菌沉,用0.1倍体积的4℃预冷的细菌裂解液重悬菌沉,-20℃结冻过夜后,37℃水浴冻融细胞,冰浴条件下使用超声细胞破碎仪破碎30 min(功率450 W,工作2 s,停顿2 s)。破碎后于4℃,12 000 r/min 离心30 min,弃去上清,即得Trx-IFN-CSP包涵体粗品。
1.2.2 包涵体的洗涤与溶解 用IBs洗涤液重悬包涵体,漩涡混匀后室温静置15 min后,10 000 r/min,4℃离心10 min。分别于洗涤前后各取40 μL样品,加入10 μL 5×SDS上样缓冲液,混匀后沸水煮5 min,冷却后10 000 r/min 离心10 min,吸上清,进行15% SDS-PAGE检定,利用Gel DOCTM凝胶成像系统分析包涵体洗涤前后重组蛋白的比例。
将洗涤后的包涵体重悬于IBs溶解液,漩涡混匀,室温放置至包涵体全部溶解。分别于溶解前后各取50 μL样品,加入9倍体积的无水乙醇-20℃放置2 h,4℃,10 000 r/min离心15 min 收集沉淀,进行15% SDS-PAGE检定,利用Gel DOCTM凝胶成像系统分析包涵体溶解前后重组蛋白的比例。
1.2.3 Trx-IFN-CSP的复性研究
1.2.3.1 pH对复性的影响 冰浴条件下,将包涵体变性液脉冲加样逐滴加入不同pH值(pH 6.5、pH 7.0、pH 7.5、pH 8.0、pH 8.5 和pH 9.0)的IBs稀释液中,低温放置2 h后,将稀释后的变性液装进透析袋中开始梯度透析,从透析外液A依次到透析外液D,每次透析至少8 h。测定上清液中的蛋白浓度及经肠激酶切去Trx标签后,肝靶向干扰素的抗病毒活性以评价pH对复性的影响。
1.2.3.2 温度对复性的影响 其他实验条件不变,分别在0℃、4℃、11℃、25℃和37℃开始梯度透析。
1.2.3.3 蛋白浓度对复性的影响 其他实验条件不变,调整IBs稀释液的量使变性蛋白终浓度分别为100、200、300、400 和500 μg/mL,开始梯度透析。
1.2.3.4 氧化还原体系对复性的影响 其他实验条件不变,将包涵体变性液脉冲加样逐滴加入分别含有 Cysteine/Cystine、DTT/GSSG、β-ME/GSSG、GSH/ GSSG的氧化还原体系的IBs稀释液中开始梯度透析。
1.2.3.5 小分子添加剂对复性的影响 其他实验条件不变,将包涵体变性液脉冲加样逐滴加入分别含有 Glycero、Tween-20、Glycine、Arginine、β-CD、CTAB、Sucrose辅助复性小分子的IBs 稀释液中开始梯度透析。
2 结果
2.1 包涵体释放
将收集的细胞重悬于30%高渗蔗糖缓冲液中,在-20℃结冻,渗透压和低温使细胞内的水分变成了冰晶,造成细胞明显脱水,另外冰晶能对细胞膜造成物理损伤,在37℃水浴解冻时,细胞吸水溶胀将导致细胞壁部分破碎,经过反复冻融处理可进一步提高细菌破碎率。由于超声破碎过程中有大量热量释放,所以使用冰浴及间歇破碎的方式,对于达到较好的破碎效果以及避免Trx-IFN-CSP包涵体的热变性有重要作用。细胞破碎后,8 000 r/min 离心30 min,弃去上清,即获得包涵体粗品。1 L发酵液可得到1.17 g Trx-IFN-CSP包涵体。
2.2 包涵体的洗涤及溶解
超声破菌后高速离心获得的包涵体沉淀除了融合蛋白外,还含有膜蛋白及脂质体等其他成分,而这些成分会影响包涵体蛋白的变复性。所以溶解变性前应先洗涤包涵体,以去除杂质。对包涵体的洗涤时发现,洗涤液的成分不同对包涵体的洗涤效果有较大的影响。首先实验发现盐酸胍洗涤包涵体会造成融合蛋白的大量损失,而低浓度的尿素的洗涤效果更好。再者实验结果证明1% TrionX-100和2% DOC对宿主菌蛋白有很好的增溶作用,但是TrionX-100 洗涤时间不宜过长,否则也会导致目的蛋白的降解。利用2 mol/L尿素、1% TrionX-100和2%DOC联合洗涤的方法,有很好的纯化效果,15%SDS-PAGE 显示(图1-A,条带3)其纯度为62.3% 左右,而且包涵体的可溶性大大提高。
在洗涤过后,包涵体的纯度及可溶性都有所提高,在此基础上分别选用过8 mol/L尿素和6 mol/L盐酸胍变性包涵体,实验结果表明Trx-IFN-CSP包涵体在8 mol/L尿素中溶解相当困难,超声助溶及37℃震荡助溶效果都不理想,而使用6 mol/L盐酸胍变性,室温放置30 min则可有效地将包涵体溶解。为了彻底的将包涵体中的二硫键打开,提高包涵体溶解度,降低重组蛋白的损失率,在IBs溶解液中加入5 mmol/L EDTA 和2.5 mmol/L DTT,15% SDSPAGE 显示(图1-B,条带3)其纯度为64.7%。
2.3 Trx-IFN-CSP的复性研究
2.3.1 pH对复性的影响 不同pH对复性的影响结果示于图2-A。可知在pH7.0-8.0 时复性的融合蛋白活性高于其他pH复性的样品,干扰素对于发挥其生物活性作用时的pH有严格的范围,若超出范围其活性受限。所以当pH偏酸或偏碱时,包涵体虽然可以发生折叠,但折叠后的融合蛋白处于不利于保持其活性的环境中,活性易丧失。当复性液pH为7.0和7.5时,其蛋白收率明显低于pH8.0。当蛋白质处于等电点时蛋白质的净电荷为零,由于相邻蛋白质分子之间没有静电斥力而趋于结聚形成沉淀,所以复性pH应避开蛋白质等电点。由此可见,Trx-IFN-CSP复性宜在pH8.0左右进行。
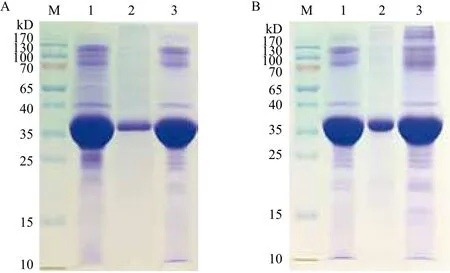
图1 融合蛋白洗涤、变性溶解结果
2.3.2 温度对复性的影响 温度对复性的影响结果如图2-B。由图可知,在4℃复性的融合蛋白的活性和收率都高于在25℃和37℃复性的样品。包涵体变性蛋白在折叠过程中,分子内的疏水氨基酸残基暴露在外,使多肽链的疏水基团之间相互发生碰撞,形成错误折叠导致蛋白聚沉。而随着复性温度的升高,疏水作用力增强,使聚集体更容于形成,造成活性及收率的降低。由此可见,Trx-IFN-CSP复性宜在低温条件(4℃)下进行。
2.3.3 蛋白浓度对复性的影响 不同蛋白浓度对复性的影响结果示于图2-C。传统的稀释复性时,复性液的蛋白浓度需在10-100 μg/mL 才会有较理想的复性效率,但这无疑会加大对活性蛋白回收的难度,不利于大规模操作。所以本研究选用脉冲加样的方式稀释变性液。当复性体系中蛋白浓度为200 μg/mL、300 μg/mL 时,复性后融合蛋白的活性与100 μg/mL 时复性的相当。而复性体系中各蛋白浓度对蛋白收率的影响不大。脉冲稀释时,保证了有足够的时间间隔使蛋白折叠通过易聚集的早期中间体阶段,Trx-IFN-CSP包涵体变性蛋白的终浓度越低,越有利于变性蛋白的重折叠。在复性时,蛋白中间态含有大量的疏水基团,溶液中蛋白浓度越高,分子间作用力越大,蛋白质分子间聚合趋向性就越大,蛋白质相互结合形成寡聚体或多聚体,这些聚合体再进一步聚合则形成沉淀,导致复性失败。蛋白浓度一般在200-300 μg/mL为宜。
2.3.4 氧化还原体系对复性的影响 不同氧化还原体系对复性的影响结果示于图2-D。4对氧化还原体系实验组中,GSH/GSSG复性组的融合蛋白复性后比活性高于其他实验组,而各组氧化还原体系对Trx-IFN-CSP复性的蛋白收率影响不大。Trx-IFN-CSP含有两对半胱氨酸,在重折叠过程中通过添加氧化还原体系来提供合适的氧化还原电位,GSSG负责促进二硫键的形成,而GSH则催化错误配对的二硫键进行重排,可促进其二硫键的正确配对。DTT/GSSG和β-ME/GSSG复性组的比活性低的原因可能是由于GSSG与DTT和β-ME的比例超出了合适范围,以致于复性液还原性太强,二硫键将难以形成。
2.3.5 小分子添加剂对复性的影响 不同辅佐复性小分子对复性的影响结果示于图3。添加了辅助复性小分子的各复性组的比活性和蛋白收率与对照组相比都有大大的提高。这些辅助添加剂一般情况下都是通过增强分子间相互作用来稳定蛋白质的天然结构,或是通过减弱分子内的疏水作用来抑制聚集体形成,从而辅助蛋白折叠。其中L-Arg的辅助效率最高,表明L-Arg可选择性与错误折叠结构结合,使错误折叠的分子不稳定从而促进分子形成正确构象,其辅助复性有一定的通用性,因为其结合错误折叠分子时不具有蛋白质种类特异性。
2.4 Trx-IFN-CSP复性工艺的稳定性
综合上述实验的结果,得出一套适合Trx-IFNCSP复性的方法:将包涵体变性液脉冲加样缓慢逐滴加预冷的IBs稀释液中,将变性液蛋白浓度调至300 μg/mL 左右,低温放置2 h后,开始梯度透析复性,温度4℃,从透析外液A依次到透析外液D,每次透析至少8 h。对复性前后的蛋白进行15% SDS-PAGE 检定,上样量10 μg,利用Gel DOCTM凝胶成像系统分析结果(图4)显示融合蛋白复性后纯度达95.0%。
连续3次进行Trx-IFN-CSP的制备,确认该工艺的合理性与稳定性,同时大量获得Trx-IFN-CSP。结果如表1所示,经肠激酶切去Trx标签后,每升发酵液最终获得的肝靶向干扰素约110-130 mg之间,每批蛋白纯度在95%以上,比活性在1.9-2.4×108U/mg之间,制备条件稳定。
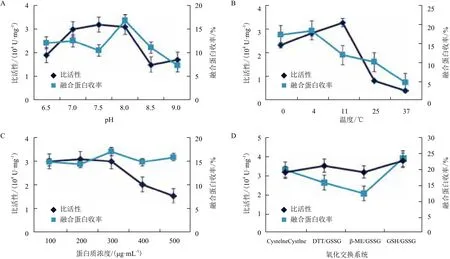
图2 Trx-IFN-CSP的复性条件研究
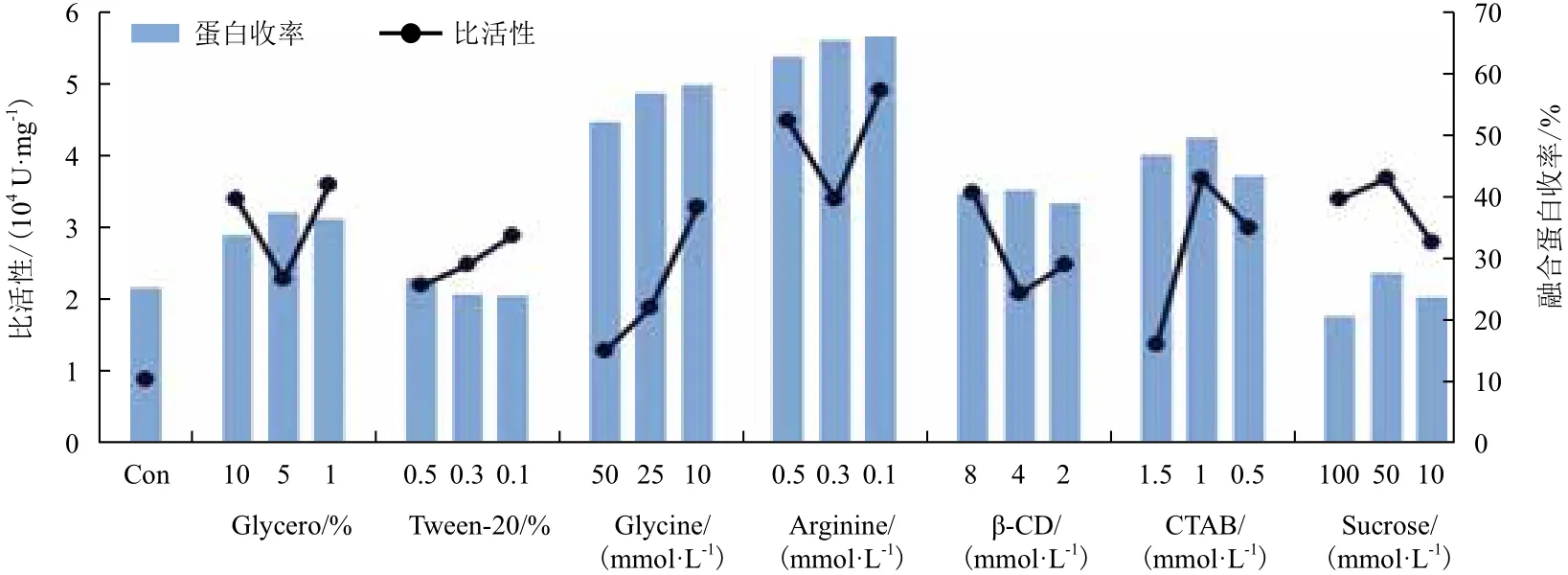
图3 添加剂对Trx-IFN-CSP包涵体复性的影响
3 讨论
Trx-IFN-CSP是本实验室通过基因工程方法构建的重组融合蛋白,是将IFN-α2b与疟原虫环子孢子蛋白多肽CSP I-plus进行融合,连接到pET32a载体上表达而获得的。Trx-IFN-CSP经肠激酶切去Trx标签后即获得肝靶向干扰素(IFN-CSP),旨在利用CSP I-plus高效特异的肝细胞靶向性可将IFN-α2b导向肝脏,使其在肝脏富集,有从而提高干扰素治疗乙型肝炎病毒慢性感染的特异性,减少全身用量,降低毒副反应,提高量效比。初步研究证实,肝靶向干扰素具备了CSP I-plus高效而特异的肝细胞靶向性与IFN的抗HBV作用,有重大的开发应用潜力。本研究正是为了获得一套稳定的肝靶向干扰素制备工艺,为开展后续新药研究工作奠定物质基础。
Anfinsen[2]经典的RNaseA折叠研究中发现蛋白质的结构、稳定性和功能的全部信息都来源于其氨基酸组成和排列;多肽链的折叠是一个自发的过程,主要决定于它的氨基酸序列。这一规律也被称为生物体内的第二套遗传密码。不同的蛋白质需要的复性条件不同,相同的因素对不同蛋白质的复性的影响也不同。本研究结合稀释复性及透析复性方法复性,一方面无需过大地增加溶液体积,便于后续回收;另一方面提高复性率。
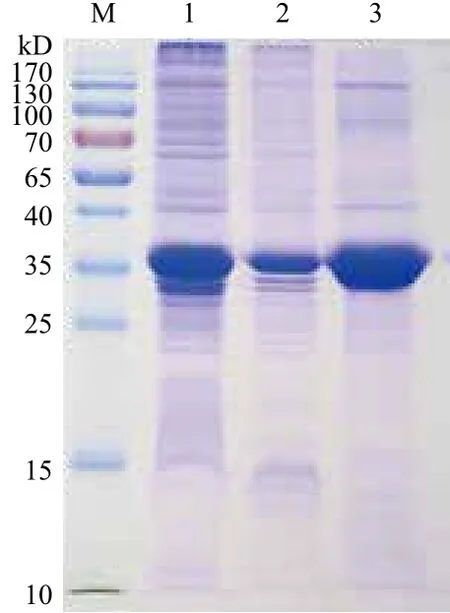
图4 Trx-IFN-CSP包涵体复性
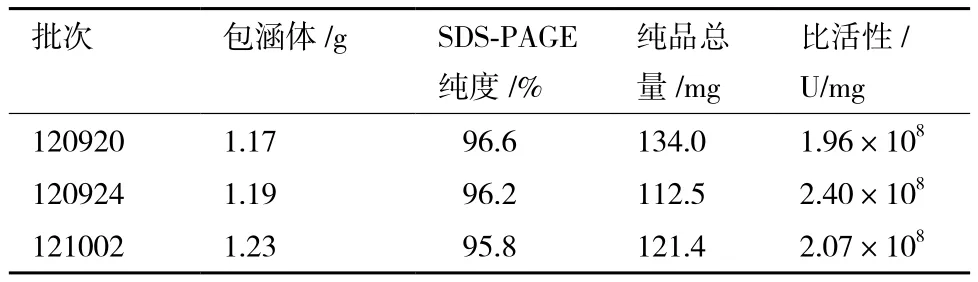
表1 肝靶向干扰素连续三批制备结果
稀释和透析都是传统的复性法,其方法简单,易于实验室操作[3]。但在单纯的稀释复性时,为了减少聚集提高复性收率,通常需要在很低的蛋白浓度(10-100 μg/mL)下进行[4]。这对于于大规模工业生产来说,效率太低,后续工作过多而显得不大实际。Katoh等[5]将流加操作引入复性过程,即脉冲稀释,以流加的方式向复性缓冲液中注入变性蛋白质。这种复性方法已在变性溶菌酶复性中得到了验证。所以本研究采用了复性,以求在提高蛋白质复性收率的同时设法增大蛋白质浓度,使复性过程中维持较低的变性蛋白浓度而复性终蛋白浓度较高,其关键在于掌握变性蛋白加入的时间间隔,在后一部分加入之前,前一部分有一段时间可以折叠,相当于降低了稀释时复性体系中变性蛋白的浓度,从而降低了变性蛋白发生分子间作用而聚集沉淀的几率。脉冲稀释复性在每次蛋白加入之间,保证有足够的时间间隔使蛋白折叠通过易聚集的早期中间体阶段,提高单位体积复性液的复性蛋白量,是实现高复性浓度下的稀释复性的一条途径。
在优化复性方式的基础上,本实验对影响复性的因素如pH、温度、变性蛋白质的浓度以及氧化还原体系进行考察,以经肠激酶去除Trx标签后肝靶向干扰素的比活性与融合蛋白收率为双指标,摸索出较优的复性条件。(1)体外折叠复性的缓冲液pH值常控制在7.0-9.0之间,这是因为碱性环境能够防止变性蛋白质中还原的自由巯基因为硫醇质子化作用而影响二硫键的正确形成[6]。在不同pH值下,蛋白质所带电荷量不同,在溶液pH值等于其pI时,蛋白质所带净电荷数最少,而蛋白质带电荷的情况直接影响其在溶液中的稳定性,进而影响其在复性中的行为[7]。所以复性液pH在偏碱性的同时还需尽量远离蛋白的pI值,以减少蛋白质的聚集。(2)折叠复性的温度范围为0-40℃[8],在这个温度范围内,折叠复性的速度和复性率随温度的增高而增高,但聚集的速度也随之增高。低温时复性虽慢但成功率高。(3)复性过程中蛋白的折叠为一级反应,而蛋白质的聚集是二级以上的反应[9],其速度受浓度影响大,低蛋白浓度有利于获得较高的复性收率。在复性时,当蛋白质浓度过大会产生不稳定的中间物,使疏水基暴露在中间物表面,在疏水基团相互作用下,产生聚集沉淀物。如此不但产物收率降低,还增加了不溶性无活性蛋白质聚积物。(4)氧化还原体系,是由小分子氧化型和还原型的巯基化合物混合组成。蛋白质折叠的机制显示,具有二硫键蛋白质的复性成功与否与二硫键的形成与重排紧密相关。由于体外折叠没有二硫键异构酶的存在,蛋白质折叠时巯基氧化容易产生错误配对的二硫键。所以需要氧化还原体系帮助蛋白质通过分子内重排成天然配对,二硫键的重排过程可能是这类蛋白质折叠的限速步骤。
在复性过程中产生聚集体的主要原因是蛋白质肽链间的疏水相互作用[1],因此抑制肽链间的疏水相互作用是提高复性收率的关键。为此,本研究比较了多种折叠促进剂和聚集抑制剂(Glycero、Tween-20、Glycine、Arginine、β-CD、CTAB、Sucrose)辅助Trx-IFN-CSP复性的效果。助折叠剂稳定蛋白质的原理在于它们能被蛋白质优先排斥,结果使蛋白质优先水化,从而增加蛋白质的稳定性[10]。聚集抑制剂是通过减弱分子内的疏水作用,从而稳定天然构象来抑制聚集发生[11]。蛋白质稳定性的提高表明从变性态到复性态的过程是热力学有利的过程,也就是说渗透质的加入可以促进蛋白质的折叠。实验结果显示,L-精氨酸对Trx-IFN-CSP复性的辅助效率最高。早在Fischer[12]和Buchner[13]的复性研究中,已经发现L-精氨酸可以大大提高变性蛋白的复性成功率,分别是80%和100%。虽然,对L-精氨酸辅助蛋白复性的机制尚不完全清楚,但相关研究发现与低浓度的盐酸胍及脲相比,L-精氨酸对蛋白质的稳定性影响微弱,因此推测可能是其增加了折叠中间体的溶解度才促进了复性。
4 结论
通过反复冻融联合超声破菌能高效获得包涵体蛋白,尿素洗涤后再用盐酸胍变性、脉冲加样稀释后梯度透析复性,建立了较为稳定的制备工艺。经肠激酶切去Trx标签后,每升发酵液可制备纯度95%以上、比活性在(1.9-2.4)×108U/mg之间的肝靶向干扰素110-130 mg。
[1]Mayer M, Buchner J. Refolding of inclusion body proteins[J]. Methods Mol Med, 2004, 94(1):239-254.
[2]Anfinsen CB. Principles that govern the folding of protein chains[J]. Science, 1973, 181(4096):223-230.
[3]Jungbauer A, Kaar W. Current status of technical protein refolding[J]. Journal of Biotechnology, 2007, 128(3):587-596.
[4] De Bemardez, Clark E. Protein refolding for industrial processes[J]. Current Opinion in Biotechnology, 2001, 12(2):202-207.
[5]Katoh S, Sezai Y, Yamaguchi T, et al. Refolding of enzymes in a fedbatch operation[J]. Process Biochem, 1999, 35:297-300.
[6]李明. 离子交换色谱复性蛋白质[D]. 北京:中国科学院2003.
[7]Maeda Y, Ueda T, Yamada H, et al. The role of net chagre on the renautration of reduced lysozyme by the sulfhydryl-disulfide interchange reaction[J]. Protein Engineering, 1994, 7(10):1249-1254.
[8]Guise AD, West S lI, Chaudhuri AB. Protein folding in Vivo and renaturation of recombinant proteins from inclusion bodies[J]. Mol Biotechnol, 1996, 6(1):53-64.
[9]Kiefhaber T. Protein aggregation in vitro and in vivo. aquantitive model of the kinetic competition between folding and aggregation[J]. Biotechnology, 1991, 9(9):825-829.
[10] Wetlaufer DB, Xie Y. Control of aggregation in protein refolding:a variety of surfactants promote renaturation of carbonic anhydrase II[J]. Protein Sci, 1995, 4(8):1535-1543.
[11]Hamada H, Shiraki K. L-argininamide improves the refolding more effectively than L-arginine[J]. J Biotechnol, 2007, 130(2):153-160.
[12]Fischer S, Rudolph R, Mattes R. Process for the activation of genetechnologically produced heterologous eukayrotic proteins after expression in prokayrotes[J]. Europen Patent, 1986, 393:725AI
[13]Buchner J, Pastan I, Brinkmann U. A method for increasing the yield of properly folded recombinant fusion proteins:single-chain immunotoxins from renuatration of bacterial inclusion bodies[J]. Anal Biochem, 1992, 205(2):263-270.
(责任编辑 李楠)
Renaturation Technology of Recombinant Fusion Protein Trx-IFN-CSP
HUANG Yan-ting1,2,3LU Xue-mei2,3YANG Xiao-rong1JIN Xiao-bao2,3ZHU Jia-yong2,3
(1. The First Affiliated Hospital of Guangdong Pharmaceutical University,Guangzhou 510006;2. Institution of Pharmaceutical Bioactive
Substances,School of Basic Courses,Guangdong Pharmaceutical University,Guangzhou 510006;3.Guangdong Key Laboratory of Pharmaceutical Bioactive Substances,Guangzhou 510006)
This work is to establish and optimize the method of refolding fusion protein Trx-IFN-CSP. The refolding of recombinant protein in vitro was studied,i.e.,investigating the effects of pH,temperature,protein concentration,redox systems and auxiliary refolding molecules on the refolding process of fusion protein. The results were as below. The proper measure to refold the Trx-IFN-CSP was to obtain the inclusion bodies by repeated combined freeze-thaw with ultrasonic to crack bacteria. The inclusion bodies were preliminarily purified using scrub solution of 1% TritonX-100,2 mol/L urea,and 2% DOC,and then denatured in 6 mol/L guanidine hydrochloride. After the pulse dilution,the renaturation was conducted under 4℃ by gradient dialysis with the assistance of L-Arg. After the Trx-tag was removed by recombinant enterokinase digestion,approximately 110-130 mg of the pure recombinant liver-targeted interferon was obtained from 1 L Escherichia coli culture. Each batch of protein had a purity of over 95% and antibacterial activities were about 1.9-2.4×108U/mg,thus the technology of preparation was stable.
fusion protein;liver-targeted interferon;inclusion body;pulse dilution;gradient dialysis
10.13560/j.cnki.biotech.bull.1985.2016.06.032
2015-08-02
国家科技部新药创制重大专项项目(2013ZX09103003-003)
黄演婷,女,硕士,研究方向:药用生物活性物质结构、功能与应用;E-mail:olive1987@aliyun.com
朱家勇,男,教授,博士生导师,研究方向:药用生物活性物质结构、功能与应用;E-mail:zhujy@gdpu.edu.cn
