EMS诱变和NaCl胁迫的正交实验及耐盐纤维亚麻种质的筛选
2016-06-10王卫国邓倩计巧灵王伟
王卫国 邓倩 计巧灵 王伟
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
EMS诱变和NaCl胁迫的正交实验及耐盐纤维亚麻种质的筛选
王卫国 邓倩 计巧灵 王伟
(新疆大学生命科学与技术学院,乌鲁木齐 830046)
旨为经愈伤组织诱导再生的耐盐性纤维亚麻植株奠定基础。以3种纤维亚麻无菌苗的下胚轴段为材,经EMS诱变和盐胁迫的正交实验,再经诱芽和愈伤组织培养,研究其理化特性。结果显示,‘范妮’、‘天鑫3号’和‘双亚5号’下胚轴段不定芽培养的最适处理组合均为0.025% EMS处理2 h(或4 h),之后用100或150 mmol/L NaCl处理12 h;总产芽率由高到低分别为‘范妮’、‘天鑫3号’和‘双亚5号’下胚轴段;对3种亚麻不定芽生长影响的顺序为:NaCl浓度>EMS浓度>EMS处理时间;3种亚麻下胚轴段不定芽诱导的适宜培养基为MS + 0.000 2 mg/L TDZ + 0.02 mg/L KT + 0.005 mg/L NAA + 0.3%蔗糖+ 0.1 g/L肌醇+ 3.3 g/L植物凝胶。经0.025% EMS处理4 h + 150 mmol/L NaCl处理12 h后生长的愈伤组织,经过2次交替筛选后,其理化指标表明,与对照组的相比,3种亚麻处理组愈伤组织脯氨酸、可溶性糖、可溶性蛋白含量、SOD和POD活性均显著提高(P<0.05)。经过0.025% EMS处理4 h+150 mmol/L NaCl处理12 h后生长的愈伤组织具有一定的耐盐性。
纤维亚麻;EMS诱变;盐胁迫;正交实验;理化特性
进入21世纪以来,全球对麻织品的需求量每年以15%-20%的速度递增[1]。而麻类是我国的传统特色作物,近年纤维亚麻在我国的种植面积和加工能力已位居世界第二[2-4],但多年来,亚麻原料缺口巨大,每年50%以上的原料需要进口[1]。为了解决麻纤维总量不足、优质率低等难题,国内科学工作者们将传统育种与现代育种手段结合,筛选配合力高且性状优良的亲本,辅之以分子标记辅助育种、外源基因导入等技术,培育出多种亚麻新品种,使原茎产量、出麻率、长麻率、株高等性状有了较大改善[4,5],但我国是粮食大国,种麻不能与种粮争地。那么,能否利用大片的中、低度盐渍土地种植亚麻就成为科学工作者们苦苦思索的问题。新疆是继黑龙江之后的国内第二大纤维亚麻产区[6],也是中国盐渍土分布最广、面积最大的省区,目前新疆的纤维亚麻主要靠引种在北疆的伊犁、塔城、昌吉等地的粮田种植。因此,迫切需要通过多种技术尽快培育耐盐、耐旱且质优的纤维亚麻新品系,以适应在新疆广袤的中、低度盐渍化土壤和干旱气候下生长,在不与种粮争地的情况下快速发展纤维亚麻业。
关于纤维亚麻耐盐育种方面国外研究较早[7,8],1984年McHughen通过组培技术就获得McGregor栽培变种的耐盐细胞系,1987年获得再生植株,并在其后代中通过多项指标筛选到耐盐植株。国内近年这方面研究只有些初步报道[9-15],赵东升[9,10]对200个亚麻品种种子进行盐碱胁迫,从中选出了11份耐性较好的品系,并以耐盐碱与不耐盐碱品系为材,用分子生物学技术寻找两者的特异性,为后续亚麻耐盐碱分子辅助育种奠定基础。郭媛等[11]通过对纤用和油用的10个亚麻品种种子进行盐碱胁迫的发芽实验,认为油用品种的耐性均强于纤用品种的。王红梅等[12]研究了盐胁迫下3个亚麻品种幼苗的理化指标,认为Ariane品种的抗盐性较高。本实验室的研究生葛春辉、李文婷、王伟等对新疆主栽的多个亚麻品种的耐盐性做了大量前期研究工作[13-15]。因此,本研究在前人研究的基础上预运用组织培养加诱变加盐胁迫的技术获得多个变异的亚麻耐盐种质,旨为经愈伤组织诱导再生的耐盐性纤维亚麻植株研究奠定基础。
1 材料与方法
1.1 材料
研究以新疆主栽的3个纤维亚麻品种为材料,‘范妮’种子由中科院麻类研究所于2011年馈赠;‘天鑫3号’种子由新疆农科院经济作物研究所于2011年馈赠;‘双亚5号’种子由新疆农科院经济作物研究所于2008年馈赠。种子用10%过氧化氢灭菌10 min,之后不经无菌水洗,直接接入种子萌发培养基(MS基本固体培养基,无生长调节剂)。培养条件:室温为(23±2)℃,光照周期16 h/d,光照强度为1 500-2 500 lx。培养8 d后,在净化台上将下胚轴切成0.5-0.9 cm长的小段,用于EMS(甲基磺酸乙酯)诱变和盐胁迫的正交实验。
1.2 方法
1.2.1 正交实验 根据前期探索的3种纤维亚麻下胚轴段经不同浓度EMS处理不同时间后的成活率、出愈率和出芽率,设定了EMS浓度、处理时间和NaCl浓度的4个水平(表1),各处理盐胁迫均为12 h。之后接种在不同的诱导培养基上(根据前期实验筛选出的较合适的诱芽培养基),在上述培养条件下生长,培养25 d后记录实验结果,以3个品种的胚轴段出芽率为指标,确定最适合的EMS浓度、时间和盐处理的组合。
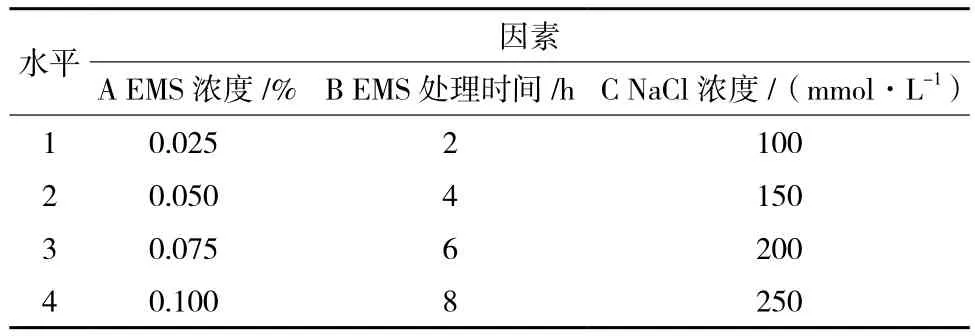
表1 L16(45)正交实验的因素与水平
1.2.2 愈伤组织的耐盐性检测和耐盐种质的筛选 选择适宜培养基进行愈伤组织的继代和不定芽的扩增,将正交实验中最适组合处理以及最佳培养基上所得的愈伤组织经过30 d培养后,分别转入与正交实验盐浓度相同的含盐固体培养基上培养25 d,之后再转入不含盐的相同固体培养基上扩增(以正常同期培养的愈伤组织为对照),再继代3次(每次30 d)后,以扩增的愈伤组织为材料进行以下几项生理生化指标检测。根据侯福林[16]的方法测定脯氨酸的含量。根据张志良[17]的方法测定可溶性糖的含量。根据邹琦[18]的方法测定可溶性蛋白的含量、SOD(超氧化物歧化酶)酶活、POD(过氧化物酶)酶活。以上实验均以未处理的3种亚麻下胚轴段生长分化的愈伤组织作为对照。
1.2.3 数据分析 SPSS 17.0软件对数据进行统计学分析,比较差异显著性。
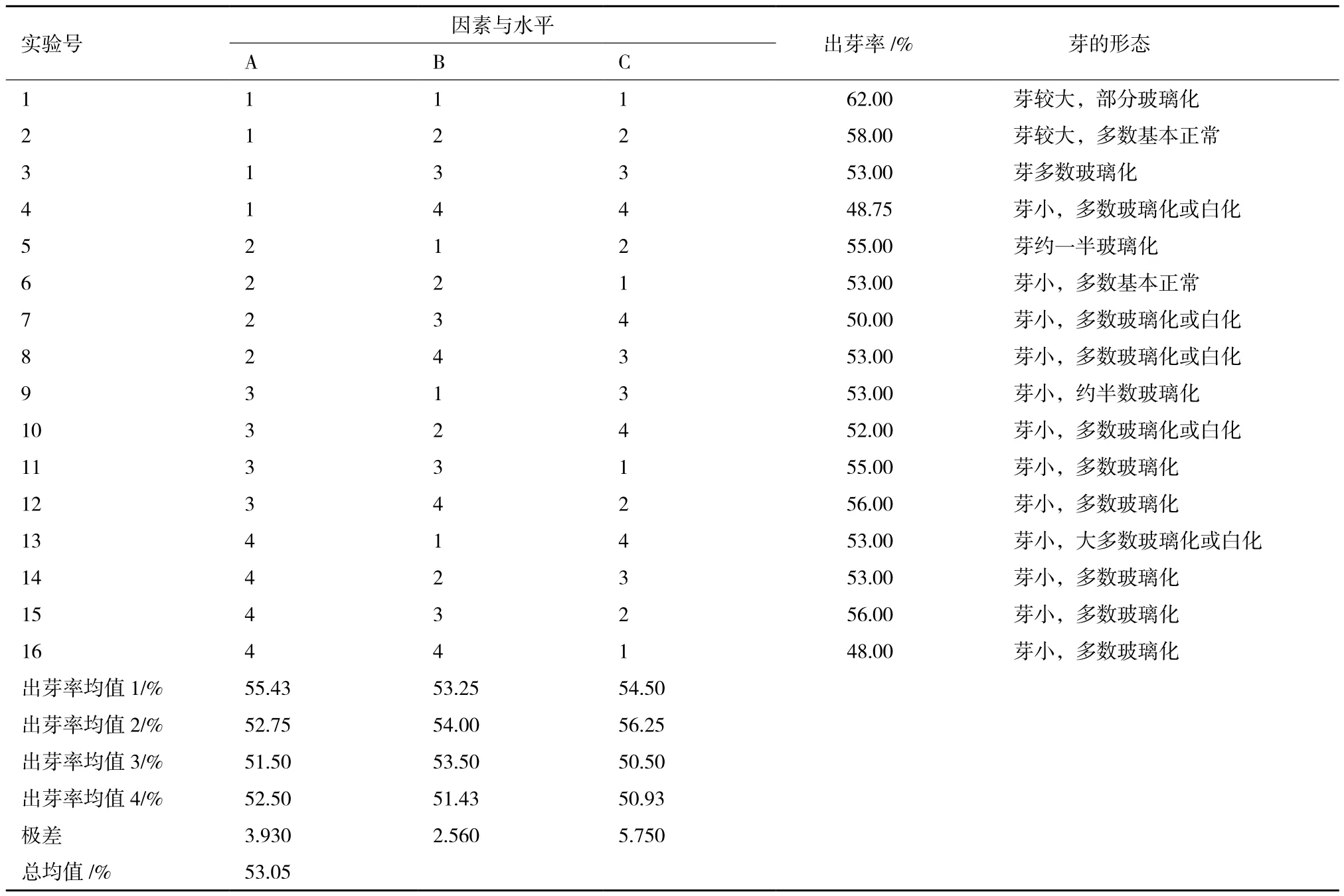
表2 纤维亚麻‘范妮’下胚轴段正交实验结果
2 结果
2.1 三种不同亚麻下胚轴段正交实验结果
纤维亚麻‘范妮’下胚轴段正交实验结果(表2)显示,在3个因素中影响‘范妮’下胚轴段不定芽出芽率由大到小的顺序为NaCl浓度> EMS浓度> EMS处理时间。结果表明,‘范妮’下胚轴段不定芽培养的最佳因素水平为A1B2C2,即0.025% EMS处理胚轴段4 h,之后用150 mmol/L NaCl处理胚轴段12 h,在此组合处理后,‘范妮’下胚轴段产芽量较多,且芽形态较好。
纤维亚麻‘天鑫3号’下胚轴段正交实验结果(表3)显示,在3个因素中,影响‘天鑫3号’下胚轴段不定芽出芽率由大到小的顺序也是NaCl浓度> EMS浓度> EMS处理时间,这与‘范妮’下胚轴段的相同。正交实验结果表明,‘天鑫3号’下胚轴段不定芽培养的最佳处理组合为A1B1C1或A1B2C2,即0.025% EMS处理2 h(或4 h),之后用100或150 mmol/L NaCl处理12 h,这与‘范妮’最佳组合相似,但出芽率的总平均数低于‘范妮’。
纤维亚麻‘双亚5号’下胚轴段正交实验结果(表4)显示,在3个因素中,影响纤维亚麻‘双亚5号’下胚轴段不定芽出芽率由大到小的顺序,也为NaCl浓度> EMS浓度> EMS处理时间,这与探究3种因素对‘范妮’和‘天鑫3号’的影响结果相同。正交实验结果表明,‘双亚5号’下胚轴段不定芽培养的最佳处理组合为A1B1C1或是A1B2C2,即0.025% EMS处理2 h(或4 h),之后用100 mmol/L(或150 mmol/L)NaCl处理12 h。经过处理后的‘双亚5号’平均出芽率为44.5%,低于‘范妮’和‘天鑫3号’的。
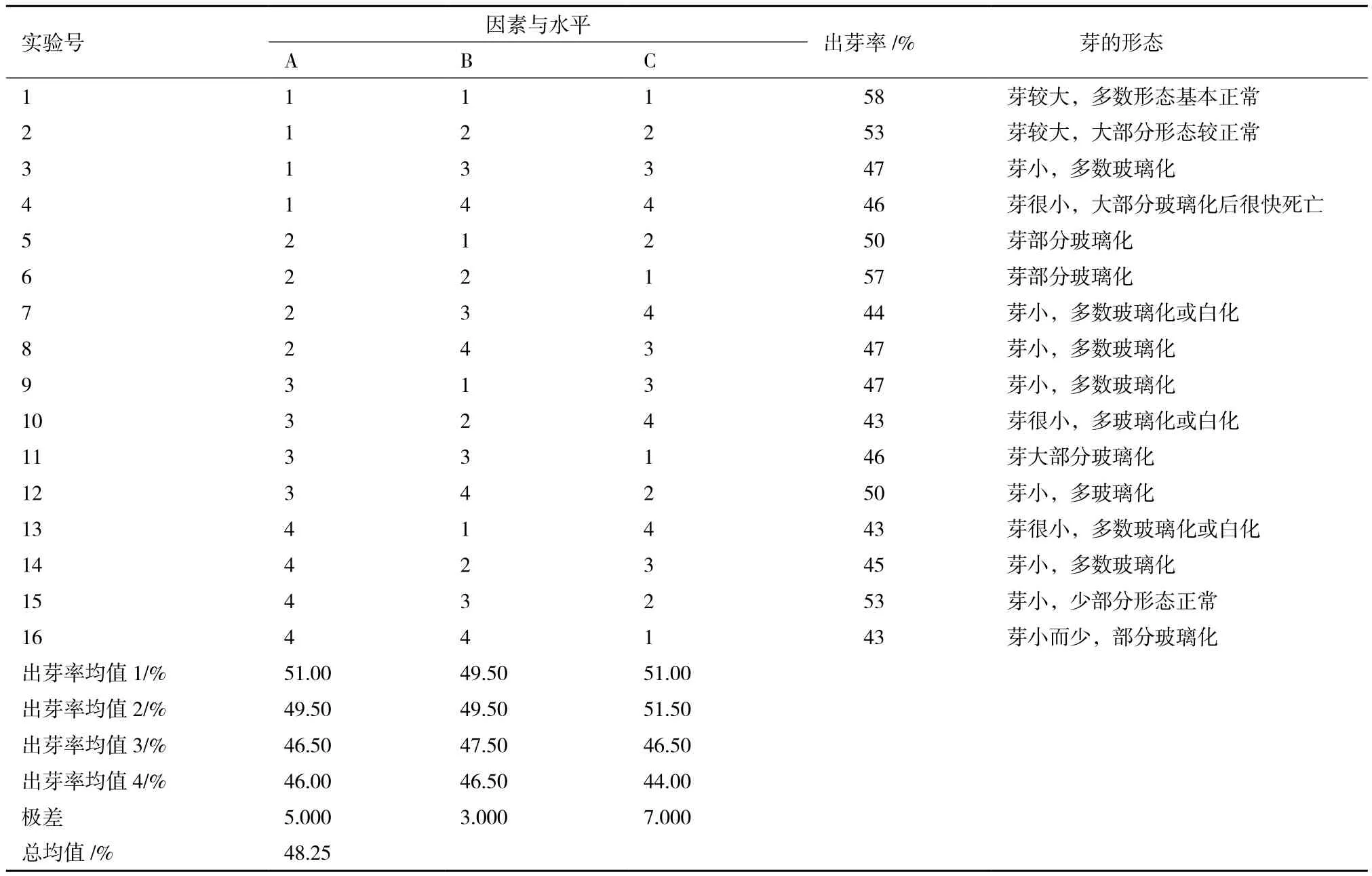
表3 纤维亚麻‘天鑫3号’下胚轴段正交实验结果
由以上所得结果可知,经处理后3种纤维亚麻下胚轴段出芽率均在组合0.025% EMS+2 h或4 h +100或150 mmol/L NaCl中为最佳。
2.2 三种亚麻下胚轴段在不同诱芽培养基上出芽和出愈情况
在同时考虑到处理的作用和可比性后,选择经0.025% EMS处理4 h,之后经150 mmol/L NaCl处理12 h的下胚轴段长出的不定芽和愈伤组织进行扩增。统计相同处理后的3种亚麻下胚轴段在不同诱芽培养基上的出芽和芽生长情况,结果如表5所示。
由表5可见,‘范妮’下胚轴段在2号培养基上长出的不定芽最多,但芽很小时就玻璃化,不能生长;在3号培养基上长出的芽白化现象严重,基本不能生长;在5号培养基上虽然产生的不定芽较少,但多数形态较正常,能生长,只是生长较慢,说明低浓度的TDZ结合低浓度KT和NAA对正常不定芽的分化有效,这与Bretagne[19]在研究纤维亚麻品种‘Ariane’和‘Viking’下胚轴离体萌芽以及Jain等[20]研究亚麻品种‘Neelam’下胚轴产生不定芽时使用的最佳TDZ浓度相差甚远,仅为其用量的1/10。‘天鑫3号’和‘双亚5号’下胚轴段的诱芽情况与‘范妮’下胚轴段的相似,只是出芽率略低一些。
从产生愈伤组织情况来看,在2、3和5号培养基上,3个亚麻品种的下胚轴段产生的愈伤组织量较多,质地稍软,特别是在3号培养基上,3个亚麻品种的下胚轴段产生的愈伤组织质地较好,生长较快。
2.3 三种亚麻愈伤组织的耐盐性
由于经过上述盐胁迫和扩增后产生的不定芽数量太少,而愈伤组织量较多,对相同处理(0.025%EMS 处理4 h,之后经150 mmol/L NaCl处理12 h)后的3种亚麻下胚轴段产生并扩增的愈伤组织进行了耐盐性鉴定。

表4 纤维亚麻‘双亚5号’下胚轴段正交实验结果

表5 不同诱芽培养基上3种纤维亚麻下胚轴段萌芽情况
2.3.1 三种亚麻愈伤组织中脯氨酸含量的变化 3种亚麻经相同的处理后生长的愈伤组织,经过含盐培养基与不含盐培养基交替培养,测定了所得的愈伤组织与对照组的愈伤组织内的脯氮酸含量,比较结果可以看出,3种亚麻各自本身脯氨酸含量有差异,但它们的处理组愈伤组织中脯氨酸含量均高于对照组(图1),‘范妮’脯氨酸含量处理组比对照组提高了2倍多,由对照组的1.18 mg/g提高到了处理组的2.78 mg/g;‘天鑫3号’的脯氨酸含量也由0.58 mg/g提高到0.99 mg/g,提高了1.7倍;‘双亚5号’的脯氨酸含量由0.78 mg/g提高到了2.01 mg/g,也提高了2倍;SPSS软件分析表明,3种亚麻处理组愈伤组织的脯氨酸含量均显著高于对照组(P<0.05),其中‘范妮’的差异最大。

图1 对照组与处理组愈伤组织中脯氨酸含量
2.3.2 三种亚麻愈伤组织中可溶性糖含量的变化 3种亚麻处理组可溶性糖含量均比对照组有所提高,其中‘天鑫3号’处理组的可溶性糖含量最高(图2)。‘范妮’由33.63 mg/g提高到88.52 mg/g;‘天鑫3号’可溶性糖含量由36.75 mg/g提高到98.31 mg/g;‘双亚5号’可溶性糖含量由30.39 mg/g提高到74.15 mg/g。经SPSS软件分析,3种亚麻处理组愈伤组织可溶性糖含量均显著高于对照组的(P<0.05)。
2.3.3 三种亚麻愈伤组织中可溶性蛋白含量的变化 3种亚麻处理组愈伤组织的可溶性蛋白含量均比对照组有所提高,其中‘天鑫3号’可溶性蛋白含量最高(图3)。范妮由对照组的57.09 mg/g提高到了处理组的94.25 mg/g;‘天鑫3号’可溶性糖含量由50.55 mg/g提高到100.4 mg/g;‘双亚5号’的可溶性糖含量由46.35 mg/g提高到了88.70 mg/g。经SPSS软件分析显示,3种亚麻处理组愈伤组织可溶性蛋白含量均显著高于对照组(P<0.05)。

图2 对照组与处理组愈伤组织中可溶性糖含量
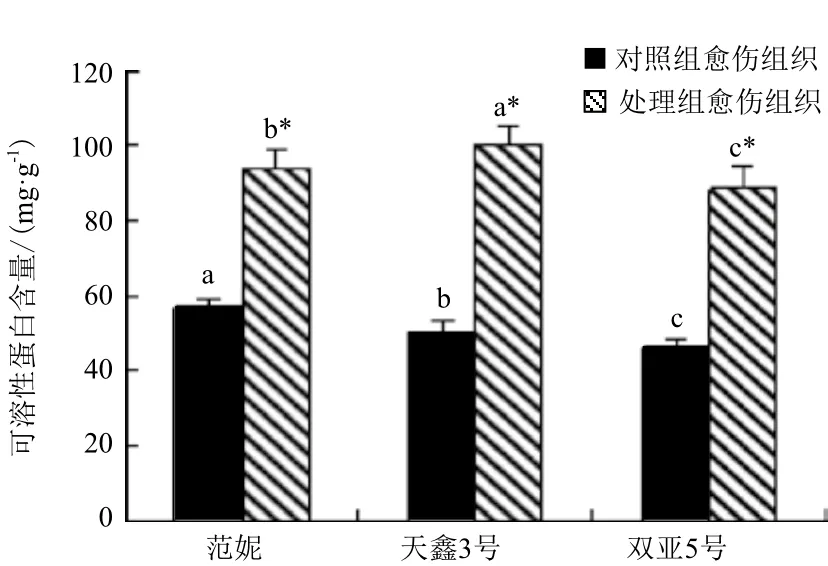
图3 对照组愈伤与处理组愈伤可溶性蛋白含量
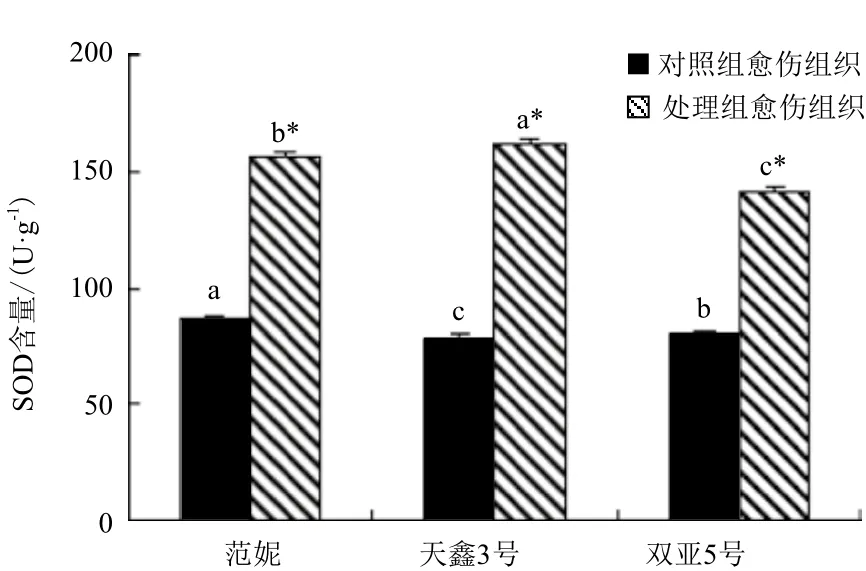
图4 对照组与处理组愈伤组织中SOD活性
2.3.4 三种亚麻愈伤组织中SOD活性的变化 3种亚麻的处理组愈伤组织的SOD活性均比对照组有所提高,其中‘天鑫3号’SOD活性最高(图4)。范妮由对照组的87.22 U/(g·min)提高到处理组的155.88 U/(g·min);‘天鑫3号’SOD活性由78.18 U/(g·min)提高到161.7 U/(g·min);‘双亚5号’的SOD活性由80.63 U/(g·min)提高到了141.51 U/(g·min)。经SPSS软件分析表明,3种亚麻愈伤组织处理组SOD活性均显著高于对照组的(P<0.05)。
2.3.5 三种亚麻愈伤组织中POD活性的变化 3种亚麻的处理组愈伤组织的POD活性均比对照组的有所提高,其中‘天鑫3号’ POD活性最高(图5)。‘天鑫3号’POD活性由44.87 U/(g·min)提高到92.44 U/(g·min);‘范妮’由对照组的46.25 U/(g·min)提高到了处理组的82.88 U/(g·min);‘双亚5号’的POD活性由49.27 U/(g·min)提高到了87.91 U/(g·min)。经SPSS软件分析表明,3种亚麻处理组愈伤组织POD活性与对照组的相比均存在显著性差异(P<0.05)。
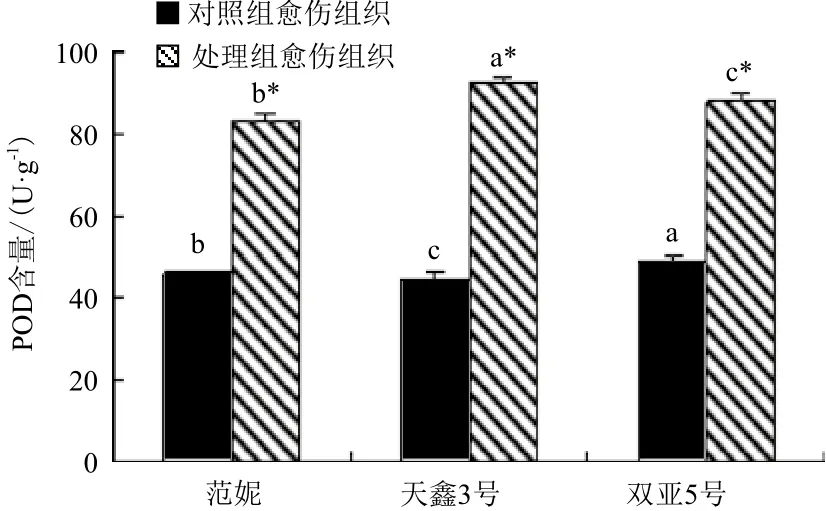
图5 对照组与处理组愈伤组织中POD活性
经上述生化、生理指标的检测,可以确定处理组中3种亚麻处理组愈伤组织与对照组愈伤组织相比较,脯氨酸含量、可溶性糖、可溶性蛋白、SOD活性、POD活性都有显著性提高。目前已证实,植物在逆境条件下会大量积累脯氨酸作为渗透调节物质,因此脯氨酸含量与植物的抗逆性之间呈明显的正相关的关系,SOD和POD都是植物中重要的保护酶,可防御氧自由基对细胞膜系统的伤害,因此纤维亚麻愈伤组织内SOD和POD活性升高,无疑会提高其耐盐性。本研究的结果表明,3种纤维亚麻经最佳处理组合处理后得到的愈伤组织在生理上有较强的抗盐性。
3 讨论
葛春辉等[13]通过组织培养加盐胁迫技术获得‘双亚5号’耐盐愈伤组织,但基本不再生芽。李文婷等[14]探讨了‘双亚5号’和‘范妮’幼苗对盐胁迫的生理反应,认为‘范尼’幼苗比‘双亚5号’幼苗更具耐盐潜力。之后中国农科院亚麻所提供了几个新品系,扩大了比较的范围,王伟等[15]探索了‘双亚5号’、‘范妮’、YOI254、YOI303、‘天鑫3号’和HIZ019纤维亚麻幼苗对盐胁迫的生理反应,认为YOI254、‘天鑫3号’和HIZ019幼苗的耐盐性较好。由于‘范妮’、‘天鑫3号’和‘双亚5号’仍是目前新疆主栽的纤维亚麻品种,且我们已对它们的组培条件、幼苗耐盐的生理生化反应有了一些了解,所以本研究仍以这3个品种为实验材料。在设计3因素(EMS浓度、EMS处理时间及NaCl浓度)4水平之前,我们已反复探索了3因素单个或组合的多个水平,发现与其它作物相比,亚麻对EMS浓度很敏感,但这种敏感不是在20-30 d中就可显现,往往是1-2个月后突然整瓶的死亡,无法控制,所以我们选用的EMS浓度较低,要保证至少有近1/3的材料是存活的,这样再经过盐胁迫,才有可能筛选到活的材料。这3种亚麻对NaCl浓度较敏感,浓度高时死亡率过高,因此,设计的盐浓度也较低。在本研究之前,我们已探明了这3种亚麻下胚轴段不经诱变和盐胁迫条件下的出芽和芽生长的最佳培养基配比和培养条件,还得到了少量试管苗,但经过诱变和盐胁迫的正交实验后,下胚轴段在这些培养基上的出芽率大大降低,且芽生长状况也不太理想,玻璃化、白化、畸形叶较多,多数芽生长缓慢,这些问题还需要深入细致地摸索。
4 结论
笔者通过正交实验探究了EMS浓度、EMS处理时间及NaCl浓度3因素4水平对3种亚麻下胚轴段不定芽和愈伤组织产生和生长的影响,确定了其中最佳的处理组合:0.025% EMS+4 h+150 mmol/L NaCl。对3种亚麻不定芽产生和生长影响的顺序为:NaCl浓度>EMS浓度>EMS处理时间;3种亚麻下胚轴段不定芽诱导的适宜培养基为:MS+ 0.000 2 mg/L TDZ+ 0.02 mg/L KT+ 0.005 mg/L NAA+0.3%蔗糖+0.1 g/L肌醇+3.3 g/L植物凝胶。经0.025% EMS+4 h+150 mmol/L NaCl处理12 h后生长的愈伤组织,经过含盐-无盐两次交替筛选后,测定其生理生化指标,结果表明:处理组愈伤组织与对照组相比,脯氨酸含量、可溶性糖含量、可溶性蛋白含量、SOD活性、POD活性均有显著提高(P<0.05),其中,‘范妮’愈伤组织中脯氨酸含量增长倍数稍高于‘天鑫3号’和‘双亚5号’;3种亚麻处理组愈伤组织中可溶性糖增长倍数相近;从可溶性蛋白含量、SOD和POD活性的增长倍数上看,‘天鑫3号’均高于其他2种纤维亚麻愈伤组织的。表明经过0.025%EMS+4 h+150 mmol/L NaCl处理12 h后生长的愈伤组织具有一定的耐盐性。
[1]熊和平. 我国麻类生产的现状与政策建议[J]. 中国麻业科学, 2010, 32(6):301-305.
[2]吕江南, 贺德意, 王朝云, 等. 全国麻类生产调查报告[J]. 中国麻业, 2004, 26(2):95-102.
[3]王玉富. 我国亚麻生物技术的研究现状及发展[J]. 中国麻业, 2005, 27(2):60-65.
[4]粟建光, 揭雨成, 龚友才, 等. 麻类优异种质的创新与利用研究[J]. 中国麻业, 2004, 26(2):56-59.
[5] 康庆华, 关凤芝, 王玉富, 等. 中国亚麻分子育种研究进展[J].中国农业科学, 2006, 39(12):2428-2434.
[6]吴广文. 我国纤维亚麻行业发展综述[J]. 中国麻业科学, 2007, 29(2):64-66.
[7]McHughen A, Swartz M. A tissue culture derived salt-tolerant line of flax(Linum usitatissimum)[J]. J Plant Physiol, 1984, 117:109-117.
[8]McHughen A. Salt tolerance through increased vigor in a flax line(STS-II)selected for salt tolerance in vitro[J]. Theoretical and Applied Genetics, 1987, 74(6):727-732.
[9]赵东升. 亚麻耐盐碱品种筛选的研究[J]. 黑龙江农业科学, 2011(7):12-13.
[10]赵东升. 亚麻耐盐碱ISSR标记引物筛选的研究[J]. 黑龙江农业科学, 2013(8):12-13.
[11]郭媛, 邱财生, 龙松华, 等. 盐碱胁迫对不同地区亚麻主栽品种种子萌发的影响[J]. 种子, 2013, 32(12):1-5.
[12]王红梅, 金忠民, 孙雪巍, 等. 盐胁迫对亚麻幼苗生长的影响[J]. 齐齐哈尔大学学报, 2005, 21(4):87-89.
[13]葛春辉, 计巧灵, 王雪华, 等. 亚麻耐盐性愈伤组织的生理生化特性[J]. 植物研究, 2008, 28(5):603-607.
[14]李文婷, 姜丽, 计巧灵, 等. 盐胁迫下两个亚麻品种幼苗的生理生化特性[J]. 生物技术, 2009, 19(2):26-29.
[15]王伟, 邓倩, 计巧灵. NaCl胁迫对6种纤维亚麻幼苗生化特性的影响[J]. 中国农学通报, 2013, 29(18):84-88.
[16]侯福林. 植物生理学实验教程[M]. 北京:科学出版社出版, 2000:2311-2314.
[17]张志良, 翟伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社, 2005:39-41.
[18]邹琦. 植物生理学实验指导[M]. 北京:中国农业出版社, 2000:2428-2434.
[19]Bretagne B, Chupeau MC, Chupeau Y, et al. Improved flax regeneration from hypocotyls using thidiazuron as a cytokinin source[J]. Plant Cell Reports, 1994, 14:120-124.
[20]Jain P, Rashid A. Stimulation of shoot regeneration on Linum hypocotyl segments by thidinzuron and its response to light and calcium[J]. Biologia Plantarum, 2001, 44(4):611-613.
(责任编辑 马鑫)
Orthogonal Test of EMS Mutation and NaCl Stress and Screening of Salt-tolerant Fiber Flax Germplasm in Vitro
WANG Wei-guo DENG Qian JI Qiao-ling WANG Wei
(College of Life Science and Technology,Xinjiang University,Urumqi 830046)
This work aims to lay the primary foundation for breeding salt-tolerant fiber flax plant induced from the callus. The hypocotyl segments from sterile seedlings of 3 kinds of fiber flax were treated in the orthogonal test with EMS induction and salt stress,and cultured through bud and callus induction. Further,the physicochemical characteristics of the buds and callus were explored. The optimal treatment combination for adventitious buds derived from “Fanny”,“Tianxin 3” and “Shuangya 5” all were 0.025% EMS for 2 h or 4 h,and then 150 mmol/L NaCl for 12 h. Total bud yield from high to low were the hypocotyls segments of “Fanny”,“Tianxin 3” and “Shuangya 5”. The order of factors affecting the emergence and growth of the adventitious buds was concentration of NaCl>concentration of EMS>treating time with EMS. The optimal medium for the induction of adventitious buds from 3 species fiber flaxes was MS+0.000 2 mg/L TDZ+0.02 mg/L KT+0.005 mg/L NAA+0.3% sucrose+0.1 g/L inositol+3.3 g/L phytogel. The callus was treated with 0.025% EMS for 4 h then 150 mmol/L NaCl for 12 h and screened through salt and salt-free medium twice alternately,and the physicochemical properties of which were determined. The results showed that proline content,soluble sugar content,soluble protein,SOD activity and POD activity in the callus of treated group of 3 species fiber flax all increased remarkably(P<0.05)compared with their control group. Conclusively,the callus of treated group with 0.025% EMS for 4 h then 150 mmol/L NaCl for 12 h possessed solid salt tolerance.
fiber flax;EMS mutation;NaCl stress;orthogonal test;physicochemical property
10.13560/j.cnki.biotech.bull.1985.2016.06.015
2015-08-03
国家自然科学基金项目(31160295)
王卫国,男,助理研究员,研究方向:植物细胞工程;E-mail:2240658411@qq.com
计巧灵,女,教授,研究方向:植物生物技术;E-mail:wji1118@163.com
