离子色谱法同时测定大气PM2.5中水溶性有机酸和无机阴离子的研究
2016-06-09丁萌萌杨懂艳周健楠刘保献石爱军
丁萌萌,杨懂艳,周健楠,刘保献,石爱军,杨 梦
北京市环境保护监测中心,大气颗粒物监测技术北京市重点实验室,北京 100048
离子色谱法同时测定大气PM2.5中水溶性有机酸和无机阴离子的研究
丁萌萌,杨懂艳,周健楠,刘保献,石爱军,杨 梦
北京市环境保护监测中心,大气颗粒物监测技术北京市重点实验室,北京 100048
建立超声提取-离子色谱法55 min内同时测定大气PM2.5中13种水溶性低分子有机酸和无机阴离子的方法,经不同样品膜空白值考察、预处理条件优化、样品保存实验研究等获得了最佳的实验条件。研究发现,无机阴离子线性回归系数均为0.999以上,有机酸均为0.993以上;样品膜中各离子的相对标准偏差为3.2%~9.8%,样品提取液中各离子的加标回收率为90.6%~108%;当采样体积为24 m3时,各目标化合物的方法检出限为0.003~0.032 μg/m3。分别于2015年1、6月采集了PM2.5实际样品,1月各离子浓度之和为31.9 μg/m3,范围为0.04~15.0 μg/m3;6月各离子浓度之和为22.3 μg/m3,范围为0.01~12.7 μg/m3。两个采样期间,氯离子、硝酸根、硫酸根在13种化合物中占绝对优势,均占总量的95%以上;乙酸、甲酸、甲烷磺酸和乙二酸为其他低含量离子中的主要组分。
离子色谱法;PM2.5;有机酸;无机阴离子;超声提取
大气细颗粒物(PM2.5)是当前北京大气环境中重要的污染物,其成分复杂,不仅对人体健康[1-3]和城市环境[4]造成诸多影响,还关系到全球大气系统能量平衡[5]。研究表明,水溶性化合物是PM2.5中的重要化学组分,包括水溶性无机物和有机酸。这些化合物主要来源于污染源直接排放和二氧化硫、氮氧化物等前体物的二次转化[6-8]。水溶性化合物可以显著改变大气颗粒物的吸湿性进而影响颗粒物的粒径分布及云凝结核的活性,降低城市大气能见度[9-10],影响区域和全球的气候;水溶性化合物还具有较强的酸性,可以改变颗粒物中重金属的形态,影响其迁移过程,在一定条件下可明显增加酸雨强度[11]。因此。开展对PM2.5中可溶性化合物的研究,建立行之有效的监测方法十分必要。
目前,PM2.5水溶性化合物的监测主要存在两个方面的问题:一是对水溶性无机物氟离子、氯离子、亚硝酸根、硝酸根、硫酸根、磷酸根、钠离子、铵离子、钾离子、镁离子、钙离子的研究相对较多[12-13],而对水溶性有机酸研究较少;二是分析方法不完善,将本来共存于同一体系中且相互作用的水溶性无机物同有机酸的分析相分离。目前水溶性无机物大多通过离子色谱(IC)分析,而水溶性有机酸大多通过气相色谱-质谱法(GC-MS)、气泡间隔流动注射法来分析。GC-MS 方法分析水溶性有机物时,样品需要萃取、蒸发、酯化等复杂的预处理过程,操作费时繁琐,该过程还会对空气产生新的污染,流动注射法则不能同时测定多种有机酸[14-15]。
针对以上两个问题,本方法建立了离子色谱法,同时测定大气PM2.5中水溶性无机阴离子和有机酸。目前,从分子水平上鉴别出来且PM2.5中广泛存在的水溶性低分子有机酸主要有甲酸、乙酸、甲烷磺酸、戊二酸、丁二酸、丙二酸、乙二酸,而PM2.5中常见的水溶性无机离子主要有氟离子、氯离子、亚硝酸根、硫酸根和磷酸根,故选取这13种水溶性化合物作为目标化合物[16-20]。研究中所采用的方法确定了采样膜的材质、测试仪器的色谱条件、前处理方法、样品保留时间等参数;研究了方法的检出限、精密度、准确度及回收率等性能指标,同时结合实际样品测定进一步对方法的适用性进行确定。为了解和掌握细颗粒物PM2.5的组成及开展相关源解析工作提供了技术依据。
1.1 样品的采集
使用2025i型连续颗粒物采样器(美国)进行PM2.5样品的采集,采样流量为16.7 L/min,采样时段为0∶00—24∶00,PM2.5样品采集完成后,放回滤膜盒,密封于4 ℃避光保存。
1.2 仪器与材料
DionexICS-5000型离子色谱仪(美国),配有淋洗液自动发生器、电导检测器;Chromeleon 6.80色谱工作站;IonpacAS11-HC阴离子分离柱(250 mm×4 mm),IonpacAG11-HC型阴离子保护柱(50 mm×4 mm),ASRS-ULTRAII阴离子抑制器(ASRSTM300~4 mm),0.45 μm过滤膜,一次性注射器:10 mL,超声波清洗器:功率范围(100~600) W,ELGA-ULTRA型实验室超纯水系统,石英滤膜(Whatman:1851047),特氟龙滤膜(Whatman:7592~104)。
标准物质:Dionex Seven Anion StandardⅡ(氟离子20、氯离子100、亚硝酸根100、硝酸根100、磷酸根200、硫酸根100 mg/L,Thermo Scientific,美国);甲酸(HCOOH,1.0 g/L,Fluka,美国);乙酸(CH3COOH,1.0 g/L,Fluka,美国);甲烷磺酸(CH3SO3H,99%,Fluka,USA);丙二酸(HOOCCH2COOH,99%,Alfa Aesar,德国);戊二酸 (C5H8O4,分析纯,Merck KGaA,德国);丁二酸[(CH2COOH)2,分析纯,Merck KGaA,德国];乙二酸(HOOCCOOH,分析纯,Merck KGaA,德国)C9~C40正构烷烃标准样品:500.0 μg/mL,美国Accustandard;内标:六甲基苯,99.5%,德国Dr.Ehrenstorfer;替代物:十四烷-d30,98%,美国CIL;二十四烷-d50,98%,美国CIL;三十六烷-d74,98%,加拿大CDN。
1.3 实验方法
1.3.1 样品前处理
选取整张样品膜进行分析,用镊子将采样膜放入50.0 mL聚四氟乙烯离心管中,超纯水定容至标线,保持样品膜于水面下,使用超声波清洗器超声提取。超声提取后,将样品混合均匀,用带0.45 μm微孔滤膜过滤器的塑料针筒吸取样品,弃去最初1~2 mL滤液,其余滤液转移至进样瓶密封保存,滤液需尽快上机测定。
1.3.2 色谱条件
设置淋洗液流速为1.00 mM/min,梯度淋洗工作条件如下:1)0.0~9.0 min,氢氧化钾(KOH)的浓度1.00 mmol/L;2)9.0~20.0 min,KOH的浓度从1.00 mmol/L升至8.00 mmol/L;3)20.0~50.0 min;KOH的浓度从8.00 mmol/L升至25.0 mmol/L;4)50.0~55.0 min,KOH的浓度又从25.0 mmol/L降至1.00 mmol/L,结束分析过程。进样量250 μL,抑制器电流为75 mA,色谱柱柱温箱温度为30 ℃。此条件可使13种水溶性离子在55 min内有效分离。标准溶液中水溶性有机酸及阴离子的色谱图见图1。

1.氯离子∶7.23; 2.乙酸∶7.83; 3.甲酸∶9.35; 4.甲烷磺酸∶10.87; 5.氯离子∶16.54; 6.亚硝酸根∶18.01; 7.硝酸根∶28.61; 8.戊二酸∶25.10; 9.丁二酸∶25.56; 10.丙二酸∶26.69; 11.硫酸根∶28.61; 12.乙二酸∶29.91; 13.磷酸根∶36.83。
2 结果与讨论
2.1 滤膜的选择
滤膜在加工、运输、保存等过程中可能会玷污少量的无机物和有机酸,会对样品结果带来影响。研究对特氟龙滤膜(直径46.2 mm,孔径2.0 μm)和石英纤维滤膜(直径47 mm)的空白膜进行测定,以选取本底浓度较低的滤膜作为采样滤膜。空白膜测定实验选取6张滤膜,其中,2张特氟龙滤膜和2张石英滤膜均为刚开启的新膜,另外2张石英滤膜为经马弗炉500 ℃烘烤6 h后的滤膜。同时,对二次去离子水的本底值进行了检测。
特氟龙滤膜和石英滤膜空白值比较,如表1所示。6张滤膜的本底值均高于二次去离子水。经过高温烘焙的石英滤膜,各化合物的本底值的平行性较好,而未烘的石英滤膜之间,同一种化合物会出现本底值波动较大的情况,例如氟离子、氯离子;另外,经过烘焙后大部分化合物浓度均有所降低。对于化合物氟离子、氯离子、硫酸根、硝酸根和磷酸根,特氟龙滤膜的空白值远低于已烘和未烘的石英滤膜;对于亚硝酸根和小分子有机酸,3种空白滤膜含量相差不大,均较低。故选定本底浓度较低且平行性较好的特氟龙滤膜作为采样滤膜。

表1 特氟龙滤膜和石英滤膜空白值比较 μg/L
注:“—”表示未检出。
2.2 样品提取时间的比较
使用3台2025i型连续颗粒物采样器(美国)在同一地点同时采集3张PM2.5样品,采集后分别将样品膜放入50.0 mL聚四氟乙烯离心管中,经超声提取20、40、60、70、80 min,并实时记录超声仪中水的温度。为避免超声振荡时间过长导致温度升高,造成部分水溶性化合物的损失,在超声振荡过程中放入了适量冰块,超声提取过程中温度控制在20.0~22.0 ℃。
分析3张采样膜,各离子取平均值,计算提取时间对各离子浓度的影响,如图2所示。
从图2可以看出,磷酸根、戊二酸、丁二酸、丙二酸等含量较低的化合物,短时间超声就能提取较完全,而对于其他化合物,尤其是含量较高的常规阴离子(氯离子、硝酸根、硫酸根等),提取60 min 时浓度达到峰值,继续超声,各化合物浓度不再有明显变化。最终确定采样膜的超声提取时间为60 min。
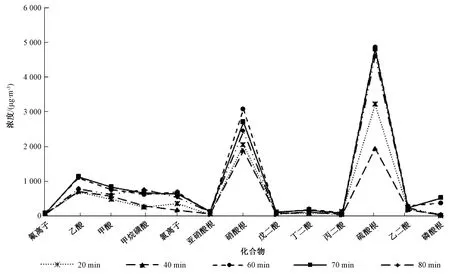
图2 前处理不同提取时间的考察
2.3 样品保存时间实验
使用4台2025i 型连续颗粒物采样器(美国)在同一地点同时进行PM2.5样品的采集,采集完PM2.5样品后放回滤膜盒,密封好,于-25 ℃避光保存。分别于采集当日、采集24 h后、采集4、7日后进行分析,检测结果见表2。对不同保存时间各化合物的含量进行非参数Friedman检验,渐进显著性为0.114>0.05,说明不存在显著差异。故PM2.5样品膜在-25 ℃下保存7 d,各组分浓度变化不大。
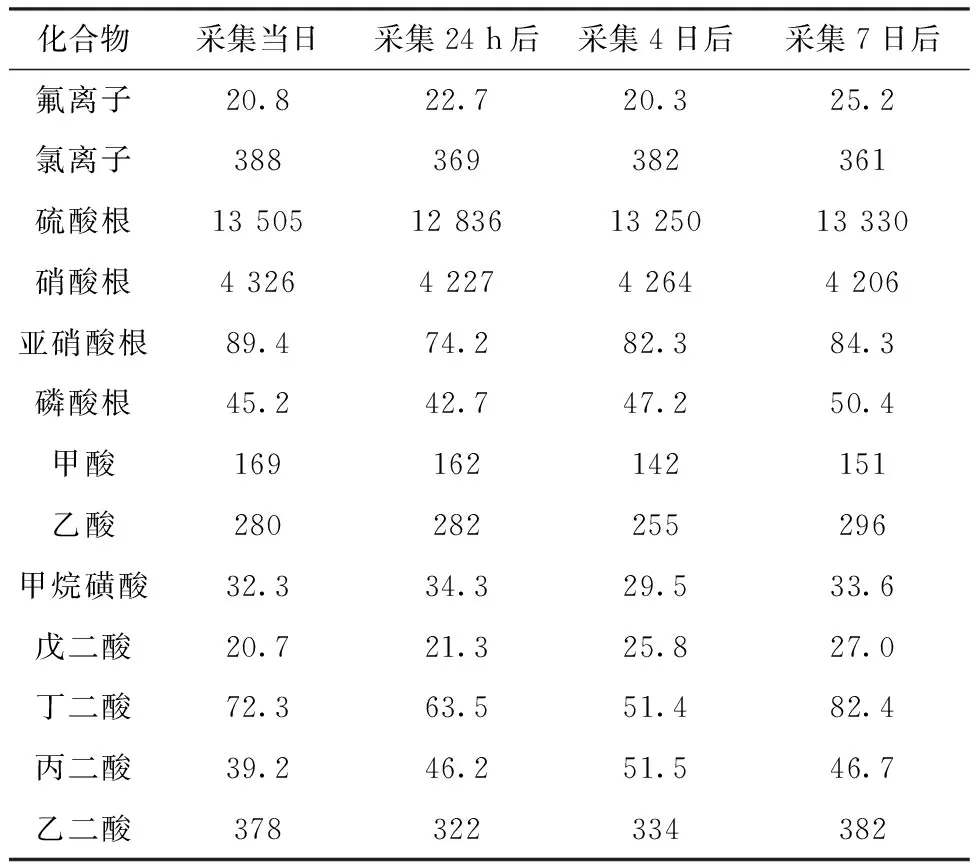
表2 样品保存时间实验 μg/L
2.4 方法性能指标
2.4.1 线性范围与方法检出限
在已确定的实验条件下,用标准物质将13种目标化合物配制成5个不同浓度的标准溶液系列,用标准溶液系列中各组分的峰面积与浓度数据作标准曲线,计算回归方程、相关系数及线性范围。无机阴离子相关系数均为0.999,有机酸均为0.993,线性相关性良好,完全满足定量分析的需要。按照《环境监测分析方法标准制修订技术导则》(HJ 168—2010)[21]的要求,对空白样品膜进行7次测定,分别计算各低分子有机酸和无机阴离子的标准偏差(S),t(7-1,α=0.99)=3.14,当采样体积为24 m3时,各目标化合物的方法检出限(MDL)为0.003~0.032 μg/m3,具有较好的灵敏度,详见表3。
2.4.2 精密度和准确度
为检验该方法对低分子有机酸和无机阴离子测定的精密度,连续测定PM2.5样品膜6次,计算各水溶性化合物的平均值、标准偏差和相对标准偏差。由于特氟龙材质具有疏水性,无法实现将标准溶液加入样品膜的实验。故为检验该方法对低分子有机酸和无机阴离子测定的准确度,取上述经过前处理的样品提取液20 ml,加入一定量含有上述13种离子的标准溶液,连续测定此混合溶液中各离子浓度3次,取平均值作为实测值,计算各离子的回收率。13种低分子有机酸和无机阴离子的相对标准偏差为3.2%~9.8%,回收率为90.6%~108%,结果表明,该方法对样品测定具有良好的精密度和准确度,详见表4。

表3 各化合物线性回归方程、相关系数、线性范围和检出限

表4 精密度和准确度实验结果
2.5 实际样品的测定
研究发现,北京地区大气细颗粒物中可溶性低分子有机酸和无机离子的含量具有明显季节特征,其中冬季较高,夏季较低。为考察方法适用性,于2015年1(冬季)、6月(夏季)在北京市某城区分别开展为期1个月的样品采集和分析,1、6月样品数量均为30个。研究期间,1月各离子浓度之和为31.9 μg/m3,范围为0.04~15.0 μg/m3。6月各离子浓度之和为22.3 μg/m3,范围为0.01~12.7 μg/m3。1月氯离子、硝酸根、硫酸根浓度分别为5.12、15.0、10.2 μg/m3,占13种化合物总量的95.2%;6月分别为0.38、8.33、12.7 μg/m3,占总量的95.2%。其他无机阴离子和有机酸中,主要组分为乙酸、甲酸、甲烷磺酸、乙二酸,1月分别为0.46、0.16、0.23、0.20 μg/m3,6月分别为0.25、0.08、0.10、0.15 μg/m3。除硫酸根外,各离子含量6月明显低于1月,见图3、图4。这与冬季受取暖等排放源的影响,各组分均处于相对较高的浓度水平有关。另外,夏季降水在洗脱大气可溶性物质中也起着重要作用。夏季硫酸根高于冬季且高于同季节的硝酸根,这和夏季高温提高了硝酸根的挥发及硫酸根的二次生成率有关[22]。

图3 北京某城区1、6月PM2.5中3种主要阴离子分布
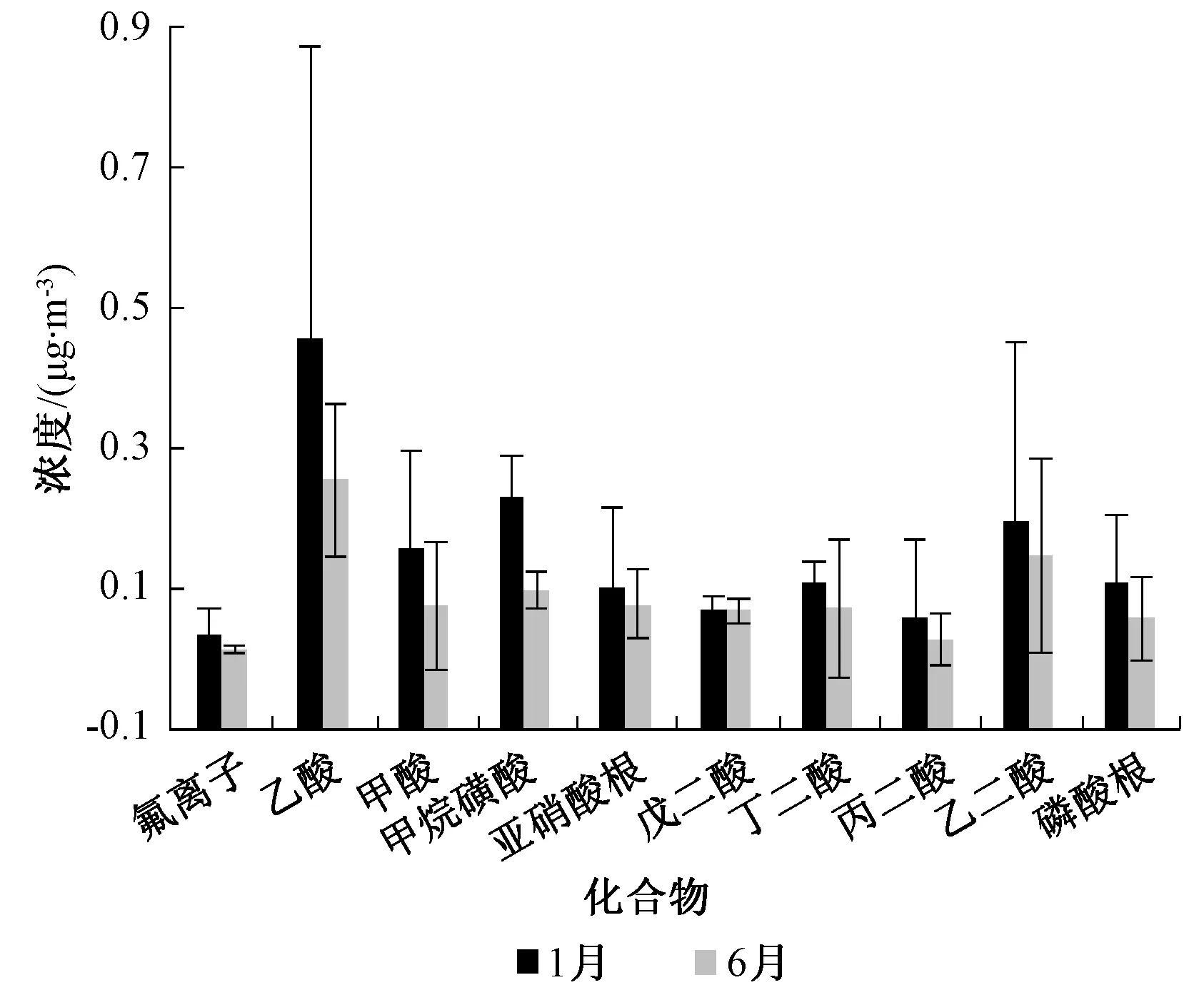
图4 北京某城区1、6月PM2.5中低含量离子分布
3 结论
研究所用方法采用超声提取-离子色谱法同时测定大气PM2.5样品中低分子有机酸和无机阴离子,离子出峰尖锐,分离度较好;选取特氟龙材质的采样膜空白较低,最佳超声提取时间为60 min,样品在-25 ℃下保存7 d内,各组分浓度不发生显著变化。
该方法具有较好的性能指标,无机阴离子相关系数均为0.999以上,有机酸均为0.993以上;当采样体积为24 m3时,低分子有机酸和无机阴离子的方法检出限(MDL)为0.003~0.032 μg/m3;测定实际样品膜,精密度小于10%,用标准溶液对样品提取液进行加标,回收率为90.6%~108%。
经2015年1、6月实际样品的验证,方法能很好的满足各目标化合物的测定,各化合物均有检出;研究期间,1月各离子浓度之和为31.9 μg/m3,6月各离子浓度之和为22.3 μg/m3。两个采样期间,氯离子、硝酸根、硫酸根均占绝对优势,均占总量的95%以上,低含量离子中,乙酸、甲酸、甲烷磺酸和乙二酸是主要组分。
[1] YANG D,QI S,DEVI N,et al.Characterization of polycyclic aromatic hydrocarbons in PM2.5and PM10in Tanggu District,Tianjin Binhai New Area,China[J].Frontiers of Earth Science,2012,6(3):324-330.
[2] SUN Z,MU Y,LIU Y,et al.A comparison study on airborneparticles during haze days and non-haze days in Beijing[J].Science of the Total Environment,2013,456:1-8.
[3] CAO J, XU H, XU Q, et al.Fine particulate matter constituents and cardiopulmonary mortality in a heavily polluted Chinese city[J]. Environmental health perspectives,2012,120(3):373-378.
[4] CHAN Y C,SIMPSON R W,MCTAINSH G H, et al.Characterization of chemical species in PM2.5and PM10aerosols in Brisbane Australia[J].Atmospheric Environment,1997,31:2 061-2 080.
[5] ZHUANG G S,HUANG R H,WANG M X,et al.Great progress in study on aerosol and its impact on the global environment[J].Progress in Natural Science,2002,12(60):407-413.
[6] BLANDO J D,TURPIN B J.Secondary organic aerosol formation in cloud and fog droplets: a literature evaluation of plausibility[J].Atmospheric Environment,2000,34:1 623-1 632.
[7] TURPIN B J,HUNTZICKER J J.Secondary formation of organic aerosol in the Los Angeles basin:a descriptive analysis of organic and elemental carbon concentrations[J].Atmospheric Environment,1991,25A:207-215.
[8] SCHUETZLE D,CRONN D,CRITTENDEN A L.Molecular composition of secondary aerosol and its possible origin[J].Environmental Science & Technology,1975,9:838-845.
[9] 宋宇,唐孝炎,方晨,等.北京市能见度下降与颗粒物污染的关系[J].环境科学学报,2003,23(4):468-471.
[10] 胡敏,唐倩,彭剑飞,等.我国大气颗粒物来源及特征分析[J].环境科学与发展,2011,5:15-19.
[11] SAXENA P,HILDEMANN L M,MCMURRY P H,et al.Organics alter hygroscopic behavior of atmospheric particles[J].Journal of Geophysical Research,1995,100:18 755-18 770.
[12] 余学春,贺克斌,马永亮,等.北京市PM2.5水溶性有机物污染[J].中国环境科学,2004,24(1):53-57.
[13] ADAMS P J,SEINFELD J H,KOCH D.Global concentrations of tropospheric sulfate,nitrate,and ammonium aerosol simulated in a general circulation model[J].Journal of Geophysical Research,1999:13 791-13 823.
[14] GROSJEAN D.Organic acids in southern California air:ambient concentrations,mobile,source emissions,in-situ formation and removal processes[J].Environ-mental Science &Technology,1989,23:1 506-1 514.
[15] GROSJEAN D,VAN CAUWENBERGHE K,SCHMID J,et al.Identification of C3-C10aliphatic dicarboxylic acids in airborne particulate matter[J].Environmental Science & Technology,1978,12:313-316.
[16] 黄晓峰,胡敏,何凌燕.北京市大气气溶胶PM2.5中水溶性有机酸的测定[J].环境科学,2004,25(5):21-25.
[17] 张宁.离子色谱对降水中有机酸的测定[J].中国环境监测,1993,9(6):12-14.
[18] 袁蕙,王瑛,庄国顺.气溶胶、降水中的有机酸、甲烷磺酸及无机阴离子的离子色谱同时快速测定法[J].分析测试学报,2003,22(6):11-14.
[19] 夏静芬,施敏凤,龚晓芳.梯度淋洗液离子色谱法同时测定雨水中12种有机酸和无机阴离子的研究[J].中国环境监测,2009,25(3):16-17.
[20] 胡敏,陆昀,曾立民.离子色谱法测定大气中的甲磺酸[J].环境化学,2000,19(4):572-575.
[21] 国家环境保护局科技标准司.环境监测分析方法标准制修订技术导则:HJ/T 168—2010[S].中国环境科学出版社,2010.
[22] 宋宇,唐孝炎,张远航,等.夏季持续高温天气对北京市大气细离子(PM2.5)的影响[J].环境科学,2002,23(4):33-36.
Determination of Water-Soluble Organic Acids and Inorganic Anions in Atmospheric PM2.5by Gradient Ion Chromatography
DING Mengmeng,YANG Dongyan,ZHOU Jiannan,LIU Baoxian,SHI Aijun,YANG Meng
Beijing Municipal Environmental Monitoring Centre, Beijing Key Laboratory of Airborne Particulate Matter Monitoring Technology, Beijing 100048, China

ion chromatography;PM2.5;organic acid;inorganic anion;ultrasonic extraction
2015-08-28;
2015-10-10
北京市科技计划课题项目(Z141100002714002);环保公益行业科研专项(201409003)
丁萌萌(1985-),女,天津人,硕士,工程师。
刘保献
X830.2
A
1002-6002(2016)06- 0100- 07
10.19316/j.issn.1002-6002.2016.06.16
