固相萃取-高效液相色谱法测地表水中11种酚类化合物
2016-06-09李海滨张厚勇
葛 璇,李海滨,张厚勇
济南市环境监测中心站,山东 济南 250014
固相萃取-高效液相色谱法测地表水中11种酚类化合物
葛 璇,李海滨,张厚勇
济南市环境监测中心站,山东 济南 250014
建立了固相萃取-高效液相色谱法同时测定地表水中11种酚类化合物的方法。水样经过全自动固相萃取仪富集,以HLB柱为萃取柱,乙腈(含1%乙酸)为洗脱剂,用高效液相色谱仪分析定量。该方法在0.5~5.0 mg/L范围内线性良好,相关系数为0.999 6~0.999 9,11种酚类化合物的纯水加标回收率为82.0%~111%,地表水加标回收率为98.5%~116%,精密度为3.58%~4.67%,检出限为1×10-4~5×10-4mg/L,该方法简单实用、准确可靠,可用于地表水中酚类化合物的同时测定。
固相萃取;高效液相色谱法;地表水;酚类化合物
酚类化合物是炼焦、造纸等工业废水的主要污染物质,在生活污水、天然水和饮用水中普遍存在[1],是造成环境污染的主要原因之一。酚类化合物是第二大环境污染物,几乎对所有生物均有毒杀作用[2]。研究显示,2,4-二氯酚、五氯酚等酚类化合物具有雌激素的特性,在环境中难以降解,易于在生物体内蓄积,即使含量极低也能使生物内分泌失调,具有致癌、致畸、致基因突变的潜在毒性[3]。
USEPA公布的129项优先控制污染物中有11项是酚类化合物(苯酚、2-氯苯酚、2,4-二氯苯酚、2,4,6-三氯苯酚、五氯酚、对硝基酚、邻硝基酚、2,4-二硝基苯酚、2,4-二甲基苯酚、对-氯-间甲苯酚、4,6-二硝基-对-甲苯酚),中国优先控制污染物黑名单[4]中也有6项酚类化合物(苯酚、间甲酚、2,4-二氯酚、2,4,6-三氯酚、五氯酚、对硝基酚),因此,建立水中酚类化合物快速准确的分析方法具有重要现实意义。
目前酚类化合物的分析方法一般有4-氨基安替比林分光光度法[5-7]、气相色谱法[8-9]和液相色谱法[10-11]等。4-氨基安替比林分光光度法溶剂使用量大,蒸馏时间长,富集效果差,易造成二次污染[12];气相色谱法测定酚类化合物,需要进行多次液-液萃取和衍生化反应,操作过程较为繁琐;而高效液相色谱(HPLC)法适用于检测分子量较大、 沸点高、 热稳定性差的有机物,弥补了气相色谱法的不足[13],可对酚类化合物进行直接测定,无需进行衍生化反应,且分离度好,灵敏度高,另外,固相萃取法与传统的液-液萃取法相比具有有机溶剂用量少、对环境污染小、不发生乳化现象、自动化程度高、节省人工、萃取效率高等优点,在环境分析中得到了广泛应用[14]。因此,研究选择固相萃取富集,通过高效液相色谱仪对地表水中11种酚类化合物进行分析(苯酚、对硝基苯酚、2-氯苯酚、2,4-二硝基苯酚、邻硝基苯酚、2,4-二甲基苯酚、4-氯-3-甲基苯酚、2,4-二氯苯酚、4,6-二硝基邻甲酚、2,4,6-三氯酚、五氯酚),操作过程简便、快捷,实验结果准确、可靠,该方法对水中酚类化合物的检测具有一定的参考价值。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器与配件
LC-20A型高效液相色谱仪(日本);全自动固相萃取仪;N-EVAP112型氮吹仪(美国);C18液相色谱柱(250 mm×4.6 mm×5 μm,美国); HLB固相萃取柱(200 mg,6 mL,美国);C18固相萃取柱(500 mg,6 mL,日本);活性炭固相萃取柱(500 mg,6 mL,美国);SAX固相萃取柱(500 mg,6 mL,美国)。
1.1.2 主要试剂
甲醇、乙腈、二氯甲烷、丙酮(农残级,德国);Millipore超纯水;冰乙酸(优级纯)。
1.2 实验方法
1.2.1 样品前处理
采用HLB固相萃取柱,依次用10 mL甲醇、纯水活化。取1L水样,加入乙酸调节pH为1~2,设置固相萃取条件,使水样以10 mL/min速度通过固相萃取柱,之后再用10 mL纯水淋洗柱,淋洗完毕后用氮气吹干,最后用10 mL乙腈(含1%乙酸)洗脱,待测。
1.2.2 液相色谱条件
C18液相色谱柱(250 mm×4.6 mm×5 μm,美国),进样量为10 μL;柱温为38 ℃;流速为1 mL/min;梯度洗脱,洗脱程序见表1。

表1 液相色谱梯度条件
注:“—”表示停止洗脱。
在此液相色谱梯度洗脱条件下,用二极管阵列检测器进行检测,得到11种酚类化合物的保留时间和最佳检测波长,见表2。

表2 酚类化合物的保留时间和检测波长
2 结果与分析
2.1 固相萃取条件优化
以11种酚类化合物的回收率作为最优化固相萃取条件的选择依据,分别研究了固相萃取柱、样品pH、洗脱溶剂、洗脱溶剂体积、氮气浓缩回收率5个实验条件参数。取1L水样,加入乙酸调节pH,分别加入11种酚类化合物的混合标准溶液,使水中11种酚类化合物质量浓度均为10 μg/L。设定不同的固相萃取条件进行萃取。
2.1.1 不同固相萃取柱的优选
分别选择HLB固相萃取小柱、C18柱、活性炭柱、SAX柱,按照相应实验步骤进行前处理,经测定后所得结果见图1。由图1看出,用HLB柱进行固相萃取时得到11种酚类化合物的回收率均较高,且11种酚类的平均回收率最高,因此选择HLB固相萃取柱。
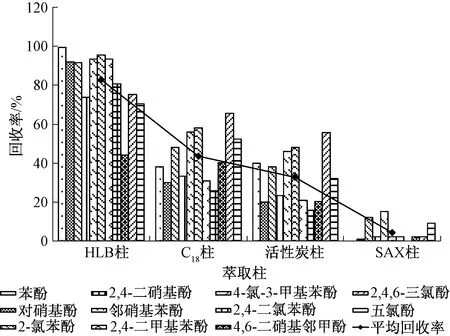
图1 不同固相萃取柱萃取11种酚类化合物的回收率
2.1.2 不同pH的优选
用乙酸分别调节6个平行水样的pH为6~7、5~6、4~5、3~4、2~3、1~2,按照相应实验步骤进行前处理,经测定后所得结果见图2。由图2看出,11种酚类化合物的回收率随着pH的降低而升高,当pH为1~2时达到最大值,因此选择待测样品pH为1~2。
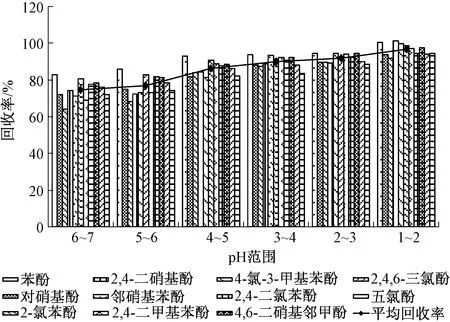
图2 不同pH时萃取11种酚类化合物的回收率
2.1.3 不同洗脱试剂的优选
分别选择二氯甲烷、二氯甲烷-丙酮(体积比为1∶1)、乙腈、乙腈(含1%乙酸)作为固相萃取的洗脱试剂,按照相应实验步骤进行前处理,经测定后所得结果见图3。由图3看出,含1%乙酸的乙腈萃取11种酚类化合物的回收率最好,平均回收率最高。因此,选择乙腈(含1%乙酸)作为最佳洗脱试剂。

图3 不同洗脱试剂萃取11种酚类化合物的回收率
2.1.4 洗脱体积的优化
分别选择2、4、6、8、10 mL乙腈(含1%乙酸)对固相萃取柱进行洗脱,按照相应实验步骤进行前处理,经测定后所得结果见图4。由图4看出,11种酚类化合物的回收率随着洗脱体积的增加而逐渐增大,当达到10 mL后11种酚类化合物的回收率达到最大,且均在85%以上,考虑到节省溶剂,不再采用更多体积的试剂进行洗脱,因此选择优化洗脱体积为10 mL。
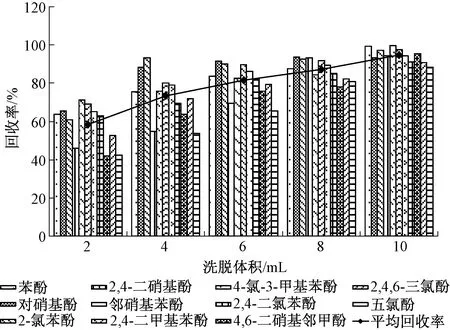
图4 不同洗脱体积时11种酚类化合物的回收率
2.1.5 氮吹回收率验证
对11种酚类化合物进行氮吹回收率的实验,结果发现经过氮气浓缩后,11种酚类化合物的回收率为70.8%~73.8%,因此为保证回收率,确定不对固相萃取洗脱液进行氮吹浓缩。
综上,11种酚类化合物的最佳固相萃取条件为水样pH为1~2,采用HLB固相萃取柱,上样速度为10 mL/min,洗脱试剂为乙腈(含1%乙酸),洗脱体积为10 mL。在此固相萃取条件下,这11种酚类化合物可以获得满意的回收率。
2.2 方法评价
2.2.1 线性方程和检出限
利用优化后的固相萃取条件和仪器分析条件,测定质量浓度为0.5、1.0、2.0、3.0、4.0、5.0 mg/L的11种酚类化合物的混合标准溶液,建立标准曲线,各目标物的检出限以10倍信噪比计算,所得结果见表3。

表3 11种酚类化合物的标准曲线、相关系数和检出限
2.2.2 回收率和精密度
配制质量浓度为10 μg/L的11种酚类化合物纯水加标平行水样6份,并对地表水进行相同浓度的加标,经过前处理后测定,所得结果见表4,由表4数据可知,11种酚类化合物的纯水加标回收率均为82.0%~111%,地表水加标回收率均为98.5%~116%,相对标准偏差均小于5%,说明11种酚类化合物的加标回收率和精密度较好,该方法准确可靠。
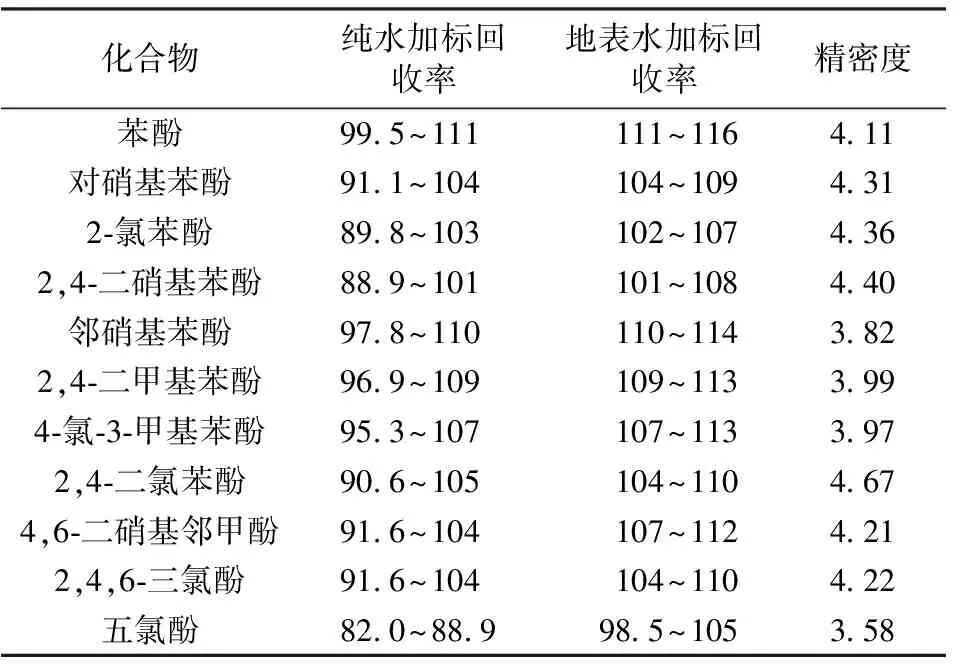
表4 11种酚类化合物的加标回收率及相对标准偏差 %
2.3 实际样品分析
选取济南市鹊山水库水、卧虎山水库水、锦绣川水库水、玉清水库水、黄河水进行11种酚类化合物的残留分析,结果表明这11种酚类化合物的质量浓度均小于检出限,说明在该地区这11种酚类化合物污染水平较低。
3 结论
建立了固相萃取-高效液相色谱法测定地表水中11种酚类化合物的高通量检测方法:样品通过HLB固相萃取柱富集,用10 mL乙腈(含1%乙酸)洗脱,然后用高效液相色谱仪进行定性定量分析。11种酚类化合物的纯水加标回收率为82.0%~111%,地表水加标回收率为98.5%~116%,精密度为3.58%~4.67%,检出限为1×10-4~5×10-4mg/L,线性方程的相关系数均大于0.999 5。采用该方法对济南市的水库水和黄河水进行检测,均未检出11种酚类化合物。
[1] 尹建四,吴新平,王瑞红,等.高效液相色谱法测定水体中的酚类化合物[J].河南化工,2006,23(4):43-44.
[2] 朱铭洪.固相萃取-气相色谱质谱法测定饮用水中的18种酚类化合物[J].中国卫生检验杂志,2013,23(5):1 129-1 131.
[3] 丘秀珍,郭会时,陈步青,等.固相萃取-微乳液相色谱法测定环境水体中的3种酚类化合物[J].色谱,2013,31(8):809-812.
[4] 周文敏,傅德黔,孙宗光.水中优先控制污染物黑名单[J].中国环境监测,1990,6(4):1-3.
[5] 程本军,王丽原.基于4-氨基安替比林分光光度法测定水中酚类化合物[J].黑龙江水利科技,2013,41(7):165-166.
[6] 潘枫燕,许宝弟,陈海宇.4氨基安替比林分光光度法测定水中挥发酚的影响因素[J].四川环境,2009,28(5):26-27.
[7] 康春莉,郭平,李军,等.水体中酚类化合物分光光度分析方法的研究[J].中国环境监测,2002,18(5):58-63.
[8] 李新纪.环境水质中酚类优先监测物的气相色谱法测定[J].色谱,1996,14(1):37-40.
[9] 褚春莹,宣肇菲,房贤文,等.毛细管柱气相色谱法测定水质五氯酚[J].干旱环境监测,2009,23(3):145-151.
[10] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法(第四版增补版)[M].北京:中国环境科学出版社,2002:588-592.
[11] 董瑞圣,张立尖.高效液相色谱法测定酚类化合物[J].净水技术,2001,20(1):36-39.
[12] 刘佳宁.固相萃取-高效液相色谱法测定水中的苯酚[J].民营科技,2013,6:52.
[13] 孙剑辉,冯精兰,孙瑞霞.水体有机污染物的研究进展[J].中国环境监测,2003,19(6):58-61.
[14] 李杰,韦桂欢,席骁,等.固相萃取-气相色谱法测定水中有机氯农药[J].舰船科学技术,2010,32(12):107-108.
Determination of Eleven Phenolic Compounds in Surface Water by Solid-Phase Extraction and High Performance Liquid Chromatography
GE Xuan, LI Haibin, ZHANG Houyong
Jinan Environmental Monitoring Centre,Jinan 250014,China
A high performance liquid chromatography (HPLC) method was established for the determination of eleven phenolic compounds in surface water. The sample was enriched with solid-phase extraction column, extracted with acetonitrile (1% acetic acid) and then analyzed by HPLC. Under the optimal conditions,good linearities were obtained in the range of 1×10-4-5×10-4mg/L with correlation coefficients of 0.999 6-0.999 9.The recoveries of eleven phenolic compounds of pure water and surface water were 82.0%-111% and 98.5%-116%.The relative standard deviations ranged from 3.58%to 4.67%.The limits were 1×10-4-5×10-4mg/L. The method was easy and reliable. It can be used to determinate the phenolic compounds in surface water at the same time.
solid-phase extraction;HPLC;surface water;phenolic compounds
2015-03-29;
2015-04-28
葛 璇(1985-),女,山东兖州人,硕士,工程师。
X832.02
A
1002-6002(2016)02- 0100- 04
