实验室制取氧气的几点注意事项
2016-06-08刘然
刘然
摘 要:通过可以操控的简单化学设备,在实验室制取氧气,能够反映化学制氧的基本原理,通过简明的观察提出应当注意的问题,不断改进制氧方式。达到有效操控的目的。快速、效率、准确和安全成为实验室制氧的基本准则。
关键词:实验室;氧气
中图分类号:G632 文献标识码:B 文章编号:1002-7661(2016)10-241-02
我们将实验室制取氧气的步骤概括为几大步:实验原理准备——实验器材准备结合检查——实验装备的安装和检查——实验步骤的进行——实验观察和操作——实验结果的得出——实验结论的总结——实验反思和改进步骤。通过以上步骤,我们得出本次实验的调查报告,然后进行实验结论的反思和总结。
一、实验室制取氧气的理论准备和思考
1、利用化学材料的实验室氧气制取
在化学实验室制取氧气过程中,我们一般采用加热高锰酸钾(KMnO4)的方式进行氧气制取,还有加热氯酸钾(KClO3),并且可以通过催化剂MnO2来催化,提升制氧速率,还有我们可以考虑利用双氧水(过氧化氢)结合催化剂MnO2来进行氧气的制取。
以上三种方式基本是利用化学原料的方式,发生化学反应,其制取氧气的数量和纯度,取决于材料的数量和纯度,包括操作过程的步骤和注意事项,通过对于过程的控制来达到获取氧气的目的。
2、利用物理电解的方式获取氧气
实验室除了化学制氧的方式之外,还有物理制氧方式,就是通过电解水的方式生成氧气和氢气。这种方式称为物理电解的方式,此种方式相对于化学制氧不便于控制,而且氧气纯度不好控制,容易消散。
二、实验室制取氧气的注意事项分析。
化学制氧剂的氧气制取注意问题分析。
鉴于以上采用不同的制氧方式,我们可以控制其制氧过程,注意化学制氧和物理制氧的不同方式和注意事项等。我们展示实验室化学制氧化学方程式如下:
(1)加热高锰酸钾方式制取氧气化学式为:2KMnO4===(△)K2MnO4+MnO2+O2↑
(2)用催化剂MnO2并加热氯酸钾化学式为:2KClO3===(△,MnO2) 2KCl+3O2↑
(3)用双氧水(过氧化氢)在催化剂MnO2生成O2和H2O,化学式为: 2H2O2===(MnO2) 2H2O+O2↑
我们通过化学制氧剂,主要是高锰酸钾和氯酸钾以及双氧水,通过加热和催化剂来使之生成氧气,按照化学方程式的过程要求,我们通过搭设基本装置如图一所示,以高锰酸钾制取氧气为例展示,我们观察到如下装置的角度和步骤顺序: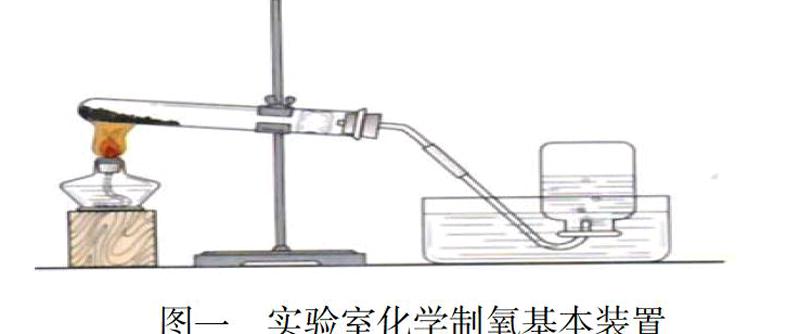
注意事项(1)整体考虑高度差。铁架衔接试管的高度要考虑到酒精灯架设的高度与导气管和装水容器采集瓶的高度,做到高效方便加热,氧气采制方便顺利控制,以获得最大限度的实验效率和质量。
(2)装置安装和架设步骤。先将化学制氧剂装入试管中,然后控制均匀铺开,架设酒精灯,放置装水容器和氧气采集瓶,同时调整试管高度,使试管底部和头部舒服角度合理,有效搭配。
(3)固体制氧剂加入制取氧气,试管略向下倾斜。
这个角度极为重要,一是方便氧气顺利通过试管通过导出管导出,更主要的就是在加热固体药品时(KMnO4、KClO3、MnO2),药品当中含有的水分蒸发编成水蒸气,在试管口冷凝成水滴倒流入试管底部,试管底部因加热与冷凝水导致爆裂,试管角度一定做好调整,保障成功和安全。
(4)试管底部在加热前做到均匀预热。
试管在使用之前通过用酒精灯预热,使之底部受热均匀,防止破裂。
(5)衔接紧密,控制导气管长度。
衔接紧密是不漏气,一是试管的橡皮塞的安装,而是导气管在水槽中与氧气采集瓶的衔接,导气管要没入水下,防止漏气,导气管在试管中的长度刚刚露出即可,保障最大限度的氧气导出,防止占用空间过多,降低实验效率。
(6)试管口是否要堵塞一团棉花,保障均匀透气性与柔软性。
高锰酸钾制氧需堵塞棉花。在加热固体制剂的时候,防止像高锰酸钾之类药品颗粒加热,随气流进行导气管,污染氧气采集,影响实验效果,不安全。
但是在采用加热氯酸钾和二氧化锰混合物制氧的时候,试管口不能放棉花,因为氯酸钾是一种强氧化剂,在加热的时候,遇到棉花容易燃烧,甚至引发爆炸,引起危险。
(7)用排水法制取氧气,最初的气泡不可立即收集。
最初在试管和导气管中混有空气,此时的氧气不够纯净,首先要进行一段时间的排气,随后收集到高纯的氧气。
(8)实验结束,要现将导气管从水中移出,然后熄灭酒精灯。
先熄灭酒精灯,试管的温度降低,导致管内压强降低,这是水会从导气管倒流如试管底部,引起试管炸裂。所以先移出导气管,将管内的水排干净,最后熄灭酒精灯,保障实验安全和成功。
三、实验室电解水制取氧气的注意事项
这种实验利用不多,因为比较难以控制,而且产生的氢气具有一定爆炸的危险性。氧气不便于保存。
实验中我们需要增强水的导电性,可以加入少量的稀硫酸或者氢氧化纳溶液,通过水的电解方式进行。此外对于制取气体的验证方面,采用带火星的木条,如果木条短时间急剧复燃,就说明获取成功,要注意观察火焰的颜色,产生淡蓝色的火焰,也可以证明氢气的存在。
综上所述,实验室制取氧气需要通过多角度多思维观察,并且通过过程的检验和结论的反思,不断提升实验的精准性,获得最终的实验数据。在课堂教学中这个过程可以不断反复进行,让学生做到技术熟练,提升实验操作的质量和效率,获得实际的实验数据。
参考文献
[1] 陈启新 王云生《化学新课程案例与评析(必修)》高等教育出版社2005-01
[2] 彭蜀晋《化学新课程的理论与实践》高等教育出版社2008-05
[3] 陈启新 黄丹青《化学新课程教学设计与评析》高等教育出版社2008-09
[4] 柳若芍《走进高中化学教学现场》首都师范大学出版社2008-01
